

Preview text:
lOMoAR cPSD| 22014077
IV. Tính chất của hợp chất ion
- Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể lớn.
- Các hợp chất ion đều khá rắn, có nhiệt độ sôi, nhiệt độ nóng chảy cao và kém hoặc không bay hơi.
- Không dẫn điện ở trạng thái rắn, dẫn điện ở trạng thái nóng chảy hoặc giòn.
- Các hợp chất ion thường tan nhiều trong nước (hydrate hóa) và dung môi phân cực. Bài tập:
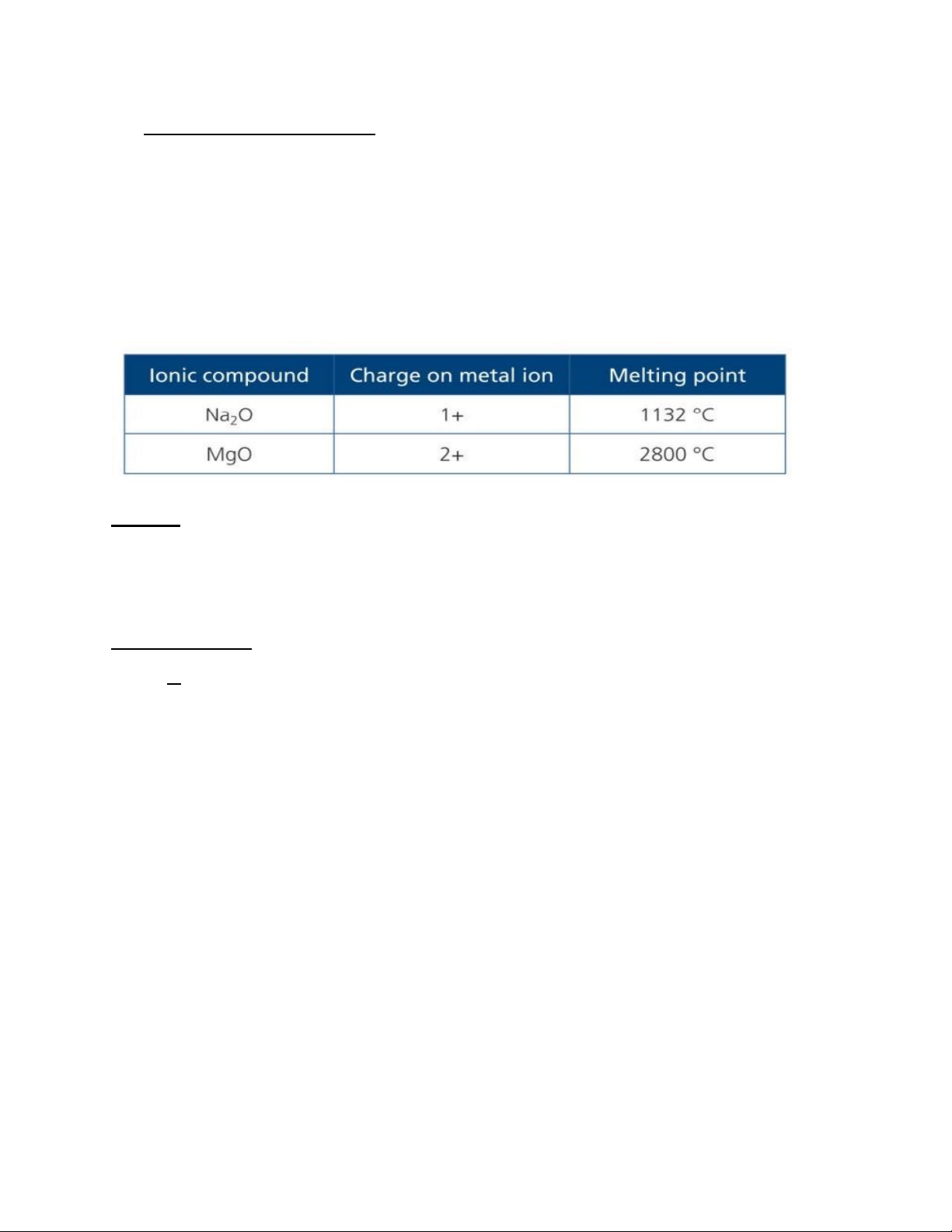
1. Giải thích số liệu thực nghiệm trên.
2. Tại sao hợp chất ion không dẫn điện ở trạng thái rắn, dẫn điện ở trạng thái nóng chảy?
Hướng dẫn giải:
1. Ta thấy: Điện tích ion Mg2+ (2+) > điện tích ion Na+ (1+)
Vì vậy, nhiệt độ nóng chảy của MgO (2800oC) cao hơn rất nhiều so với Na2O (1132oC)
do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion. lOMoAR cPSD| 22014077
2. - Khi nóng chảy hoặc tan trong nước, các ion bị
tách khỏi mạng lưới tinh thể, chuyển động tự do
và là tác nhân dẫn điện.
- Ở trạng thái rắn, các ion không di chuyển tựdo được nên
hợp chất ion không dẫn điện.
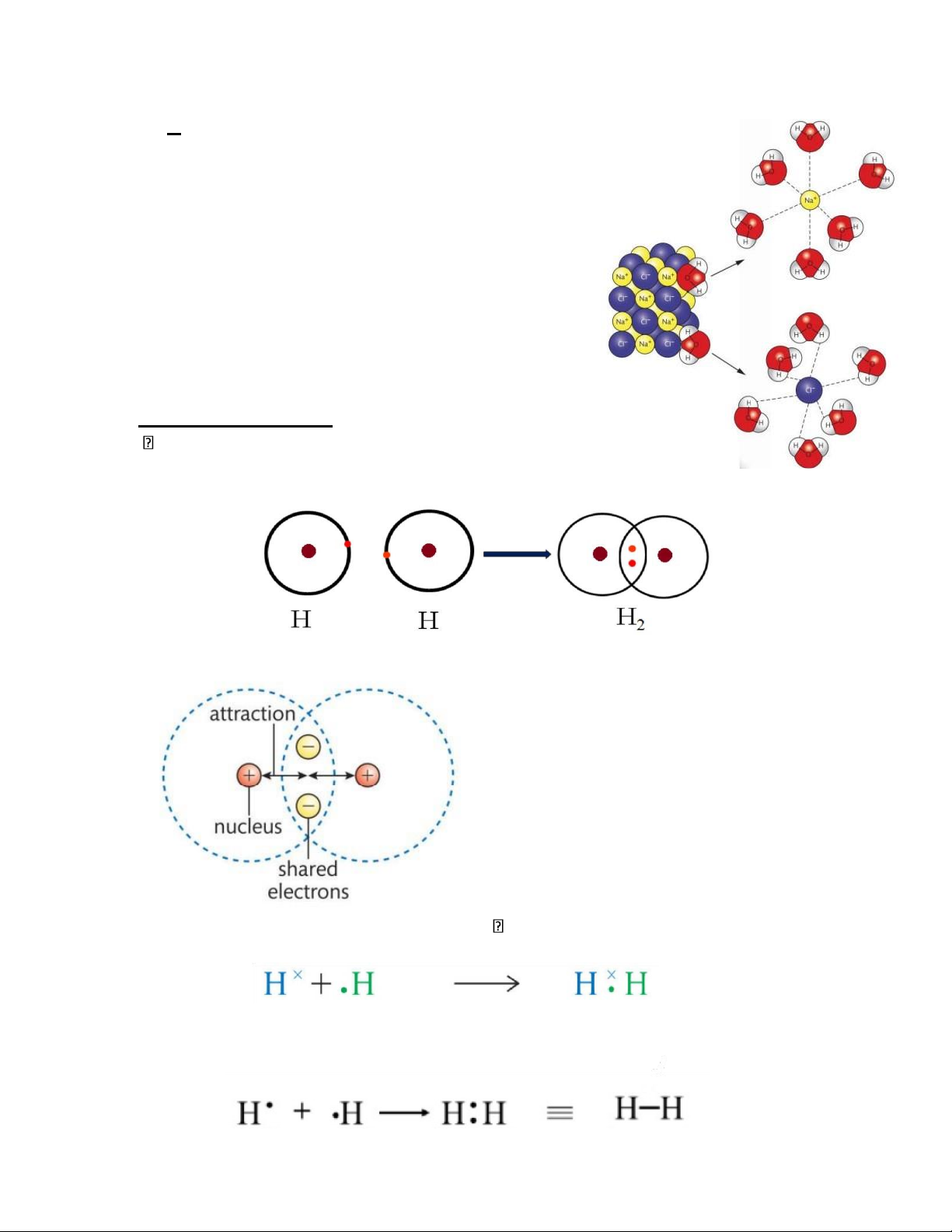
V. Liên kết cộng hóa trị
Liên kết cộng hóa trị hình thành khi hai nguyên tử
dùng chung (sharing) electrons. Bản chất là
tương tác tĩnh điện giữa các hạt nhân và electrons.
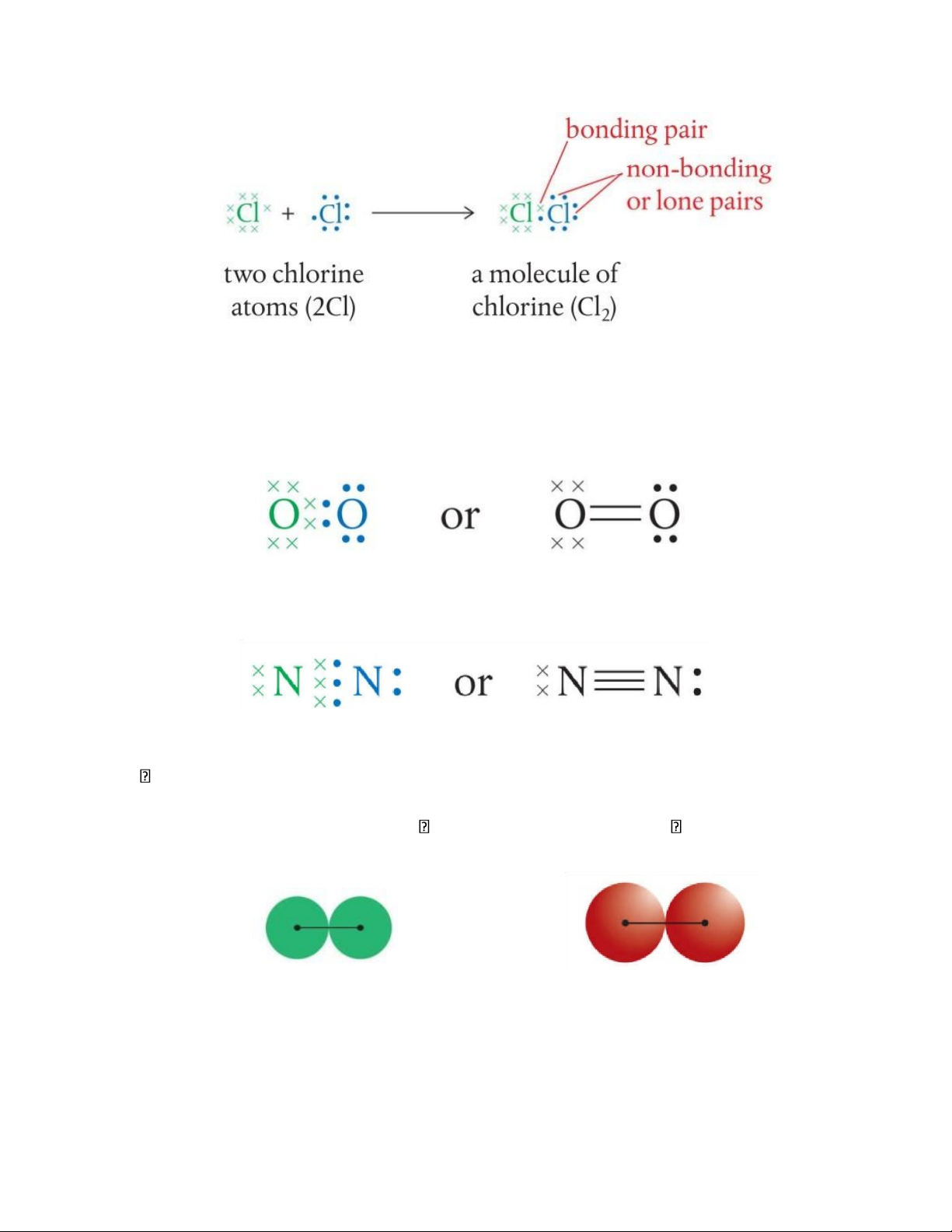
Trừ hydrogen, các nguyên tử chu kì
2 khi phản ứng nhau đều đạt lớp vỏ 8 electron (quy tắc bát tử) lOMoAR cPSD| 22014077
Liên kết đơn:
Liên kết đôi: Liên kết ba: Đặc điểm liên kết:
- Năng lượng liên kết phụ thuộc vào độ dài, độ bội liên kết
- Liên kết càng ngắn năng lượng liên kết càng lớn liên kết càng bền
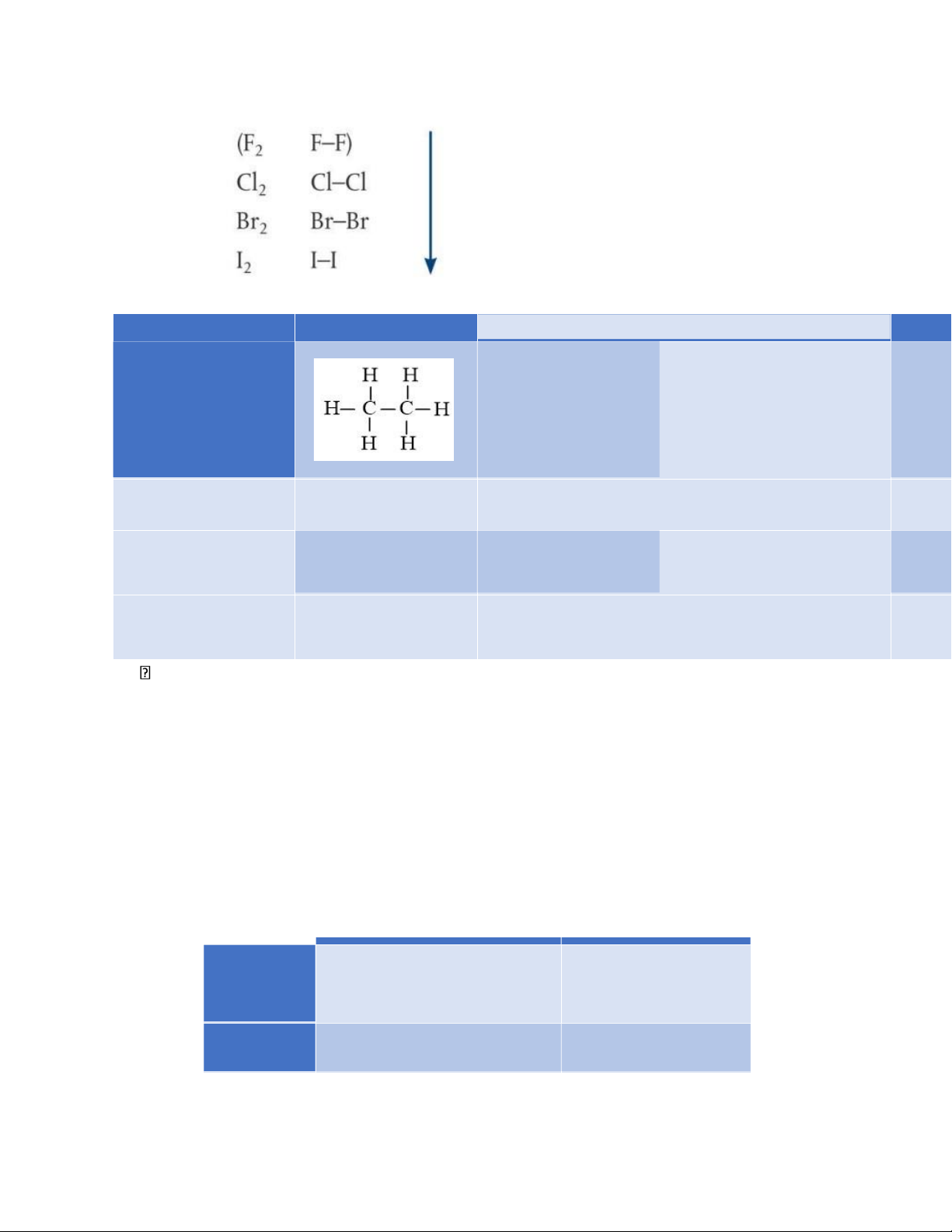
Độ dài liên kết Cl : 199 pmĐộ dài 2 liên kết Br2: 228 pm lOMoAR cPSD| 22014077
Độ dài liên kết càng tăng
Năng lượng liên kết càng giảm Hydrocarbon C2H6
C 2 H 4 C2H2
Công thức cấu tạo
Liên kết giữa các Liên kết đơn nguyên tử carbon Liên kết đôi Liên kết ba
Độ dài liên kết/ pm 154 134 Năng lượng liên kết / kJ.mol-1 346 614 839
Phân loại liên kết cộng hóa trị
- Liên kết cộng hóa trị có cực: Là liên kết hóa học có cặp electron dùng
chung bị hút lệch về phía nguyên tử có độ âm điện mạnh hơn
- Liên kết cộng hóa trị không cực: Là liên kết có cặp electron dùng chung
phân bố đối xứng giữa hai hạt nhân nguyên tử.
- Liên kết cho – nhận: Là liên kết mà cặp electron dùng chung chỉ do một
nguyên tử đóng góp. Nguyên tử đóng góp cặp electron được gọi là
nguyên tử cho còn nguyên tử nhận cặp electron được gọi là nguyên tử
nhận. Liên kết này được biểu diễn bằng mũi tên “→”, nguyên tử cho ở
trước mũi tên còn nguyên tử nhận ở sau mũi tên.
Giá trị độ âm điện của
Sự chênh lệch độ nguyên tử âm điện H – F 2.2 4.0 1.8 lOMoAR cPSD| 22014077 2.2 3.2 1.0 H – Cl H – Br 2.2 3.0 0.8 2.2 2.7 0.5 H - I Ion
Cộng hóa trị phân cực
Cộng hóa trị không phân cực Chuyển hoàn toàn các
Chia sẻ electron không đều Chia sẻ electron đều (Cặp e điện tử
(Cặp e chung không lệch về chung lệch về phía nguyên tử có phía nguyên tử nào) độ âm điện lớn hơn) Na+Cl- HF, HCl, HBr, HI Cl2 Mạng tinh thể ion Phân tử rời rạc
- Điểm khác nhau giữa liên kết ion, liên kết cộng hóa trị có cực và liên
kết cộng hóa trị không cực:
Hiệu độ âm điện dùng để đánh giá loại liên kết trong phân tử hợp chất:
Từ 0,0 đến < 0,4 : liên kết cộng hóa trị không cực
Từ 0,4 đến < 1,7 : liên kết cộng hóa trị có cực ≥ 1,7 : liên kết ion.
* Bài tập 1:Cho X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A; A và Z; Z và X.
* Hướng dẫn giải:
a) Viết cấu hình electron nguyên tử của các nguyên tố: lOMoAR cPSD| 22014077
9X: 1s22s22p5: Là nguyên tố F có độ âm điện (tra bảng độ âm điện) là 3,98
19A: 1s22s22p63s23p64s1 : Là nguyên tố K có độ âm điện là 0,82
9Z: 1s22s22p4: Là nguyên tố O có độ âm điện là 3,44
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A; A và Z; Z và X
– Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16 → có liên kết ion.
– Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62 → có liên kết ion.
– Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54 → có liên kết cộng hóa trị có cực.

