








Preview text:
Bài 1. Để định lượng ion Fe3+ trong dung dịch, người ta tiến hành như sau: lấy chính xác 25,00
ml dung dịch mẫu thử cho vào bình tam giác 250 ml, thêm vài giọt acid sulfosalicylic. Sau đó
tiến hành chuẩn độ bằng dung dịch EDTA 0,1M cho đến khi có sự chuyển màu từ hồng tím
sang vàng nhạt thì dừng lại. Thể tích dung dịch EDTA 0,1M tiêu tốn hết 15,40 ml. Hãy cho biết:
a. Đây là kỹ thuật chuẩn độ gì?
➔ Đây là kỹ thuật chuẩn độ trực tiếp
b. Giải thích vai trò của EDTA, acid sulfosalicyclic trong qui trình trên
➔ EDTA đóng vai trò là chất chuẩn
➔ acid sulfosalicyclic đóng vai trò là chất chỉ thị
c. Xác định hằng số bền điều kiện (p’) của phức chất FeY- trong điều kiện chuẩn độ và giải
thích tại sao quá trình chuẩn độ này có thể thực hiện trong môi trường axit với pH=2.
Có pFe3+ = 1,3.1025 và ở pH = 2 thì α4 = 3,7.10-14 ➔ p’ p
FeY- = α 4 FeY- = 4,81.1011 > 103
➔ Trong môi trường pH= 2 có thể thực hiện chuẩn độ tạo phức ion Fe3+ vì p’FeY- lớn,
biểu thị khả năng tạo phức mạnh.
d. Viết phương trình phản ứng để giải thích vì dừng chuẩn độ khi có sự chuyển màu từ
hồng tím sang vàng nhạt. ➔ Fe3+ + H3Ind FeInd + 3H+ (không màu) (hồng tím) Fe3+ + H2Y2- FeY- + 2H+ FeInd + H2Y2- FeY- + H2Ind- (hồng tím) (vàng nhạt)
e. Xác định nồng độ mol của Fe3+ (mol.l-1) có mặt trong dung dịch.
➔ Khi có sự chuyển màu từ hồng tím sang vàng nhạt thì dừng lại thì phản ứng đang ở
tại điểm tương đương. ➔ F = 1 ➔ CV = CoVo ➔ C.25 = 0,1.15,4 0,1.15,4 ➔ C = = 0,0616M 25
Bài 2. Để xác định độ cứng của nước sinh hoạt, người ta tiến hành phân tích như sau: lấy
chính xác 25,00 ml dung dịch mẫu nước cho vào bình tam giác 250ml, điều chỉnh pH =10
bằng dung dịch NH4OH, sau đó thêm đệm ammoni và vài giọt ET00. Thực hiện chuẩn độ
bằng dung dịch EDTA 0,1M cho đến khi có sự chuyển màu từ đỏ nhỏ sang xanh chàm thì kết
thúc quá trình chuẩn độ. Thể tích của dung dịch EDTA 0,1M tiêu tốn là 8,20 ml. Hãy cho biết:
a. Đây là kỹ thuật chuẩn độ gì?
➔ Đây là kỹ thuật chuẩn độ trực tiếp
b. Giải thích vai trò của EDTA, ET00 trong qui trình phân tích nói trên.
➔ EDTA đóng vai trò là chất chuẩn
➔ ET00 đóng vai trò là chất chỉ thị
c. Giải thích vì sao cần điều chỉnh pH =10 trước khi thực hiện chuẩn độ.
Ở pH = 10 thì α4 = 3,5.10-1 và hằng số bền của phức tạo bởi Ca2+ với EDTA là
5.0×1010, hằng số bền của phức tạo bởi Mg2+ với EDTA là 4.9×108
Đối với Ca2+: p’ = α p 4 = 1,75.1010
Đối với Mg2+: p’ = α p 4 = 1,715.108
➔ Trong môi trường pH= 10 có thể thực hiện chuẩn độ tạo phức ion Ca2+ và Mg2+ vì
p’ lớn, biểu thị khả năng tạo phức mạnh.
d. Viết phương trình phản ứng để giải thích việc dừng chuẩn độ khi có sự chuyển màu từ đỏ nho sang xanh chàm. M2+ + HInd2- MInd- + H+ (chàm) (đỏ nho) M2+ + H2Y2- MY2- + 2H+
Tại điểm tương đương, điểm cuối: màu chuyển từ đỏ nho sang xanh chàm MInd- + H2Y2- MY2- + HInd2- + H+ (đỏ nho) (chàm)
e. Xác định tổng nồng độ của các ion Ca2+ và Mg2+ (mol.l-1) có mặt trong mẫu nước nói trên.
➔ Khi có sự chuyển màu từ hồng tím sang vàng nhạt thì dừng lại thì phản ứng đang ở
tại điểm tương đương. ➔ F = 1 ➔ CV = CoVo ➔ C.25 = 0,1.8,2 0,1.8,2 C = = 0,0328M 25
Bài 3. Định lượng Al3+, Fe3+ trong dung dịch, người ta làm như sau:
Giai đoạn 1: Hút 20,00ml dung dịch EDTA 0,05N cho vào bình tam giác đa có chứa
100,00ml dung dịch hỗn hợp Al3+, Fe3+ có pH=5, đun sôi dung dịch 5 phút, rồi để nguội, thêm
một lượng nhỏ chỉ thị Xylenol da cam. Chuẩn độ EDTA dư trong dung dịch thu được bằng
dung dịch chuẩn Zn2+ 0,02N. Khi dung dịch chuyển từ vàng sang hồng tím thì thể tích Zn 2+ tiêu tốn là 20,00 ml.
Giai đoạn 2: Tiếp tục thêm 5ml dung dịch NaF bão hòa vào dung dịch vừa chuẩn độ, đun
sôi dung dịch trong 2 phút rồi để nguội, bổ sung một lượng nhỏ chỉ thị Xylenol da cam. Sau
đó lại chuẩn độ dung dịch bằng dung dịch chuẩn Zn2+ 0,02N. Khi dung dịch chuyển từ màu
vàng sang hồng tím thì thể tích của Zn2+ tiêu tốn là 2,50 ml.
a. Quy trình này sử dụng các kỹ thuật chuẩn độ gì?
➔ Quy trình gồm 2 giai đoạn, giai đoạn 1 sử dụng kỹ thuật chuẩn độ ngược, giai
đoạn 2 sử dụng kỹ thuật chuẩn độ thay thế
b. Viết các phương trình xảy ra ở giai đoạn 1; Al3+ + H2Y2-(dư) AlY- + 2H+ Fe3+ + H2Y2-(dư) FeY- + 2H+
Phản ứng chuẩn độ: Zn2+ + H2Y2-(dư) ZnY2- + 2H+
Phản ứng chỉ thị (XO): Zn2+ + H3Ind- ZnHInd3- + 2H+
(màu vàng) (màu hồng tím)
c. Giải thích sự đổi màu của chỉ thị.
Màu của chỉ thị khi tạo phức với ion kim loại khác với màu của chỉ thị ở dạng tự do,
gần điểm tương đương complexon lấy kim loại trong phức chất với chỉ thị => giải
phóng chỉ thị dạng tự do làm dung dịch thay đổi màu.
d. Viết các phương trình xảy ra ở giai đoạn 2; AlY- + 6F- + 2H+ AlF 3−¿¿ + H 6 2Y2-
Phản ứng chuẩn độ: Zn2+ + H2Y2-(dư) ZnY2- + 2H+
Phản ứng chỉ thị (XO): Zn2+ + H3Ind- ZnHInd3- + 2H+
(màu vàng) (màu hồng tím)
Bài 4. Lấy 10,00 ml dung dịch hỗn hợp Al3+, Fe3+ có pH = 2. Thêm vào một lượng nhỏ axít
Sunfosalicylic, chuẩn độ dung dịch này bằng dung dịch EDTA 0,02N tốn hết 1,80ml. Nâng
pH của dung dịch lên 5. Thêm tiếp 20,00 ml dung dịch EDTA 0,02N, đun sôi 5 phút, để
nguội, thêm một lượng nhỏ chỉ thị Xylenol da cam và chuẩn độ dung dịch này bằng dung
dịch Zn2+ 0,02N tiêu tốn hết 16,30ml.
a. Quy trình này sử dụng các kỹ thuật chuẩn độ gì?
➔ Quy trình này sử dụng kỹ thuật chuẩn độ trực tiếp và chuẩn độ ngược
b. Xác định hằng số bền điều kiện (p’) của phức chất FeY- và AlY- ở pH = 2 và ở pH = 5.
Có ở pH = 2 thì α4 = 3,7.10-14 và pH = 5 thì α4 = 3,5.10-7. Hằng số bền của phức tạo
bởi Al3+ với EDTA là 1.3×1016, hằng số bền của phức tạo bởi Fe3+ với EDTA là 1.3×1025 ✓ Ở pH = 2:
Đối với Al3+: p’ = α p 4 = 481
Đối với Fe3+: p’ = α p 4 = 4,81.1011 ✓ Ở pH = 5:
Đối với Al3+: p’ = α p 4 = 4,55.109
Đối với Fe3+: p’ = α p 4 = 4,55.1018
c. Viết các phương trình phản ứng xảy ra. Giải thích sự đổi màu của chỉ thị. Fe3+ + H3Ind FeInd + 3H+ (không màu) (hồng tím) Fe3+ + H2Y2- FeY- + 2H+ FeInd + H2Y2- FeY- + H2Ind- (hồng tím) (vàng nhạt) Al3+ + H3Ind AlInd + 3H+ (không màu) (không màu) Al3+ + H2Y2-(dư) AlY- + 2H+ Zn2+ + H2Y2-(dư) ZnY2- + 2H+ Zn2+ + H3Ind- ZnHInd3- + 2H+ (màu vàng) (màu hồng tím)
Thí nghiệm ở pH = 2, khi sử dụng chỉ thị axít Sunfosalicylic tại điểm cuối chuẩn độ màu
chuyển từ hồng tím sang vàng nhạt, đó là màu của phức chất Fe3+ và EDTA. Thí nghiệm ở pH
= 5, khi sử dụng chỉ thị XO tại điểm cuối chuẩn độ màu chuyển từ vàng sang hồng tím vì
màu của chỉ thị khi tạo phức với ion Zn2+ khác với màu của chỉ thị ở dạng tự do
Bài 5. Lấy 10,00 ml dung dịch chứa ion Pb2+ cho vào bình tam giác 250ml. Thêm vào đó
20ml dung dịch MgY2- được pha trong dung dịch đệm amoni có pH= 10 và vài giọt chất chỉ
thị. Chuẩn độ Mg2+ vừa giải phóng ra bằng dung dịch chuẩn H2Y2- 0,02N thì tốn hết 8,50ml.
a. Cho biết quy trình này sử dụng kỹ thuật chuẩn độ gì?
➔ Đây là kỹ thuật chuẩn độ thay thế
b. Viết các phương trình phản ứng xảy ra. Pb2+ + MgY2- Mg2+ + PbY2- Mg2+ + HInd2- MgInd- + H+ (chàm) (đỏ nho) Mg2+ + H2Y2- MgY2- + 2H+
Tại điểm tương đương, điểm cuối: màu chuyển từ đỏ nho sang xanh chàm MgInd- + H2Y2- MgY2- + HInd2- + H+ (đỏ) (xanh chàm)
c. Xác định loại chỉ thị sử dụng trong quá trình phân tích nói trên và giải thích sự đổi
màu của dung dịch trong quá trình chuẩn độ.
➔ Chỉ thị sử dụng trong quá trình phân tích nói trên là ETOO. Màu của chỉ thị khi
tạo phức với ion Mg2+ khác với màu của chỉ thị ở dạng tự do, gần điểm tương
đương complexon lấy kim loại trong phức chất với chỉ thị (màu đỏ nho) và giải
phóng chỉ thị dạng tự do (màu xanh chàm) làm dung dịch thay đổi màu.
Bài 6. Để xác định hàm luợng Ca2+ và Mg2+ trong một mẫu muối, người ta thực hiện các bước như sau:
Cân 10,021 g mẫu muối, hòa tan trong nước cất, cho vào bình định mức 250 ml sau đó bổ
sung nước đến vạch định mức, ta thu được dung dịch 1
Giai đoạn 1: Lấy chính xác 10,00ml dung dịch 1 + 3ml NaOH 2N + 1 ít chỉ thị murexit,
lắc đến tan hoàn toàn. Chuẩn độ dung dịch thu được bằng dung dịch chuẩn EDTA đến khi
dung dịch chuyển từ đỏ sang tím hoa cà. Lặp lại thí nghiệm 3 lần, lấy kết quả trung bình. Thể
tích dung dịch chuẩn EDTA tiêu tốn là 8,20 ml.
Giai đoạn 2: Lấy chính xác 10ml dung dịch 1 khác + 10ml đệm pH 10 + 1 ít chỉ thị
ETOO. Chuẩn bằng dd chuẩn EDTA cho đến khi dung dịch chuyển từ đỏ nho sang xanh
chàm. Lặp lại thí nghiệm 3 lần, lấy kết quả trung bình. Thể tích dung dịch chuẩn EDTA tiêu tốn là 24,60 ml.
Giai đoạn 3: Để xác định nồng độ của dung dịch chuẩn EDTA người ta hòa tan 0,625g
CaCO3 nguyên chất trong HCl và pha loãng thành 250 ml (sử dụng bình định mức 250ml). Chuẩn độ
25,00 ml dung dịch này thì tiêu tốn 24,20 ml EDTA nói trên.
a. Cho biết ý nghĩa của các giai đoạn 1, 2 và 3.
✓ Giai đoạn 1 có ý nghĩa định lượng ion Ca2+
✓ Giai đoạn 2 có ý nghĩa định lượng tổng Ca2+ và Mg2+
✓ Giai đoạn 3 để xác định nồng độ của dung dịch chuẩn EDTA
Bài 7. Chuẩn độ 25,00 ml dung dịch X gồm có Pb2+ và Ni2+ ở pH =10 phải dùng hết
21,40 ml EDTA 0,02M để phản ứng hết với cả hai kim loại.
Lấy 25,00 ml dung dịch X mới, bổ sung thêm dung dịch KCN dư để che Ni2+. Chuẩn độ dung
dịch thu được tiêu tốn hết 12,05 ml EDTA 0,02M.
a. Đề xuất chất chỉ thị sử dụng cho quá trình phân tích nói trên
➔ Đề xuất chỉ thị ETOO cho quá trình phân tích trên
b. Hằng số bền của phức chất [Ni(CN)4]2- như thế nào so với hằng số bền của NiY2-
Hằng số bền của phức chất [Ni(CN)4]2- lớn hơn so với hằng số bền của NiY2- vì Ni2+
tạo phức với CN- có số phối trí là 4 tạo phức bền che Ni2+ và không còn bị ảnh hưởng
bởi quá trình tạo phức của EDTA.
c. Viết các phương trình phản ứng xảy ra trong 2 quá trình chuẩn độ nói trên (Biết Ni2+
tạo phức với CN- có số phối trí là 4). ✓ Quá trình 1: Pb2+ + H2Y2-(dư) PbY2- + 2H+ Ni2+ + H2Y2-(dư) NiY2- + 2H+ ✓ Quá trình 2: Ni2+ + 4CN- [Ni(CN)4]2- Pb2+ + H2Y2-(dư) PbY2- + 2H+
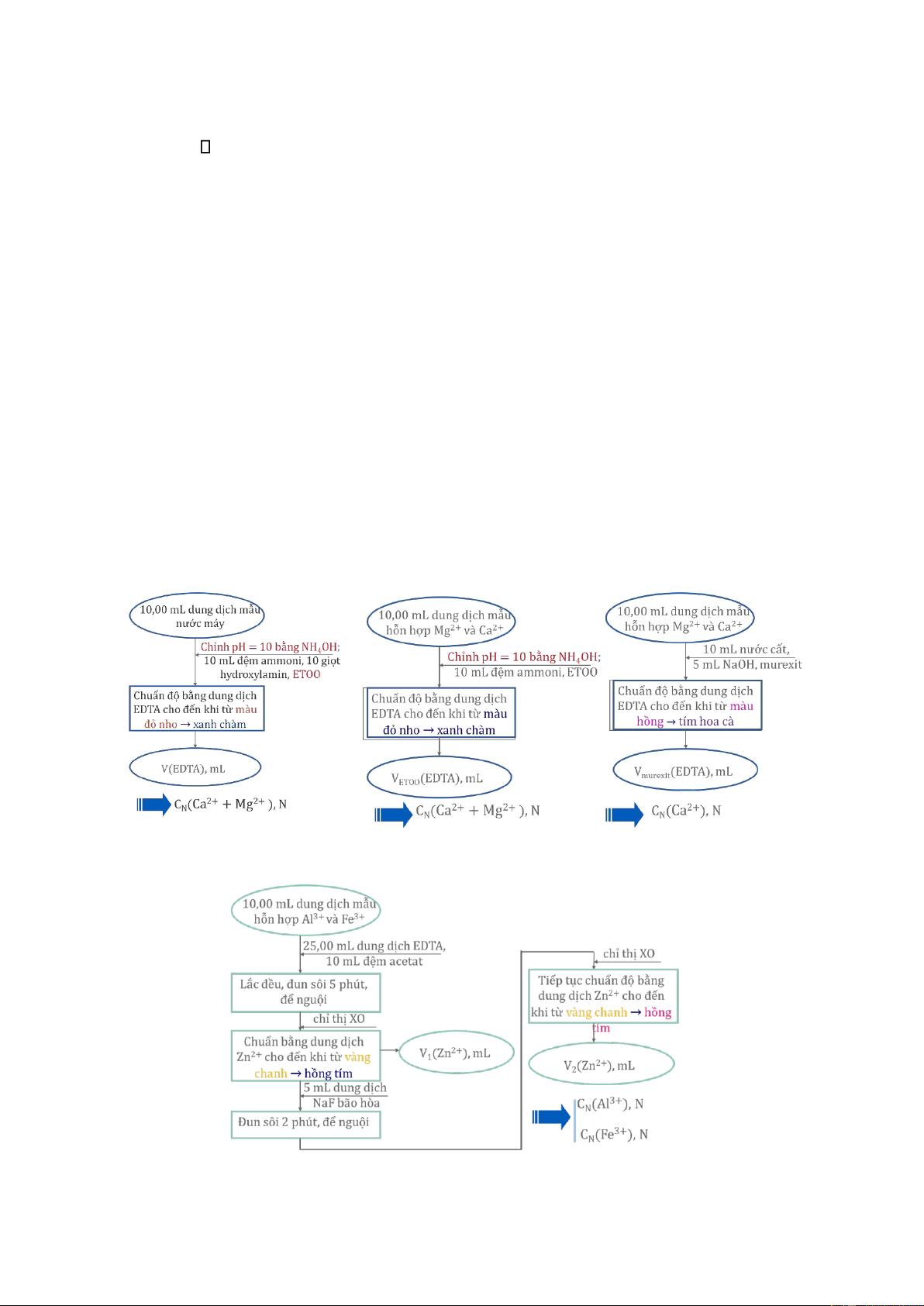
Bài 8. Trình bày các quy trình phân tích được cho ở các hình kèm theo với các nội dung sau: 1. Hình 8a:
a. Chất cần phân tích: dung dịch mẫu nước máy (định lượng tổng nồng độ Ca2+ và Mg2+)
b. Mô tả quá trình chuẩn độ, kèm theo các phản ứng hóa học.
Cho vào bình tam giác 10ml dung dịch mẫu nước máy, chỉnh pH = 10 bằng NH4OH.
Sau đó bổ sung 10ml đệm ammoni, 10 giọt hydroxylamin và ETOO để quá trình tạo
phức giữa Ca2+ và Mg2+ với EDTA diễn ra. Chuẩn độ bằng dung dịch EDTA cho đến
khi từ màu đỏ nho sang màu xanh chàm. Sau đó đọc thể tích EDTA đã tiêu tốn. M2+ + HInd2- MInd- + H+ (chàm) (đỏ nho) M2+ + HY3- MY2- + H+
Tại điểm tương đương, điểm cuối: màu chuyển từ đỏ nho sang xanh chàm MInd- + HY3- MY2- + HInd2- (đỏ nho) (chàm)
c. Vai trò của mỗi hóa chất và các thao tác được sử dụng trong sơ đồ chuẩn độ.
Đây là kỹ thuật chuẩn độ trực tiếp
- NH4OH có vai trò làm tăng pH trong môi trường pH= 10 có thể thực hiện chuẩn độ
tạo phức ion Ca2+ và Mg2+ vì p’ lớn, biểu thị khả năng tạo phức mạnh
- Đệm ammoni là hệ đệm giúp ổn định pH
- Hydroxylamin có vai trò loại trừ ảnh hưởng của ion Mn2+ có trong nước - ETOO là chỉ thị - EDTA là chất chuẩn 2. Hình 8b:
a. Chất cần phân tích: dung dịch mẫu hỗn hợp Ca2+ và Mg2+
b. Mô tả quá trình chuẩn độ, kèm theo các phản ứng hóa học.
✓ Giai đoạn 1: Cho vào bình tam giác 10ml dung dịch mẫu nước máy, chỉnh pH = 10
bằng NH4OH. Sau đó bổ sung 10ml đệm ammoni, và ETOO để quá trình tạo phức giữa
Ca2+ và Mg2+ với EDTA diễn ra. Chuẩn độ bằng dung dịch EDTA cho đến khi từ màu
đỏ nho sang màu xanh chàm. Sau đó đọc thể tích EDTA đã tiêu tốn. M2+ + HInd2- MInd- + H+ (chàm) (đỏ nho) M2+ + HY3- MY2- + H+
Tại điểm tương đương, điểm cuối: màu chuyển từ đỏ nho sang xanh chàm MInd- + HY3- MY2- + HInd2- (đỏ nho) (chàm)
✓ Giai đoạn 2: Cho vào bình tam giác 10ml dung dịch mẫu nước máy. Sau đó bổ sung
10ml H2O, 5ml NaOH và murexit để quá trình tạo phức giữa Ca2+ với EDTA diễn ra.
Chuẩn độ bằng dung dịch EDTA cho đến khi từ màu hồng sang màu tím hoa cà. Sau
đó đọc thể tích EDTA đã tiêu tốn. Ca2+ + H2Ind3- CaInd3- + 2H+ (tím hoa cà) (hồng) Ca2+ + H2Y2- CaY2- + 2H+
Tại điểm tương đương, điểm cuối: màu chuyển từ hồng sang màu tím hoa cà CaInd3- + H2Y2- CaY2- + H2Ind3- (hồng) (tím hoa cà)
c. Vai trò của mỗi hóa chất và các thao tác được sử dụng trong sơ đồ chuẩn độ.
Đây là kỹ thuật chuẩn độ trực tiếp ở cả 2 giai đoạn ✓ Giai đoạn 1:
- NH4OH có vai trò làm tăng pH trong môi trường pH= 10 có thể thực hiện chuẩn độ
tạo phức ion Ca2+ và Mg2+ vì p’ lớn, biểu thị khả năng tạo phức mạnh
- Đệm ammoni là hệ đệm giúp ổn định pH - ETOO là chỉ thị - EDTA là chất chuẩn ✓ Giai đoạn 2:
- NaOH có vai trò làm tăng pH mạnh vì phản ứng tạo phức CaY2- thực hiện ở pH = 12 - Muxerit là chỉ thị - EDTA là chất chuẩn 3. Hình 8c:
a. Chất cần phân tích: dung dịch mẫu hỗn hợp Al3+ và Fe3+
b. Mô tả quá trình chuẩn độ, kèm theo các phản ứng hóa học.
Giai đoạn 1: Cho vào bình tam giác 10ml dung dịch mẫu hỗn hợp Al3+ và Fe3. Sau đó bổ sung
25ml dd EDTA và 10ml đệm acetat để quá trình tạo phức giữa hỗn hợp Al3+ và Fe3+ với EDTA
diễn ra. Lắc đều, đun sôi 5 phút, để nguôi sau đó thêm vài giọt chỉ thị XO vào bình tam giác.
Chuẩn độ bằng dung dịch Zn2+ cho đến khi từ màu vàng chanh sang màu hồng tím. Sau đó
đọc thể tích (V1) Zn2+ đã tiêu tốn.
Giai đoạn 2: Thêm tiếp 5ml dung dịch NaF bão hòa vào bình, đun sôi 2 phút, để nguội, thêm
một lượng nhỏ chỉ thị Xylenol da cam và chuẩn độ dung dịch này bằng dung dịch Zn2+ cho
đến khi từ màu vàng chanh sang màu hồng. Sau đó đọc thể tích (V2) Zn2+ đã tiêu tốn. ✓ Giai đoạn 1: Al3+ + H2Y2-(dư) AlY- + 2H+ Fe3+ + H2Y2-(dư) FeY- + 2H+
Phản ứng chuẩn độ: Zn2+ + H2Y2-(dư) ZnY2- + 2H+
Phản ứng chỉ thị (XO): Zn2+ + H3Ind- ZnHInd3- + 2H+ (màu vàng) (màu hồng tím) ✓ Giai đoạn 2: AlY- + 6F- + 2H+ AlF3−¿¿ + H 6 2Y2-
Phản ứng chuẩn độ: Zn2+ + H2Y2-(dư) ZnY2- + 2H+
Phản ứng chỉ thị (XO): Zn2+ + H3Ind- ZnHInd3- + 2H+ (màu vàng) (màu hồng tím)
c. Vai trò của mỗi hóa chất và các thao tác được sử dụng trong sơ đồ chuẩn độ.
Quy trình sử dụng kỹ thuật chuẩn độ ngược và chuẩn độ thay thế
- Đệm acetat là hệ đệm giúp ổn định pH
- EDTA để tạo phức với Al3+ và Fe3+ - XO là chỉ thị - Zn2+ là chất chuẩn
- Lắc đều, đun sôi 5 phút, để nguội để quá trình tạo phức giữa Al 3+ và Fe3+ và EDTA diễn ra hoàn toàn
- Sau khi chuẩn EDTA dư bằng thể tích (V1) Zn2+ có thể tính được nồng độ Al3+ và Fe3+
- Thêm tiếp 5ml dung dịch NaF bão hòa vào bình để ion F- thay thế complexon của Al3+
- Đun sôi 2 phút, để nguội, thêm một lượng nhỏ chỉ thị Xylenol da cam vì khi đun sôi
chỉ thị XO đã cho trước đó bị phân hủy nên cần phải bổ sung lại và để cho phản ứng
giữa AlY- và F- diễn ra hoàn toàn tạo ra AlF3−¿¿ 6 Hình 8a Hình 8b Hình 8c
Bài 9. Tìm hiểu về Tiêu chuẩn Việt Nam TCVN 1272:1986 (Về thuốc thử, hoá chất tinh khiết
đặc biệt và phương pháp complexon xác định hàm lượng chất chính) và so sánh các quy trình
phân tích Ca2+, Mg2+, Al3+ và Fe3+ theo TCVN 1272:1986 và trong các quy trình phân tích đã
được học về (i) Kỹ thuật phân tích, (ii) dung dịch chuẩn, (iii) chỉ thị, (iv) các bước tiến hành. (i) Kĩ thuật phân tích:
- TCVN 1272-1986: Tiêu chuẩn này nêu ra 2 kiểu chuẩn độ complexon. Là chuẩn độ trực tiếp và chuẩn độ ngược
- Còn trong quá trình phân tích đã được học, ngoài hai cách chuẩn độ như trên còn có chuẩn độ thay thế (ii) Dung dịch chuẩn:
-TCVN 1272-1986: Amoni axetat, dung dịch 2% và 20%, thêm axit axetic đến pH= 4,5
(Kiểm tra trên máy đo pH); Amoni clorua; Amoni hydroxit không chứa cabon dioxit, dung dịch
25%; 1:5 và 1:1; Amoni sunfat; Axit axetic đóng băng, dung dịch 1:10 và 1N; Axit boric, dung
dịch 3%; Axit clohydric đậm đặc, dung dịch 1:1, 1N, 6N và 25%; Axit nitric đậm đặc, dung
dịch 1:1 và 25%; Axit sunfuric đậm đặc, dung dịch 1:1 và 16 %; Bạc nitrat, dung dịch 0,1N;
Cadimi sunfat (3CdSO4.8H2O), dung dịch 0,05M chuẩn bị như sau: hoà tan 38,28 g muối vào
nước, thêm 0,1ml dung dịch axit sunfuric 16% và thêm nước đến 1l; Dinatri etylen diamin
tetraaxetic axit (complexon III) dung dịch 0,05M và 0,01M chuẩn bị theo điều 3.2; Hydrazin
sunfat; Hidro peoxit 30%; Kali clorua; Kali hidroxit; dung dịch 25%; Kali nitrat; Kali
pyrosunfat; Kẽm kim loại( kẽm đúc) 99,975 -99,99% Kẽm sunfat( ZnSO4.7H2O),
dung dịch 0,05M chuẩn bị theo điều 3.3; Muối kẽm, dung dịch chính xác 0,05M chuẩn bị
theo điều 3.1; Natri axetat (NaCH3COO.3H2O); Natri cacbonat khan; Natri clorua; Natri
hydroxit, dung dịch 50% không chua cacbondioxit, dung dịch 1N; Natri tetraborat-borax
(Na2B4O7.10H2O) dung dịch 0,05M; nước cất theo TCVN 2117-77; Rượu etylic 36%
- Còn trong quá trình phân tích đã được học thì cũng sử dụng một số dung dịch chuẩn giống như TCVN 1272-1986. (iii) Chỉ thị:
- TCVN 1272-1986 Axit sunfosalixylic, dung dịch 10% Berilon II, dung dịch 0,05% dùng tốt
trong vòng 1 tháng: Camagit, chỉ thị hỗn hợp; Canxein( fluorexon) dung dịch 0,1% dùng tốt
trong 7 ngày, hỗn hợp chỉ thị giữ trong lọ thuỷ tinh màu, kín; Giấy chỉ thị vạn năng; Giấy
công gô; Giấy quì Glyxintimol xanh, hỗn hợp chỉ thị, giữ trong lọ thủy tinh màu, kín;
Murexit, hỗn hợp chỉ thị, giữ trong lọ bằng thuỷ tinh màu, kin; PAR (4-2-piridin-azo)-
rezorain; dung dịch 0,1%; Pirocatechin tím, dung dịch 0,1% dùng tốt trong 1 tháng; hỗn hợp
chỉ thị, giữ trong lọ thuỷ tinh màu và kín; Sunfasazen dung dịch 0,05% trong dung dịch borac
0,05M, dùng tốt trong 15 ngày; TAR[ 4-(2-Tiazolilazo)-rezorsin], dung dịch 0,1% variamin
xanh B, hỗn hợp chỉ thị; Xylenol da cam, dung dịch 0,1% dùng tốt trong 14 ngày, hỗn hợp
chỉ thị giữ trong lọ kín, thuỷ tinh màu.
- Còn trong quá trình phân tích đã được học Eriocrom đen T (NET,ETOO); Murexit; Xylenol
(XO); axit Sulfosalycylic (SSA)
(iv) Các bước tiến hành: - TCVN 1272-1986 1. Canxi
Pha loãng dung dịch chứa 55-65 mg canxi đến thể tích 100 ml, thêm ml dung dịch kali
hidroxyt( đến pH=12), 0,5 ml dung dịch canxion và chuẩn độ bằng dung dịch complexon III
đến khi màu của dung dịch chuyển từ đỏ tím sang xanh da trời.
Chú thích: Cho phép chuẩn độ với 1 ml dung dịch Fluorexon chuẩn trên đen hoặc trong ánh
sáng tử ngoại, đến khi hết huỳnh quang ánh xanh vàng và dung dịch có màu hồng. Khi dùng
chỉ thị metyltimola xanh, màu dung dịch chuyển từ xanh sang xám. 2. Magiê
Dung dịch chứa 33-38 mg magiê, pha loãng bằng nước đến 100 ml, thêm 5 ml dung dịch I,
khoảng 0,1g hỗn hợp chỉ thị eriochrom đen T hoặc 0,3 ml dung dịch berilon II và chuẩn độ
bằng dung dịch complexon III 0,05 M đến chuyển màu dung dịch từ đỏ tím sang xanh (nếu
dùng eriochrom đen T) hoặc xanh sang tím ( nếu dùng berilon II).
Cho phép chuẩn độ dùng chỉ thị camagit, khi đó màu dung dịch chuyển từ đỏ sang xanh. 3. Nhôm
Cho 40 ml dung dịch complexon III 0,05M vào dung dịch chứa 40-53 mg nhôm( pH 2,5-3,0),
thêm 15 ml dung dịch đệm II và đun sôi 5 phút, sau đó để nguội, thêm 0,3 ml hoặc khoảng
0,1g hỗn hợp chỉ thị xylenol da cam và chuẩn độ bằng dung dịch kẽm sunfat đến khi màu
dung dịch chuyển từ vàng sang hồng. 4. Sắt
Pha loãng dung dịch chứa 80-90 mg sắt và 9 ml dung dịch axit clohydric 1N đến 200 ml ( pH
khoảng 1,5) , thêm 1 ml dung dịch axit sunfosalixilic. Đung dung dịch đến khoảng nhiệt độ
60-700C và chuẩn nóng bằng dung dịch complexon III 0,05M đến khi màu đỏ nho của dung
dịch chuyển sang màu vàng. Nên so sánh với màu của một dung dịch đã được chuẩn độ trong cùng một điều kiện
- Còn trong quá trình phân tích đã được học thì cũng tiến hành giống như TCVN 1272-1986.




