


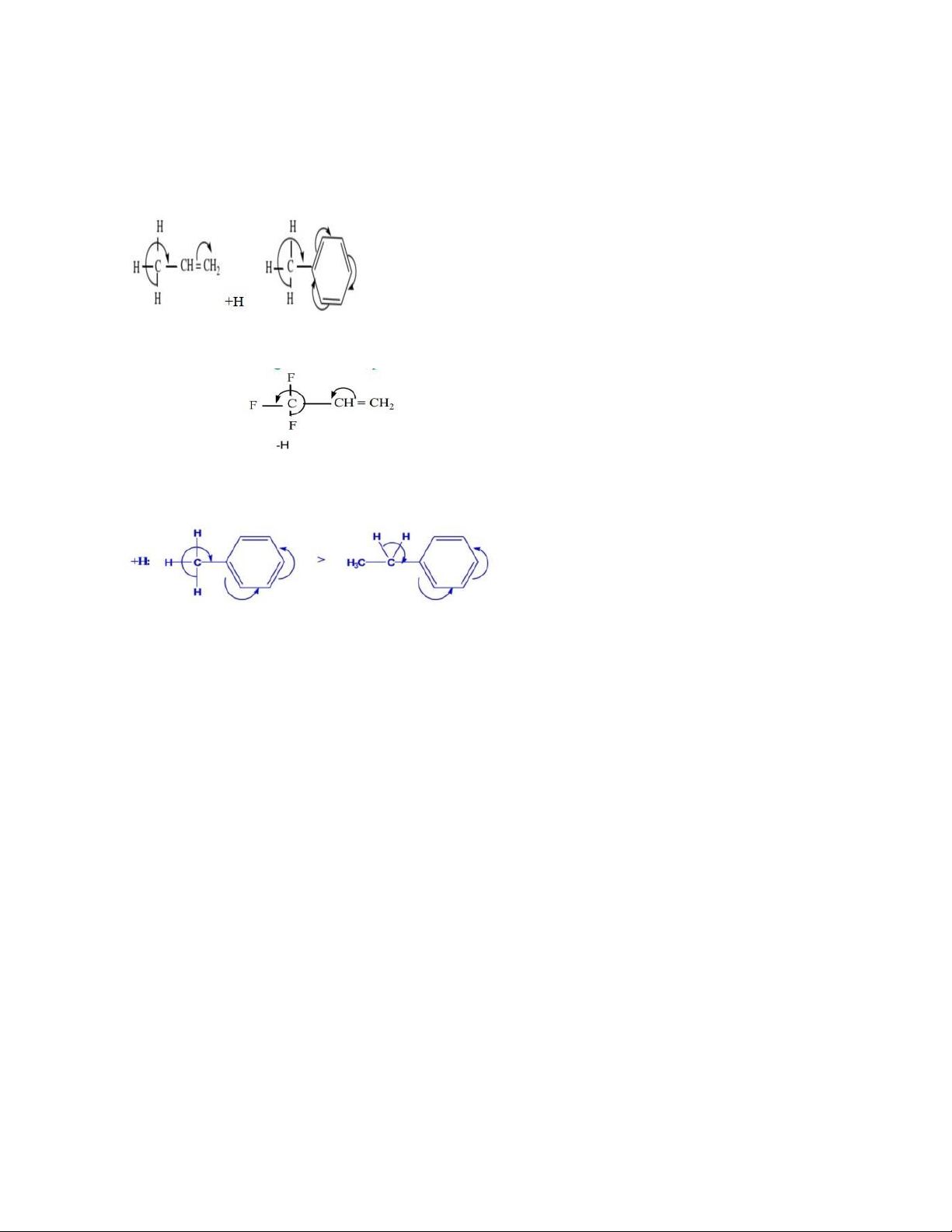
Preview text:
NỘI DUNG LÝ THUYẾT HÓA HỮU CƠ CUỐI KỲ
1. Phân biệt phản ứng tách loại E1 và E2 Phản ứng E1 Phản ứng E2 Căn cứ Phản ứng E1 xảy ra khi
Phản ứng E2 xảy ra khi có hoàn toàn không có bazơ bazơ mạnh. hoặc khi có bazơ yếu Cơ chế
Cơ chế phản ứng của phản
Cơ chế phản ứng của phản
ứng E1 được gọi là sự loại
ứng E2 được gọi là loại bỏ bỏ đơn phân tử. hai phân tử. Các bước
Phản ứng E1 là phản ứng
Cơ chế phản ứng E2 là phản hai bước. ứng khử một bước. Sự hình thành Phản ứng E1 tạo thành
Phản ứng của E2 không tạo cacbocation cacbocation là hợp chất thành cacbocation nào. trung gian. Vài cái tên khác
Phản ứng E1 được gọi là
Phản ứng E2 được gọi là
phản ứng khử đơn phân tử. loại bỏ hai phân tử. Ví dụ
Phản ứng E1 thường gặp ở Phản ứng E2 thường gặp ở các ankyl halogenua bậc ba
các ankyl halogenua sơ cấp
và một số ankyl halogenua và một số ankyl halogenua bậc hai. thứ cấp.
2. Phân biệt phản ứng thế SN1 và SN2
1) Trạng thái trung gian / chuyển tiếp:
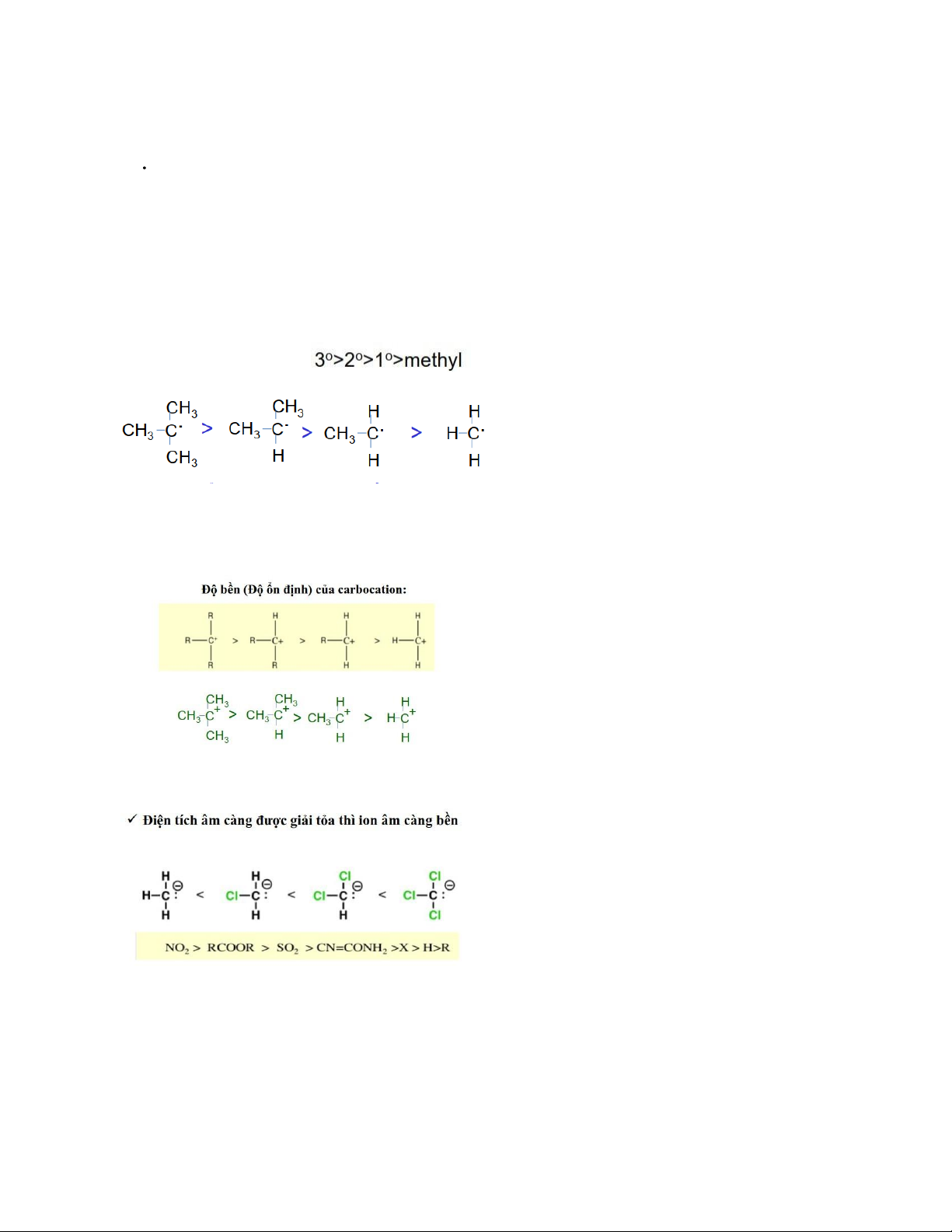
- Carbocation bền: phenyl > allyl > bậc 3 > bậc 2 > bậc 1.
Như đã trình bày, carbocation tạo thành càng bền thì phản ứng xảy ra càng nhanh, và do
đó càng ưu tiên theo hướng SN1. - Hiệu ứng lập thể.
Phản ứng SN2 tạo thành trung gian trong đó có 1 nguyên tử carbon tồn tại 5 "liên kết".
Do đó, để trạng thái trung gian này càng ổn định thì không gian xung quanh nguyên tử
carbon đó phải càng nhiều. Vậy, theo thứ tự ưu tiên cơ chế SN2 thì carbon bậc 1 > bậc 2 > bậc 3.
Ngoài ra, tương tự SN1, trạng thái trung gian của SN2 có một phần điện tích âm, do đó
càng có nhiều nhóm rút và ít nhóm cho cũng sẽ làm cho trạng thái trung gian bền hơn, và
ưu tiên phản ứng theo SN2. 2) Nhiệt độ:
- SN1 cần nhiệt độ cao: Do phản ứng SN1 có 2 giai đoạn và trong đó có giai đoạn cắt đứt
liên kết, nên nhiệt độ sẽ cung cấp năng lượng cho giai đoạn này xảy ra nhanh hơn.
- SN2 không cần nhiệt độ cao: Cơ chế của phản ứng SN2 xảy ra sự cắt đứt liên kết và sự
hình thành liên kết mới gần như cùng lúc, do đó có thể xem như chúng bù trừ nhau về
mặt năng lượng. Vì vậy, có thể không cần nhiệt độ vẫn có thể xảy ra phản ứng SN2. 3) Dung môi:
- Phản ứng SN1 tạo thành trung gian là carbocation, do đó dung môi càng phân cực sẽ tạo
hiệu ứng solvat hóa càng tốt cho carbocation, làm carbocation bền hơn => phản ứng xảy ra nhanh hơn.
- Phản ứng SN2 có trạng thái chuyển tiếp gồm 1 điện tích âm giải tỏa trên 3 nguyên tử,
do đó không cần dung môi phân cực như SN1. Tuy nhiên, điều này không có nghĩa là
dung môi càng kém phân cực càng ưu tiên SN2. Dung môi rất kém phân cực có thể dẫn
đến phản ứng tách loại E2 (với cùng tác nhân) thay vì phản ứng SN2.
3. Nêu quy tắc tách Zeisev, quy tắc tách Hofmann. Trong những trường hợp
nào thì sản phẩm tạo thành theo quy tắc tách Hofmann chiếm ưu thế? Cho ví dụ? - Quy tắc tách Zeisev: H
ở C bậc cao nhất sẽ ưu tiên tách cùng nhóm X và tạo nối đôi có nhiều nhóm alkyl nhất
- Quy tắc tách Hofmann: X tách cùng H ở C bậc thấp hơn - Nếu:
+ gốc R của R-X chứa nhiều nhóm thế kích thước lớn,
+ tác nhân base có kích thước lớn
+ nhóm thế X mang điện tích dương có kích thước lớn (N+R3, S+R2, SO2R,…)
⟶ Tách Hofman chiếm ưu thế: X tách cùng H ở C bậc thấp hơn
4. Nêu quy tắc cộng Markovnikov, Cho ví dụ. -Những trường hợp nào cộng
trái Markovnikov (Kharasch), cho ví dụ?
- Quy tắc Markovnikov: Phản ứng cộng tác nhân không đối xứng (HX, HOH,…) vào hợp
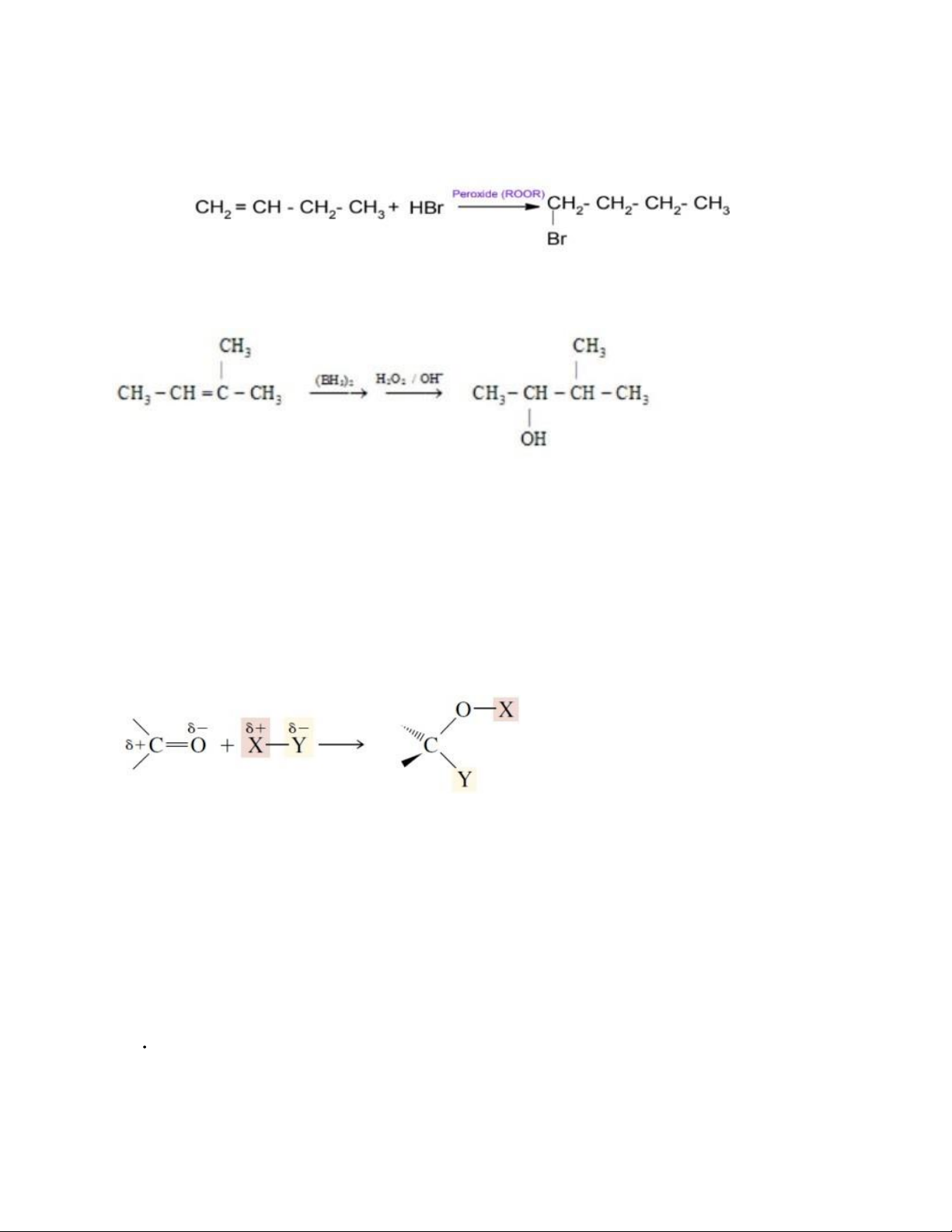
chất có liên kết bội bất đối xứng sẽ ưu tiên xảy ra theo hướng tạo thành carbocation trung gian bền hơn. Nhāng trường hợp cộng trái Markovnikov (Kharasch): - Cộng H-Br theo quy tắc Kharasch (trái Markovnikov): có mặt oxy hoặc các hợp chất Peroxide
- Những trường hợp cộng trái Markovnikov (Kharasch):
+ Cộng H-Br theo quy tắc Kharasch (trái Markovnikov): có mặt oxy hoặc các hợp chất peroxide
+ Phản ứng hydrobo hóa – cộng hợp B2H6:
5. Phản ứng cộng ái nhân, các yếu tố ảnh hưởng đến khả năng phản ứng cộng ái nhân
- Thường là cộng nucleophile vào nối đôi C = O của nhóm cacbonyl - Chất ái nhân
+ Mang điện tích âm: HO-, RO-, NC-, carbanion…
+ Chứa dị tố, có cặp điện tử tự do: H2O, ROH, NH3, amin...
- Các yếu tố ảnh hưởng đến khả năng phản ứng cộng ái nhân:
+ Nhóm thế -I, -C, -H gắn trực tiếp với nguyên tử C (của C=O)
→ khả năng phản ứng và ngược lại
+ Nhóm thế gắn với nguyên tử C (của C=O) càng cồng kềnh → khả năng phản ứng
6. Khái niệm gốc tự do, carbocation, carbanion. Độ ổn định (độ bền) của gốc tự
do, carbocation, carbanion? a. Gốc tự do:
- Là nguyên tử hay nhóm nguyên tử chứa e độc thân
- Độ ổn định của gốc C:
b. Carbocation: ion dương mà điện tích (+) tập trung ở nguyên tử C
c. Carbanion: ion âm mà điện tích (-) tập trung ở nguyên tử C
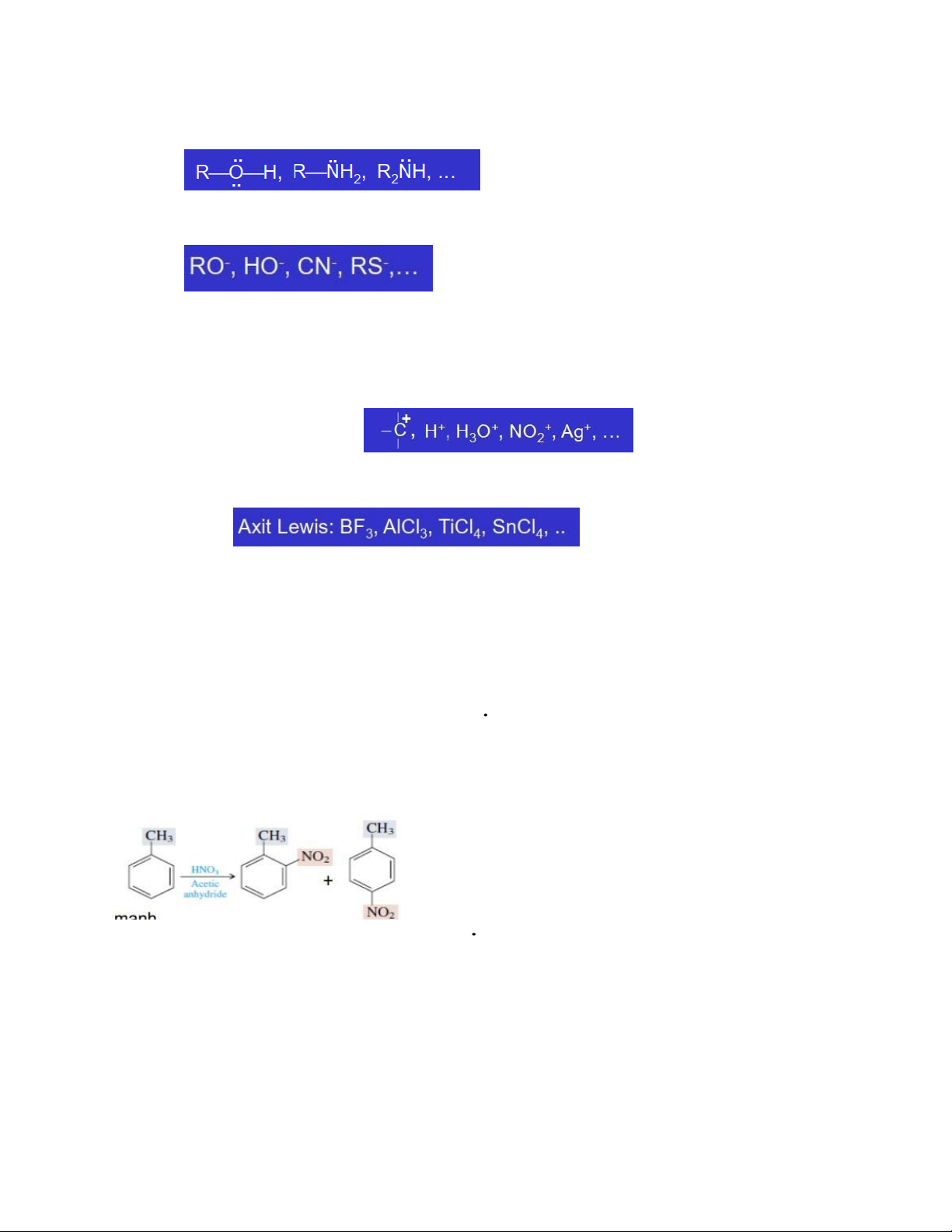
7. Chất ái nhân, chất ái điện tử?
- Chất ái nhân (Nucleophile):
+ Là những tác nhân cho cặp e cho phân tử khác
+ Những chất trung hòa có chứa các cặp e tự do + Các ion âm
- Chất ái điện tử (Electrophile):
+ Là những tác nhân có orbital trống, có thể nhận cặp e từ phần tử khác
-> Các ion có điện tích dương:
+ Các hợp chất có vỏ e chưa hoàn chỉnh
+ Các phân tử trung hòa có thể phân cực hóa: Carbonyl, halogen, acetylene…
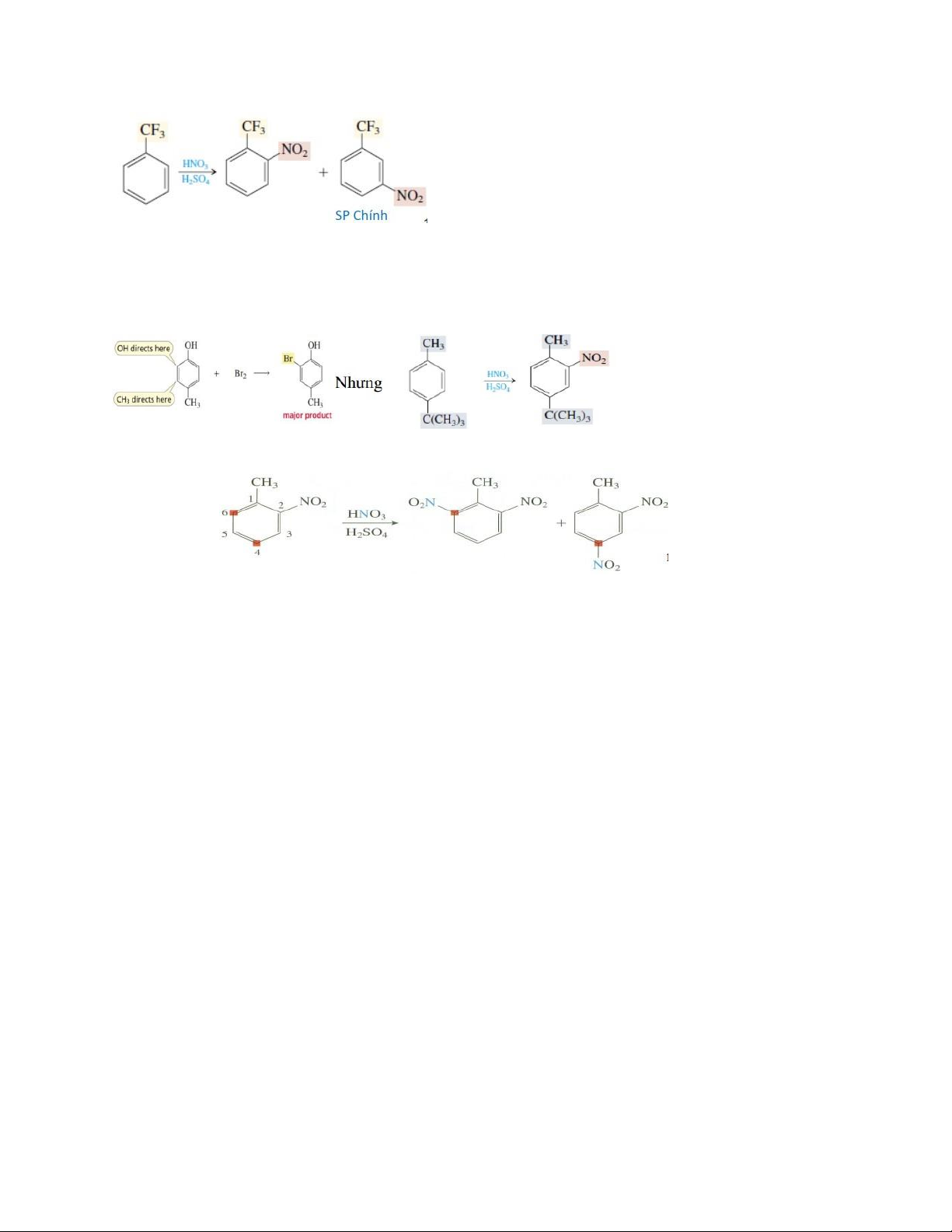
8. Quy tắc thế ái điện tử vào nhân thơm trường hợp có sẵn 1 nhóm thế, 2 nhóm thế?
- Khi vòng benzen có 1 nhóm thế:
+ Các nhóm thế đẩy e (+C, +I, +H) (loại I) ⟶ SE < sp chính orthor, para > ➢ Alkyl⟶+I, +H
➢ -NR2, -OCH3, -OH,… ⟶ +C>-I
➢ Anion (-O-) ⟶ +C, +I mạnh
+ Các nhóm thế hút e (-C, -I, -H) (loại II) ⟶ SE < sp chính meta >
➢ -N+Ξ N, -CN, -NO2, -CHO, -COR, -COCl, -COOH⟶ -C, -I
➢ Cation (-N+R3) ⟶ -I mạnh ➢ Halogen ⟶ -I >+C
- Khi vòng benzen có 2 nhóm thế:
+ 2 nhóm thế cùng loại: Nhóm thế thứ 3 được định hướng theo nhóm thế mạnh hơn
+ 2 nhóm thế khác loại: Nhóm thế loại 1 quyết định định hướng nhóm thế thứ 3
9. Quy tắc gọi tên theo danh pháp IUPAC và tính chất vật lý (Độ hòa tan, nhiệt
độ sôi) của alkane, alkene, alkyne, dẫn xuất halogen của hydrocarbon,
ancohol, phenol, ether, aldehyde ketone, acid, amine (trong tập tài liệu)
10. Khái niệm hiệu ứng cảm ứng, hiệu ứng liên hợp, hiệu ứng siêu liên hợp?
Khi nào xuất hiện hiệu ứng cảm ứng/liên hợp/siêu liên hợp dương, âm?
- Hiệu ứng cảm ứng: là hiệu ứng của nối đơn ơ sinh ra do sự
khác biệt độ âm điện của 2 nhóm/nguyên tử
+ Hiệu ứng cảm dương (+I):
✓ Các nhóm alkyl luôn đẩy e (+I): +I: bậc 1
✓ Các ngtử/nhóm ngtử mang e - ⟶ +I
+ Hiệu ứng cảm âm (-I):
✓ Các ngtử/nhóm ngtử mang e+⟶ -I
✓ Các nguyên tử có độ âm điện lớn: Độ âm điện càng lớn thì –I càng tăng -I: F > Cl > Br > I
✓ Các nhóm không no ⟶ -I
- I tăng dần theo độ không no - Hiệu ứng liên hợp:
✓ Do sự dịch chuyển electron trong 1 hệ liên hợp gây nên sự phân cực của hệ liên hợp đó
✓ Ít thay đổi khi kéo dài mạch liên hợp
✓ Có 2 loại hiệu ứng liên hợp:
+ Hiệu ứng liên hợp dương (+C): các ngtử hay nhóm ngtử có khả năng đẩy e
+ Hiệu ứng liên hợp âm (-C): các ngtử/nhóm ngtử có khả năng hút e
- Hiệu ứng siêu liên hợp:
✓ là trường hợp mở rộng của hệ liên hợp theo kiểu ơ-u (liên kết C-H, C-F cách liên kết u
(C=C, CΞ C) một liên kết ơ)
+ Hiệu ứng siêu liên hợp dương (+H)
⟶ +H của C-H trở nên linh động
+ Hiệu ứng siêu liên hợp âm (-H):
+ H càng mạnh khi số nguyên tử H ở Cα càng nhiều