Preview text:
lOMoARcPSD|45316467 lOMoARcPSD|45316467
ĐỀ THI GIỮA KỲ HÓA ĐẠI CƯƠNG 2 (CHE00002) -13/10/2022-
TỔNG SỐ CÂU: 35 THỜI GIAN LÀM BÀI: 45 PHÚT MÃ ĐỀ:
Các thông số cần thiết: R = 8,314 J.K 1.mol 1 = 8,314 m3.Pa.K 1.mol 1
= 0,082 L.atm.K 1.mol 1 = 1,987 cal.K 1.mol 1 = 0,083 L.bar. K 1.mol 1
Lưu ý thí sinh: Không cần tham khảo mọi tài liệu, kể cả Bảng HTTH.
> Chọn phát biểu đúng:
A. U, H, S, G đều là hàm trạng thái.
B. U, q, w, H, S, G đều là hàm trạng thái.
C. U, q, H, S, G đều là hàm trạng thái nhưng w không phải hàm trạng thái.
D. Trong U, q, w, H, S, G, chỉ có U là hàm trạng thái.
E. Trong U, q, w, H, S, G, chỉ có H, S, G là hàm trạng thái.
<C2> Hiệu ứng nhiệt đẳng tích của một phản ứng hóa học là_______. A. ΔU B. ΔS C. ΔH D. ΔG E. ΔGo
<C3> Hiệu ứng nhiệt đẳng áp của một phản ứng hóa học là_______. A. ΔH B. ΔU C. ΔS D. ΔG E. ΔGo
<C4> Giả sử các chất khí đều là khí lý tưởng, hãy tính công thực hiện bởi sự
chuyển hoá của 1,00 mol H2(k) thành H2O (k) tại 2500 oC theo phản ứng dưới đây?
2H2 (k) + O2 (k) 2H2O (k) ΔH = –483.6 kJ A. 11,53 kJ B. 23,05 kJ C. 23,05 kJ D. 28,7 kJ E. 11,53 kJ
<C5> Giả sử các chất khí đều là khí lý tưởng, hãy tính biến thiên nội năng của phản ứng dưới đây? 2H2 (k) + O2 (k) 2H2O (k) ΔH =-483.6 kJ A. –460.55 kJ B. 460.55 kJ C. 23,05 kJ D. 23,05 kJ E. –483.6 kJ lOMoARcPSD|45316467
<C6> Nếu cung cấp một lượng nhiệt là 4,123 kJ cho hệ nhiệt lượng kế chứa
75,0 g nước, nhiệt độ của nước và nhiệt lượng kế tăng từ 24,6 oC lên 34,6 oC.
Hãy tính nhiệt dung của nhiệt lượng kế (J/oC). Cho biết nhiệt dung riêng của nước là 4,184 J/g. oC A. 98,5 J/ oC B. 154,24 J/ oC C. 337,5 J/ oC D. 25,31 J/ oC E. 17,36 J/ oC
<C7> Hãy tính nhiệt phản ứng ∆Horxn cho phản ứng sau ở 298 K:
CH3-CH=CH2(k) + 2 H2(k) → CH3-CH2-CH3 (k)
sử dụng các giá trị năng lượng liên kết DH-C = 346 kJ/mol; DC-C = 413 kJ/mol;
DH-H = 435 kJ/mol; DC=C = 602 kJ/mol. A. –135 kJ B. –278 kJ C. 278 kJ D. 240 kJ E. –240 kJ
<C8> Chất nào sau đây có ∆Hof # 0? A. Br2 (k) B. Cl2 (k) C. O2 (k) D. N2 E. H2 (k) (k)
<C9> Xem phản ứng đốt cháy của sucrose (C12H22O11) tại 25oC:
C12H22O11 (r) + 12 O2 (k) → 12 CO2 (k) + 11 H2O (l) ∆Horxn = ?
Hãy tính giá trị ∆Horxn (kJ/mol). Cho biết ∆Hof, 298 của của sucrose, CO2 và
H2O lần lượt là 2218 kJ/mol, 393,5 kJ/mol và 285,8 kJ/mol. A. 5648 B. 1676 C. 4969 D. 1431 E. 2640
<C10> Cho biết: C(graphite) + O2(k) → CO2(k) ΔHo = -393.51 kJ
2C(graphite) + O2(k) → 2CO(k) ΔHo = -221.08 kJ
Tính biến thiên enthalpy (kJ) của phản ứng sau:
2CO(k) + O2(k) → 2CO2(k) ∆Horxn = ? A. –282,97 B. –172,43 C. 282,97 D. 172,43 E.–614,59 lOMoARcPSD|45316467
Enthalpy của phản ứng nào sau đây là enthalpy mol chuẩn thức (nhiệt
hình thành mol chuẩn) của NaClO3(r)?
A. Na(r) + 1/2 Cl2(k) + 3/2 O2(k) → NaClO3(r)
B. NaClO2(r) + 1/2 O2(k) → NaClO3(r)
C. Na(r) + Cl(k) + 3/2 O2(k) → NaClO3(k)
D. Na(r) + Cl(k) + 3O(k) → NaClO3(r)
E. NaCl(r) + 3/2 O2(k) → NaClO3(r)
Phát biểu nào sau đây về entropy là SAI?
A. Entropy S tại 298 K của một chất có thể âm hoặc dương.
B. Entropy S của một chất tinh thể hoàn hảo tại 0 K là zero.
C. Các chất tinh khiết luôn có entropy dương tại nhiệt độ T > 0 K.
D. Entropy của một chất tại nhiệt độ 300 K lớn hơn tại nhiệt độ 100 K.
E. Entropy của một chất tại áp suất 1atm lớn hơn tại áp suất 3atm.
<C13> Quá trình nào sau đây có ∆S dương?
I. Sự bay hơi của 1 mol methanol (l)
II. Trộn lẫn 1 mol ethanol với 5 mol nước.
III. Nén 1 mol khí N2 ở nhiệt độ không đổi từ 1,5 L xuống 0,5 L.
IV. Làm lạnh 500 g kim loại đồng từ 398 K lên 298 K.
V. Làm làm tan chảy 100 g nước đá. A. I, II và V B. II, III và V C. I và IV D. II, III và IV E. III, IV và V
<C14> Hãy ước lượng nhiệt độ sôi của toluene biết rằng nhiệt hóa hơi mol của
toluene là ∆Hvap = 35,28 kJ/mol và quá trình bay hơi toluene tuân theo định luật Trouton. A. 132.5 oC B. 110.6 oC C. 80 oC D. 100 oC E. 87 oC lOMoARcPSD|45316467
Sắp xếp các chất theo thứ tự tăng dần entropy mol chuẩn ở 25oC.
A. Al(r) < NaF(r) < HF(k) < SiH4(k) < SiF4(k)
B. SiF4(k) < SiH4(k) < NaF(r) < HF(k) < Al(r)
C. HF(k) < Al(r) < NaF(r) < SiF4(k) < SiH4(k)
D. Al(r) < HF(k) < NaF(r) < SiF4(k) < SiH4(k)
E. NaF(r) < Al(r) < HF(k) < SiF4(k) < SiH4(k)
Xét phản ứng: 2Cl2O(k) → 2Cl2(k) + O2(k) ∆Horxn = –161 kJ.
Phản ứng này sẽ ___________.
A. Tự xảy ra tại mọi nhiệt độ.
B. Tự xảy ra tại nhiệt độ thấp và không tự xảy ra ở nhiệt độ cao.
C. Không xảy ra tại mọi nhiệt độ.
D. Chỉ tự xảy ra ở nhiệt độ cao.
E. Chỉ tự xảy ra ở nhiệt độ thấp.
Cho phản ứng: 2PbS(r) + 3O2(k) → 2PbO(r) + 2SO2(k). Sử dụng các số
liệu nhiệt động trong bảng sau, tính ∆S° của phản ứng trên. Hợp chất S°(J/K·mol) PbS(r) 91,2 O2(k) 205,0 PbO(r) 69,45 SO2(k) 248,5 A. – 161,5 J/K B. – 410 J/K C. 21,8 J/K D. 43,5 J/K E. – 47,7 J/K
Dựa vào các dữ kiện cho dưới đây, hãy tính ∆Go cho phản ứng sau ở
25oC. 2 Zn(r) + TiO2(r) → 2 ZnO(r) + Ti(r) Hợp chất ∆Hof, 298 (kJ/mol) S°(J/K·mol) Zn(r) 0 41,63 Ti(r) 0 30,63 TiO2(r) – 939,7 49,92 ZnO(r) – 348,28 43,64 A. 247,7 kJ B. 238,6 kJ C. – 247,7 kJ D. 4790 kJ E. – 4790 kJ lOMoARcPSD|45316467
<C19> Phenol (C6H5OH) có nhiệt độ nóng chảy ở áp suất 1 bar là 40,5 oC. Đối
với quá trình nóng chảy của phenol, hãy cho biết dấu của các đại lượng ΔHo,
ΔSo và ΔGo ở 25 oC và 1 bar.
A. ΔHo>0, ΔSo >0, ΔGo>0
B. ΔHo<0, ΔSo >0, ΔGo=0
C. ΔHo>0, ΔSo >0, ΔGo<0
D. ΔHo>0, ΔSo <0, ΔGo<0
E. ΔHo<0, ΔSo <0, ΔGo=0
<C20> Tại 298 K, phản ứng 2PCl3(k) + O2(k) → 2POCl3(l) ΔHo = –620.2 kJ
có các số liệu nhiệt động trong bảng sau, tính ∆G° của phản ứng trên. Hợp chất S°(J/K·mol) PCl3(k) 311,8 O2(k) 205,0 POCl3(l) 222,4 A. – 506 kJ B. – 532 kJ C. 506 kJ D. 532 kJ E. – 620 kJ
<C21> Một hệ thống biến đổi từ trạng thái A sang trạng thái B tỏa ra một lượng
nhiệt là 68,0 kJ. Giả sử lượng nhiệt này được truyền cho môi trường ngoài ở
điều kiện đẳng áp và đẳng nhiệt tại 29 oC. Biến thiên entropy của môi trường
ngoài trong quá trình này bằng: A. 225 J/K B. 2,345 J/K C. 0,225 J/K D. –225 J/K E. –2345 J/K
Xét phản ứng: HgO(r) Hg(l) + 1/2O2(k) ∆Horxn = 90,84 kJ. Dự đoán nhiệt
độ mà tại đó phản ứng trên xảy ra tự nhiên ở trạng thái chuẩn, cho biết:
S°(Hg lỏng) = 76,02 J/K·mol, S°(O2 khí) = 205,0 J/K·mol, S°(HgO rắn) = 70,29 J/K·mol A.T≥840K B.T<840K C.T≥430K D.T≤620K E.T<775K lOMoARcPSD|45316467 Cho các phản ứng:
(1) C(r) + ½ O2(k) → CO(k) So = – 110,5 J/K
(2) H2(k) + ½ O2(k) → H2O(l) So = – 285,8 J/K
(3) H2(k) + O2(k) + C(r) → HCOOH(l) So = – 409,2 J/K Hãy
tính biến thiên entropy So (J K–1) của phản ứng sau:
HCOOH(l) → CO(k) + H2O(l) A. 12,9 B. –17,9 C. 25,8 D. –12,9 E. –175,3
> Cho tất cả các phản ứng trong pha khí dưới đây đều thu nhiệt. Chọn
phản ứng không thể xảy ra tự nhiên ở mọi nhiệt độ?
A. 4NO(k) + 6H2O(k) → 4NH3(k) + 5O2(k)
B. COCl2(k) → CO(k) + Cl2(k)
C. 2SO3(k) → 2SO2(k) + O2(k)
D. N2O4(k) → 2NO2(k)
E. CH3OH(k) → CO(k) + 2H2(k)
Phản ứng 2A B + C có bậc một theo A. Chọn phát biểu ĐÚNG?
A. Đường biểu diễn ln[A] theo thời gian t là đường thẳng. B. Đường biểu
diễn 1/[A] theo thời gian t là đường thẳng.
C. Thời gian bán hủy của phản ứng tỉ lệ thuận với nồng độ A.
D. Tốc độ hình thành C bằng tốc độ tiêu hao của A.
E. Tốc độ hình thành B bằng tốc độ tiêu hao của A.
Biểu thức tốc độ trung bình của phản ứng: aA + bB → cC + dD là: A. v = –∆[A]/(a×∆t) B. v = –∆[A]/(∆t) C. v = ∆[B]/(b×∆t) D. v = ∆[A]/(a×∆t) E. v = –∆[C]/(c×∆t)
Chất xúc tác làm tăng tốc độ phản ứng là do:
A. Làm giảm năng lượng hoạt hóa của phản ứng.
B. Làm tăng nồng độ phức chất hoạt động của phản ứng.
C. Làm tăng xác suất va chạm giữa các tác chất. D.
Làm tăng nồng độ chất trung gian của phản ứng. E.
Làm tăng năng lượng hoạt hóa của phản ứng. lOMoARcPSD|45316467
<C28> Xét phản ứng bậc 2: NOCl(k) NO(k) + ½ Cl2(k). Sau 5,82 giờ phản ứng,
nồng độ NOCl còn lại là 50%. Hỏi sau bao lâu thì nồng độ NOCl còn lại 25%.
Biết nồng độ đầu của NOCl là 4,46 M. A. 17,5 giờ B. 5,82 giờ C. 23,0 giờ D. 15,5 giờ E. 8,75 giờ
<C29> Chu kỳ bán rã của 32P là 14.3 ngày. Biết tốc độ phân rã của radium tuân
theo phương trình động học bậc 1. Tính thời gian (ngày) để lượng 32P phân rã hết 99%? A. 95 ngày B. 71.5 ngày C. 42.5 ngày D. 101.5 ngày E. 115.5 ngày
<C30> Xét phản ứng: 2 S 2- 2-
2O3 (dd) + I2 (dd) S4O6 (dd) + 2 I- (dd)
Giả sử trong 10 giây có 0,0080 mol S 2-
2O3 bị oxy hóa (Vdd = 250 mL) thì tốc độ
phản ứng tính theo I2 sẽ là: A. 0,0016 mol. l-1. s-1 B. 0,016 mol. l-1. s-1 C. 0,0040 mol. l-1. s-1 D. 0,0080 mol. l-1. s-1 E. 0,0032 mol. l-1. s- 1
<C31> Một phản ứng có hệ số nhiệt bằng 3. Cần phải tăng nhiệt độ lên bao
nhiêu (oC) để tốc độ phản ứng đó tăng lên 1.5 lần. A. 5 B. 10 C. 15 D. 20 E. 25
<C32> Cho phản ứng: H2 (k) + I2 (k) → 2HI (k)
Có hằng số tốc độ là k1= 5.4 ×10-4 M-1 s-1 tại 599 K và k2= 2.8 ×10-2 M-1 s-1 tại
683 K, hãy tính năng lượng Ea của phản ứng A. 160 kJ/mol B. 19.3 kJ/mol C. 193 kJ/m D. 160 J/mol E. 193 J/mol lOMoARcPSD|45316467
<C33> Cho phản ứng: H2 (k) + I2 (k) → 2HI (k)
Có hằng số tốc độ là k1= 5.4 ×10-4 M-1 s-1 tại 599 K và k2= 2.8 ×10-2 M-1 s-1 tại 683 K, tại nhiệt độ nào phản ứng sẽ
có hằng số tốc độ k3 = 5.0 ×10-3 M-1 s-1 A. 645 K B. 655 K C. 665 K D. 645 oC E. 665 oC
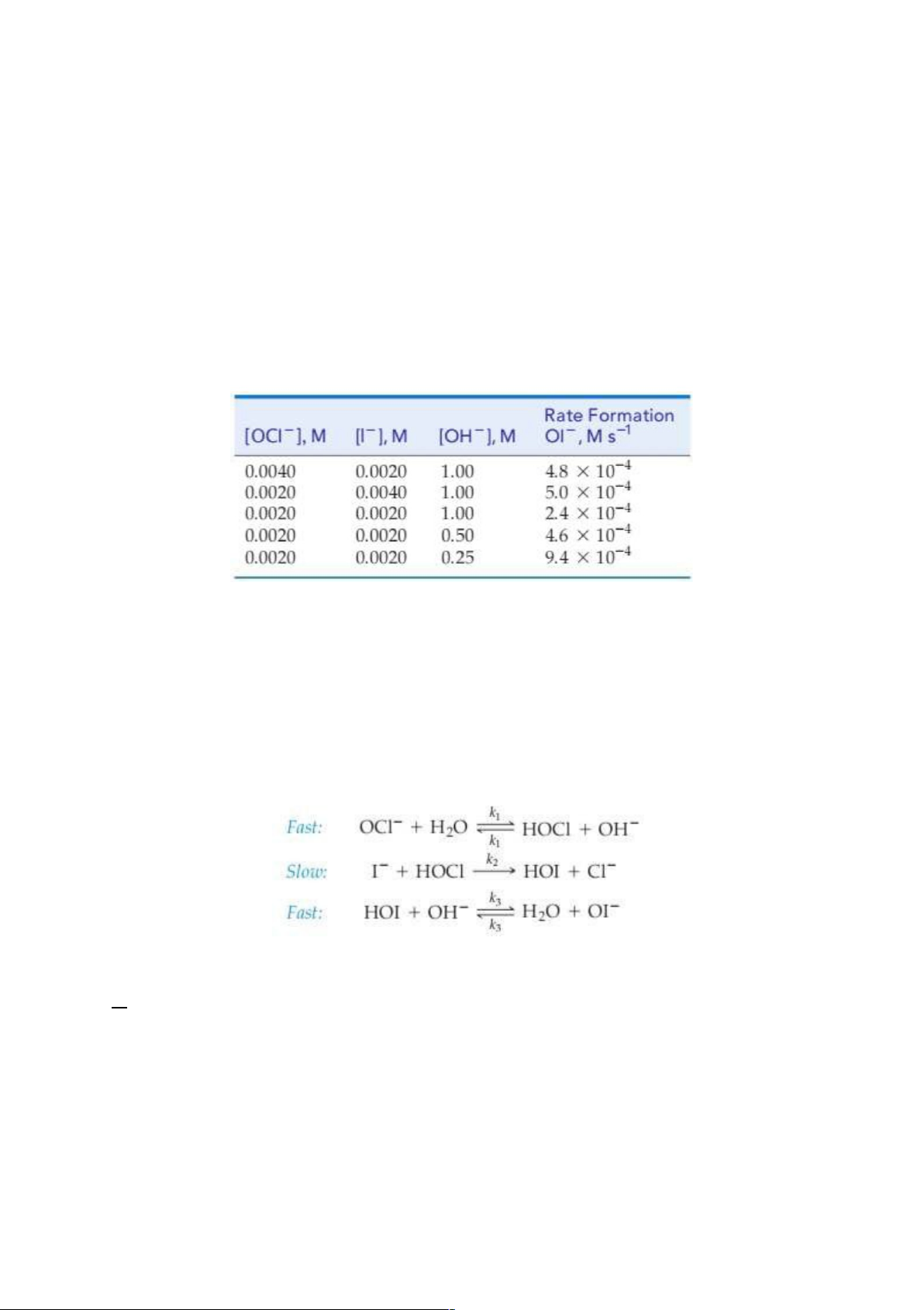
<C34> Ion hydroxit (OH–) có tham gia phản ứng sau nhưng không bị tiêu
hao trong phản ứng tổng thể:
Dựa theo bảng dữ liệu, hãy xác định bậc của từng ion: OCl–, I–, OH– A. 1, 1, –1 B.1,0,1 C.1,1,0 D. 1, 1, 1/10 E. 1, 0, 1/10
<C35> Cho phản ứng
có cơ chế giả định như sau:
Hãy xác định quy luật tốc độ và nhận định xem cơ chế giả định ở trên có phù hợp hay không? A. ; phù hợp B. ; phù hợp C. ; không phù hợp D. ; phù hợp E. ; không phù hợp ---Hết----