




Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI HỌC SINH GIỎI CẤP TỈNH THCS TỈNH QUẢNG NAM NĂM HỌC 2021 - 2022 Môn thi: HÓA HỌC
ĐỀ CHÍNH THỨC
Thời gian: 150 phút (không kể thời gian giao đề)
(Đề thi có 02 trang)
Ngày thi: 19/4/2022
Cho nguyên tử khối: H= 1; He= 4; Li= 7; Be= 9; B= 11; C= 12, N= 14, O= 16;
Mg= 24; Al= 27; Cl=35,5; Ca= 40; Fe= 56. Câu 1 (4,0 điểm).
1.1. Phân tử chất X được tạo thành từ 3 nguyên tử. Tỉ khối hơi của X so với He bằng 4,5. Tìm chất X.
Từ X, viết 4 phương trình hóa học tạo thành 4 chất sau: NaOH, Fe(OH)3, H2SO4, H2.
1.2. Hỗn hợp Y gồm CaCO3 và MgCO3. Cho a gam Y vào 500 ml dung dịch HCl 1
M, thu được 4,48 lít CO2 (đktc) và dung dịch Y chứa m gam chất tan. Cho rằng CO2
không tan trong nước, các phản ứng xảy ra hoàn toàn, chỉ có CO2 và hơi nước thoát ra
khỏi dung dịch. Viết phương trình hóa học các phản ứng xảy ra và xác định khoảng giá trị của m. Câu 2 (4,0 điểm).
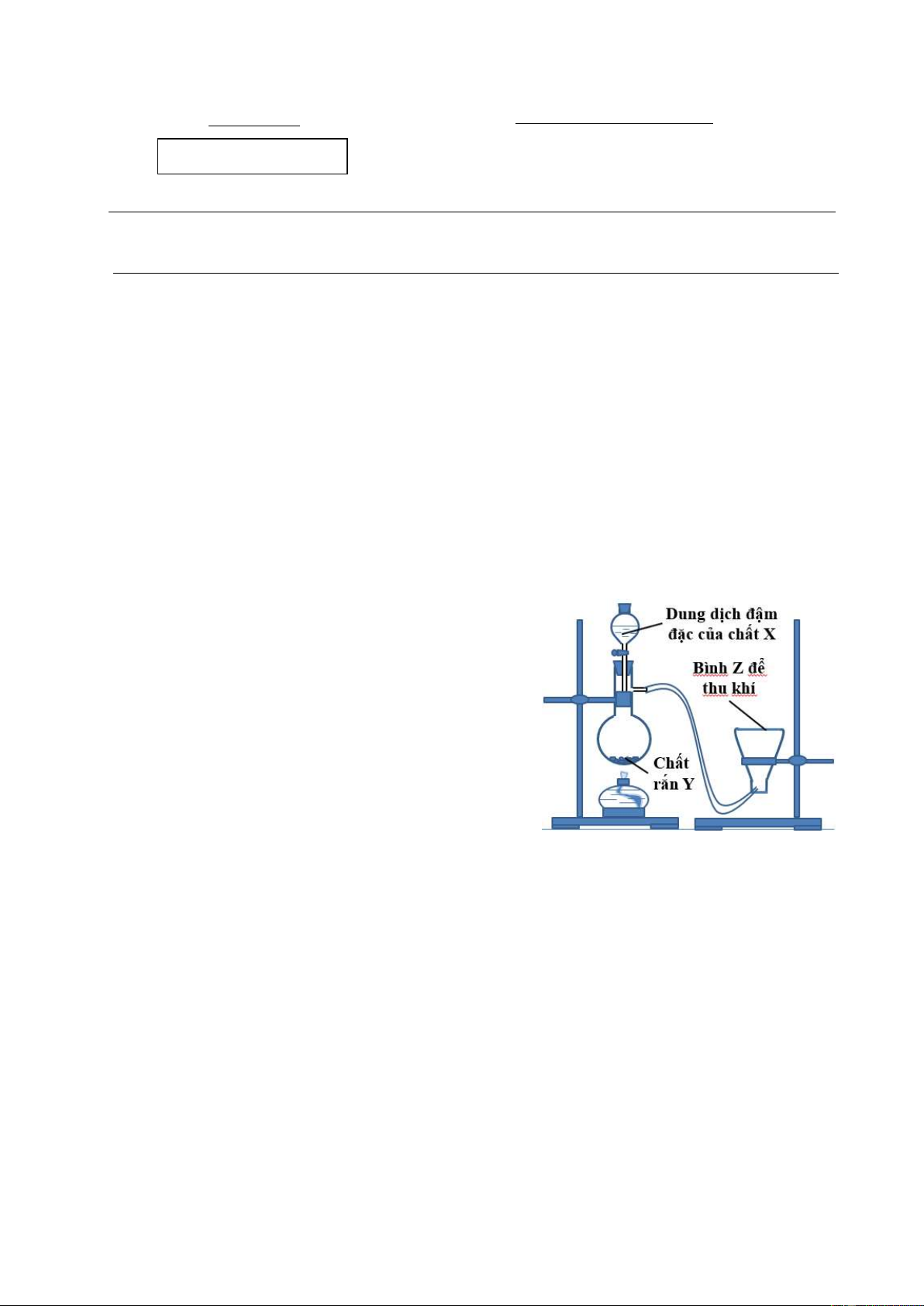
2.1. a. Một học sinh bố trí sơ đồ dụng cụ,
hóa chất điều chế khí clo như hình vẽ bên. Vì sao
không thể thu đầy khí clo vào bình Z? Cần điều
chỉnh những gì để đảm bảo hiệu suất thu khí clo lớn nhất?
b. Chất X, Y là chất nào trong các chất sau:
HNO3, CaCO3, H2SO4, MnO2, KOH, NaCl, HCl?
c. Khí clo thoát ra theo ống dẫn trong hình
vẽ bên có lẫn những tạp chất gì?
d. Nêu hiện tượng xảy ra và giải thích khi
sục khí thoát ra trong thí nghiệm trên vào:
- Lọ thủy tinh chứa cánh hoa hồng tươi.
- Cốc chứa nước, thêm tiếp vài giọt dung dịch NaHCO3.
2.2. Một loại quặng manhetit (trong đó Fe3O4 chiếm 63% về khối lượng, các thành
phần khác trong quặng không chứa nguyên tố sắt) được dùng để làm nguyên liệu sản
xuất gang. Biết rằng từ 25,0 tấn quặng thì sản xuất được 10,1 tấn gang với hiệu suất toàn
bộ quá trình đạt 85%. Xác định phần trăm khối lượng của sắt trong loại gang ở trên. Câu 3 (4,0 điểm).
3.1. Dầu, mỡ dùng làm thực phẩm có điểm gì giống và khác với dầu, mỡ dùng để
bôi trơn xe, máy (được tách ra từ dầu mỏ) về thành phần nguyên tố và cấu tạo? Trình bày
phương pháp hóa học phân biệt hai loại chất trên. Trang 1
3.2. a. Thống kê của Hiệp hội Xăng dầu Việt Nam cho thấy trung bình mỗi năm,
Việt Nam tiêu thụ khoảng 20 triệu tấn xăng dầu. Nếu toàn bộ lượng xăng dầu nêu trên là
hỗn hợp các hiđrocacbon (hỗn hợp Z) chứa 15% hiđro về khối lượng thì lượng CO2 (tấn)
phát thải ở Việt Nam từ việc sử dụng xăng dầu hằng năm là bao nhiêu? (Cho sản phẩm
cháy chỉ có CO2 và nước).
b. Nếu thay toàn bộ lượng xăng dầu nói trên bằng một loại xăng E5 (được tạo
thành bằng cách pha trộn hỗn hợp hỗn hợp Z với etanol lần lượt theo tỉ lệ 95:5 về khối
lượng) thì lượng CO2 (tấn) sinh ra từ việc sử dụng xăng dầu hằng năm ở Việt Nam là bao nhiêu?
c. Tại sao việc sử dụng xăng E5 (thay vì xăng A95) góp phần bảo vệ môi trường? Câu 4 (4,0 điểm).
4.1. Cho dãy chuyển hóa:
Biết rằng các chất trong dãy chuyển hóa đều là chất hữu cơ (C, H, O), mỗi mũi tên
là một phương trình hóa học, mỗi kí hiệu là một chất khác nhau, trong đó chất X có
những đặc điểm: tỉ khối hơi so với N2 nhỏ hơn 3,5; phân tử chứa 54,5% C và 9,1% H về khối lượng.
a. Xác định công thức phân tử của X, công thức cấu tạo của X, Y, Z, T.
b. Viết phương trình thực hiện dãy chuyển hóa.
4.2. Trong thời gian qua, một số sản phẩm mì ăn liền có xuất xứ từ Việt Nam phải
thu hồi trên thị trường Châu Âu do bị cảnh báo về mối nguy chứa 2-clo etanol (C2H5OCl,
viết tắt là 2-CE) và etilen oxit (C2H4O, viết tắt là EO) vượt ngưỡng cho phép. Đây là các
tác nhân có khả năng gây ung thư, đột biến, độc tính sinh sản, ... Hãy cho biết hợp chất 2-
CE có thể được tạo thành từ phản ứng cộng hợp giữa EO với chất nào? Vì sao? Câu 5 (4,0 điểm).
5.1. Cho các chất X, Y, Z, T không theo thứ tự gồm: polietilen, natri cacbonat,
đồng (II) oxit, glucozơ và các thông tin trong bảng sau (ô để trống là chưa điền thông tin): Thuốc thử Hiện tượng (dùng dư) X Y Z T HCl loãng (1) Tan hết (3) (4) NaOH loãng Không tan (2) Không tan O2, t0 Cháy được Cháy được
a. Xác định các chất X, Y, Z, T.
b. Ghi thông tin hiện tượng xảy ra ở các ô đã được đánh số từ (1) đến (4).
5.2. Cho hệ trục tọa độ Descartes có tỉ lệ đơn vị trên trục tung: trục hoành là 1:1,
các đoạn thẳng (được đánh số từ (1) đến (8)) và tia (9) như hình vẽ.
Cho từ từ đến hết 450 ml dung dịch NaOH
0,2 M vào 100 ml dung dịch chứa đồng thời
Al2(SO4)3 0,1 M và H2SO4 0,1 M, khuấy đều. Cho
các phản ứng xảy ra hoàn toàn. Trang 2
a. Viết phương trình hóa học phản ứng xảy ra.
b. Tính số mol kết tủa tạo thành sau phản ứng.
c. Đồ thị mô tả sự biến thiên số mol kết tủa xuất hiện trong hệ phản ứng (trục
tung) theo số mol NaOH đã dùng (trục hoành) lần lượt được tạo thành từ các đoạn thẳng,
tia nào (tính từ gốc tọa độ)? ----- Hết -----
Học sinh được dùng bảng tuần hoàn. Cán bộ coi thi không giải thích gì thêm.
Họ tên thí sinh: ............................................................ Số báo danh: ...............
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI HỌC SINH GIỎI CẤP TỈNH THCS TỈNH QUẢNG NAM NĂM HỌC 2021 - 2022 Môn thi: HÓA HỌC
HƯỚNG DẪN CHẤM
Thời gian: 150 phút (không kể thời gian giao đề)
(HDC này có 03 trang)
Ngày thi: 19/4/2022 HƯỚNG DẪN CHẤM Nội dung Điểm Câu 1 1.1. 2,0 MX= 4,5 x 4 = 18.
Nguyên tử lượng trung bình của 1 nguyên tử: 18/3= 6 0,25
=> X phải chứa nguyên tử thứ nhất là H.
Nguyên tử lượng trung bình của 2 nguyên tử còn lại: (18-1)/2= 8,5. Nguyên tử thứ 2 H Li 0,25 M (Nguyên tử thứ 3) 18- 2= 16 18- 1 - 7= 10 Tên nguyên tố Oxi Không có X là nước (H2O). 0,5 H2O + Na2O 2NaOH. 2H2O + 4Fe(OH)2 + O2 4Fe(OH)3. H2O + SO3 H2SO4. 1,0 2H2O + 2Na 2NaOH + H2.
(0,25 điểm/ 1pt đúng) 1.2. 2,0
n(CO2)= 0,2; n(HCl ban đầu)= 0,5. 0,25
n(HCl dư) = 0,1 mol; m(HCl dư)= 3,65 gam. 0,25 MgCO3 + 2HCl MgCl2 + CO2 + H2O. 0,25 CaCO3 + 2HCl CaCl2 + CO2 + H2O. 0,25 Trang 3 Nội dung Điểm
Số mol muối cacbonat: 0,2 mol.
Nếu chỉ có MgCO3: n(MgCl2)= 0,2 => m(MgCl2)= 19 gam. 0,25
Nếu chỉ có CaCO3: n(CaCl2)= 0,2 => m(CaCl2)= 22,2 gam. 0,25
Khoảng giá trị của m: 19+ 3,65 = 22,65 < m < 22,2 + 3,65 = 25,85. 0,5 Câu 2 2.1. 2,0
a. Vì khí clo nặng hơn không khí sẽ chìm xuống thay vì bay lên chiếm đầy bình Z. 0,25
Để đảm bảo hiệu suất thu khí cao nhất, cần để ngửa bình Z, đồng thời đưa sâu
ống dẫn khí vào đáy bình Z, đặt một mẫu quỳ tím ẩm lên trên miệng bình Z. 0,25 b. X: HCl, Y: MnO2. 0,25
c. Tạp chất: HCl (k), hơi nước. 0,25
d. - Cánh hoa hồng nhạt hoặc mất màu. 0,25
Do Cl2 phản ứng với hơi nước tạo thành HClO có tính oxi hóa mạnh, tẩy màu. 0,25
- Sủi bọt khí không màu. 0,25
Do Cl2 phản ứng với nước tạo thành HCl, HCl phản ứng với NaHCO3 tạo CO2. 0,25 2.2. 2,0
Khối lượng Fe3O4 trong quặng: 25 x 63/100 = 15,75 tấn. 0,5
Khối lượng sắt trong quặng: 15,75 x 56 x 3/232= 11,41 tấn. 0,5
Khối lượng sắt đi vào gang: 11,41 x 0,85= 9,69 tấn. 0,5
Phần trăm khối lượng sắt trong gang: 9,69/10,1 x 100= 96%. 0,5 Câu 3. 3.1. 1,5
Giống: Thành phần nguyên tố đều chứa C, H. 0,5 Khác:
Dầu, mỡ dùng làm thực phẩm Dầu, mỡ bôi trơn xe, máy Thành phần Chứa nguyên tố oxi nguyên tố
Không chứa nguyên tố oxi 0,25 Cấu tạo Không chứa nhóm chức Chứa nhóm chức (este) (hiđrocacbon) 0,25
Cách phân biệt: Đun hai loại với dung dịch kiềm: loại tan được là dầu, mỡ làm
thực phẩm; loại không tan được là dầu, mỡ bôi trơn xe, máy. 0,5 3.2. 2,5
a. Khối lượng cacbon trong 20 triệu tấn xăng dầu: 20 x 85/100= 17 triệu tấn. 0,5
Khối lượng CO2 phát thải: 17 x 44/12= 62,33 triệu tấn. 0,5
b. Khối lượng etanol trong 20 triệu tấn xăng E5: 5/100 x 20= 1 triệu tấn. 0,25
Khối lượng CO2 sinh ra từ etanol: 1 x 44 x 2/46= 1,91 triệu tấn. 0,25
Khối lượng CO2 sinh ra từ xăng E5: 1,91 + 62,33 x 95/100= 61,12 triệu tấn. 0,5 Trang 4 Nội dung Điểm
c. Việc sử dụng xăng E5 góp phần bảo vệ môi trường vì:
- Ít phát thải CO2 hơn trên cùng một lượng dùng.
- Etanol là nhiên liệu tái tạo, giúp hạn chế khai thác nhiên liệu hóa thạch. 0,5
- Ít tạo khí thải CO và hiđrocacbon do có hàm lượng oxi trong xăng cao hơn.
(Đúng 1 ý: 0,25 điểm; Đúng 2 đến 3 ý: 0,5 điểm) Câu 4. 4.1. 3,25 a. %m(O)= 36,4. Gọi X là C 0,25 xHyOz: x: y: z= 2: 4: 1.
CTĐG nhất: C2H4O => CTPT: (C2H4O)n. 0,25
44n < 3,5 x 28= 98 => n< 2,2. 0,25
Nếu n= 1: X là C2H4O, không phản ứng được với NaOH => Loại. 0,25 Nếu n= 2: X là C4H8O2. 0,25
X: CH3COOC2H5; Y: C2H5OH; Z: CH3CHO; T: CH3COOH. 1,0 b. CH 3COOC2H5 + NaOH CH3COONa + C2H5OH. 0,25/ CH3CH2OH + CuO CH3CHO + Cu + H2O. 1 pt 2CH3CHO + O2 2CH3COOH. CH3COOH + C2H5OH CH3COOC2H5 + H2O. 4.2. 0,75 Cộng với HCl. 0,5
Vì C2H5OCl và C2H4O chênh nhau 1 phân tử HCl. 0,25 Câu 5. 5.1 1,5
a. X: Đồng (II) oxit; Y: Glucozơ; Z: Polietilen; T: Natri cacbonat. 0,5
(0,25 điểm/ 2 chất được xác định đúng)
b. (1): Tan, tạo dung dịch màu xanh. (2): Tan.
(3): Không tan. (4): Tan, sủi bọt khí. 1,0
(0,25 điểm cho mỗi ý đúng) 5.2 2,5 a. 2NaOH + H2SO4 Na2SO4 + 2H2O. 6NaOH + Al2(SO4)3 2Al(OH)3 + 3Na2SO4. 0,5 NaOH + Al(OH)3 NaAlO2 + 2H2O.
(Đúng 1 pt: 0,25 điểm; đúng 2 đến 3 pt: 0,5 điểm) n(NaOH)= 0,09 mol.
n(Al2(SO4)3 = 0,01 mol => n(Al3+)= 0,02 mol. 0,25
n(H2SO4)= 0,01 mol => n(H+)= 0,02 mol. Trang 5 Nội dung Điểm
n(NaOH) phản ứng H+: 0,02 => 0,02 mol NaOH ban đầu cho vào không xuất hiện
kết tủa. Còn lại 0,07 mol OH- phản ứng với Al3+. 0,25
Khi dùng hết 0,06 mol NaOH tiếp theo: kết tủa đạt tối đa là 0,02 mol. Lúc này số
mol NaOH đã dùng là 0,08, còn 0,01. 0,25
0,01 mol NaOH cuối cùng hòa tan lại 0,01 mol kết tủa, còn 0,01 mol kết tủa. 0,25
Đồ thị được tạo thành lần lượt từ (6), (5), (1). 1,0
(Nếu hs vẽ đồ thị đúng nhưng kết luận sai các đoạn thẳng thì trừ 0,5 điểm).
Thí sinh làm cách khác nhưng đúng thì vẫn cho điểm tối đa. Trang 6




