



Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN QUẢNG NAM
NĂM HỌC 2017 – 2018 Môn thi : HÓA HỌC ĐỀ CHÍNH THỨC
Thời gian làm bài : 120 phút (không kể thời gian giao đề)
(Đề thi có 1 trang) Ngày thi
: 12/7/2017
Câu I. (2,0 điểm)
1. Cho các chất: KOH, Ca(NO3)2, SO2, SO3, NaHSO4, Na2SO3, K2SO4. Những chất nào trong dãy đã cho
tạo kết tủa khi phản ứng với dung dịch BaCl2? Viết phương trình hóa học của phản ứng xảy ra.
2. Chỉ dùng một thuốc thử, trình bày phương pháp phân biệt các dung dịch riêng biệt: NH4Cl, (NH4)2SO4,
NaNO3, Al(NO3)3, MgCl2, FeCl2, FeCl3. Câu II. (2,0 điểm)
1. Trong phòng thí nghiệm có thể dùng muối KClO3 hoặc KMnO4 để điều chế khí oxi bằng phản ứng phân
hủy. Viết phương trình hóa học của các phản ứng và tính thể tích khí oxi thu được (đktc) khi nhiệt phân
hoàn toàn 0,1 mol mỗi chất trên.
2. Có 6 hợp chất hữu cơ mạch hở A, B, C, D, E, F chỉ chứa các nguyên tố C, H, O; đều không làm mất
màu Br2/CCl4; khối lượng phân tử đều bằng 74 đvC. Các chất A, C, E, F tác dụng được với Na; C, D, F
tác dụng được với dung dịch NaOH; E, F tác dụng được với dung dịch AgNO3/NH3, đun nóng tạo kết tủa
Ag. Xác định công thức phân tử và công thức cấu tạo thu gọn có thể có của A, B, C, D, E, F. Câu III. (2,0 điểm)
1. Iso amyl axetat (thường gọi là dầu chuối) được điều chế bằng cách đun nóng hỗn hợp gồm axit axetic,
rượu iso amylic [(CH3)2CHCH2CH2OH] và H2SO4 đặc. Tính khối lượng axit axetic và khối lượng rượu iso
amylic cần dùng để điều chế 19,5 gam dầu chuối trên, biết hiệu suất của quá trình đạt 80%.
2. Một hỗn hợp khí X gồm 2 hiđrocacbon mạch hở (ở đktc). Lấy 268,8 ml X cho từ từ qua bình chứa dung
dịch brom dư thì có 3,2 gam brom phản ứng, không có khí thoát ra khỏi bình. Mặt khác, đốt cháy hết
268,8 ml X thu được 1,408 gam CO2. Xác định công thức phân tử các hiđrocacbon trong X. Biết các phản ứng xảy ra hoàn toàn. Câu IV. (2,0 điểm)
1. Hỗn hợp X gồm M2CO3, MHCO3, MCl (M là kim loại kiềm). Hòa tan hoàn toàn 30,15 gam hỗn hợp X
trong V ml dung dịch HCl 10,52% (D=1,05 g/ml) thu được dung dịch Y và 5,6 lít CO2 (đktc). Chia Y thành 2 phần bằng nhau.
- Phần 1: tác dụng vừa đủ với 100ml dung dịch KOH 1M thu được m gam muối.
- Phần 2: tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 50,225 gam kết tủa.
a. Xác định tên kim loại M.
b. Tính thành phần phần trăm theo khối lượng của từng chất trong hỗn hợp X. c. Tính V và m. Số mol Al(OH)
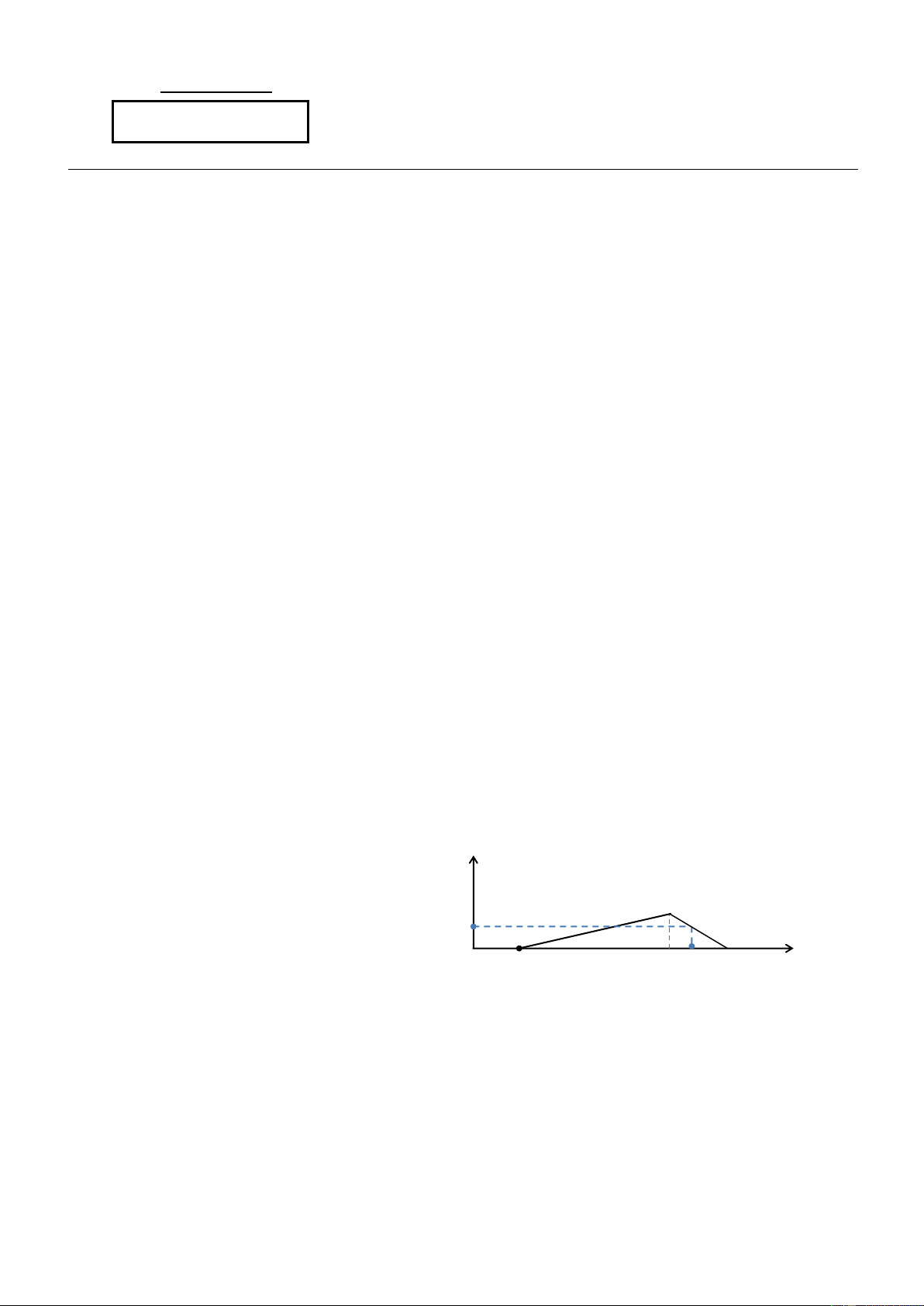
2. Cho a mol Al tan hoàn toàn trong dung 3
dịch chứa b mol HCl thu được dung dịch
Y chứa 2 chất tan có cùng nồng độ mol.
Thêm từ từ dung dịch NaOH vào dung 0,1875b
dịch Y đến dư, ta có đồ thị như Hình 1. 0,68 Xác đị 0 Số mol NaOH nh giá trị của a và b. Hình 1 Câu V. (2,0 điểm)
1. Đốt cháy hoàn toàn 0,1 mol một este đơn chức, mạch hở X, thu được 17,6 gam CO2 và 7,2 gam H2O.
a. Xác định công thức phân tử của X.
b. Đun nóng 8,8 gam X với 200 ml dung dịch NaOH 1M đến khi phản ứng hoàn toàn thu được dung
dịch Y. Cô cạn dung dịch Y thu được 13,6 gam chất rắn khan. Xác định công thức cấu tạo của X.
2. Đốt cháy hoàn toàn 0,15 mol hỗn hợp X gồm metyl acrylat (CH2=CH-COO-CH3), etylen glicol
[C2H4(OH)2], anđehit axetic (CH3CHO), và rượu metylic (CH3OH) cần dùng a mol O2. Sản phẩm cháy
dẫn qua 200 ml dung dịch Ba(OH)2 1M, lọc bỏ kết tủa, cho dung dịch Ca(OH)2 dư vào phần nước lọc thì
thu được thêm 53,46 gam kết tủa. Xác định giá trị của a.
(Cho: H=1; C=12; O=16; Cl=35,5; Br=80; Li=7; Na=23; K=39; Ca=40; Ba=137; Ag=108).
Họ tên thí sinh:...................................................................................... SBD:............................................. Trang 1
(Thí sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học)
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN QUẢNG NAM Năm học : 2017-2018
HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM MÔN HÓA HỌC ĐỀ CHÍNH THỨC Câu
Nội dung hướng dẫn chấm Điểm Câu I 1. (1,00 đ) (2,00 đ) SO 0,25đ
3 + H2O + BaCl2 → BaSO4 + 2HCl NaHSO 0,25đ
4 + BaCl2 → BaSO4 + NaCl + HCl Na 0,25đ
2SO3 + BaCl2 → BaSO3 + 2NaCl K 0,25đ
2SO4 + BaCl2 → BaSO3 + 2KCl 2. (1,00 đ)
Cho từ từ dung dịch Ba(OH)2 lần lượt vào các mẫu thử và đun nóng nhẹ 0,125đ
Tạo kết tủa và có khí mùi khai là dung dịch (NH4)2SO4 (NH 0,125đ
4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
Chỉ có khí mùi khai là dung dịch NH4Cl 2NH 0,125đ
4Cl + Ba(OH)2 → BaCl2 + 2NH3 + 2H2O
Tạo kết tủa keo trắng sau đó kết tủa tan là dung dịch Al(NO 3)3 2Al(NO
3)3 + 3Ba(OH)2 → 3Ba(NO3)2 + 2Al(OH)3 2Al(OH) 0,125đ
3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O
Tạo kết tủa trắng, kết tủa không tan là dung dịch MgCl 2 MgCl 0,125đ
2+ Ba(OH)2 → BaCl2 + Mg(OH)2
Tạo kết tủa trắng xanh hóa nâu ngoài không khí là dung dịch FeCl 2 FeCl
2+ Ba(OH)2 → BaCl2 + Fe(OH)2 0,125đ
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
(không có hóa nâu trong không khí vẫn được điểm tối đa)
Tạo kết tủa nâu đỏ là dung dịch 0,125đ FeCl3
2FeCl3 + 3Ba(OH)2 → 3BaCl2 + 2Fe(OH)3 Còn lại là NaNO 0,125đ 3 không có hiện tượng Câu II 1. (1,00 đ) (2,00 đ) 0 0,25đ 2KClO t 3 2KCl + 3O2 0,1 mol 0,15 mol 0,25đ
V = 0,15.22,4 = 3,36 lít O2 0 2KMnO t 4 K2MnO4 + MnO2 + O2 0,25đ 0,1 mol 0,05 mol
V = 0,05.22,4 = 1,12 lít 0,25đ O2 2.(1,00 đ) CTPT: C4H10O, C3H6O2, C2H2O3 0,25đ CTCT: A là rượu: C 0,125đ 4H9OH B là ete: CH 0,125đ 3OC3H7; C2H5OC2H5 C là axit: C 0,125đ 2H5COOH D là este: CH 0,125đ 3COOCH3 E là: HOC 0,125đ 2H4CHO F là: HOOC-CHO 0,125đ Câu III 1. (1,00 đ) Trang 2 (2,00 đ) H SO CH 3COOH+ (CH3)2CHCH2CH2OH 2 4
CH3COOCH2CH2CH(CH3)2 +H2O 0,50đ 0,15 mol 0,15 mol 0,15 mol 100 100 m 60.0,15. 11, 25 g; m 88.0,15. 16,5 g 0,50đ CH3COOH 80 5 C 1 H 1OH 80 2. (1,00 đ) C H + k Br 2 → C H Br n 2n22k n 2n22k 2k 3n 1 k C H + O 0,25đ
2 → n CO2 + ( n 1 k )H2O n 2n22k 2 (1) 5 k (2) 8 n 3 3
Hỗn hợp X qua dung dịch Br
2 không có khí thoát ra cả 2 hiđrocacbon đều không no. 8 n
có 1 hiđrocacbon là C2H2 hoặc C2H4 3 TH1: C2H2
- Hiđrocacbon còn lại là CmH2m, chiếm x% thể tích
2(100 x) 1x 5 100 k x = 100 3 3 200 100 2. . m 8 3 3 0,25đ n m = 4 (C4H8) 100 3 TH2: C 2H4
- Hiđrocacbon còn lại là C
mH2m+2-2a, chiếm x% thể tích 8
m 4 m = 3 hoặc m = 4 3 + Nếu m = 3 ta có:
2(100 x) 3x 8 200 n x = 100 3 3 100 200 1. a 5 3 3 k a = 2 C 0,25đ 3H4 100 3
+ Nếu m = 4, tương tự ta có a = 3 C4H4 0,25đ Câu IV 1. (1,25 đ)
(2,00 đ) Đặt n n n M 2C 3 O = x, MHC 3 O = y, n = 0,25 MCl = z ; 2 CO 5 PTHH:
M2CO3 + 2HCl → 2MCl + H2O + CO2 0,25đ x 2x 2x x
MHCO3 + HCl → MCl + H2O + CO2 y y y y n x + y = 2 CO = 0,25
* Phần 1: nKOH = 0,1 và chỉ có HCl phản ứng HCl + KOH → KCl + H2O 0,1 0,1 0,1
* phần 2: nAgCl = 50,225 / 143,5 = 0,35
HCl + AgNO3 → AgCl↓ + HNO3 0,1 0,1 0,1 MCl + AgNO3 → AgCl↓ +MNO3 0,25 0,25 0,25 n
MClphản ứng= 1/2 (2x + y + z) = 0,25 2x + y + z = 0,5 x + z = 0,25 m
hh= (2M + 60)x + (M + 61)y + (M + 35,5)z = 30,15
(2M + 60)x + (M + 61)(0,25 - x) + (M + 35,5)(0,25 - x) = 30,15 Trang 3
0,5M - 36,5x = 6,025 x = (0,5M - 6,025)/36,5
Do 0 < x < 0,25 0 < (M - 12,05)/73 < 0,25
0 < M - 12,05 < 18,25 12,05 < M < 30,3
a. M là kim loại kiềm M = 23 (Na) 0,25đ
b. M = 23 x = 0,15; y = z = 0,1
mNa2CO3 = 0,15.106 = 15,9 52,74%
y = 0,1 mNaHCO3 = 0,1.84 = 8,4 27,86% z = 0,1 m 0,25đ
NaCl = 0,1.58,5 = 5,85 19,4%
c. nHCl = 2x + y + 0,2 = 0,6 mHCl = 0,6.36,5 = 21,9
mdung dịch HCl 10,52% = 21,9.100 / 10,52 = 208,17
Vdung dịch HCl 10,52% = 208,17 / 1,05 = 198,26 (ml) 0,25đ
mmuói khan = mKCl + mNaCl = 0,1.74,5 + 0,25.58,5 = 22,075 (g) 0,25đ 2. (0,75 đ) 2Al + 6HCl → 2AlCl3 + 3H2 4 PTHH: a 3a a 0,25đ
Dung dịch Y: AlCl3 a mol và HCl a mol b – 3a = a b = 4a HCl + NaOH → NaCl + H2O a a AlCl
3 + 3NaOH → Al(OH)3 + 3NaCl Al(OH) 3 + NaOH → NaAlO2 + 2H2O Khi n 0,50đ
NaOH = 0,68 ta có 0,1875b = 4a – (0,68 – a) a = 0,16; b = 0,64. Câu V 1. (1,00 đ)
(2,00 đ) a. n = n = 0,4 CTPT của X: C 0,50đ nH2nO2 n = 4 C4H8O2 2 CO H2O
b. RCOOR’ + NaOH → RCOONa + R’OH 0,1 mol 0,1 mol 0,1 mol
Chất rắn: RCOONa: 0,1 mol và NaOH dư: 0,1 mol 0,50đ
(R + 67).0,1 + 40.0,1 = 13,6 R = 29 (C2H5) CTCT của X: C2H5COOCH3 2. (1,00 đ) C
H O C H .2H O 4 6 2 4 2 2 PTHH C
H O C H .2H O 2 6 2 2 2 2 X gåm C H .yH O 0,25đ x 2 2
C H O C H .H O 2 4 2 2 2 C
H O CH .H O 4 2 2
CO2 + Ba(OH)2→ BaCO3 + H2O x x x 2CO2 + Ba(OH)2→ Ba(HCO3)2 2y y y
Ba(HCO3)2 +Ca(OH)2→ BaCO3 + CaCO3 +2H2O y y y x + y = 0,2 (1) 197y + 100y = 53,46 (2)
x = 0,02; y = 0,18 n = 0,38 0,25 đ 2 CO 0, 38 x 0,15 1 C H x
O xCO H O x 2 2 2 2 2 0, 38 1 n .0,15 0, 455 0,50đ 2 O 0,15 2 Lưu ý: Trang 4
- Đối với bài toán nếu học sinh làm theo cách khác nhưng kết quả đúng vẫn cho điểm tối đa bài toán đó.
- Phương trình hóa học có hệ số cân bằng sai nhưng phần tính toán không liên quan đến hệ số cân bằng đó
và cho kết quả đúng thì vẫn cho điểm phần tính toán. --- HẾT --- Trang 5