Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN QUẢNG NAM
NĂM HỌC 2018 – 2019 Môn thi : HÓA HỌC ĐỀ CHÍNH THỨC
Thời gian : 150 phút (không kể thời gian giao đề)
(Đề thi có 02 trang)
Ngày thi : 09/6/2018.
Cho nguyên tử khối: H=1; C=12; O=16; Na=23; Al=27; Si=28; P=31; S=32; Cl=35,5; K=39; Ca=40; Br=80; Ba=137.
Câu 1. (2,0 điểm)
1.1. Chỉ được dùng thêm dung dịch HCl và các dụng cụ thí nghiệm như ống nghiệm,
đũa thủy tinh, thìa nhựa, ống hút nhỏ giọt (không dùng các dụng cụ gia nhiệt), hãy trình
bày cách phân biệt các chất rắn màu trắng chứa trong các lọ thủy tinh riêng biệt sau (không
cần viết phương trình phản ứng):
Na2SO4, Na2SO3, CaCO3, KHCO3, BaSO4, CuSO4.
1.2. Hòa tan hết m gam P2O5 vào 0,1 lít dung dịch hỗn hợp NaOH 0,2M và KOH 0,3M,
thu được dung dịch X. Cô cạn cẩn thận dung dịch X, thu được 3,54 gam hỗn hợp chất rắn
khan. Xác định giá trị của m.
Câu 2. (2,0 điểm)
Cho R là một trong các kim loại: Cu, Fe, Zn, Al, Ag. Biết R và hợp chất của nó tham
gia vào các sơ đồ phản ứng sau (mỗi kí hiệu đại diện cho một chất khác nhau):
(1) R + HCl → X1 + X2. (2) X2 + X3 t0 R + H2O. (3) R + Cl2 t0 X4.
(4) X1 + Cl2 → X4.
(5) X1 + NaOH → X5 + X6.
(6) X4 + NaOH → X7 + X6.
(7) X5 + H2O + X8 → X7. (8) X7 t0 X3 + H2O.
a. Hãy biện luận để xác định kim loại R.
b. Viết các phương trình hóa học tương ứng với các sơ đồ phản ứng ở trên.
Câu 3. (2,0 điểm)
3.1. Hỗn hợp X gồm KCl và KClO3, trong đó clo chiếm 34,4% về khối lượng. Trộn
34,5 gam hỗn hợp X với 5,0 gam MnO2 rồi nung ở nhiệt độ cao, thu được 5,6 lít khí oxi
(đo ở điều kiện tiêu chuẩn). Tính hiệu suất quá trình điều chế oxi từ hỗn hợp X ở trên.
3.2. Trong tinh dầu vỏ quế có thành phần chính là Cinnamaldehyde (A), có tính kháng
khuẩn rất cao. A là hợp chất hữu cơ chứa 81,82% cacbon, 12,12% oxi, còn lại là hiđro
(tính theo khối lượng). Biết rằng A có công thức phân tử trùng với công thức đơn giản
nhất. Hãy xác định công thức phân tử của A.
Câu 4. (2,0 điểm)
4.1. Hãy viết công thức phân tử và công thức cấu tạo thu gọn của các hiđrocacbon mạch
hở, có công thức chung là C3Hy. Trang 1
4.2. Hỗn hợp X gồm tất cả các hiđrocacbon mạch hở của C3Hy. Tỉ khối hơi của X so với
H2 bằng 20,5. Trộn 3,36 lít hỗn hợp X với 2,24 lít H2 trong bình kín (có mặt xúc tác Ni) rồi
đun nóng đến khi phản ứng xảy ra hoàn toàn, thu được V lít hỗn hợp Z. Toàn bộ lượng Z
trên phản ứng được với tối đa m gam brom trong dung dịch. Biết thể tích các khí đo ở điều
kiện tiêu chuẩn. Xác định giá trị của m và V.
Câu 5. (2,0 điểm)
5.1. Thêm từ từ đến dư dung dịch Ba(OH)2 0,1M vào 50 ml dung dịch Al2(SO4)3 0,1M.
Hãy tính toán để vẽ đồ thị biểu diễn sự phụ thuộc của khối lượng kết tủa thu được (đơn vị
gam) vào thể tích dung dịch Ba(OH)2 đã dùng (đơn vị ml).
5.2. Để xác định thành phần phần trăm khối lượng mỗi chất trong hỗn hợp X gồm các
chất rắn CaCO3, CaCl2 và SiO2, một học sinh đã thao tác qua các bước như sau:
Bước 1. Cân một cốc thủy tinh được m1 gam, thêm vào cốc hỗn hợp X rồi cân lại được m2 gam.
Bước 2. Thêm từ từ đến hết m3 gam dung dịch HCl vào cốc trên, khuấy đều, thấy sủi
bọt khí. Tiếp tục thêm từ từ đến hết m4 gam dung dịch HCl vào cốc trên, thấy khi lượng
dung dịch HCl thêm đến hơn một nửa thì không còn sủi bọt khí.
Bước 3. Cân toàn bộ cốc và hỗn hợp còn lại trong cốc được m5 gam.
Bước 4. Lọc hỗn hợp trong cốc rồi rửa kĩ phần chất rắn trên phễu lọc bằng nước cất,
thu được nước lọc (chứa cả phần nước cất đã dùng để rửa) và phần rắn. Làm khan phần rắn
rồi cân được m6 gam.
Các giá trị m1 đến m6 được ghi lại trong bảng sau: Các đại lượng m1 m2 m3 m4 m5 m6
Giá trị cân được (gam) 135,2 173,7 62,3 82,4 309,6 11,2
a. Bỏ qua sự bay hơi của nước trong quá trình thao tác ở các bước 1, 2, 3, từ các dữ kiện
thu được ở trên, hãy tính toán để xác định thành phần phần trăm khối lượng mỗi chất trong X.
b. Trường hợp bạn học sinh đã thực hiện hết cả 4 bước nêu trên nhưng quên ghi lại giá
trị m5. Hãy nêu cách xử lí phần nước lọc để có đủ dữ kiện xác định thành phần phần trăm
khối lượng mỗi chất trong X. Trình bày sơ lược cách tính toán với dữ kiện vừa có thêm. -----HẾT-----
(Thí sinh chỉ được sử dụng Bảng tuần hoàn các nguyên tố hóa học)
Họ tên thí sinh:.............................................................................. SBD:............................
Chữ kí giám thị 1……………………………...; Chữ kí giám thị 2…………………………….
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN QUẢNG NAM
NĂM HỌC 2018 – 2019 Môn thi : HÓA HỌC HƯỚNG DẤN CHẤM Trang 2
Thời gian : 150 phút (không kể thời gian giao đề)
Ngày thi : 09/6/2018
Câu 1. (2,0 điểm)
1.1. Chỉ được dùng thêm dung dịch HCl và các dụng cụ thí nghiệm như ống nghiệm,
đũa thủy tinh, thìa nhựa, ống hút nhỏ giọt (không dùng các dụng cụ gia nhiệt), hãy trình
bày cách phân biệt các chất rắn màu trắng chứa trong các lọ thủy tinh riêng biệt sau (không
cần viết phương trình phản ứng):
Na2SO4, Na2SO3, CaCO3, KHCO3, BaSO4, CuSO4. Ý NỘI DUNG ĐIỂM 1.1 - Trích mẫu thử Phân biệt mỗi
(1,25đ) - Thêm từ từ đến dư dung dịch HCl vào các mẫu thử chất được
Mẫu sinh ra khí mùi hắc là Na2SO3 0,25đ
Mẫu tan tạo thành dung dịch màu xanh là CuSO4 0,25*5=1,25đ
Mẫu không tan, không sủi bọt khí là BaSO4
Mẫu tan và không sủi bọt khí là Na2SO4
Mẫu gây sủi bọt khí không mùi, tiếp tục tan khi HCl hết (khi
không còn sủi bọt khí) là KHCO3
Mẫu gây sủi bọt khí không mùi, không tan sau khi HCl hết
(khi không còn sủi bọt khí) là CaCO3
1.2. Hòa tan hết m gam P2O5 vào 0,1 lít dung dịch hỗn hợp NaOH 0,2M và KOH 0,3M,
thu được dung dịch X. Cô cạn cẩn thận dung dịch X, thu được 3,54 gam hỗn hợp chất rắn
khan. Xác định giá trị của m. Ý NỘI DUNG ĐIỂM 1.2
Nếu phản ứng vừa đủ tạo muối trung hòa, khối lượng muối 0,25 photphat tạo thành là: 0, 02 0, 03 241 *164 * 212 3, 21 3,54 3 3 75
0,75đ Vậy có sinh ra muối axit. Na : 0,02 0,25 NaOH : 0,02 K : 0,03 P O dd 2 5 3 KOH : 0,03 PO : x 4 H : y m
95x y 23*0.02 39*0.03 3,54(1) cran BTDT
3x y 0,02 0,03(2) x 0,02 0,25 Từ (1) và (2) 0,01 n m = 1,42g 2 5 2 5 y 0,01 P O P O Trang 3
Câu 2. (2,0 điểm)
Cho R là một trong các kim loại: Cu, Fe, Zn, Al, Ag. Biết R và hợp chất của nó tham
gia vào các sơ đồ phản ứng sau (mỗi kí hiệu đại diện cho một chất khác nhau):
(1) R + HCl → X1 + X2. (2) X2 + X3 t0 R + H2O. (3) R + Cl2 t0 X4.
(4) X1 + Cl2 → X4.
(5) X1 + NaOH → X5 + X6.
(6) X4 + NaOH → X7 + X6.
(7) X5 + H2O + X8 → X7. (8) X7 t0 X3 + H2O.
a. Hãy biện luận để xác định kim loại R.
b. Viết các phương trình hóa học tương ứng với các sơ đồ phản ứng ở trên. Ý NỘI DUNG ĐIỂM a.
Kim loại R phản ứng với HCl và phản ứng với Cl2 cho ra 2 0,25
0,25đ muối không trùng nhau nên R là Fe. b. (1) Fe + 2HCl → FeCl2 + H2.
1,75đ (2) 3H2 + Fe2O3 t0 2Fe + 3H2O. (3) 2Fe + 3Cl2 t0 2FeCl3. (4) 2FeCl 0,25đ/1ptpư 2 + Cl2 → 2FeCl3.
(5) FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl. 0,25*7 pt= 1,75
(6) FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl. Đúng cả 8 ptpư
(7) 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3. vẫn được 1,75đ (8) 2Fe(OH)3 t0 Fe2O3 + 3H2O.
*HS không cân bằng hoặc cân bằng sai ptpư nào thì không có điểm ptpư đó.
Câu 3. (2,0 điểm)
3.1. Hỗn hợp X gồm KCl và KClO3, trong đó clo chiếm 34,4% về khối lượng. Trộn
34,5 gam hỗn hợp X với 5,0 gam MnO2 rồi nung ở nhiệt độ cao, thu được 5,6 lít khí oxi (ở
điều kiện tiêu chuẩn). Tính hiệu suất quá trình điều chế oxi từ hỗn hợp X ở trên. Ý NỘI DUNG ĐIỂM 3.1
Trong X, cứ 1 Cl thì có 1 K. 0,25 (1 điểm)
=> Phần trăm khối lượng kali: 34, 4*39 37,79% 35,5
Phần trăm khối lượng oxi: 100 - 37,79 - 34,4 = 27,81%. 0,25
Khối lượng oxi trong X: 34,5*27,81% = 9,59445g.
nO/X = 9,59445/16 ≈ 0,6 mol. 0,25
=> Số mol khí O2 sinh ra 0,3 mol
Số mol khí oxi theo thực tế: 5,6/22,4 = 0,25 mol. 0,25 Hiệu suất: 0, 25 H% = *100% ≈ 83,33% 0, 3 Trang 4
3.2. Trong tinh dầu vỏ quế có thành phần chính là Cinnamaldehyde (A), có tính kháng
khuẩn rất cao. A là hợp chất hữu cơ chứa 81,82% cacbon, 12,12% oxi, còn lại là hidro
(tính theo khối lượng). Biết rằng A có công thức phân tử trùng với công thức đơn giản
nhất. Hãy xác định công thức phân tử của A. Ý NỘI DUNG ĐIỂM 3.2
%mH = 100 - 81,82 - 12,12 = 6,06% 0,25 (1 điểm)
Gọi công thức chung của A là CxHyOz. 0,25 Ta có: 81,82 6, 06 12,12
x : y : z : : = 6,818 : 6,06 : 0,7575 12 1 16 = 9: 8 : 1. 0,25 => CTĐGN: C9H8O. 0,25 => CTPT: C9H8O
Câu 4. (2,0 điểm)
4.1. Hãy viết công thức phân tử và công thức cấu tạo thu gọn của các hiđrocacbon mạch
hở, có công thức chung là C3Hy. Ý NỘI DUNG ĐIỂM 4.1 C3H8: CH3-CH2-CH3. 0,25 (1 điểm) C3H6: CH2=CH-CH3. 0,25 C3H4: CH3-C≡CH. 0,25 CH2=C=CH2. 0,25
4.2. Hỗn hợp X gồm tất cả các hiđrocacbon mạch hở của C3Hy. Tỉ khối hơi của X so với
H2 bằng 20,5. Trộn 3,36 lít hỗn hợp X với 2,24 lít H2 trong bình kín (có mặt xúc tác Ni) rồi
đun nóng đến khi phản ứng xảy ra hoàn toàn, thu được V lít hỗn hợp Z. Toàn bộ lượng Z
trên phản ứng được với tối đa m gam brom trong dung dịch. Biết thể tích các khí đo ở điều
kiện tiêu chuẩn. Xác định giá trị của m và V. Ý NỘI DUNG ĐIỂM 4.2 M 20,5*2 41 0,25 X
(1 điểm) Công thức chung của X: C3Hy => y = 41 - 12*3 = 5.
=> Công thức chung của X là C3H5.
Nếu H2 pứ tối đa với X 0,25 3 xt ,t
C H H C H 3 5 2 2 3 8 0,15 0, 225 n 0,225 0,1 H H (t.da)
2 phản ứng hết, Z chỉ chứa các hiđrocacbon 2
Số mol các hiđrocacbon không đổi: VZ = VX = 3,36 lít. 0,25 n n 0,225 n 0,2250,1 0,125 0,25 H pu Br pu Br pu 2 2 2 m 0,125*160 = 20g Br pu 2 Trang 5
Câu 5. (2,0 điểm)
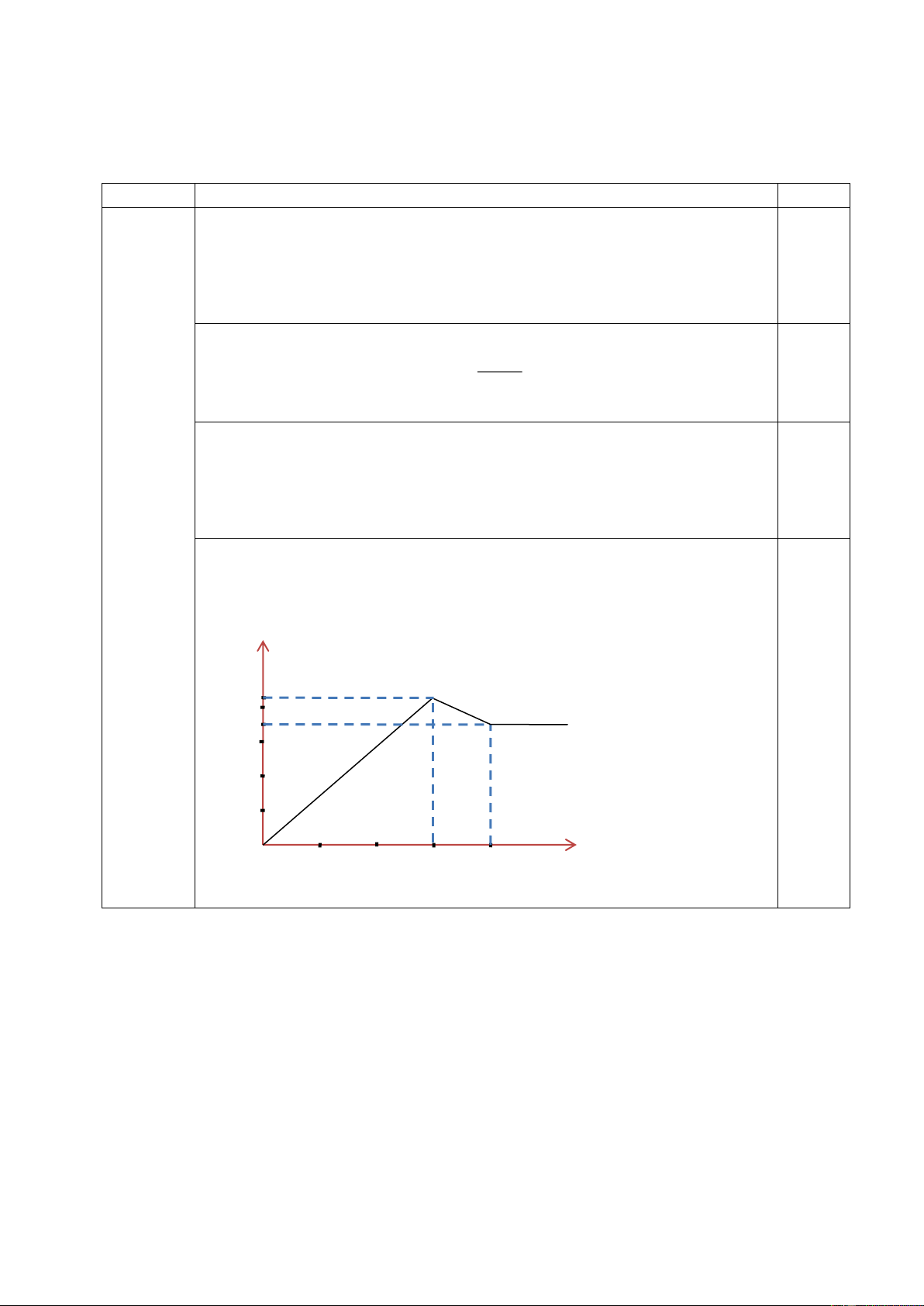
5.1. Thêm từ từ đến dư dung dịch Ba(OH)2 0,1M vào 50 ml dung dịch Al2(SO4)3 0,1M.
Hãy tính toán để vẽ đồ thị biểu diễn sự phụ thuộc của khối lượng kết tủa thu được (đơn vị
gam) vào thể tích dung dịch Ba(OH)2 đã dùng (đơn vị ml). Ý NỘI DUNG ĐIỂM 5.1
Số mol Al2(SO4)3= 0,005 mol. 0,25
(1 điểm) 3Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓. (1)
0,015 ← 0,005 → 0,015 → 0,01
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O. (2) 0,01 → 0,005
Theo (1), lượng kết tủa đạt tối đa khi lượng Ba(OH)2 là 0,015 mol 0,25 0, 015
thể tích dung dịch Ba(OH)2 là
0,15lit = 150ml. 0,1
khối lượng kết tủa tối đa: 0,015*233 + 0,01*78 = 4,275g.
Từ (1) và (2), số mol Ba(OH)2 = 0,015 + 0,005 = 0,02 0,25
thể tích dung dịch Ba(OH)2 là 0,2 lít (200ml)
kết tủa chỉ còn BaSO4 với khối lượng: 0,015*233 = 3,495g.
Khi thể tích dung dịch Ba(OH)2 0,1M đạt từ 200ml trở lên thì khối
lượng kết tủa không đổi và bằng khối lượng BaSO4.
Từ các dữ kiện trên, đồ thị biểu diễn sự phụ thuộc của khối lượng kết 0,25
tủa (gam) vào thể tích dung dịch Ba(OH)2 0,1M (ml) được vẽ như sau: m (gam) 4,275 3,495 V (ml) 0 150 200 Trang 6
5.2. Để xác định thành phần phần trăm khối lượng mỗi chất trong hỗn hợp X gồm các
chất rắn CaCO3, CaCl2 và SiO2, một học sinh đã thao tác qua các bước như sau:
Bước 1. Cân một cốc thủy tinh được m1 gam, thêm vào cốc hỗn hợp X rồi cân lại được m2 gam.
Bước 2. Thêm từ từ đến hết m3 gam dung dịch HCl vào cốc trên, khuấy đều, thấy sủi
bọt khí. Tiếp tục thêm từ từ đến hết m4 gam dung dịch HCl vào cốc trên, thấy khi lượng
dung dịch HCl thêm đến hơn một nửa thì không còn sủi bọt khí.
Bước 3. Cân toàn bộ cốc và hỗn hợp còn lại trong cốc được m5 gam.
Bước 4. Lọc hỗn hợp trong cốc rồi rửa kĩ phần chất rắn trên phễu lọc bằng nước cất,
thu được nước lọc (chứa cả phần nước cất đã dùng để rửa) và phần rắn. Làm khan phần rắn
rồi cân được m6 gam.
Các giá trị m1 đến m6 được ghi lại trong bảng sau: Các đại lượng m1 m2 m3 m4 m5 m6
Giá trị cân được (gam) 135,2 173,7 62,3 82,4 309,6 11,2
a. Bỏ qua sự bay hơi của nước trong quá trình thao tác ở các bước 1, 2, 3, từ các dữ kiện
thu được ở trên, hãy tính toán để xác định thành phần phần trăm khối lượng mỗi chất trong X.
b. Trường hợp bạn học sinh đã thực hiện hết cả 4 bước nêu trên nhưng quên ghi lại giá
trị m5. Hãy nêu cách xử lí phần nước lọc để có đủ dữ kiện xác định thành phần phần trăm
khối lượng mỗi chất trong X. Trình bày sơ lược cách tính toán với dữ kiện vừa có thêm. Ý NỘI DUNG ĐIỂM a.
Khối lượng X: m2 – m1= 173,7- 135,2 = 38,5g. 0,25
(0,75đ) Phần chất rắn thu được trên phễu lọc là SiO2: m = m Si 6 = 11,2g. 2 O %m = 29,09%. SiO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O. 0,25
Lượng HCl thêm vào lần 2 đã hoà tan hết CaCO3, dung dịch HCl dư.
CaCO3 phản ứng với HCl giải phóng khí CO2 thoát khỏi dung dịch
làm khối lượng hệ giảm đi. m = m2 + m3 + m4 - m5 = 8,8g 2 CO 8,8 n = n = 0, 2 mol 2 CO CaC 3 O 44 m = 0,2*100 = 20g. CaC 3 O 20 0,25 => %m *100% = 51,95%. CaCO3 38, 5 => %m
= 100 - 29,09 - 51,95 = 18,96%. CaCl2 b.
Cô cạn phần nước lọc thu lấy muối khan đem cân (CaCl2). 0,25
(0,25đ) Từ các giá trị: khối lượng hỗn hợp X, khối lượng SiO2 và khối
lượng muối khan CaCl2, lập hệ 3 phương trình giải được khối lượng từng chất, suy ra %. *Lưu ý:
- Học sinh giải theo cách khác nhưng đúng vẫn cho điểm tối đa. Trang 7