



Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN QUẢNG NAM
NĂM HỌC 2019 – 2020 Môn thi: HÓA HỌC ĐỀ CHÍNH THỨC
Thời gian làm bài: 150 phút (không kể thời gian giao đề)
(Đề thi có 02 trang)
Khóa thi ngày: 10 - 12/06/2019
Cho nguyên tử khối: H=1; C=12; O=16; S= 32; Cl= 35,5; Fe= 56; Ba= 137; Na= 23; K= 39; Al= 27.
Họ tên thí sinh:.............................................................................. SBD:...........................
Câu 1. (2,0 điểm)
1.1. Nguyên tử của nguyên tố R có tổng số hạt proton, nơtron và electron là 18, trong
đó số hạt mang điện gấp đôi số hạt không mang điện.
a. Xác định tên nguyên tố R.
b. Sắp xếp các nguyên tố R, oxi, silic theo chiều tăng dần tính phi kim. Giải thích.
1.2. Cho các thông tin sau:
- Chất X độc, hơi nhẹ hơn không khí, sinh ra khi thổi không khí qua lượng lớn than nóng đỏ.
- Chất Y là khí nhẹ nhất trong tự nhiên, thể hiện tính khử mạnh ở nhiệt độ cao.
- Chất Z không màu, không mùi, có nhiều trong khí dầu mỏ, khí thiên nhiên, khí
biogas, là tác nhân gây hiệu ứng nhà kính.
- Chất T sinh ra khi cho đất đèn phản ứng với nước, được dùng trong hàn, cắt kim loại.
a. Viết công thức hóa học của các chất X, Y, Z, T.
b. Trình bày phương pháp hóa học để phân biệt X, Y, Z, T (không cần viết phương trình minh họa).
Câu 2. (2,0 điểm)
Để điều chế dung dịch chất X, người ta tiến hành thí nghiệm như sau:
- Lấy chính xác V ml dung dịch NaOH a M vào mỗi cốc thủy tinh được đánh số (1) và (2).
- Sục đến dư khí CO2 vào dung dịch trong cốc (1).
- Cho toàn bộ dung dịch trong cốc (2) vào cốc (1), khuấy đều.
Cho rằng lượng CO2 tồn tại ở dạng hòa tan trong dung dịch là không đáng kể.
a. Viết công thức của chất X và các phương trình hóa học xảy ra trong thí nghiệm trên.
b. Chất X ở trên tham gia vào dãy chuyển hóa dưới đây:
Biết rằng mỗi mũi tên là một phương trình hóa học, mỗi khí hiệu là một chất khác
nhau, V là hợp chất tan được của kẽm.
Hãy viết các phương trình hóa học thể hiện dãy chuyển hóa trên.
Câu 3. (2,0 điểm)
3.1. Hỗn hợp X gồm một oxit sắt (FexOy) và FeCO3. Nung 37,12 gam X trong không
khí đến khối lượng không đổi, thu được 32,00 gam một oxit sắt duy nhất và khí CO2. Hấp
thụ toàn bộ lượng CO2 sinh ra ở trên vào 800 ml dung dịch Ba(OH)2 0,15M, thu được
15,76 gam kết tủa. Cho các phản ứng xảy ra hoàn toàn. Xác định công thức của FexOy. Trang 1
3.2. Một trong những phương pháp sản xuất rượu uống phổ biến là thủy phân rồi lên
men tinh bột. Tính thể tích rượu 400 sản xuất được từ 4,0 kg bột sắn khô (chứa 70% khối
lượng là tinh bột, các thành phần khác không tạo ra ancol etylic). Cho hiệu suất của toàn
bộ quá trình sản xuất đạt 80%, khối lượng riêng của ancol etylic nguyên chất là 0,8 g/ml.
Câu 4. (2,0 điểm)
4.1. Đốt cháy hoàn toàn 180 ml hỗn hợp khí X gồm hai hiđrocacbon, thu được 800 ml
hỗn hợp Y gồm oxi dư, khí cacbonic và hơi nước. Dẫn toàn bộ Y qua lượng dư dung dịch
H2SO4 đặc, thu được hỗn hợp khí Z có thể tích giảm 41,25% so với Y. Dẫn toàn bộ lượng
Z qua dung dịch Ca(OH)2 dư, thể tích khí thoát ra giảm 44,68% so với Z. Các thể tích khí
được đo ở cùng điều kiện nhiệt độ, áp suất. Cho các phản ứng xảy ra hoàn toàn. Xác định
công thức phân tử của hai hiđrocacbon trong X.
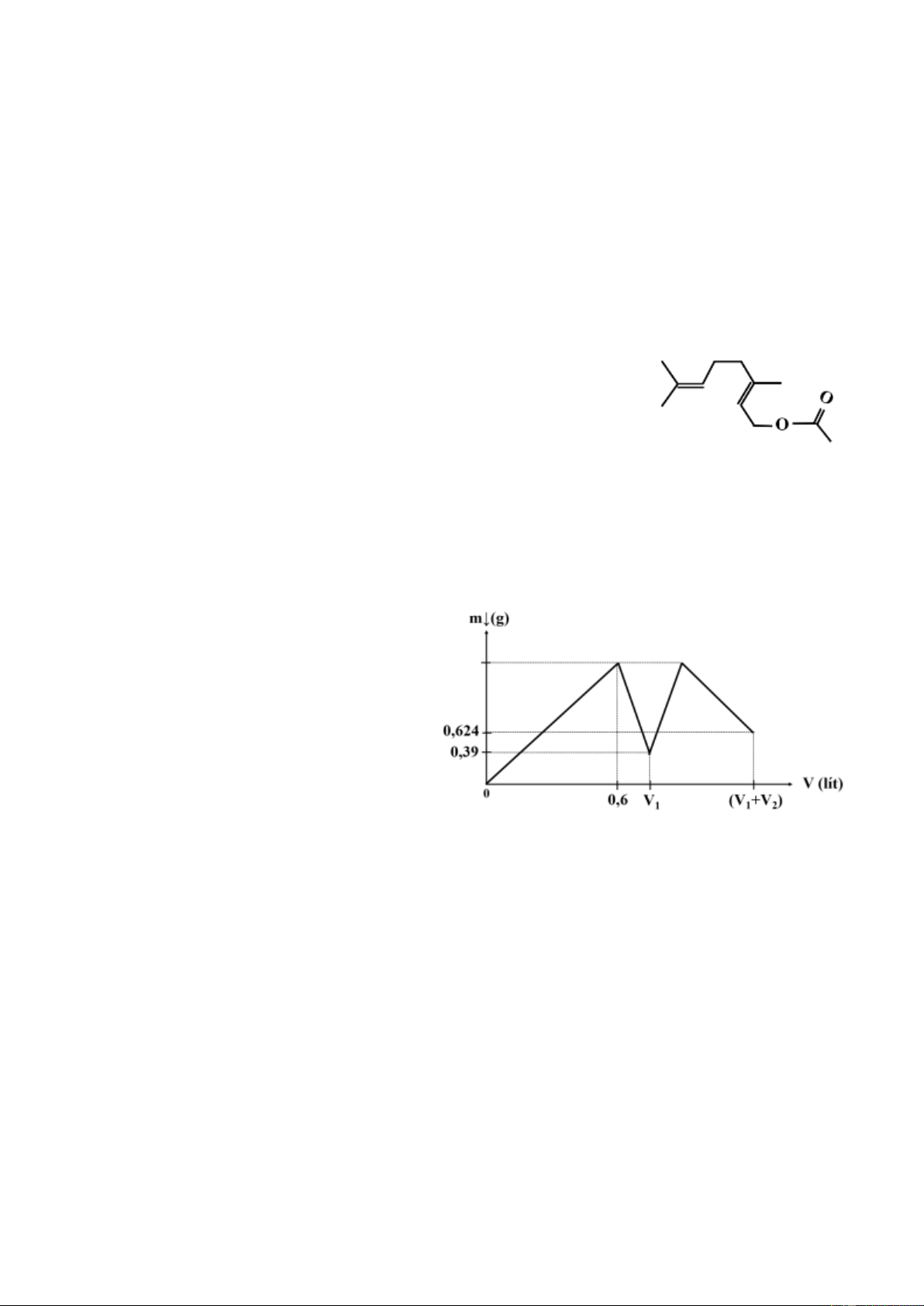
4.2. Geranyl axetat là chất lỏng dạng đặc, có màu vàng đẹp, là
thành phần tự nhiên của hơn 60 loại tinh dầu như cỏ chanh, hoa
cam, phong lữ, rau mùi, …, được sử dụng làm hương liệu trong
nước hoa, các loại kem, xà phòng. Công thức cấu tạo thu gọn nhất
của geranyl axetat như hình bên.
a. Viết công thức phân tử của geranyl axetat.
b. Viết phương trình hóa học xảy ra khi cho geranyl axetat lần lượt phản ứng với lượng
dư các chất: H2 (xúc tác niken, t0), Br2 (trong dung môi CCl4), dung dịch NaOH (đun nóng).
Câu 5 (2,0 điểm)
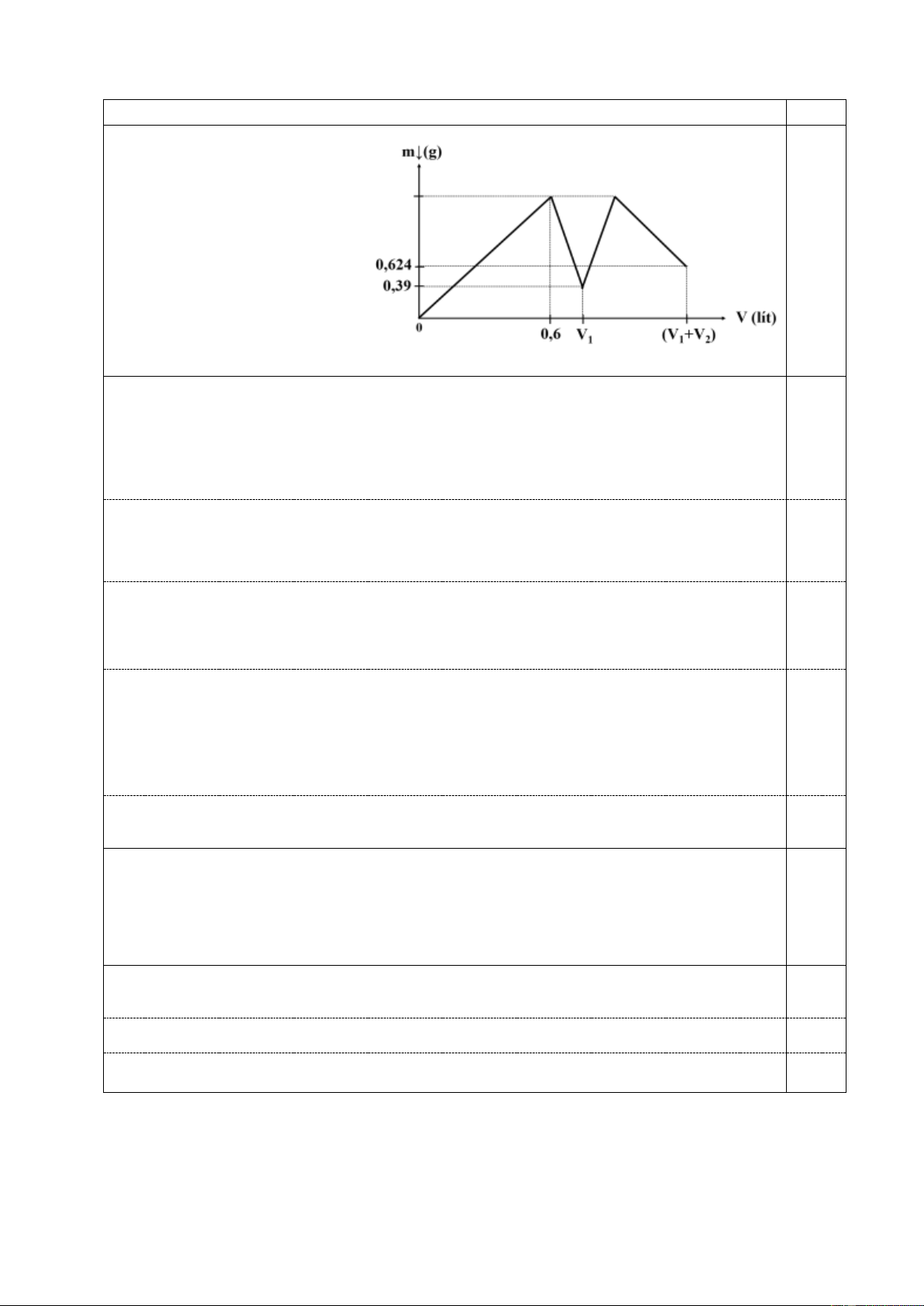
5.1. Thêm từ từ đến hết V1 lít dung
dịch NaOH 0,1 M vào 100 ml dung
dịch Al2(SO4)3 a M, sau đó thêm từ từ
đến hết V2 lít dung dịch HCl 0,1 M
vào hệ. Gọi V là tổng của V1 và V2.
Khối lượng kết tủa trong hệ biến đổi
theo V như đồ thị bên. Cho các phản
ứng xảy ra hoàn toàn. Xác định giá trị của a, V1 và V2.
5.2. Trong chất béo thường có lẫn một ít axit béo; để đánh giá lượng axit béo tự do có
trong chất béo, người ta dùng chỉ số axit, đó là số miligam KOH cần dùng để trung hòa
axit béo tự do có trong một gam chất béo.
Tính chỉ số axit của một loại chất béo, biết rằng để trung hòa lượng axit béo tự do có
trong 28 gam chất béo đó cần dùng 0,12 gam NaOH.
----------HẾT----------
(Học sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học) Trang 2
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN QUẢNG NAM
NĂM HỌC 2019 – 2020 Môn thi: HÓA HỌC HƯỚNG DẪN CHẤM
Thời gian làm bài: 150 phút (không kể thời gian giao đề)
(HDC này có 05 trang)
Khóa thi ngày: 10 - 12/06/2019 Nội dung Điểm Câu 1. 2,0
1.1. Nguyên tử của nguyên tố R có tổng số hạt proton, nơtron và electron là 18, trong đó
số hạt mang điện gấp đôi số hạt không mang điện. 1,0
a. Xác định tên nguyên tố R.
b. Sắp xếp các nguyên tố R, oxi, silic theo chiều tăng dần tính phi kim. Giải thích. p + n + e = 2p + n = 18. P + e = 2p = 2n 0,25 => p = n = e = 6 => R là cacbon (C). 0,25
Theo chiều tính phi kim tăng dần: Si, C, O. 0,25
Vì trong bảng HTTH, đi từ trên xuống dưới trong 1 nhóm, tính phi kim giảm; đi từ trái
sang phải trong 1 chu kì, tính phi kim tăng; mà Si cùng nhóm và ở phía dưới C (Si có 0,25
tính phi kim yếu hơn C); O cùng chu kỳ và ở phía bên phải C (O có tính phi kim mạnh hơn C).
1.2. Cho các thông tin sau:
- Chất X độc, hơi nhẹ hơn không khí, sinh ra khi thổi không khí qua lượng lớn than nóng đỏ.
- Chất Y là khí nhẹ nhất trong tự nhiên, thể hiện tính khử mạnh ở nhiệt độ cao.
- Chất Z không màu, không mùi, có nhiều trong khí dầu mỏ, khí thiên nhiên, khí biogas, 1,0
là tác nhân gây hiệu ứng nhà kính.
- Chất T sinh ra khi cho đất đèn phản ứng với nước, được dùng trong hàn, cắt kim loại.
a. Viết công thức hóa học của các chất X, Y, Z, T.
b. Trình bày phương pháp hóa học để phân biệt X, Y, Z, T (không cần viết phương trình minh họa).
a. X: CO; Y: H2; Z: CH4; T: C2H2. 0,25 b. Trích mẫu thử.
Cho tác dụng với nước brom, chỉ có C2H2 làm mất màu, các khí còn lại không làm mất 0,25 màu nước brom.
Đốt 3 khí còn lại trong oxi rồi lần lượt dẫn qua CuSO4 khan và dung dịch Ca(OH)2. 0,25
Mẫu thử chỉ làm CuSO4 khan từ trắng chuyển sang xanh là H2.
Mẫu thử chỉ cho kết tủa trắng trong dung dịch Ca(OH)2 là CO. 0,25
Mẫu thử làm đổi màu CuSO4 khan và tạo kết tủa trắng là CH4. Trang 3 Câu 2. 2,0
Để điều chế dung dịch chất X, người ta tiến hành thí nghiệm như sau:
- Lấy chính xác V ml dung dịch NaOH a M vào mỗi cốc được đánh số (1) và (2).
- Sục đến dư khí CO2 vào dung dịch trong cốc (1).
- Cho toàn bộ dung dịch trong cốc (2) vào cốc (1), khuấy đều.
Cho rằng lượng CO2 tồn tại ở dạng hòa tan trong dung dịch là không đáng kể.
a. Viết công thức của chất X và các phương trình hóa học xảy ra trong thí nghiệm trên. 2,0
b. Chất X ở trên tham gia vào dãy chuyển hóa dưới đây:
Biết rằng mỗi mũi tên là một phương trình hóa học, mỗi khí hiệu là một chất khác
nhau, V là hợp chất tan được của kẽm.
Hãy viết các phương trình hóa học thể hiện dãy chuyển hóa trên. a. X là Na2CO3. 0,25 CO2 + 2NaOH → Na2CO3 + H2O.
Na2CO3 + CO2 + H2O → 2NaHCO3. 0,25
(HS viết NaOH + CO2 → NaHCO3 thay cho 2 pt trên vẫn đạt điểm tối đa).
NaHCO3 + NaOH → Na2CO3 + H2O. 0,25
b. Na2CO3 + CaCl2 → CaCO3 + 2NaCl. 0,25 CaCO3 CaO + CO2. 0,25 CaO + H2O → Ca(OH)2. 0,25
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH. 0,25
4NaOH + ZnCl2 → Na2ZnO2 + 2H2O + 2NaCl. 0,25 Trang 4 Câu 3. 2,0
3.1. Hỗn hợp X gồm một oxit sắt (FexOy) và FeCO3. Nung 37,12 gam X trong không khí
đến khối lượng không đổi, thu được 32,00 gam một oxit sắt duy nhất và khí CO2. Hấp thụ 1,25
toàn bộ lượng CO2 sinh ra ở trên vào 800 ml dung dịch Ba(OH)2 0,15M, thu được 15,76
gam kết tủa. Cho các phản ứng xảy ra hoàn toàn. Xác định công thức của FexOy.
n(Ba(OH)2 = 0,12 mol. n(BaCO3) = 0,08 mol.
Oxit sắt duy nhất thu được là Fe2O3: m(Fe2O3) = 32g => n(Fe2O3) = 0,2 mol. Trường hợp hấp thụ CO 0,25
2 vào dung dịch Ba(OH)2 chỉ tạo ra BaCO3: n(CO 2) = n(BaCO3) = 0,08 mol.
Lúc này m(CO2) + m(Fe2O3) = 0,08x44+32 = 35,52 < 37,21 => Loại (vì trong quá trình
phản ứng, hợp chất của sắt đã kết hợp thêm oxi để tạo Fe2O3).
Trường hợp hấp thụ CO2 vào dung dịch Ba(OH)2 tạo ra BaCO3 và Ba(HCO3)2:
n(CO2) = n(OH)- - n(BaCO3) = 0,12x2- 0,08 = 0,16 mol. 0,25 => n(FeCO3) = 0,16 mol
n(Fe/FexOy) = 2x0,2 - 0,16 = 0,24 mol. 0,25
=> n(O/FexOy) = (37,12- 116x 0,16- 0,24x 56)/ 16 = 0,32 mol. 0,25
=> x: y = 0,24: 0,32 = 3: 4. 0,25 => Oxit sắt là Fe3O4.
3.2. Một trong những phương pháp sản xuất rượu uống phổ biến là thủy phân rồi lên
men tinh bột. Tính thể tích rượu 400 sản xuất được từ 4,0 kg bột sắn khô (chứa 70% khối
lượng là tinh bột, các thành phần khác không tạo ra ancol etylic). Cho hiệu suất của 0,75
toàn bộ quá trình sản xuất đạt 80%, khối lượng riêng của ancol etylic nguyên chất là 0,8 g/ml.
m(tinh bột) = 4000x70/100 = 2800g.
(C6H10O5)n → nC6H12O6 → 2n C2H5OH 0,25 162n gam 92n gam
m(C2H5OH) = 2800 x 92/162x0,8 = 1272,1g.
Thể tích rượu nguyên chất: 1272,1/0,8 = 1590,1 ml. 0,25
Thể tích dung dịch rượu 400: 1590,1x100/40 = 3975,3 ml. 0,25 Trang 5 Câu 4. 2,0
4.1. Đốt cháy hoàn toàn 180 ml khí X, thu được 800 ml hỗn hợp Y gồm oxi dư, khí
cacbonic và hơi nước. Dẫn toàn bộ Y qua lượng dư dung dịch H2SO4 đặc, thu được hỗn
hợp khí Z có thể tích giảm 41,25% so với Y. Dẫn toàn bộ lượng Z qua dung dịch 1,0
Ca(OH)2 dư, thể tích khí thoát ra giảm 44,68% so với Z. Các thể tích khí được đo ở cùng
điều kiện nhiệt độ, áp suất. Cho các phản ứng xảy ra hoàn toàn. Xác định công thức
phân tử của 2 hiđrocacbon trong X.
H2SO4 chỉ hấp thụ hơi nước: V(H2O) = 41,25x800/100 = 330 ml. V(Z) = 800- 330 = 470 ml. 0,25
Sục Z qua dung dịch Ca(OH)2 thì CO2 bị hấp thụ:
V(CO2) = 44,68x470/100 = 210 ml.
Gọi công thức trung bình của 2 hidrocacbon là CxHy. CxHy → x CO2 + y/2 H2O. 0,25 180 210 330
x = 1,17 => Một trong 2 hidrocacbon phải có 1 nguyên tử cacbon trong phân tử: CH4.
y/2 = 330/180 = 1,83 => y = 3,67; Số nguyên tử H trong hidrocacbon luôn chẵn. 0,25
=> Hidrocacbon còn lại phải là CaH2. CaH2 2 0,33 3,67 CH4 4 1,67 => n(CaH2)/n(CH4) = 1/5 0,25
=> V(CH4)= 150 ml; V(CaH2) = 30 ml.
Bảo toàn cacbon: 30xa + 150 = 210 => a = 2.
Vậy hidrocacbon còn lại là C2H2.
4.2. Geranyl axetat là chất lỏng dạng đặc, có màu vàng đẹp, là
thành phần tự nhiên của hơn 60 loại tinh dầu như cỏ chanh,
hoa cam, phong lữ, rau mùi, …, được sử dụng làm hương liệu
trong nước hoa, các loại kem, xà phòng. Công thức cấu tạo
thu gọn nhất của geranyl axetat như hình bên. 1,0
a. Viết công thức phân tử của geranyl axetat.
b. Viết phương trình hóa học xảy ra khi cho geranyl axetat lần lượt phản ứng với
lượng dư các chất: H2 (xúc tác niken, t0), Br2 (trong dung môi CCl4), dung dịch NaOH (đun nóng).
a. CTPT của X là: C12H20O2. 0,25 b. C12H20O2 + 2H2 C12H24O2. 0,25
C12H20O2 + 2Br2 → C12H20O2Br4. 0,25
C12H20O2 + NaOH → C10H18O + C2H3O2Na. 0,25 Trang 6 Câu 5. 2,0
5.1. Thêm từ từ đến hết V1 lít
dung dịch NaOH 0,1 M vào 100 ml dung dịch Al2(SO4)3 a M,
sau đó thêm từ từ đến hết V2 lít
dung dịch HCl 0,1 M vào hệ.
Gọi V là tổng của V1 và V2. 1,25
Khối lượng kết tủa trong hệ
biến đổi theo V như đồ thị bên.
Cho các phản ứng xảy ra hoàn
toàn. Xác định giá trị của a, V1 và V2.
Khi thể tích dung dịch dùng đến 0,6 thì lượng kết tủa đạt tối đa, lượng dung dịch NaOH
chưa dùng hết (V1> 0,6, chưa dùng đến HCl), lúc này n(NaOH) = 0,6 x 0,1 = 0,06 mol. Al3+ + 3OH- → Al(OH)3. 0,25
n(Al(OH)3) = 0,06/3 = 0,02 mol.
=> n(Al2(SO4)3) = 0,01 mol => a = 0,01/0,1 = 0,1.
Khi vừa dùng hết dung dịch NaOH (ở V = V1): n(Al(OH)3) = 0,39/78 = 0,005 mol.
n(NaOH) = 4xn(Al3+)- n(Al(OH)3) = 4x0,02 – 0,005 = 0,075 mol. 0,25
=> V1 = 0,075/0,1 = 0,75 lít.
Ở thời điểm này, n(AlO -
2 ) = 0,02 – 0,005 = 0,015 mol. 0,25 AlO - 2 + H2O + H+ → Al(OH)3.
Số mol HCl cần dùng để đưa kết tủa về max: 0,015 mol.
Tại thời điểm V = V1 + V2: n(Al(OH)3) = 0,624/78 = 0,008 mol.
Sau khi đưa kết tủa về max, HCl lại hòa tan kết tủa:
Al(OH)3 + 3H+ → Al3+ + 3H2O. 0,25
n(Al(OH)3) tan = 0,02 – 0,008 = 0,012 mol. n(HCl) = 0,012x3 = 0,036 mol.
Tổng số mol HCl đã dùng: 0,036 + 0,015 = 0,051 mol. 0,25 V2 = 0,051/0,1 = 0,51 lít.
5.2. Trong chất béo thường có lẫn một ít axit béo; để đánh giá lượng axit béo tự do có
trong chất béo, người ta dùng chỉ số axit, đó là số miligam KOH cần dùng để trung hòa
axit béo tự do có trong một gam chất béo. 0,75
Tính chỉ số axit của một loại chất béo, biết rằng để trung hòa lượng axit béo tự do có
trong 28 gam chất béo đó cần dùng 0,12 gam NaOH.
n(NaOH) = 0,12/40 = 0,003 mol. 0,25
Số mol KOH cần dùng cũng là số mol NaOH: n(KOH) = 0,003 mol.
=> m(KOH) = 0,003 x 56 = 0,168g = 168 mg. 0,25 Chỉ số axit: 168/28 = 6. 0,25 -----HẾT----- Trang 7