




Preview text:
PHÚC TRÌNH Dược – K48
BÀI: ĐỊNH TÍNH NHÓM CHỨC HỮU CƠ & ĐIỀU CHẾ ASPIRIN
I. Định tính nhóm chức hữu cơ
Dụng cụ và hóa chất Dụng cụ Hóa chất Ống nghiệm 10 Cyclohexan Phenol Giá ống nghiệm 1 Cyclohexanol Acid Acetic Ống đong 10 ml 1 dd KMnO4 dd HCl Kẹp ống nghiệm 3 dd NaOH 10% Cyclohexen dd H2SO4 đđ Tert-butanon dd FeCl3 Aceton Benzaldehyd Acetophenon Etanol Phenilhydrazin dd glucose Thuốc thử Tollens II. Thực hành 1. Tính tan
a. Trong nước – Thí nghiệm 1 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm: + Ống 1: 5 giọt cyclohexan + Ống 2: 5 giọt phenol
+ Ống 3: 5 giọt acid acetic
Thêm vào từng ống nghiệm 1ml nước cất, lắc đều và quan sát hiện tượng.
Kết quả hiện tượng & giải thích:
- Ống 1: Tách lớp: Cyclohexane ở trên, nước ở dưới => không tan
Giải thích: Vì nước là dung môi phân cực, cyclohexane là dung môi không phân cực
nên cyclohexane không thể hòa tan trong nước, tạo hiện tượng tách lớp. Khối lượng
riêng của cyclohexane (lỏng) là 0,7739g/ml, nhỏ hơn so với nước là 1g/ml nên
cyclohexane sẽ nổi lên trên.
- Ống 2: Hiện tượng tạo nhũ, dd phenol tan ít trong nước ở điều kiện thường.
Giải thích: Do phenol có tính phân cực yếu => tan rất kém ở điều kiện thường.
- Ống 3: dd đồng nhất, acid acetic tan trong nước.
Giải thích: Vì acid acetic là một hợp chất phân cực và trong acid acetic có nhóm -OH
có khả năng tạo liên kết hydro với nước.
b. Trong môi trường acid – Thí nghiệm 2 Các bước tiến hành: Dược – K48
Cho lần lượt vào 3 ống nghiệm: + Ống 1: 5 giọt cyclohexan + Ống 2: 5 giọt phenol
+ Ống 3: 5 giọt acid acetic
Thêm vào từng ống nghiệm 1ml dd HCl, lắc đều và quan sát hiện tượng.
Kết quả hiện tượng & giải thích:
- Ống 1: dd tách lớp, cyclohexan ở trên, HCl ở dưới => Không tan
Giải thích: Cyclohexane là hợp chất hữu cơ, dung môi không phân cực nên không tan
trong dung môi phân cực là HCl. Do khối lượng riêng của cyclohexane nhỏ hơn HCl
nên cyclohexan ở lớp trên, HCl ở lớp dưới.
- Ống 2: có hiện tượng tạo nhũ
Giải thích: Phenol là một hợp chất hữu cơ có tính phân cực kém nên tan rất ít trong
dung môi phân cực như HCl ở điều kiện thường.
- Ống 3: dd đồng nhất => Tan
Giải thích: Vì acid acetic là một dung môi phân cực nên tan tốt trong dung môi phân cực là HCl.
c. Trong môi trường base– Thí nghiệm 3 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm: + Ống 1: 5 giọt cyclohexan + Ống 2: 5 giọt phenol
+ Ống 3: 5 giọt acid acetic
Thêm vào từng ống nghiệm 1ml dd NaOH, lắc đều và quan sát hiện tượng.
Kết quả hiện tượng & giải thích:
- Ống 1: dd tách lớp, cyclohexan ở trên, NaOH ở dưới => Không tan
Giải thích: Cyclohexane là hợp chất hữu cơ, dung môi không phân cực nên không tan
trong dung môi phân cực là NaOH. Do khối lượng riêng của cyclohexane nhỏ hơn
NaOH nên cyclohexan ở lớp trên, NaOH ở lớp dưới.
- Ống 2: dd đồng nhất => Tan
Giải thích: Do phenol phản ứng NaOH tạo thành muối natri phenolate tan trong nước nên dd đồng nhất. PTHH:
C6H5OH + NaOH → C6H5ONa + H2O Dược – K48
- Ống 3: dd đồng nhất => Tan
Giải thích: Acid axetic phản ứng với NaOH tạo thành muối natri acetat tan trong nước
nên dung dịch đồng nhất. PTHH:
CH3COOH + NaOH → CH3COONa + H2O
2. Nhận biết Alcan, Alcen và Alcol
a. Bằng H2SO4 đđ – Thí nghiệm 4 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm:
+ Ống 1: 10 giọt cyclohexan
+ Ống 2: 10 giọt cyclohexen
+ Ống 3: 10 giọt cyclohexanol
Ngâm lạnh các ống nghiệm trong nước đá, sau đó tiếp tục thêm vào từng ống nghiệm
10 giọt H2SO4 đđ, lắc đều, quan sát và giải thích hiện tượng.
Kết quả hiện tượng & giải thích:
- Ống 1: dd trong suốt (khó nhận thấy tách lớp)
Giải thích: Cyclohexan không tan trong H2SO4 đậm đặc, nếu quan sát kĩ sẽ thấy dung dịch tách lớp. - Ống 2: dd hóa đen
Giải thích: Cyclohexen bị sulfo hóa bởi H2SO4 đậm đặc, xảy ra phản ứng: C6H10 + H2SO4 → C6H11(HSO4)
- Ống 3: dd có màu vàng cam và dần ngả đen do phản ứng chậm hơn so với cyclohexen
Giải thích: Cyclohexanol bị H2SO4 đđ khử nước tạo thành cyclohexen sau đó
cyclohexen bị sulfo hóa bởi H2SO4 đậm đặc, xảy ra 2 phản ứng: sdfasf C H2SO4 đđ 6H11OH C6H10 2 + H O C6H10 + H2SO4 → C6H11(HSO4)
b. Bằng dd KMnO4 loãng – Thí nghiệm 5 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm:
+ Ống 1: 10 giọt cyclohexan
+ Ống 2: 10 giọt cyclohexen
+ Ống 3: 10 giọt cyclohexanol Dược – K48
Ngâm lạnh các ống nghiệm trong nước đá, sau đó thêm vài giọt dd KMnO4 vào mỗi
ống nghiệm, lắc đều, quan sát và giải thích hiện tượng.
Kết quả hiện tượng & giải thích:
- Ống 1: Không phản ứng, dd tách lớp và vẫn giữ nguyên màu tím.
Giải thích: Ở nhiệt độ thường, KMnO4 không oxy hóa được cyclohexan, dd vẫn giữ nguyên màu tím của KMnO4
- Ống 2: Phản ứng xảy ra nhanh, dd mất màu tím, xuất hiện chất rắn màu đen (MnO2).
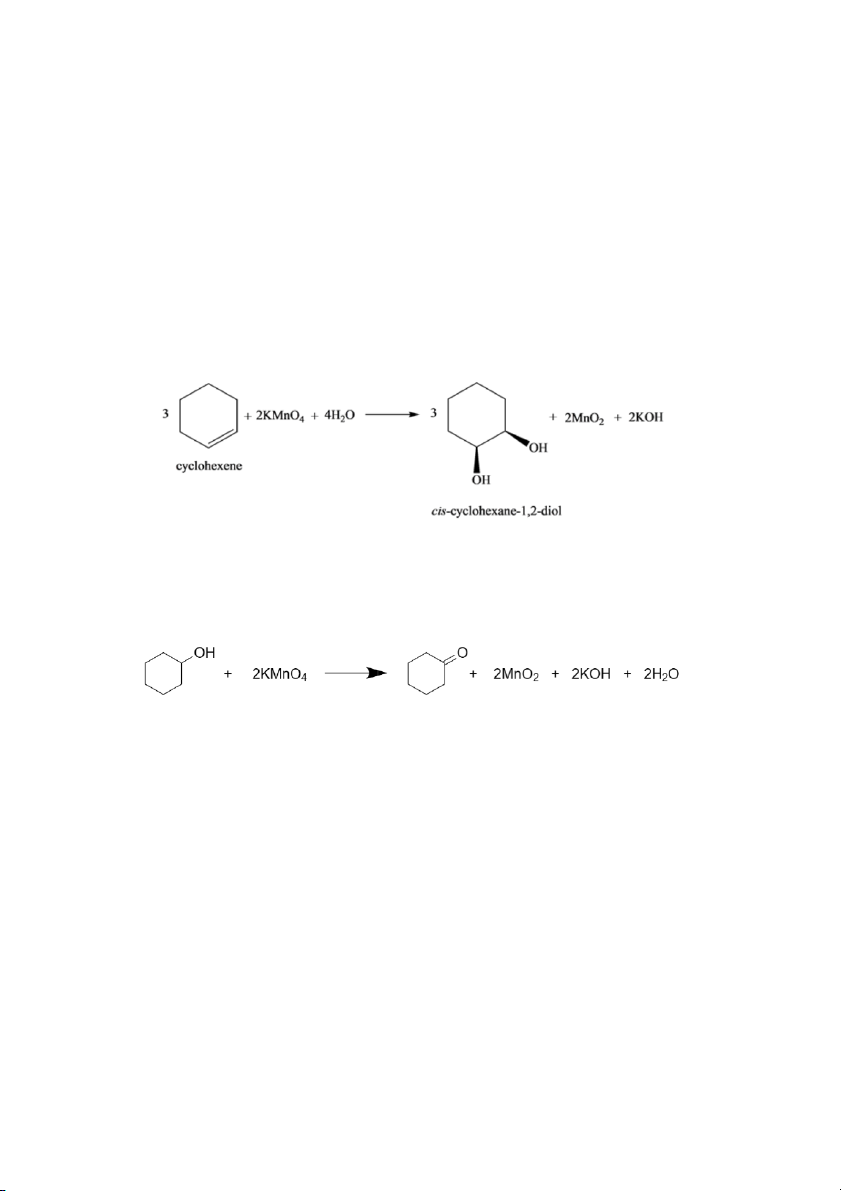
Giải thích: Cyclohexen bị KMnO4 oxy hóa thành cyclohexan-1,2-diol
- Ống 3: dd mất màu tím chậm, xuất hiện chất rắn màu đen (MnO2).
Giải thích: KMnO4 oxy hóa cyclohexanol thành cyclohexanone. Do thực hiện phản ứng
ở nhiệt độ thấp, phản ứng xảy ra chậm nên mất màu tím chậm hơn.
3. Nhận biết Alcol & Phenol
a. Bằng dd NaOH – Thí nghiệm 6 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm: + Ống 1: 10 giọt phenol
+ Ống 2: 10 giọt cyclohexanol
+ Ống 3: 10 giọt tert-butanol
Thêm vào mỗi ống nghiệm 10 giọt dd NaOH 10%, lắc đều, quan sát hiện tượng và giải thích.
Kết quả hiện tượng & giải thích:
- Ống 1: dd không màu, đồng nhất.
Giải thích: Phenol phản ứng với NaOH tạo muối natri phenolat tan trong nước nên dd Dược – K48 đồng nhất.
C6H5OH + NaOH → C6H5ONa + H2O
- Ống 2: dd tách lớp, cyclohexanol ở trên, NaOH ở dưới
Giải thích: Do sự tăng nóm hydrocarbon dẫn đến phân cực kém nên cyclohexanol nên
không tan trong NaOH là dung môi phân cực.
- Ống 3: dd bị đục, tách lớp.
Giải thích: Do sự tăng nóm hydrocarbon dẫn đến phân cực kém nên tert-butanol tan
kém, rất ít tan trong dung môi phân cực là NaOH.
b. Bằng dd FeCl3 – Thí nghiệm 7 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm: + Ống 1: 10 giọt phenol
+ Ống 2: 10 giọt cyclohexanol
+ Ống 3: 10 giọt tert-butanol
Thêm vào mỗi ống nghiệm 1 giọt dd FeCl3. Lắc đều, quan sát hiện tượng và giải thích.
Kết quả hiện tượng & giải thích:
- Ống 1: dd có màu xanh-tím.
Giải thích: Muối Fe3+ tạo phức với 6 phối tử phenolat tạo ra dung dịch có màu xanh tím. Fe3+ + 6C + 6H5OH → [Fe(C6H5O)6]3- + 3H
- Ống 2: dd tách lớp, FeCl3 ở lớp trên, cyclohexanol ở lớp dưới, màu vàng nâu của FeCl3 không đổi.
Giải thích: Do cyclohexanol là chất hữu cơ không tan trong dung môi phân cực là
FeCl3 nên có hiện tượng tách lớp và màu của FeCl3 được giữ nguyên.
- Ống 3: dd đồng nhất, có màu nâu đỏ nhẹ.
Giải thích: Tert-butanol tác dụng với FeCl3 tạo thành muối sắt (III) acetate có màu nâu đỏ tan trong nước.
3CH3COOH + FeCl3 → Fe(CH3COO)3 + 3HCl
4. Nhận biết Aldehyd & Ceton
a. Bằng phenilhydrazin – Thí nghiệm 8 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm: Dược – K48 + Ống 1: 10 giọt aceton
+ Ống 2: 10 giọt benzaldehyd
+ Ống 3: 10 giọt acetophenon
Thêm vào mỗi ống nghiệm khoảng 1ml etanol. Lắc đều cho tan hết, sau đó thêm vào
mỗi ống 1ml dd phenilhydrazin, đun nhẹ trong vài phút, để nguội, quan sát hiện tượng và giải thích.
Kết quả hiện tượng & giải thích:
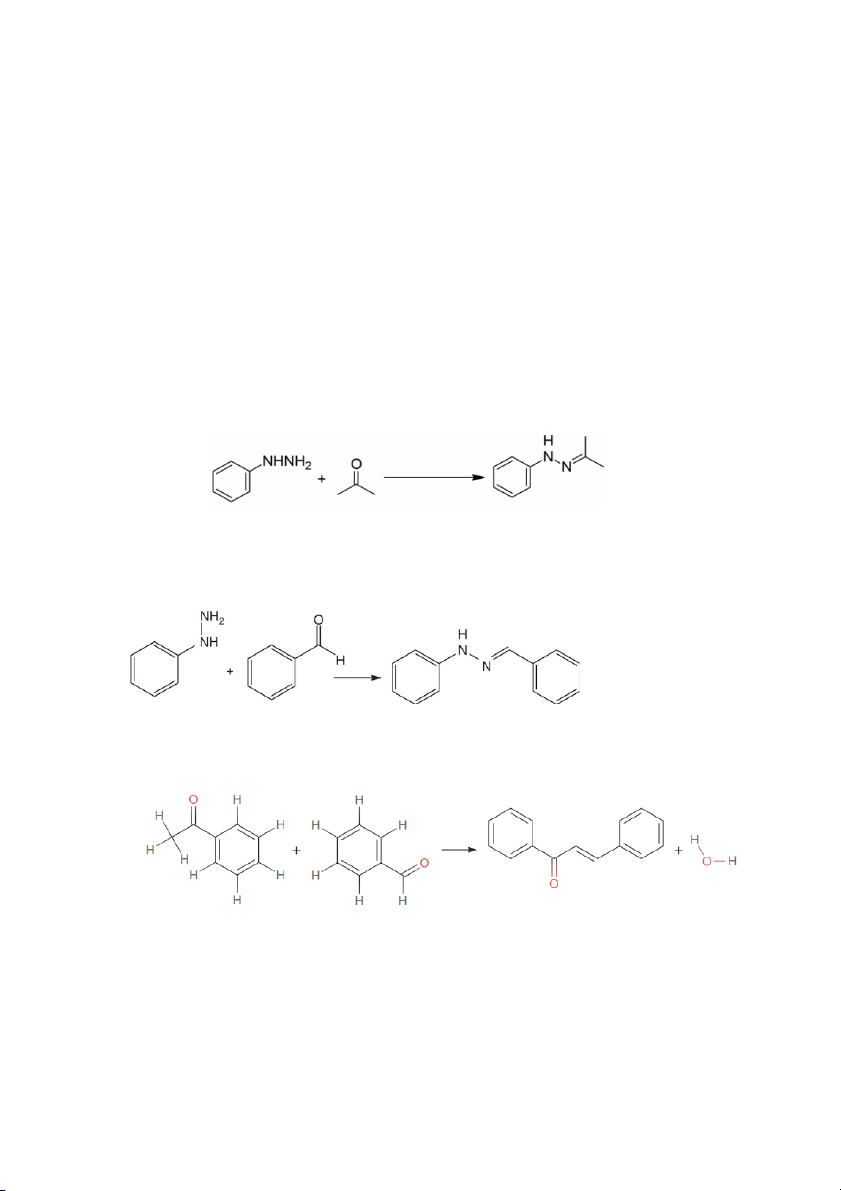
- Ống 1: dd chuyển sang màu nâu đen
Giải thích: Aceton phản ứng với dd phenilhydrazine tạo ra acetone phenylhydrazone,
đây là một trong những phương pháp dùng để nhận biết các ceton.
- Ống 2: xuất hiện kết tủa màu nâu đỏ
Giải thích: Benzaldehyd phản ứng với phenilhydrazine tạo ra phenylhydrazone
benzaldehyde không tan trong nước. + H2O
- Ống 3: dd chuyển sang màu nâu đen
Giải thích: Acetophenon phản ứng với phenilhydrazine tạo thành Chalcone và nước.
b. Bằng thuốc thử Tollens – Thí nghiệm 8 Các bước tiến hành:
Cho lần lượt vào 3 ống nghiệm sạch và khô: + Ống 1: 5 giọt dd glucose Dược – K48
+ Ống 2: 5 giọt dd benzaldehyd
+ Ống 3: 5 giọt dd acetophenon
Sau đó cho khoảng 15 giọt thuốc thử Tollens vào cả ba ống nghiệm, lắc nhẹ vài giây rồi
đun cách thủy ống nghiệm trong nước nóng khoảng 10 phút. Quan sát và giải thích hiện tượng.
Kết quả hiện tượng & giải thích:
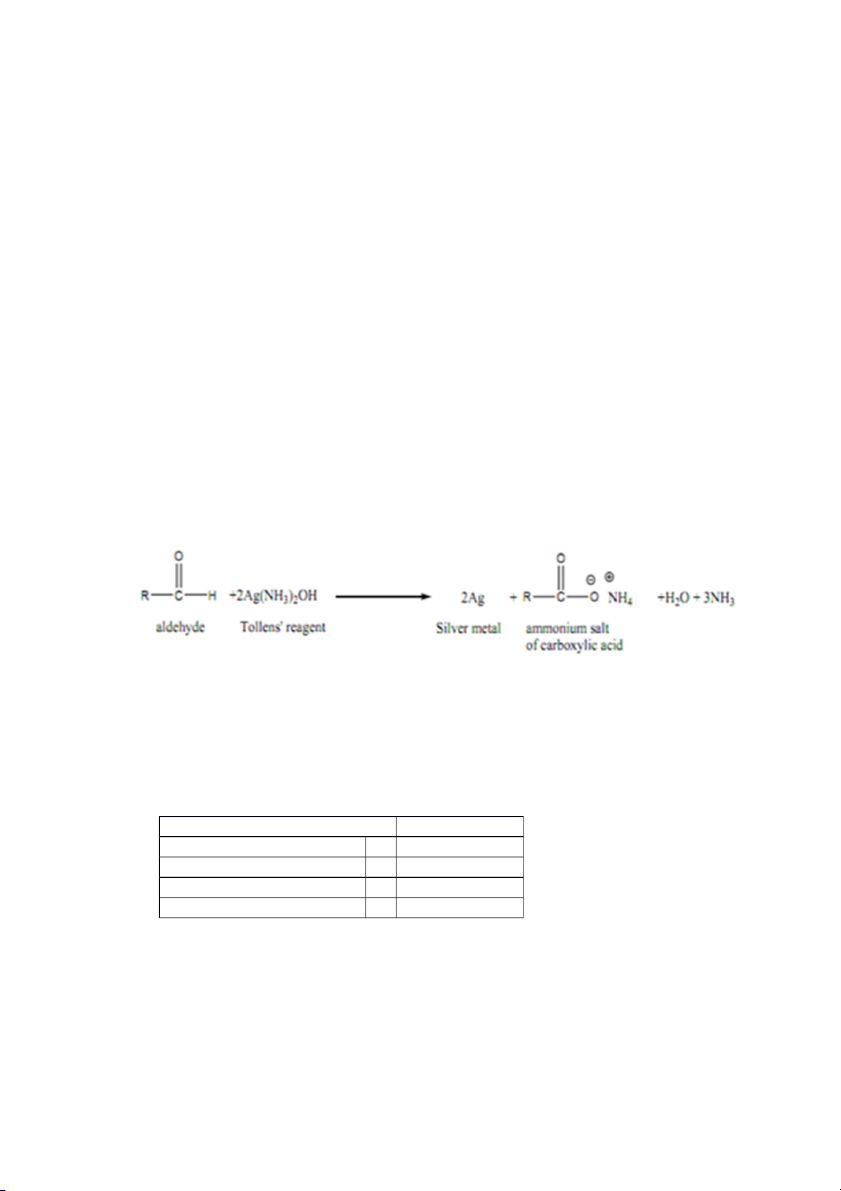
- Ống 1: xuất hiện lớp bạc phủ quanh thành ống nghiệm
Giải thích: Glucose tham gia phản ứng tráng gương, tạo ra bạc (Ag) phủ kín thành ống nghiệm.
C6H12O6 + 2Ag(NH3)2OH → C5H11O5COONH4 + 2Ag + 3NH3 + H2O
- Ống 2: xuất hiện kết tủa trắng đục
Giải thích: Trong công thức cấu tạo của benzaldehyd có nhóm chức –CHO, nhưng do
ảnh hưởng của vòng benzen, nên benzaldehyd rất khó tham gia phản ứng tráng gương, rất ít Ag được tạo ra
- Ống 3: dd tách lớp
Giải thích: Trong công thức cấu tạo acetophenol không có nhóm chức –CHO. Nên
acetophenol không tham gia phản ứng tráng gương, ta thấy dung dịch tách lớp. III. Điều chế Aspirin
Dụng cụ và hóa chất Dụng cụ Hóa chất
Bình cầu đáy phẳng 250ml 1 Anhidric acetic Ống nhỏ giọt 1 Acid salicylic Ống đong 10ml 1 Etanol Becher 250ml 1 H2SO4 đđ IV. Thực hành 1. Điều chế Aspirin
Cho vào bình cầu đáy phẳng 250ml: 5g acid salicylic, 7ml dd anhidric acetic, 3 giọt H2SO
Dược – K48 4
đđ. Đun cách thủy nhẹ trong 30 phút.
Để nguội rồi thêm vào bình cầu 100ml nước cất, khuấy thật kỹ xong đem đi lọc khô dưới
áp suất thấp bằng phễu sứ buchner, ta thu được aspirin thô.
2. Kết tinh lại aspirin
Hòa tan aspirin thô trong khoảng 15ml etanol nóng (thêm từ từ etanol cho đến khi aspirin
tan hoàn toàn), sau đó thêm từ từ nước nóng cho đến khi xuất hiện tinh thể aspirin. Để
nguội dung dịch từ từ, aspirin sẽ kết tinh thành tinh thể hình kim.
Lọc khô sản phẩm dưới áp suất thấp, cân tinh thể.
Thu được: 3,44g tinh thể aspirin Hiệu suất phản ứng:
Ta có: nacid salicylic = m/M ≈ 0,036 mol
nanhrydride acetic = m/M ≈ 0,074 mol
Mà naspirin = nacid salicylic = 0,036 mol
mlt aspirin = n aspirin * Maspirin = 0,036*180 = 6,48 (g)
Ta lại có mtt của aspirin là: mtt = 3,44 (g)
H = (mtt / mlt)*100 = (3,44/6,48)*100 = 53,08%
V. Trả lời câu hỏi
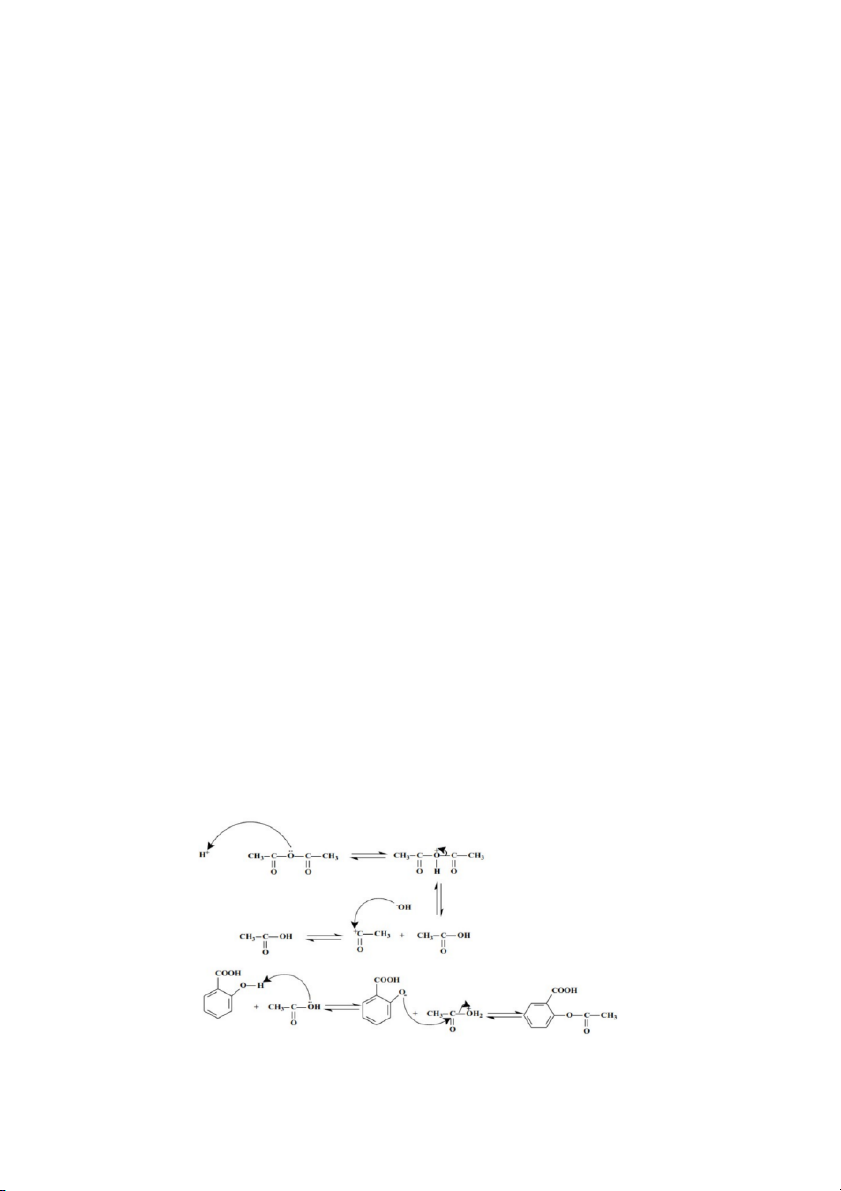
Câu 1: Viết cơ chế phản ứng điều chế aspirin
- Cơ chế phản ứng điều chế Aspirin là phản ứng este hóa giữa acid salicylic và anhydride
acetic trong môi trường acid (H2SO4 đđ).
- Cơ chế phản ứng este hóa giữa Anhydride acetic là SN(CO): Nhóm carbonyl của
anhydride được proton hóa – hình thành cation trung gian. Tiếp theo là gian đoạn tấn
công của nguyên tử oxygen trên phân tử acid salicylic vào cation. Theo sau gian đoạn
proton hóa là tạo thành CH3COOH, sau cùng là giai đoạn tách proton, tái sinh xúc tác, hình thành aspirin. Câu 2: Cho
- 100ml nước có tác dụng phản ứng hết anhydride acetic dư để tạo ra acid acetic
Dược – K48 và
đồng thời giúp cho aspirin kết tinh nhanh hơn, vì ở nhiệt độ phòng, aspirin chỉ hòa tan 0,33% trong nước.
Câu 3: Ta có thể dùng phương pháp nào để nhận biết aspirin tinh khiết?
- Rửa sản phẩm bằng nước cất đến khi dịch lọc không cho màu tím với dd FeCl3.
- Việc rửa sản phẩm dịch lọc cho đến khi không cho phản ứng với dd FeCl3 nhằm mục
đích: Hợp chất loại phenol có thể tạo phức màu xanh-tím với Fe3+. Acid salicylic cũng
thuộc loại hợp chất đó (có nhóm OH gắn với nhân thơm) nên nó cũng tạo phức màu xanh-
tím với Fe3+. Vì vậy việc rửa sản phẩm thực chất là để nhận biết sản phẩm đã tinh khiết hay còn acid salicylic.
Câu 4: Có thể thay thế anhydride acetic trong phản ứng trên được không?
- Có thể thay thế anhydride acetic trong phản ứng trên bằng acetyl chloride. Tuy
nhiên theo như nghiên cứu, anhydride acetic là chất acetyl hóa tốt hơn, với sản phẩm phụ
sinh ra là acid acetic không có các đặc tính có hại như acid hydrochloric và còn có thể được tái sử dụng.




