
Preview text:
Electron là gì? Cấu hình electron là gì? Các viết cấu hình Electron nguyên tử chính xác nhất
Khi tìm hiểu các kiến thức hóa học, ta ít nhiều cũng đã được biết đến electron. Vậy electron là gì? Cấu
hình electron là gì và được viết như thế nào? Trong bài viết dưới đây, Luật Minh Khuê sẽ đưa ra cho
bạn những thông tin cơ bản nhất về electron và cấu hình electron.
Mục lục bài viết 1. Electron là gì?
Nguyên tử có cấu tạo gồm một hạt nhân mang điện dương nằm ở trung tâm và các electron mang
điện âm chuyển động xung quanh. Hay nói cách khác, electron là một hạt mang điện tích âm có trong
nguyên tử và bao quanh hạt nhân. Điện tích trên mỗi electron là -1,6.10-19 Coulomb (ký hiệu là C),
khối lượng là 9,1.10-31 kg. Electron được ký hiệu là e.
Electron có những đặc điểm sau đây:
• Nếu một nguyên tử có cùng số proton (số p) và số electron (số e) thì nguyên tử đó trung
hòa về điện vì điện tích âm của electron đã được trung hòa bởi điện tích dương của proton
• Các electron luôn quay xung quanh hạt nhân trong các lớp vỏ theo một quỹ đạo
• Một lực hút do hạt nhân mang điện tích dương (+) tác động lên các electron mang điện tích
âm (-). Lực hút này hoạt động như lực hướng tâm cần cho sự quay quanh hạt nhân của các electron.
• Các điện tử ở gần hạt nhân sẽ có liên kết chặt chẽ với hạt nhân và khó kéo (loại bỏ) các điện tử
này ra khỏi nguyên tử hơn những điện tử ở xa hạt nhân. 2. Thuyết electron
Thuyết dựa vào sự cư trú và di chuyển của các electron để giải thích các hiện tượng điện và các tính
chất điện của các vật gọi là thuyết electron. Nội dung thuyết electron như sau:
• Electron có thể rời khỏi nguyên tử để di chuyển từ nơi này đến nơi khác. Nguyên tử bị mất
electron sẽ trở thành một hạt mang điện dương gọi là ion dương
• Một nguyên tử trung hòa có thể nhận thêm electron để trở thành một hạt mang điện âm và
được gọi là ion âm
• Một vật nhiễm điện âm khi số electron mà nó chứa lớn hơn số proton. Nếu số electron ít hơn
số proton thì vật nhiễm điện dương.
3. Bản chất của electron
Mức năng lượng của electron
• Cần một lượng năng lượng xác định để electron có thể bứt ra khỏi quỹ đạo của nó. Năng
lượng cần thiết để bứt electron khỏi quỹ đạo thứ nhất sẽ nhiều hơn nhiều so với năng lượng
cần thiết để bứt electron ra khỏi quỹ đạo ngoài. Nguyên nhân là do lực hút do hạt nhân tác
động lên các điện tử ở quỹ đạo thứ nhất nhiều hơn so với lực hút do hạt nhân tác động đến
các điện tử ở quỹ đạo ngoài. Tương tự, năng lượng cần thiết để bứt electron khỏi quỹ đạo
thứ hai lớn hơn quỹ đạo thứ ba. Do đó, chúng ta có thể nói rằng
• Các mức năng lượng của electron được ký hiệu bằng những chữ cái K, L, M, N... Thứ tự mức
năng lượng được sắp xếp như sau: K < L < M < N ... Trong đó K là quỹ đạo gần hạt nhân nhất
cũng như có mức năng lượng thấp nhất, quỹ đạo N ngoài cùng là quỹ đạo có mức năng lượng cao nhất.
Thứ tự của các mức năng lượng trong một nguyên tử
Trong nguyên tử, các electron trên các obitan khác nhua có cùng mức năng lượng như nhau nếu cùng
một phân lớp. Các mức năng lượng nguyên tử được sắp xếp theo thứ tự tăng dần.
Ở trạng thái cơ bản, các electron (e) nguyên tử lần lượt chiếm mức năng lượng từ thấp đến cao. Đồng
thời, theo chiều từ trong ra ngoài thì mức năng lượng của các lớp tăng theo thứ tự từ 1 đến 7 và năng
lượng của phân lớp tăng theo thứ tự là s, p, d, f.
Thứ tự sắp xếp các phân lớp theo chiều tăng của năng lượng được xác định như sau: 1s 2s 3s 3p 4s 3d
4p 5s... Khi điện tích hạt nhân tăng xảy ra hiện tượng chèn mức năng lượng nên mức năng lượng 4s thấp hơn 3d.
4. Cấu hình electron
Cấu hình electron hay còn được gọi là cấu hình điện tử, là sự phân bố các lớp electron trong phần vỏ
của hạt nguyên tử ở các mức trạng thái năng lượng khác nhau của chúng. Nhờ vào cấu hình của vỏ
nguyên tử mà chúng ta có thể xác định được các tính chất cơ bản của một nguyên tố bất kỳ.
Sự phân bố electron theo các mức năng lượng
Mỗi nguyên tử đều có các mức năng lượng khác nhau. Chính vì thế mà electron được chia ra và phân
bố ở các mức năng lượng riêng. Như đã nói ở phần "Thứ tự của các mức năng lượng trong một
nguyên tử", sự phân bố electron theo các mức năng lượng cụ thể như sau:
• Cấu hình electron nguyên tử ở trạng thái cơ bản được sắp xếp theo mức năng lượng tăng dần
• Mức năng lượng được tăng theo cấp bậc từ 1 đến 7 và xếp theo thứ tự các lớp s, p, d, f.
• Với mức điện tích hạt nhân lớn hơn thì mức năng luwongj 4s sẽ thấp hơn 3d
• Số electron tối đa có thể xếp ở mỗi phân lớp là s2, p6, d10, f14
• Số electron tối đa được xếp ở mỗi lớp thứ n là 2n2 với n = 1, 2, 3, 4
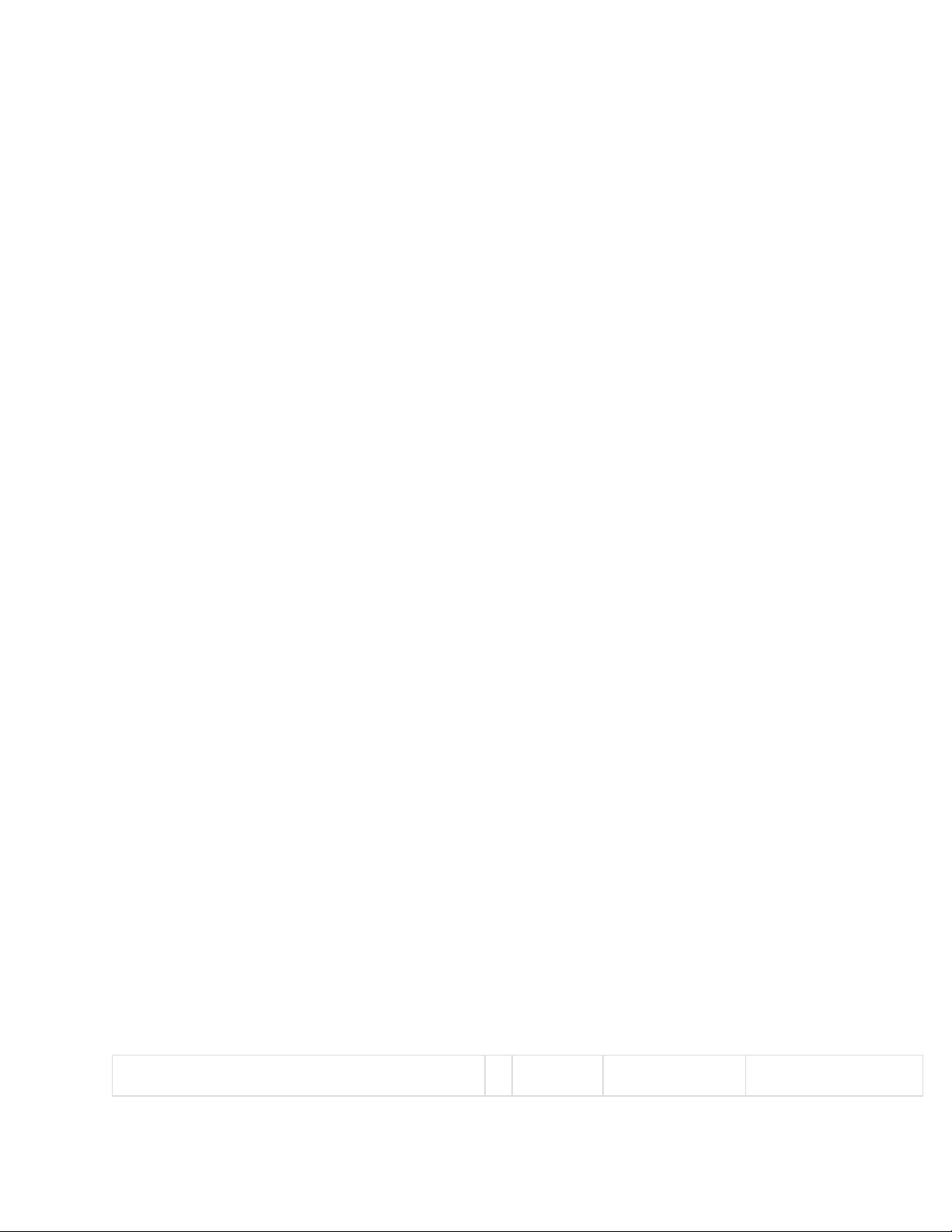
Số thứ tự lớp (n) 1 2 3 4 Tên của lớp K L M N
Số electron tối đa 2 8 18 32 Số phân lớp 1 2 3 4 Kí hiệu phân lớp 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
Số electron tối đa ở phân lớp và ở lớp 2 (2,6) -> 8 (2, 6, 10) -> 18
(2, 6, 10, 14) -> 32
Bảng mức năng lượng cấu hình electron
Ngoài các lớp K, L, M, N thì còn có các lớp O, P, Q,... cho tới khi các electron được sắp xếp đủ vào các lớp.
Các đặc điểm của electron lớp ngoài cùng ở vỏ nguyên tử
Dựa vào số hạt electron ở lớp ngoài cùng mà ta có thể biết được cấu hình vỏ nguyên tử, từ đó biết
được tính chất của nguyên tố cấu tạo và loại nguyên tố đó.
• Đối với nguyên tử của tất cả các nguyên tố trong bảng tuần hoàn, số e tối đa có thể ở lớp
ngoài cùng là 8 electron
• Nguyên tử Heli và các nguyên tử gồm 1, 2 hay 3 electron lớp ngoài cùng thường không tham
gia các phản ứng hóa học vì các liên kết này rất bền vững
• Các nguyên tử mà lớp ngoài cùng có 1, 2 hay 3 electron dễ nhường electron và thường là các
nguyên tử kim loại trừ các khí H, He và B
• Các nguyên tử có lớp ngoài cùng gồm 5, 6 hay 7 electron dễ nhận thêm electron để đạt trạng
thái ền vững là 8 electron và chúng thường là các phi kim
• Các nguyên tử lớp ngoài cùng có 4 electron có thể là phi kim lẫn kim loại.
5. Cách viết cấu hình electron
Nguyên lý và quy tắc viết cấu hình electron:
• Nguyên lý Pau-li: Trên một obital nguyên tử chỉ có thể chứa tối đa là 2 electron và 2 electron
này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
• Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron lần lượt chiếm các
obital có mức năng lượng từ thấp đến cao
• Quy tắc Hund: Trong cùng 1 phân lớp, các electron sẽ phân bố trên các obital sao cho số
electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
Các bước viết cấu hình electron:
Bước 1: Xác định số e của nguyên tử (Z)
Bước 2: Sắp xếp các e theo thứ tự tăng dần mức năng lượng và tuân theo quy tắc:
• Phân lớp s chứa tối đa 2 e
• Phân lớp p chứa tối đa 6 e
• Phân lớp d chứa tối đa 10 e
• Phân lớp f chứa tối đa 14 e
Bước 3: Sắp xếp cấu hình e theo thứ tự từng lớp (1 -> 7), trong mỗi lớp theo thứ tự từng phân lớp (s - > p -> d -> f)
Ví dụ: Fe (Z = 26)
• Trong nguyên tử Fe có 26 electron
• Các electron được phân bố như sau: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
• Sắp xếp lại các phân lớp, ta được cấu hình electron của Fe là: 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Hoặc ta có thể viết gọn là: [Ar]3d6 4s2 (Trong đó: [Ar] là cấu hình electron nguyên tử của nguyên tố
Argon - khí hiếm gần nhất đứng trước Fe)




