






















Preview text:
TRƯỜNG ĐẠI HỌC DƯỢC HÀ NỘI BỘ MÔN HÓA SINH ENZYM
Giảng viên: TS. Nguyễn Xuân Bắc Email: bacnx@hup.edu.vn
❖TL học tập : Bộ môn Hoá sinh (2015), Hoá sinh học, NXB Y học ❖TL tham khảo
: Lehninger, Principles of biochemistry, 7th edition Mục tiêu
1. Trình bày được thành phần cấu tạo, danh pháp, phân loại enzym và coenzym
2. Trình bày được cấu trúc phân tử và tính đặc hiệu của enzym
3. Giải thích được các đặc tính của trung tâm hoạt động và cơ chế hoạt động của enzym
4. Phân tích được động học của enzym một cơ chất, có chất ức chế cạnh tranh và không cạnh tranh
5. Giải thích được các yếu tố ảnh hưởng đến hoạt động và nguyên lý điều hòa hoạt động enzym
6. Giải thích được một số ứng dụng của enzym trong y dược Nội dung I. Đại cương về enzym II. Động học enzym
III. Các yếu tố ảnh hưởng đến hoạt động của enzym
IV. Điều hòa hoạt động enzym
V. Ứng dụng của enzym trong Y Dược I. Đại cương về enzym 1. Khái niệm về enzym
2. Cách gọi tên enzym (Danh pháp) 3. Phân loại enzym 4. Đặc điểm của enzym
5. Thành phần cấu tạo của enzym
6. Cấu trúc phân tử enzym
7. Cơ chế hoạt động xúc tác của enzym 1. Khái niệm về enzym
ENZYM = CHẤT XÚC TÁC SINH HỌC
• Không bị tiêu hao hoặc được sinh ra thêm trong quá trình phản ứng
• Tăng tốc độ nhưng không làm thay đổi hằng số cân bằng của phản ứng
• Bản chất: Phần lớn enzym là protein – mã hóa bởi ¼ số gen của cơ thể; một số enzym là ARN
2. Cách gọi tên enzym (danh pháp)
1. Tên thường gọi: pepsin, trypsin, chymotrypsin
2. Tên cơ chất + ase: Urease, proteinase (protease)
3. Tên tác dụng + ase: oxidase, transferase, decarboxylase
4. Tên cơ chất + tên tác dụng + ase: lactat dehydrogenase, tyrosin decarboxylase
3. Phân loại enzym (theo hội hóa sinh quốc tế) Enzym Loại phản ứng Ví dụ 1. Oxidoreductase Oxy hóa khử
-dehydrogenase, -reductase, -oxidase 2. Transferase Vận chuyển nhóm
-transferase, -kinase, -polymerase, synthase 3. Hydrolase Thủy phân
-lipase, -phosphatase, -glycosidase,
peptidase, nucleosidase (nuclease) 4. Lyase Phân cắt
-decarboxylase, -dehydratase, -aldolase 5. Isomerase Đồng phân hóa
-isomerase, epimerase, racemase, synthetase, synthase 6. Ligase Tổng hợp
-ligase, -synthetase, -synthase
ATP: glucose phosphotransferase ATP + D-glucose ADP + 6-phosphat glucose Hexokinase 2: Loại (vận chuyển) Ký hiệu: EC 2.7.1.1
7: Dưới lớp (vận chuyển gốc phosphat)
1. Nhóm (vận chuyển gốc phosphat vào nhóm –OH) https://enzyme.expasy.org
1. Enzym riêng biệt (D-glucose là chất nhận gốc phosphat) 4. Đặc điểm của enzym
• Bản chất protein => có những đặc điểm chung của protein (cấu trúc, tính chất lý hóa)
• Đặc điểm riêng của enzym: (1) Khả năng xúc tác cao; (2) Đặc
hiệu: Cả loại phản ứng và cơ chất enzym
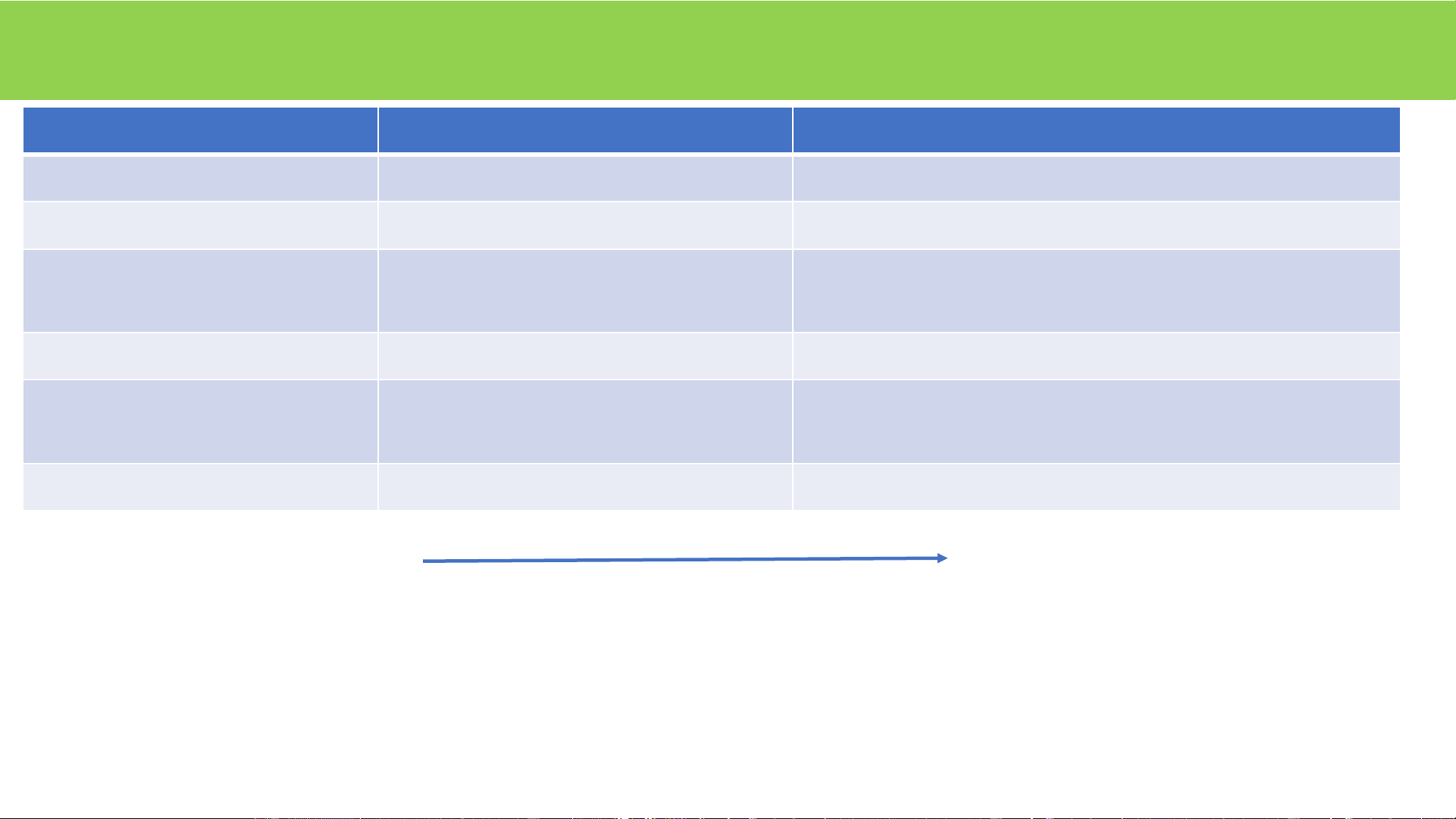
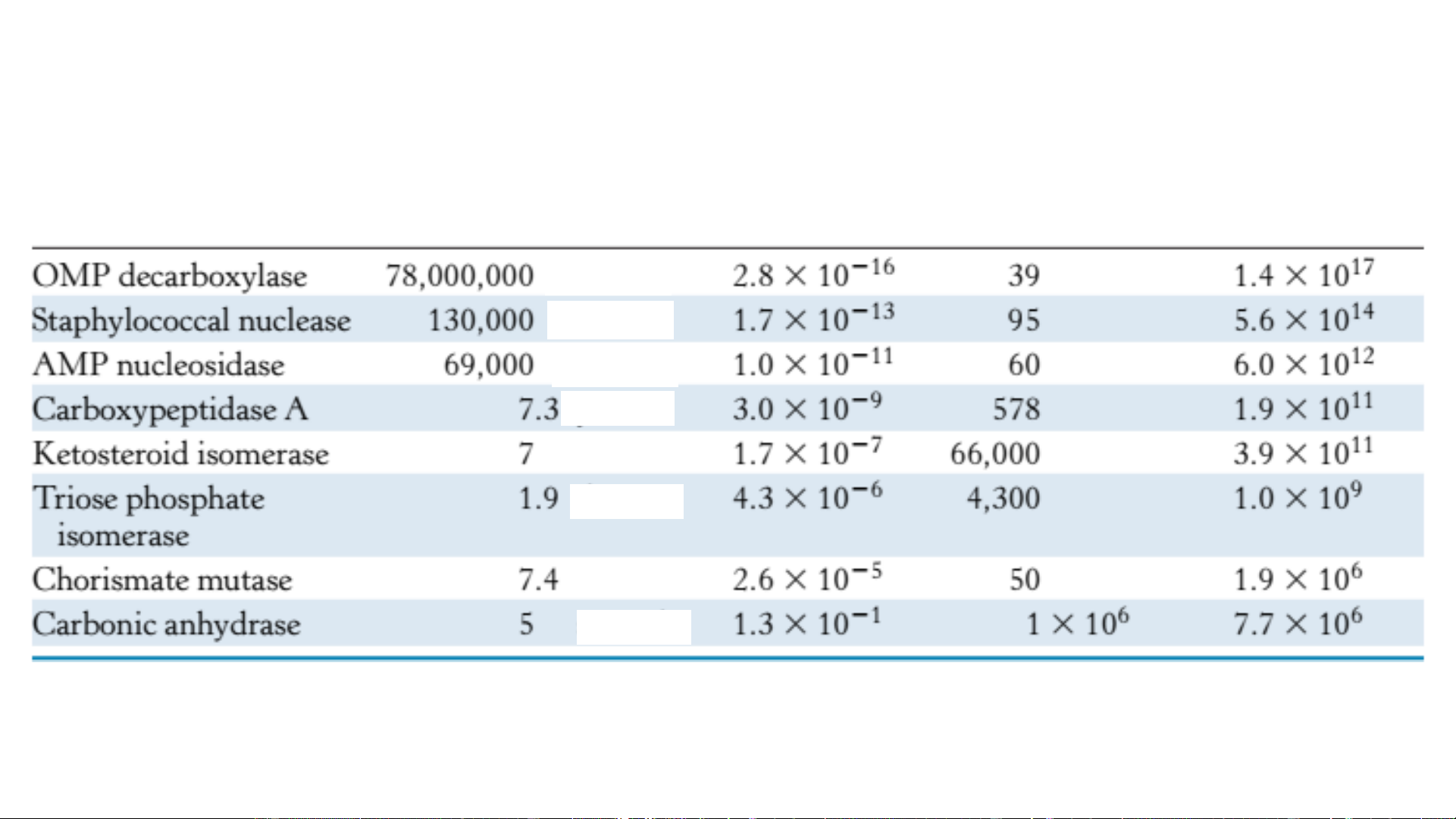
Khả năng xúc tác của enzym Thời gian bán hủy Tốc độ p/ư (k ) Tốc độ p/ư (k ) Hệ số tăng cat cat Enzym khi không có enzym
không enzym (số pt/s) có enzym (số pt/s) tốc độ phản ứng năm năm năm năm tuần ngày giờ giây Ghi chú:
OMP decarboxylase: Orotidine 5'-phosphate decarboxylase (Enzym trong tổng hợp pyrimydin) AMP: Adenosin monophosphat
k : số chuyển hóa (catalytic number) của enzym cat protease
Tính đặc hiệu của enzym
Khái niệm: Mỗi enzym chỉ có khả năng xúc tác cho sự chuyển
hóa một hay một số chất nhất định, theo một kiểu phản ứng nhất định.
• Đặc hiệu kiểu phản ứng: chỉ xúc tác cho 1 phản ứng hoặc các
phản ứng gần giống nhau: phản ứng thủy phân.
• Đặc hiệu cơ chất: Biến đổi 1 cơ chất hoặc nhóm cơ chất gần
giống nhau: đặc hiệu tuyệt đối, đặc hiệu nhóm tuyệt đối, đặc
hiệu nhóm tương đối, đặc hiệu quang học. (Tự học ví dụ) Ví dụ: protease
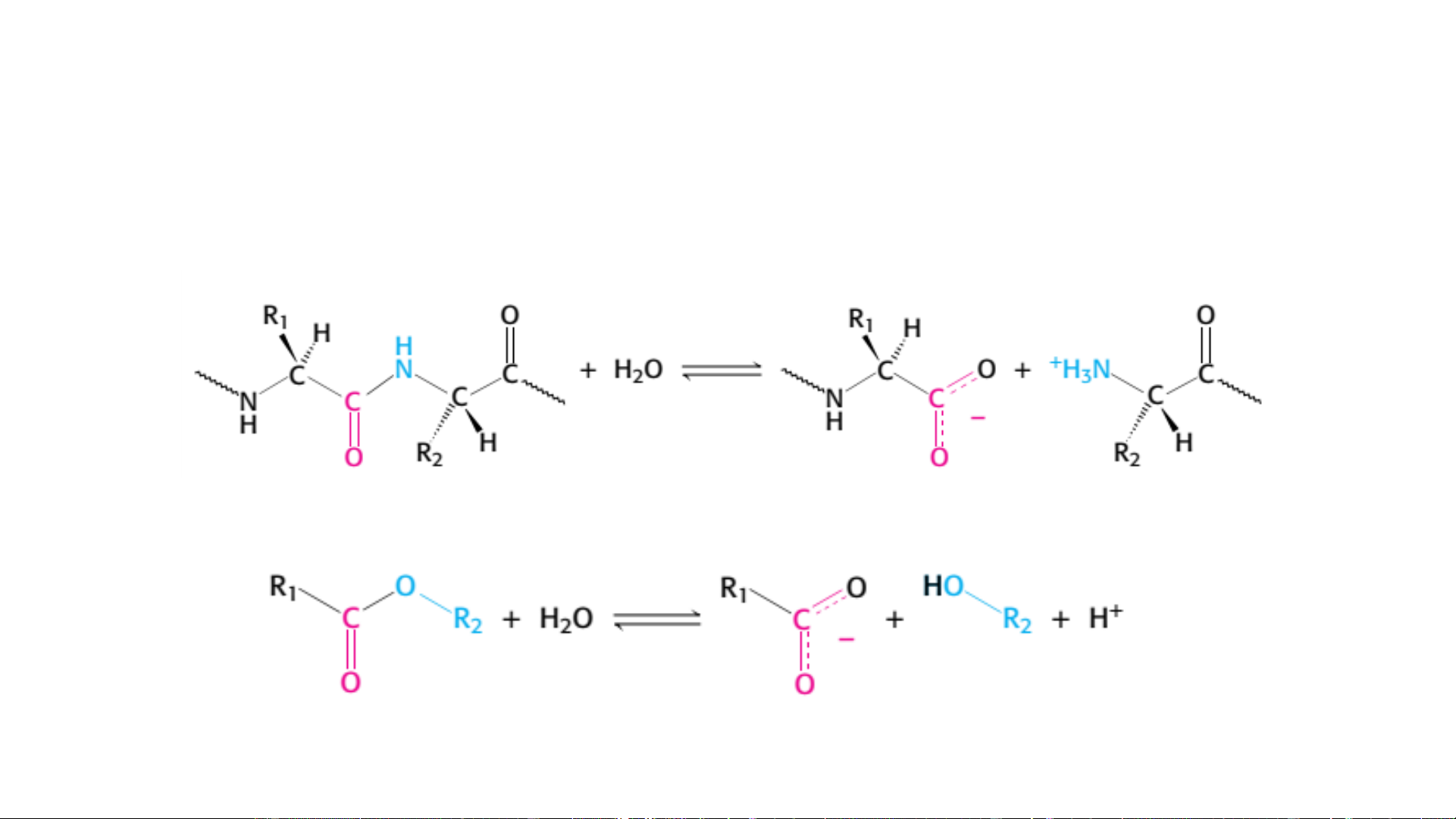
Tính đặc hiệu của enzym
• Đặc hiệu kiểu phản ứng: Liên kết peptid Liên kết este
Tính đặc hiệu của enzym Trypsin
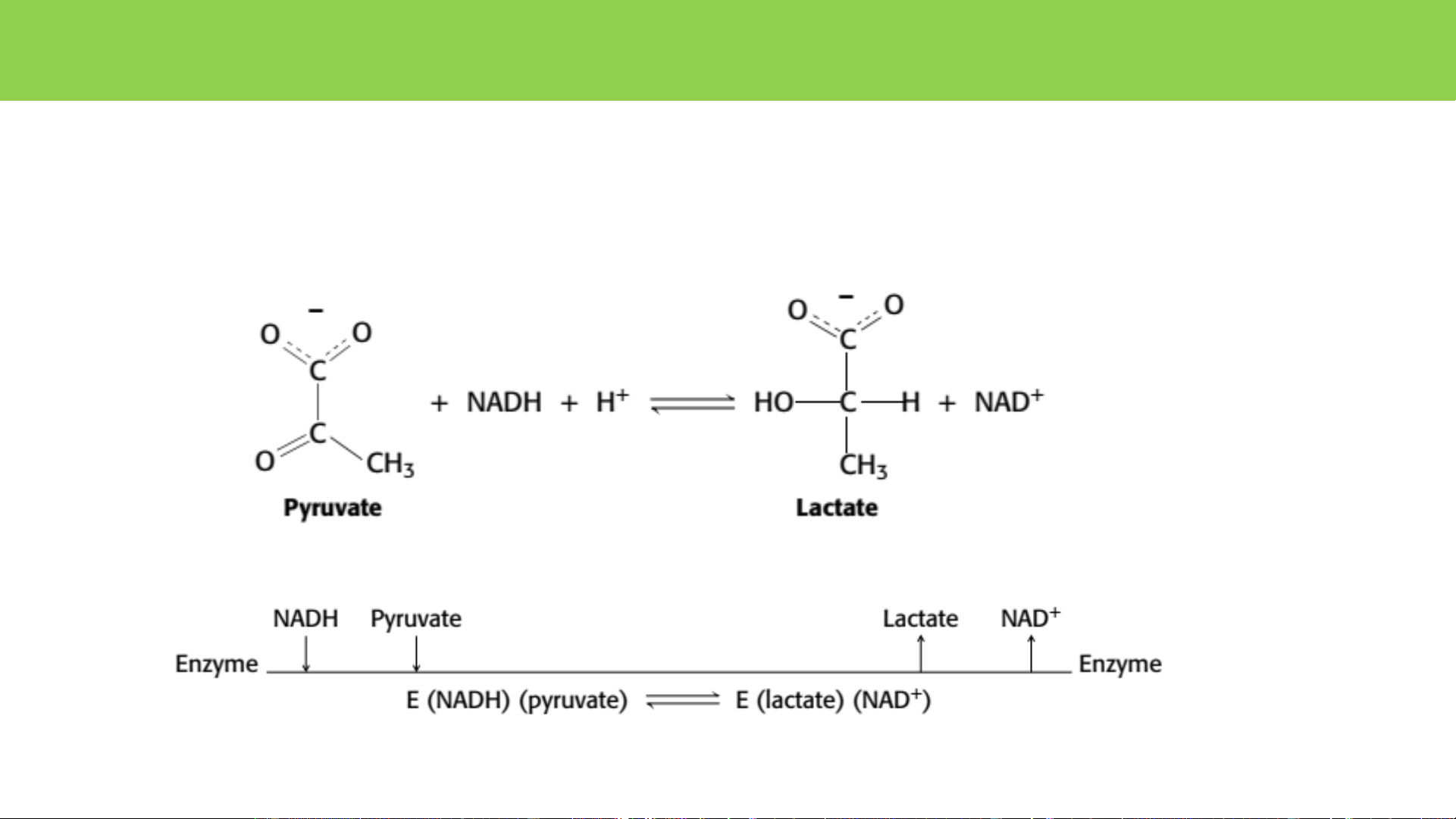
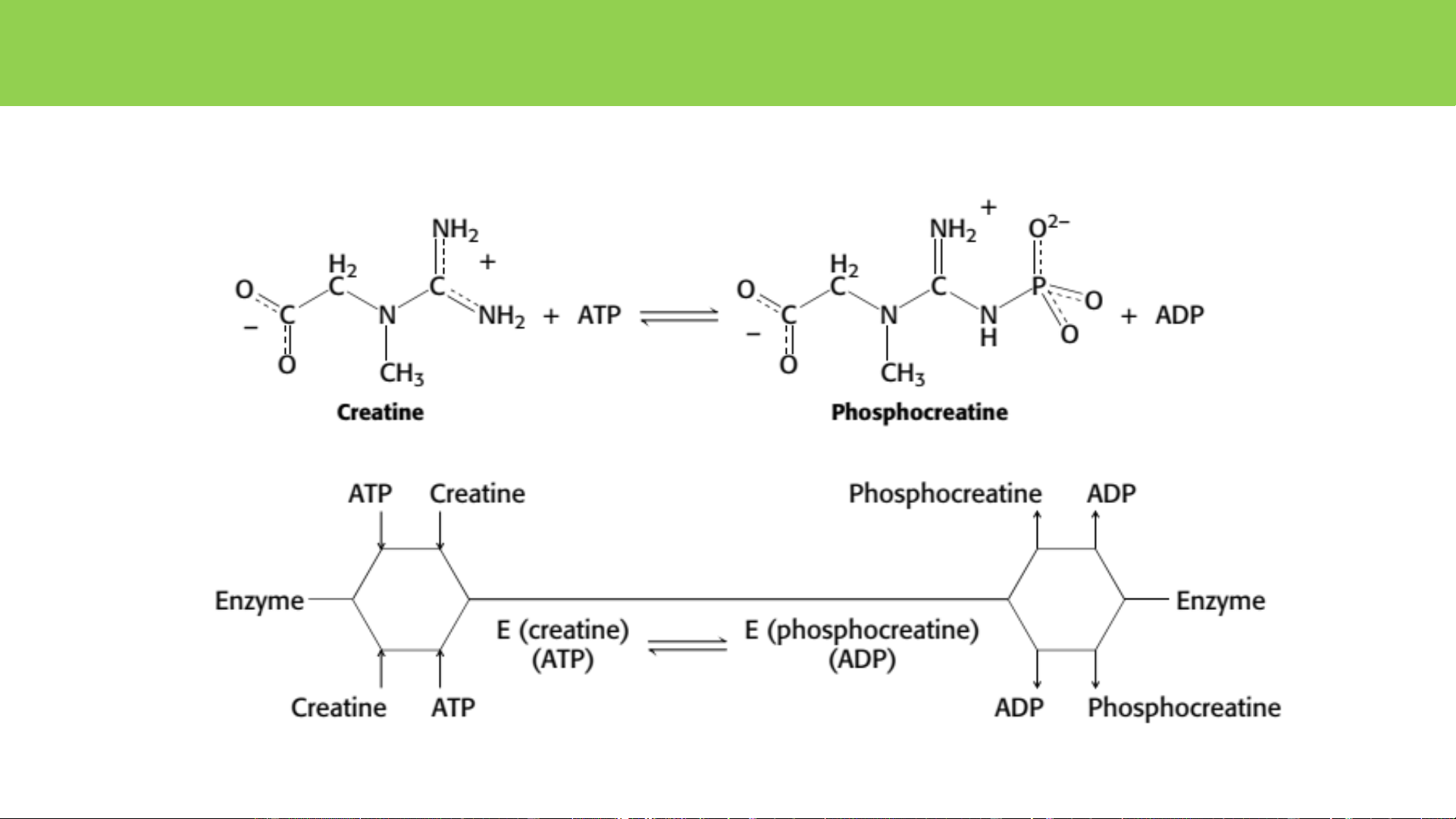
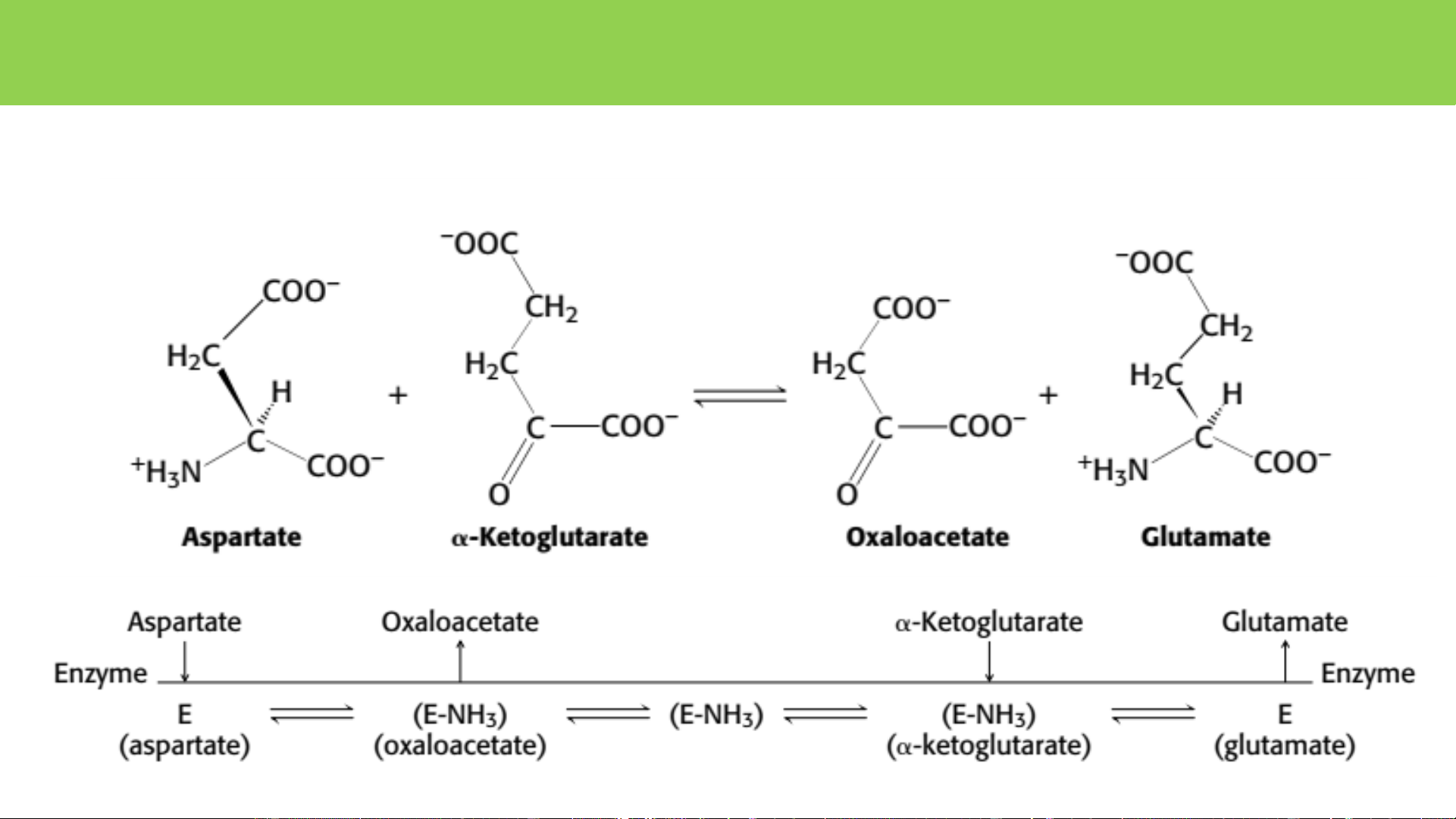
• Đặc hiệu cơ chất: papain, trypsin, thrombin Thrombin
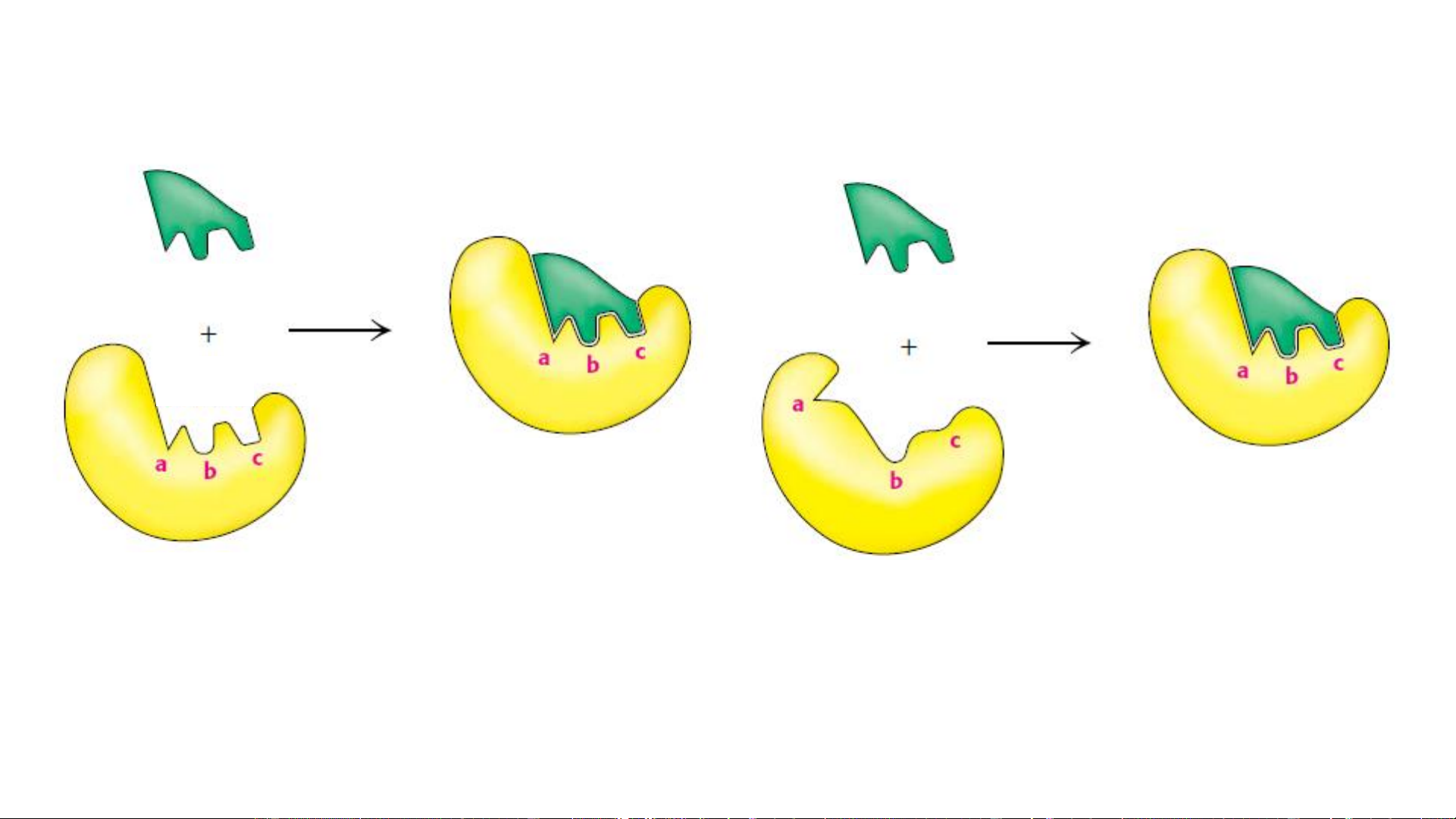
Tính đặc hiệu của enzym Cơ chất Cơ chất TTHĐ Phức hợp ES Phức hợp ES Enzym Enzym
Mô hình “Khóa và chìa khóa”
Mô hình “Nhận diện cảm ứng” (Fisher-1890)
Đặc điểm chung của TTHĐ
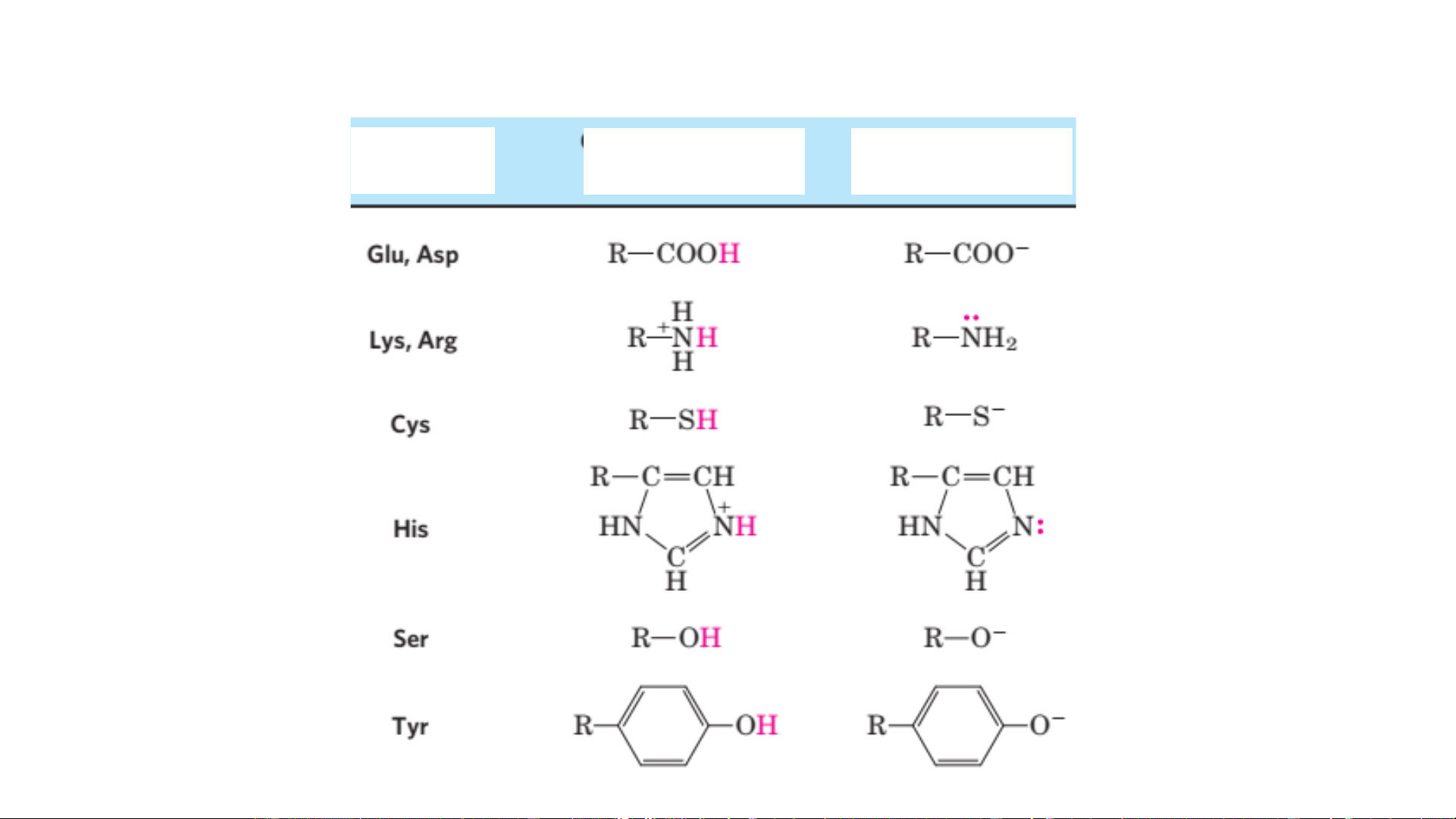
1. Thường có các acid amin có nhóm chức đặc biệt: serin (-OH), cysteine (-SH)
glutamic (-COO-), lysin (-NH +), histitin (imidazole) 3
tryptophan, phenylalanine, valin (các nhóm kỵ nước).
2. Cơ chất thường gắn với enzym bằng các liên kết yếu (hydro, ion, kị nước)
3. Chỉ chiếm một phần nhỏ phân tử enzym, tối thiểu khoảng 100 acid amin
(các acid amin khác hỗ trợ cấu trúc phù hợp của TT hđ). Một enzym có thể có một hay nhiều TTHĐ.
4. Có môi trường riêng biệt: Không có H O (trừ khi nước là chất tham gia phản 2
ứng). Môi trường không phân cực giúp tăng gắn cơ chất và tăng khả năng xúc tác.
5. Thành phần cấu tạo của enzym Carbonic Trypsin anhydrase
Enzym thuần = protein (đơn giản)
Enzym phức tạp = protein (apoenzym)
+ chất cộng tác (cofactor)
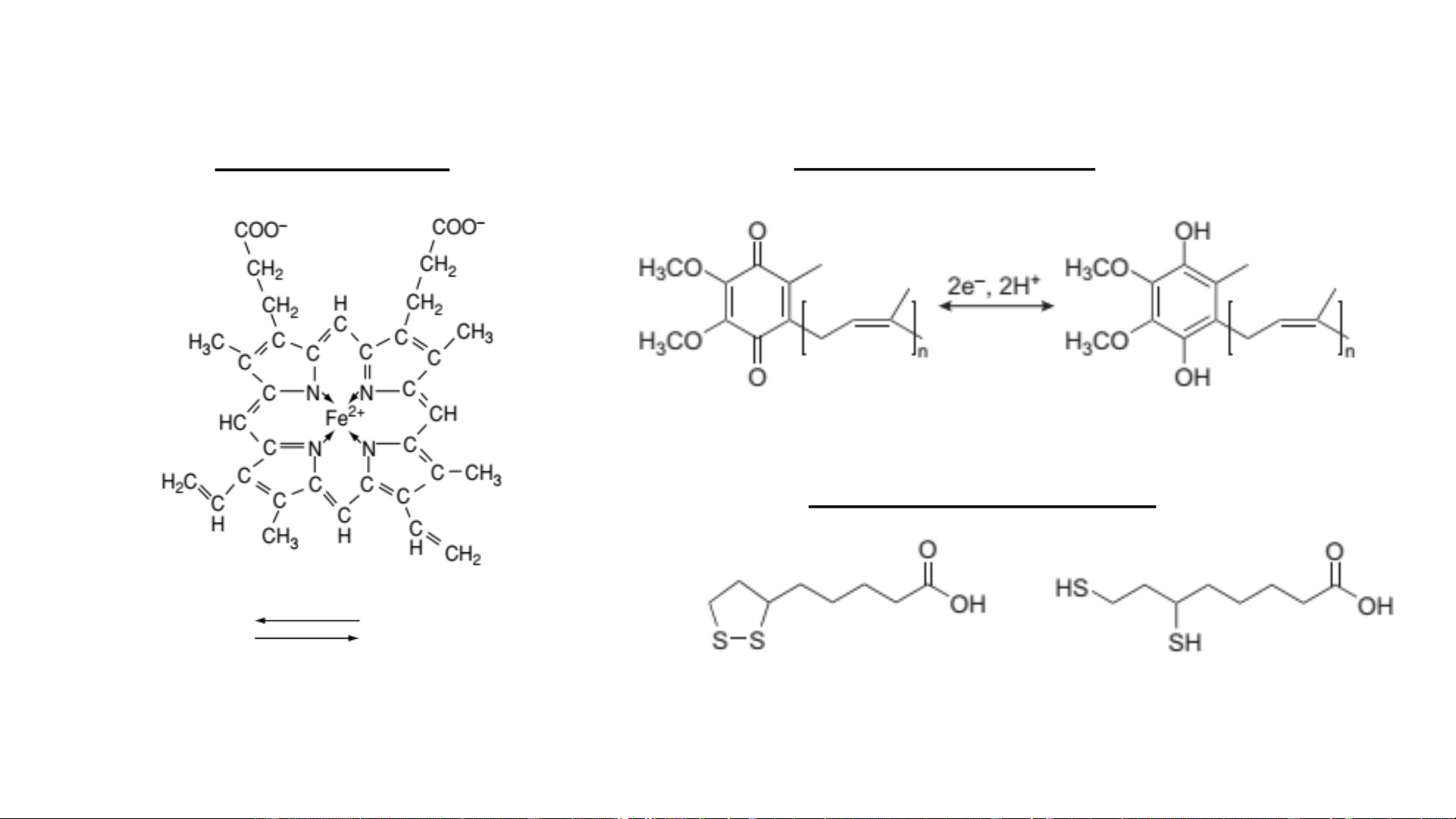
Cofactor: coenzym (hợp chất hữu cơ phân tử lượng nhỏ), kim loại
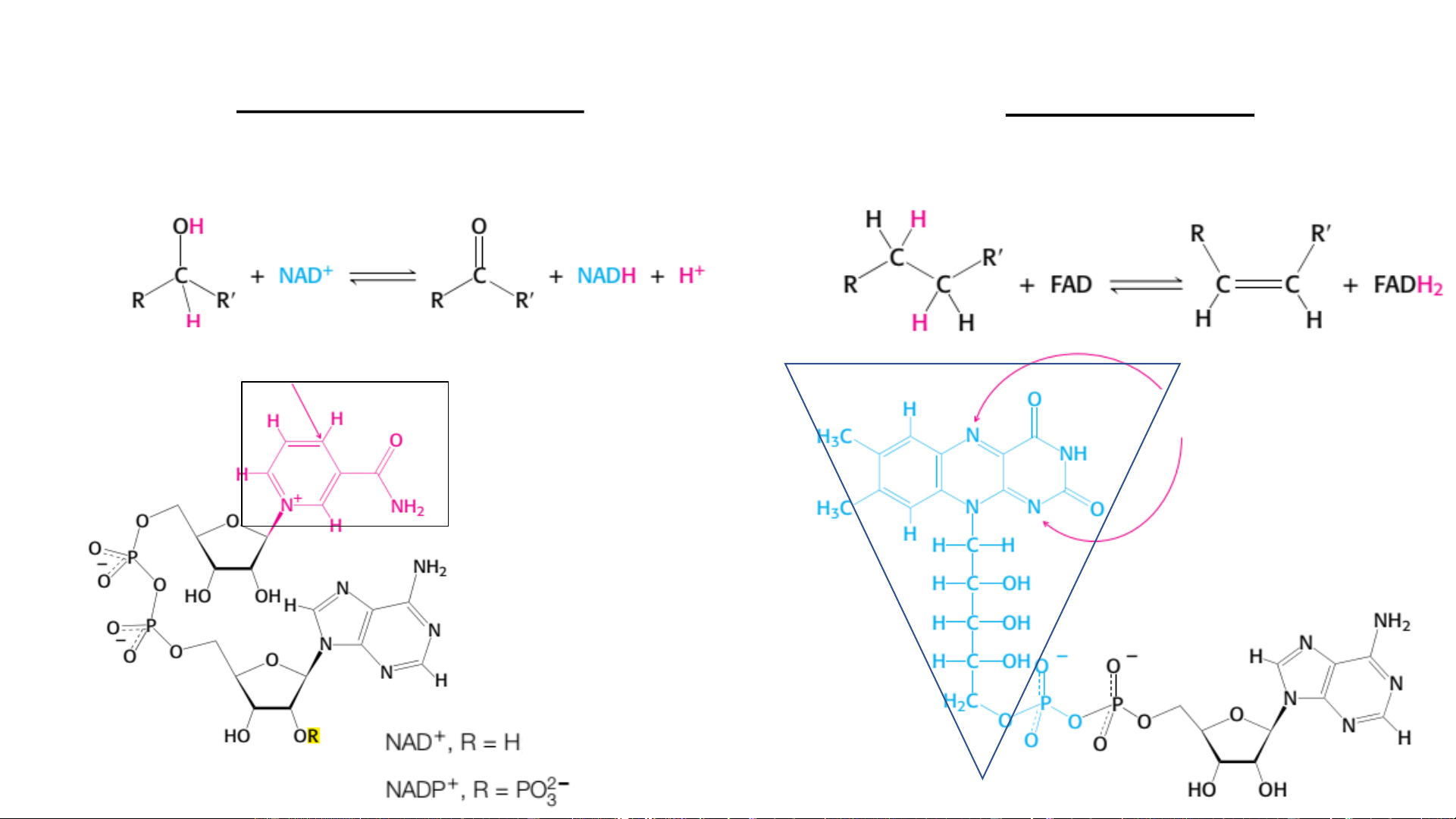
Coenzym oxy hóa khử (vận chuyển điện tử) (1) Coenzym nicotinamid Coenzym flavin slide:
NAD+-Nicotinamid adenin dinucleotid FAD-Flavin adenin dinucleotid
NADP+-Nicotinamid adenin dinucleotid phosphat FMN-Flavin mononucleotid 2e, 1H+ 2e, 2H+
Vị trí phản ứng (trên nhân nicotinamide)
Vị trí phản ứng (trên nhân
flavin –d/c của isoalloxazine) Nicotinamid (vit B3) Riboflavin (vit B2)
Ví dụ enzym: SV tự liệt kê các enzym 2’
sau khi đã học chuyển hóa các chất
Coenzym oxy hóa khử (vận chuyển điện tử) (2) Coenzym hem Coenzym Q (CoQ) CoQ : n=10 (ĐV có vú) 10 Coezym từ acid lipoic Acid lipoic Acid dihydrolipoic 1e Fe2+ Fe3+ Số e được v/c:?
Ví dụ enzym: catalase, peroxidase,
Ví dụ enzym: α-ketoglutarat dehydrogenase, monooxygenase, dioxygenase,
pyruvate dehydrogenase, ketoacid dehydrogenase, cytochrom oxidase 2-oxoadipate dehydrogenase Coenzym vận chuyển nhóm Coenzym A: VC nhóm acyl Vị trí phản ứng
Thiamin pyrophosphat (TPP): VC nhóm aldehyd (tách nhóm CO ); 2
Pyridoxal phosphat: VC nhóm amin; Biocytin: VC nhóm carboxyl;
Tetrahydrofolat: VC 1 đơn vị carbon;
5’-deoxyadenosyl cobalamin: VC nhóm methyl
Nguồn gốc của các coenzym, ví dụ enzym? (SV tự tìm hiểu) ion kim loại ion Enzym Cu2+ Cytochrom oxidase K+ Pyruvat kinase Mg2+
Hexokinase, glucose-6-phosphatase, pyruvate kinase Mn2+
Arginase, ribonucleotide reductase, Ni2+ Urease Zn2+
Carbonic andydarse, alcolhol dehydrogenase, carboxypeptidase A và B
6. Cấu trúc phân tử enzym
• Cấu trúc trung tâm hoạt động
• Cấu trúc của cofactor (coenzym, kim loại)
• Các dạng cấu trúc của phân tử enzym: Enzym đơn chuỗi Enzym đa chuỗi (polyzym) Enzym dị lập thể Isoenzym/isozym
Phức hợp đa enzym (Multienzym)
Tiền chất enzym (Zymogen/proenzym)
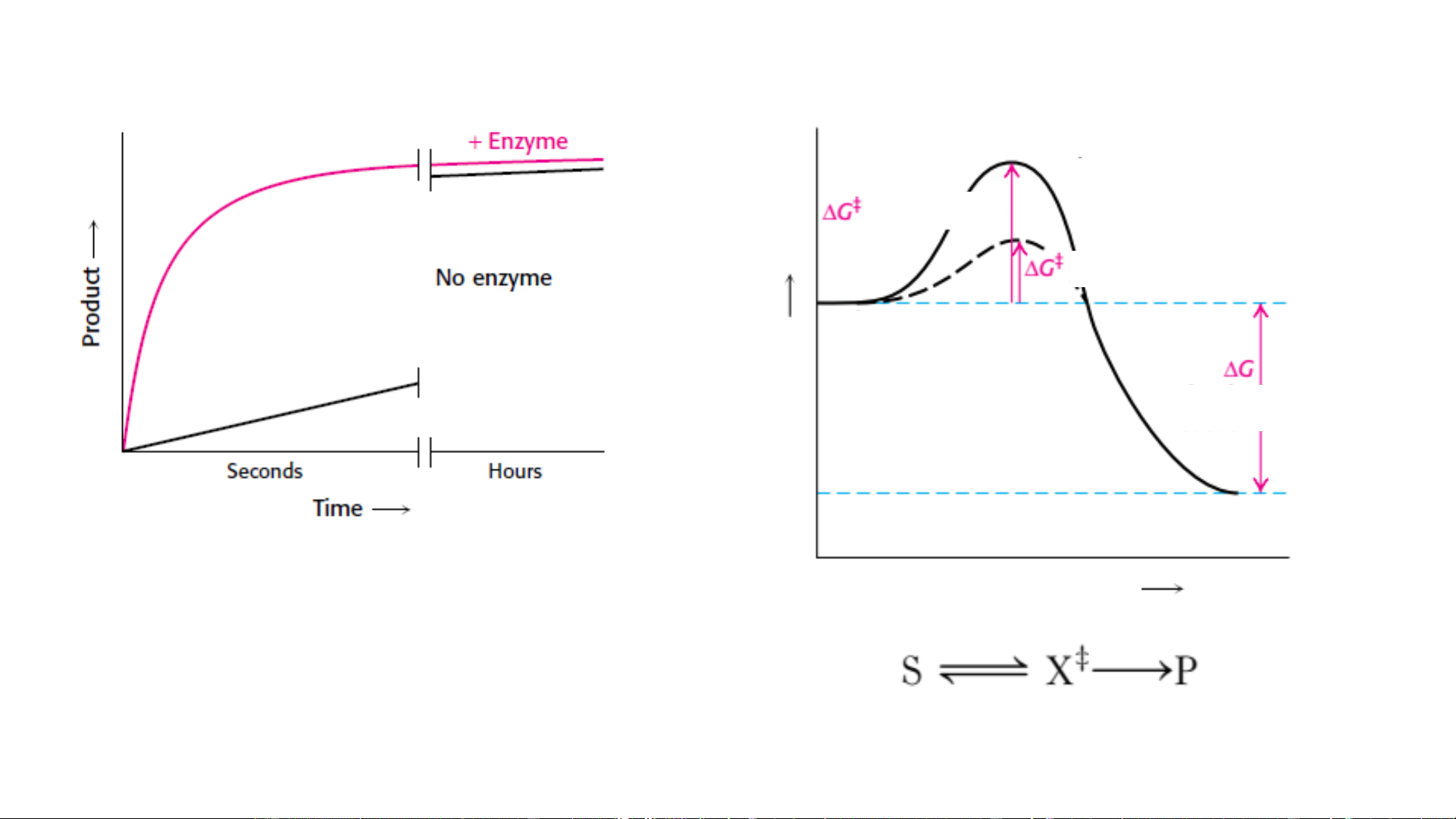
7. Cơ chế hoạt động xúc tác của enzym TT chuyển tiếp X‡ Không xt Có xt Cơ chất do tự của phản ứng ượngl Năng Sản phẩm
Enzym làm tăng tốc độ phản ứng Chiều phản ứng
Không làm thay đổi cân bằng phản ứng
Cơ chế enzym làm giảm năng lượng hoạt hóa
• Gắn đồng thời các cơ chất vào TTHĐ để các cơ chất tiếp xúc gần nhau
• Sử dụng năng lượng liên kết (Binding energy)
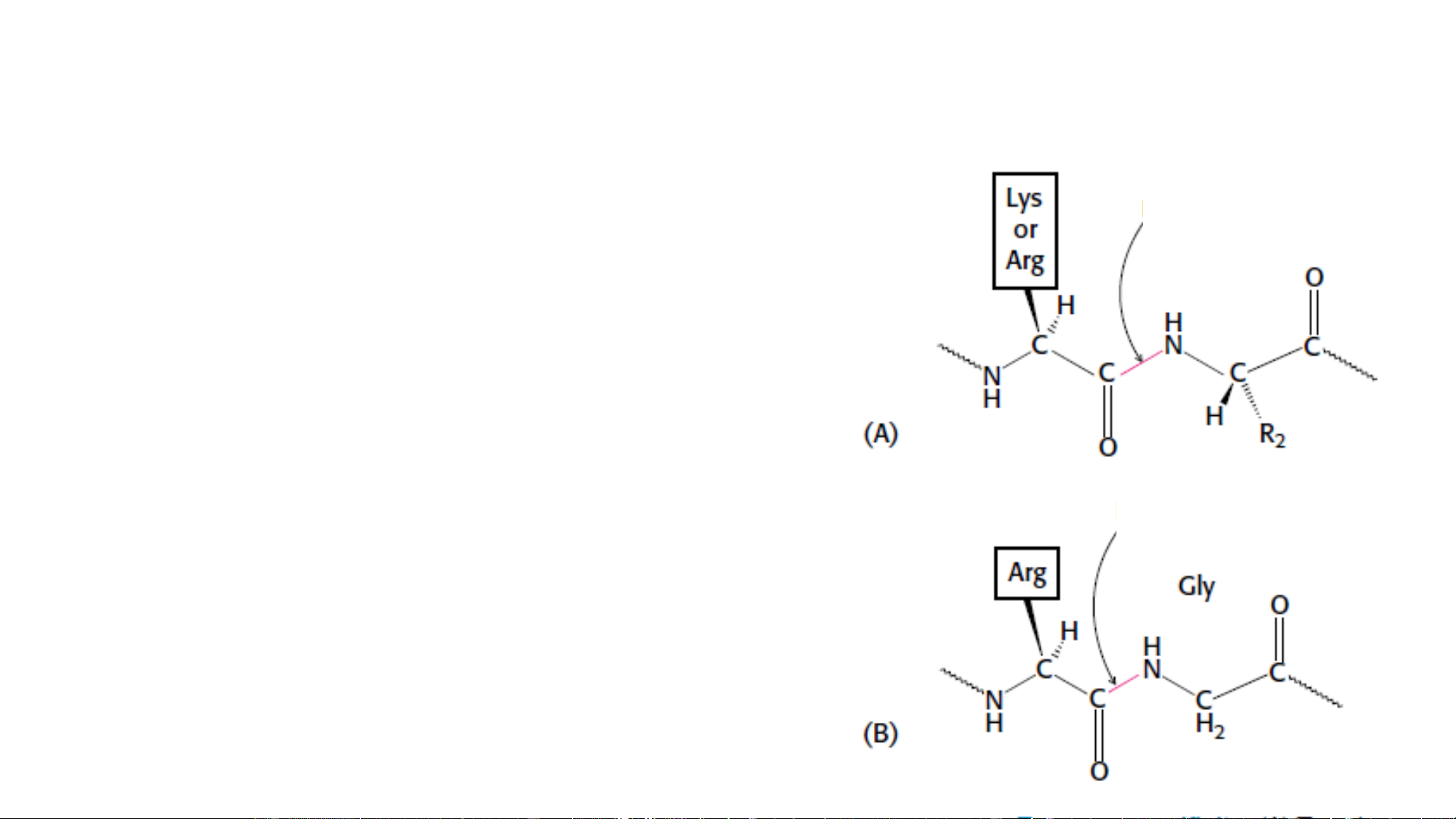
• Tạo liên kết cộng hóa trị (chymotrypsin)
• Acid-base: cho nhận proton giữa enzym và trạng thái trung gian
• Ion kim loại: tạo tác nhân ái nhân, ái điện tử, ổn định điện tích âm
trên chất trung gian, cầu nối giữa enzym và cơ chất làm tăng
năng lượng gắn và giữ cơ chất ở cấu hình phù hợp cho phản ứng xảy ra
Cơ chế cho nhận proton (acid-base) Dạng acid Dạng base Acid amin (cho proton) (nhận proton) ĐẠI CƯƠNG VỀ ENZYM 1. Khái niệm về enzym
2. Cách gọi tên enzym (Danh pháp) 3. Phân loại enzym 4. Đặc điểm của enzym
5. Thành phần cấu tạo của enzym
6. Cấu trúc phân tử enzym
7. Cơ chế hoạt động xúc tác của enzym II. ĐỘNG HỌC ENZYM
1. Động học phản ứng enzym một cơ chất
2. Động học enzym có chất ức chế
3. Động học enzym có nhiều cơ chất (đọc thêm)
4. Các enzym không tuân theo động học M-M (đọc thêm) ĐỘNG HỌC ENZYM
Khái niệm: Sự nghiên cứu tốc độ các phản ứng có sự xúc tác của enzym
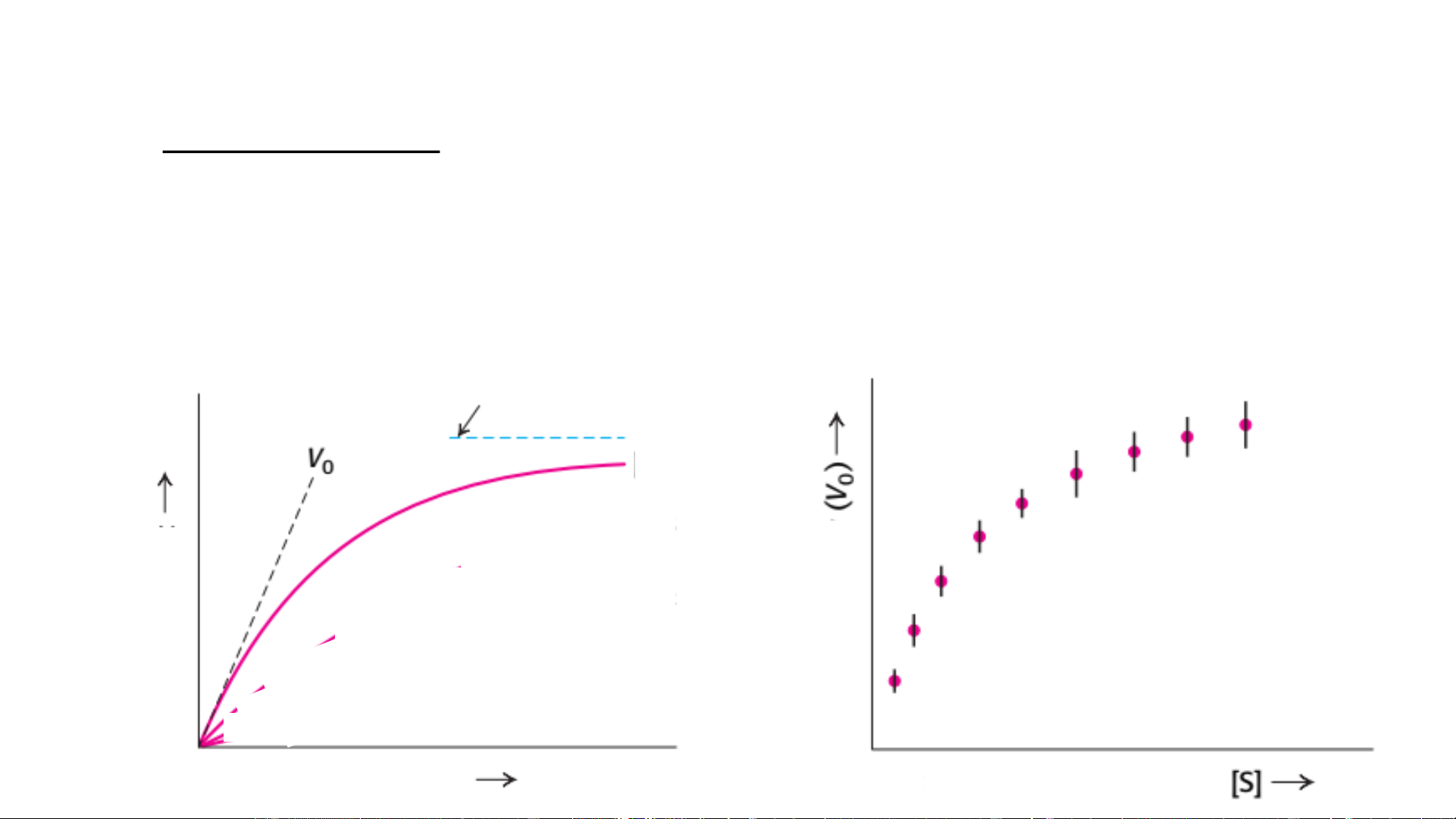
Vai trò: nghiên cứu các đặc tính xúc tác của enzym Một số khái niệm Tốc độ phản ứng
• Tốc độ p/ư enzym: lượng S bị biến đổi (hoặc P tạo thành) do t/d của E trong một đv t/g
• Tốc độ ban đầu (V ): t~0 (tốc độ p/ư chưa ảnh hưởng bởi sự thay đổi o
của t°, pH, [S], [P]) (Đ/v: M/s)
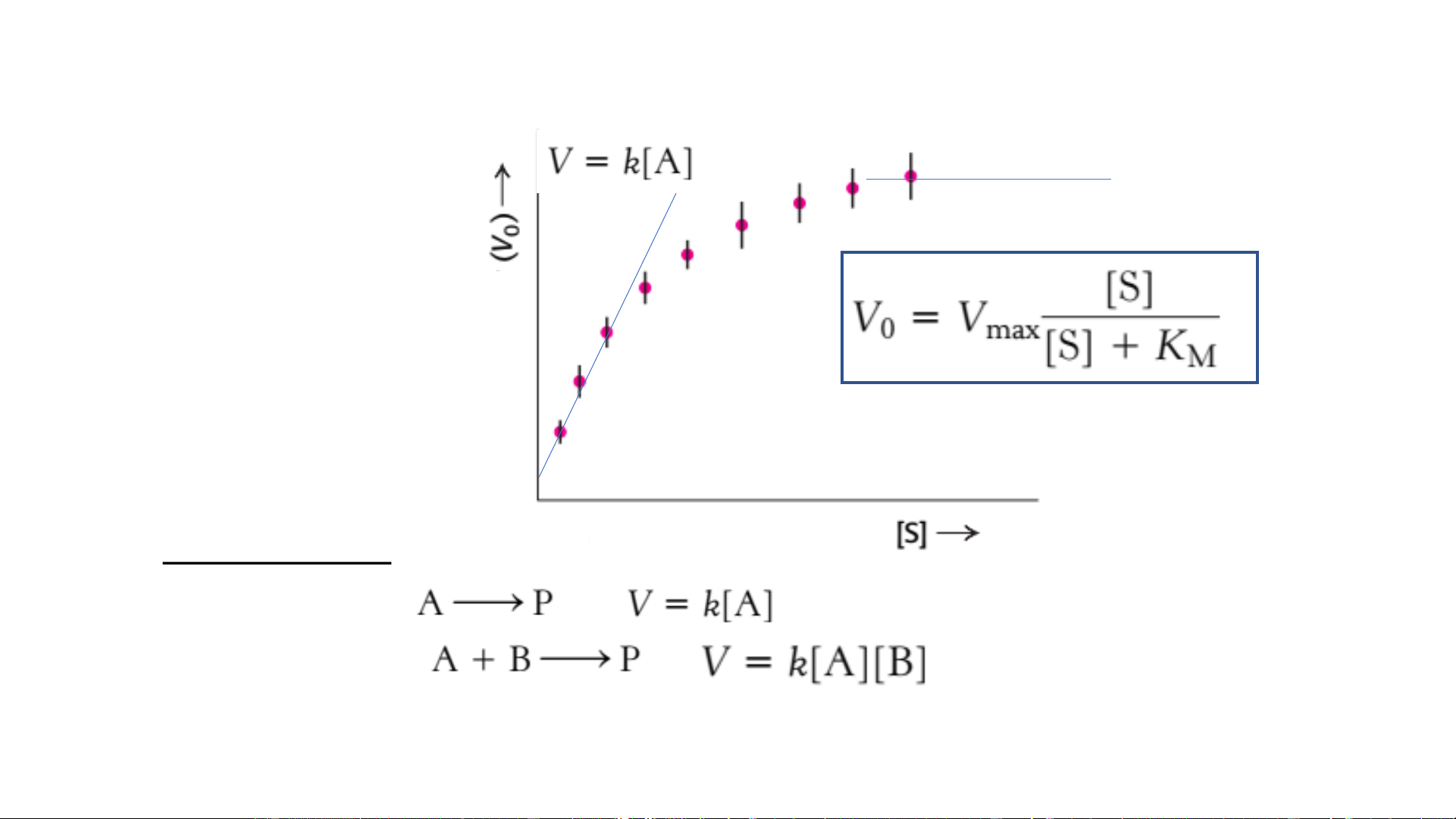
• Tốc độ cực đại (V ): khi E bão hòa S max Cân bằng [S] ẩm đầu ph ban Sản độ ốcT Thời gian Nồng độ cơ chất Một số khái niệm V=k Hyperbol đầu ban độ Phương trình ốcT Michaelis-Menten Bậc phản ứng Nồng độ cơ chất • Phản ứng bậc 1:
k: hằng số tốc độ (s-1) • Phản ứng bậc 2:
k: hằng số tốc độ (M-1s-1)
• Phản ứng bậc 1 giả: V chỉ phụ thuộc A, không phụ thuộc B (nồng độ B rất cao)
• Phản ứng bậc 0: V=k, không phụ thuộc nồng độ cơ chất
1. Động học phản ứng enzym một cơ chất (1) Pư 2 giai đoạn (2) Khi t ~ 0 Tốc độ tạo thành ES Tốc độ phân hủy ES
(3) Giả thuyết “trạng thái ổn định” Hằng số Michaelis-Menten Phương trình Michaelis-Menten
Bài tập về nhà 1 (assignment): đầu ban
Hãy chứng minh phương trình độ Michaelis-Menten ốcT • [S]<M M P/ư bậc Nồng độ cơ chất 1:
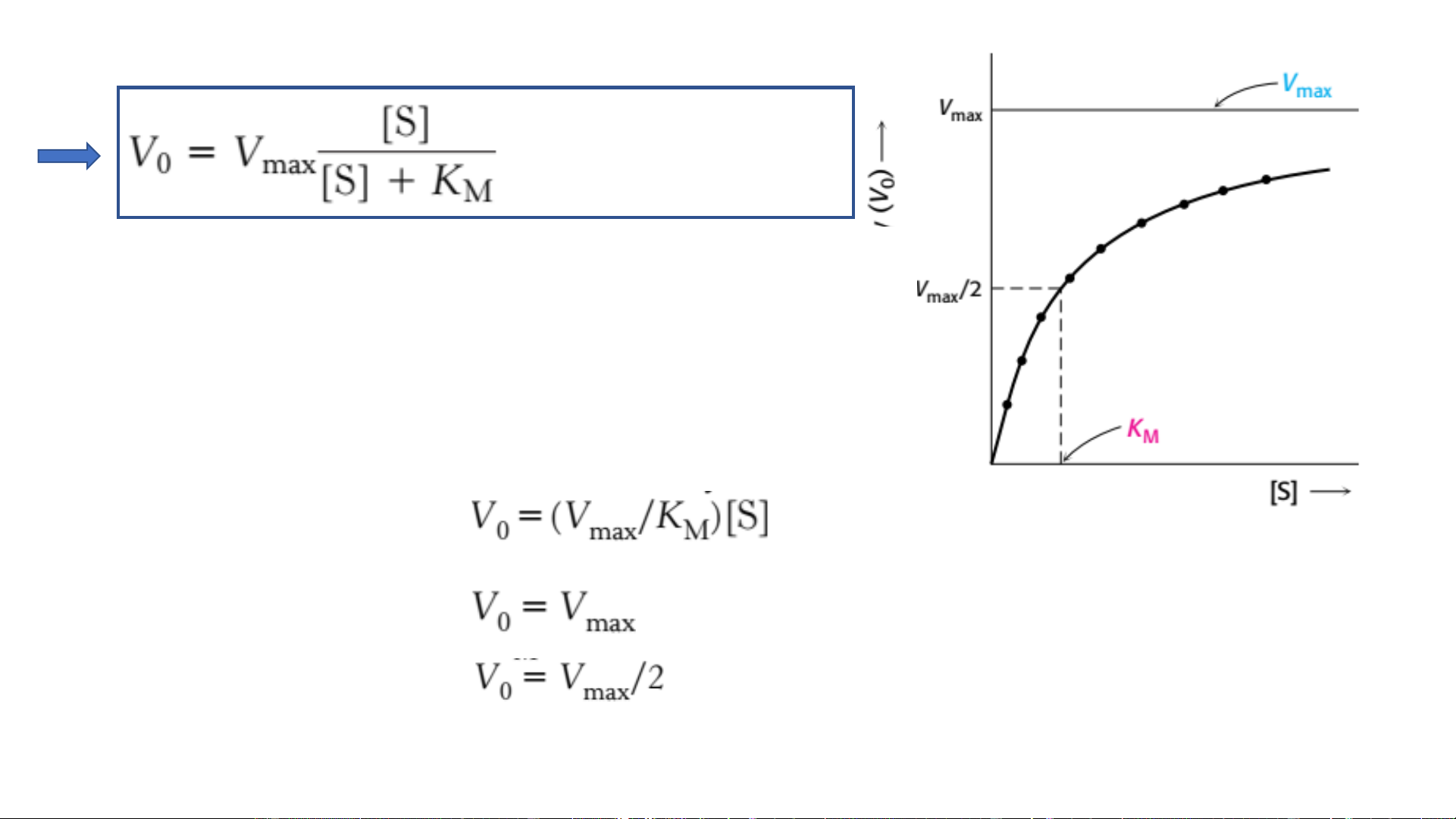
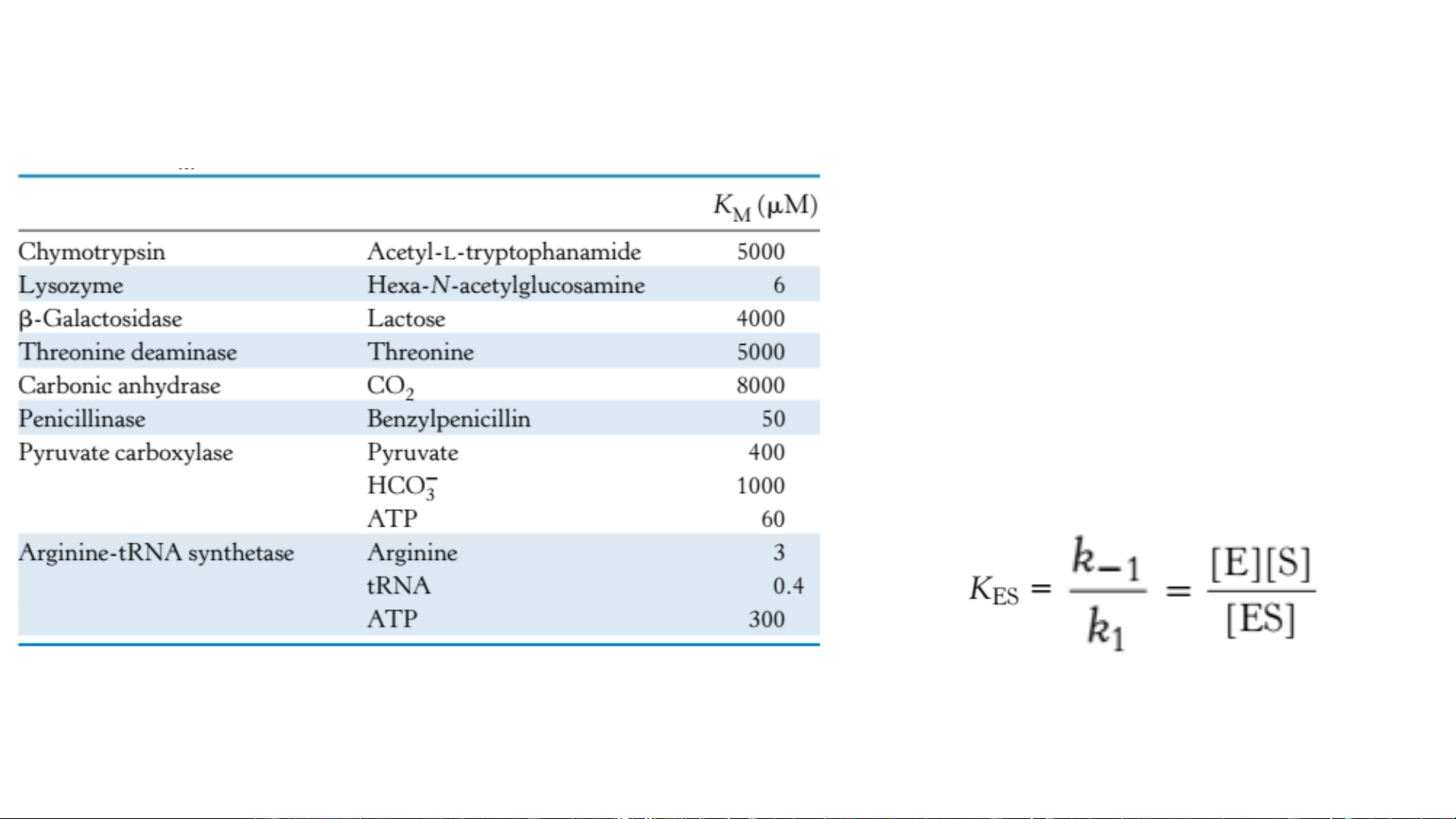
• [S]>>K ([S]>100 K ) M M P/ư bậc 0: • [S] = K : M Ý nghĩa của KM và Enzym Cơ chất • K = [S] khi ½ số TTHĐ M
được gắn với S (V=1/2 V ) max
(1) Tính [S] cần thiết để p/ư xảy ra đáng kể • K ~ [S] => (2) tính [S] M in vivo in vivo • Nếu k >> k : -1 2 (3) K thể hiện ái lực lk E-S M = KM Ý nghĩa của Vmax (1) V
cho biết số chuyển hóa k
(hằng số xúc tác-số phân tử max cat Số chuyển
cơ chất được chuyển hóa bởi 1 phân tử enzym trong hóa của một số enzym
một đơn vị thời gian khi enzym bão hòa cơ chất) Số chuyển Enzym hóa/giây
(2) Xác định tỷ lệ TTHĐ gắn cơ chất
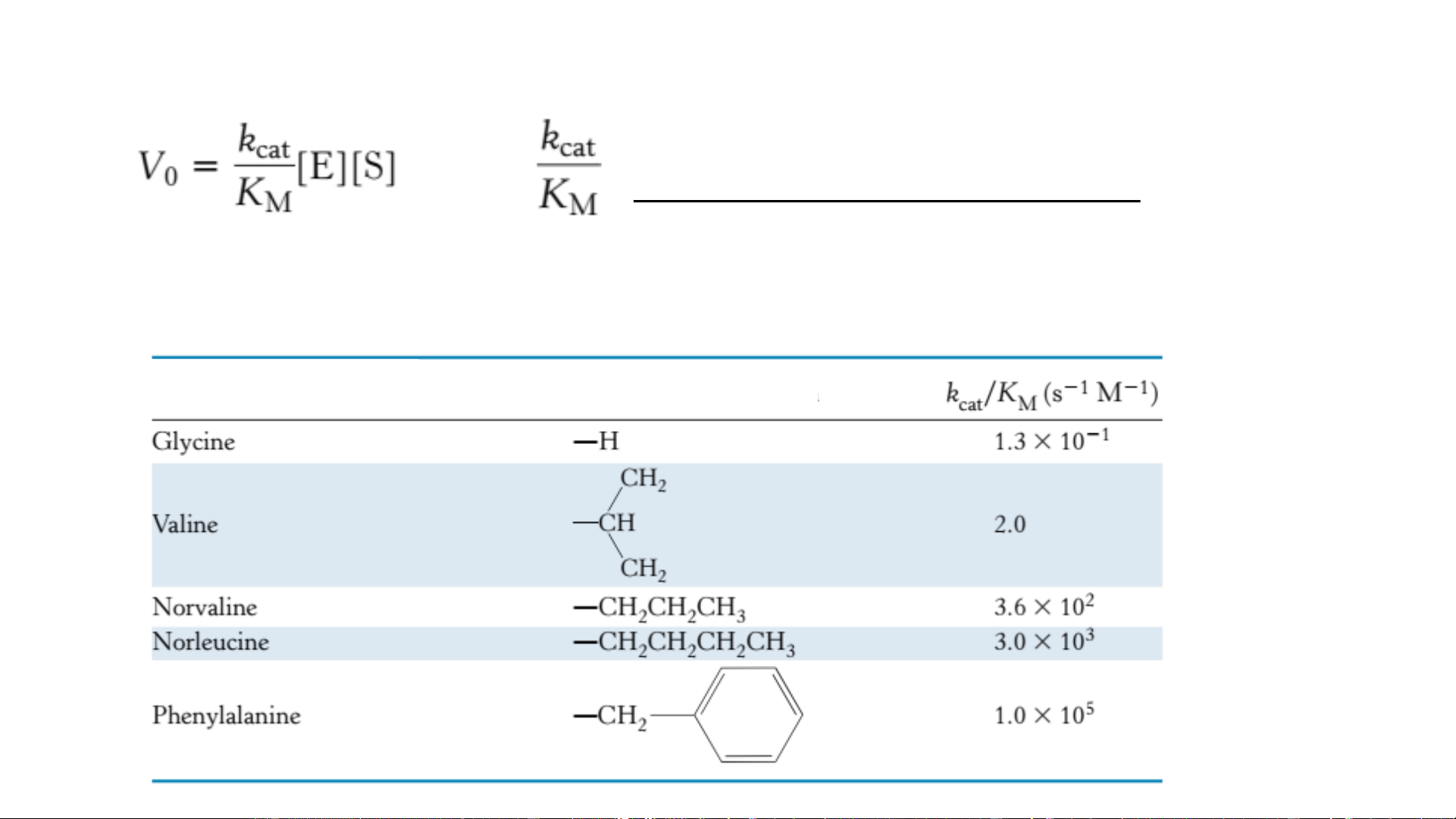
(3) Xác định Hằng số đặc hiệu: đo lường hiệu quả ( xúc tác của enzym)
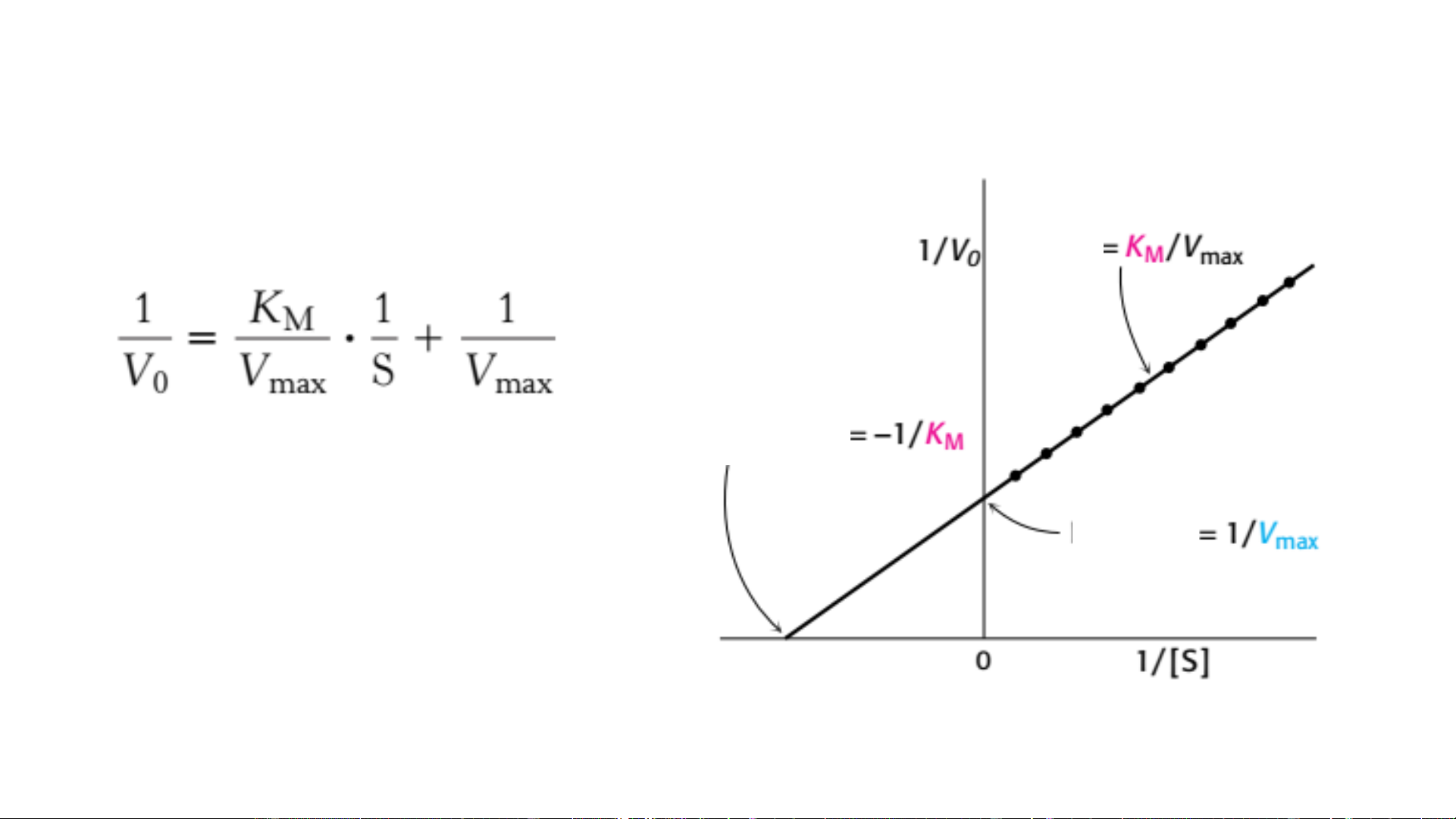
Hằng số đặc hiệu của một số cơ chất của chymotrypsin Acid amin trong este Gốc acid amin Xác định K và V M max • Phương Độ trình Lineweaver-Burk dốc Giao trục hoành Giao trục tung
2. Động học enzym có chất ức chế
• Chất ức chế cạnh tranh
• Chất ức chế không cạnh tranh Chất ư/c Cơ chất cạnh tranh Chất ư/c không cạnh tranh
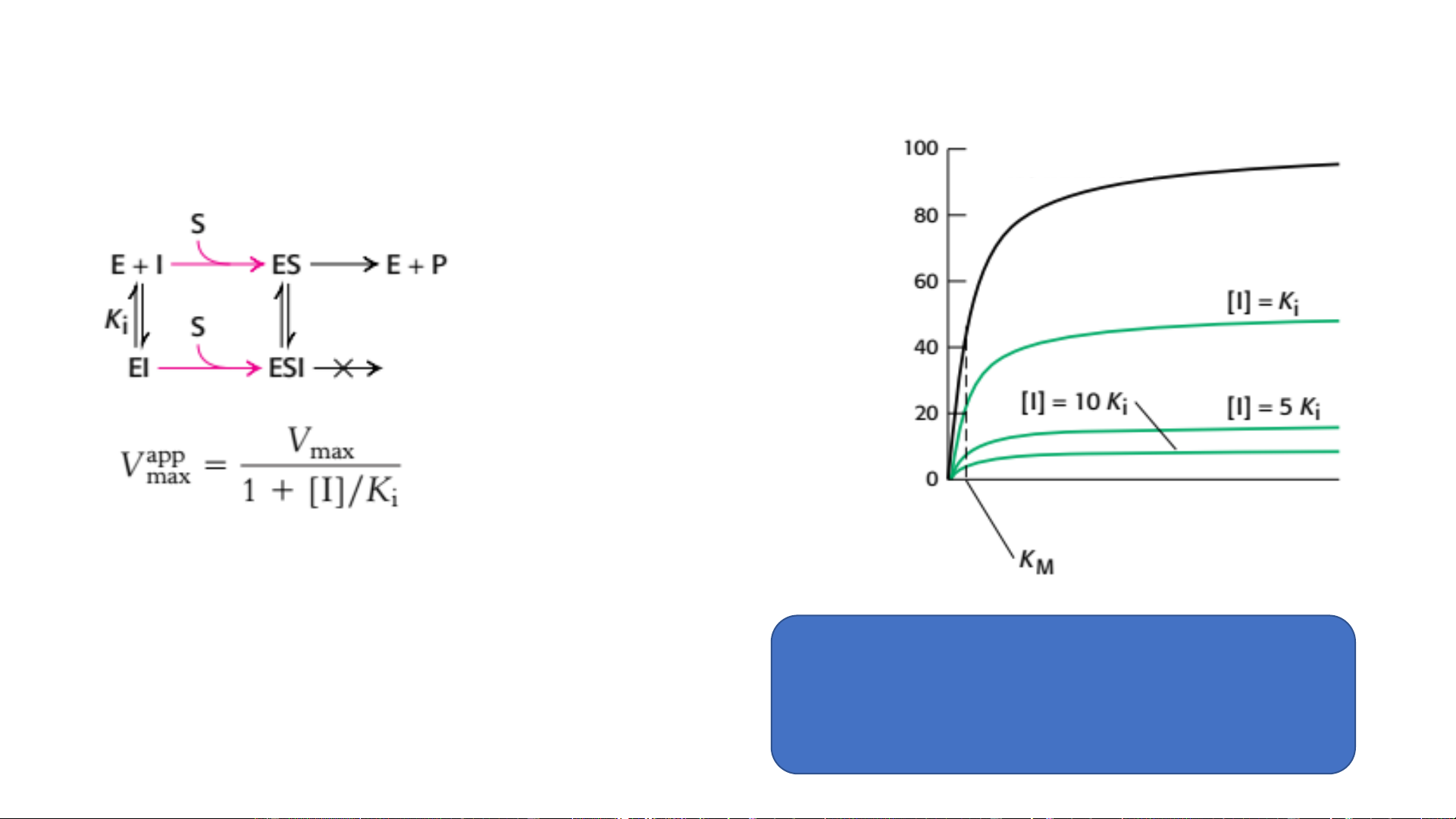
Động học enzym có chất ức chế cạnh tranh Không có chất ư/c đối g ơn ưt độ ốcT
Hằng số phân ly chất ức chế: Hằng số Nồng độ cơ chất phân ly E-I Đặc điểm: • K tăng Thuốc M : ibuprofen, các statin • V không thay đổi max
• Tăng [S] có thể làm mất ức chế
Động học enzym có chất ức chế không cạnh tranh Không có
Noncompetitive (doxycyclin + collagenase) chất ư/c đối g ơn ưt độ ốcT Nồng độ cơ chất Đặc điểm: • K không thay đổi M • V giảm max
• Tăng [S] không làm mất ức chế
3. Động học enzym có nhiều cơ chất (1)
• Theo thứ tự (Tất cả cơ chất gắn vào E, sau đó mới tạo thành SP) (1)
3. Động học enzym có nhiều cơ chất (2)
• Theo thứ tự (Tất cả cơ chất gắn vào E, sau đó mới tạo thành SP) (2)
3. Động học enzym có nhiều cơ chất (3)
• Chuyển dịch kép (SP tạo thành xen kẽ các cơ chất gắn vào E)
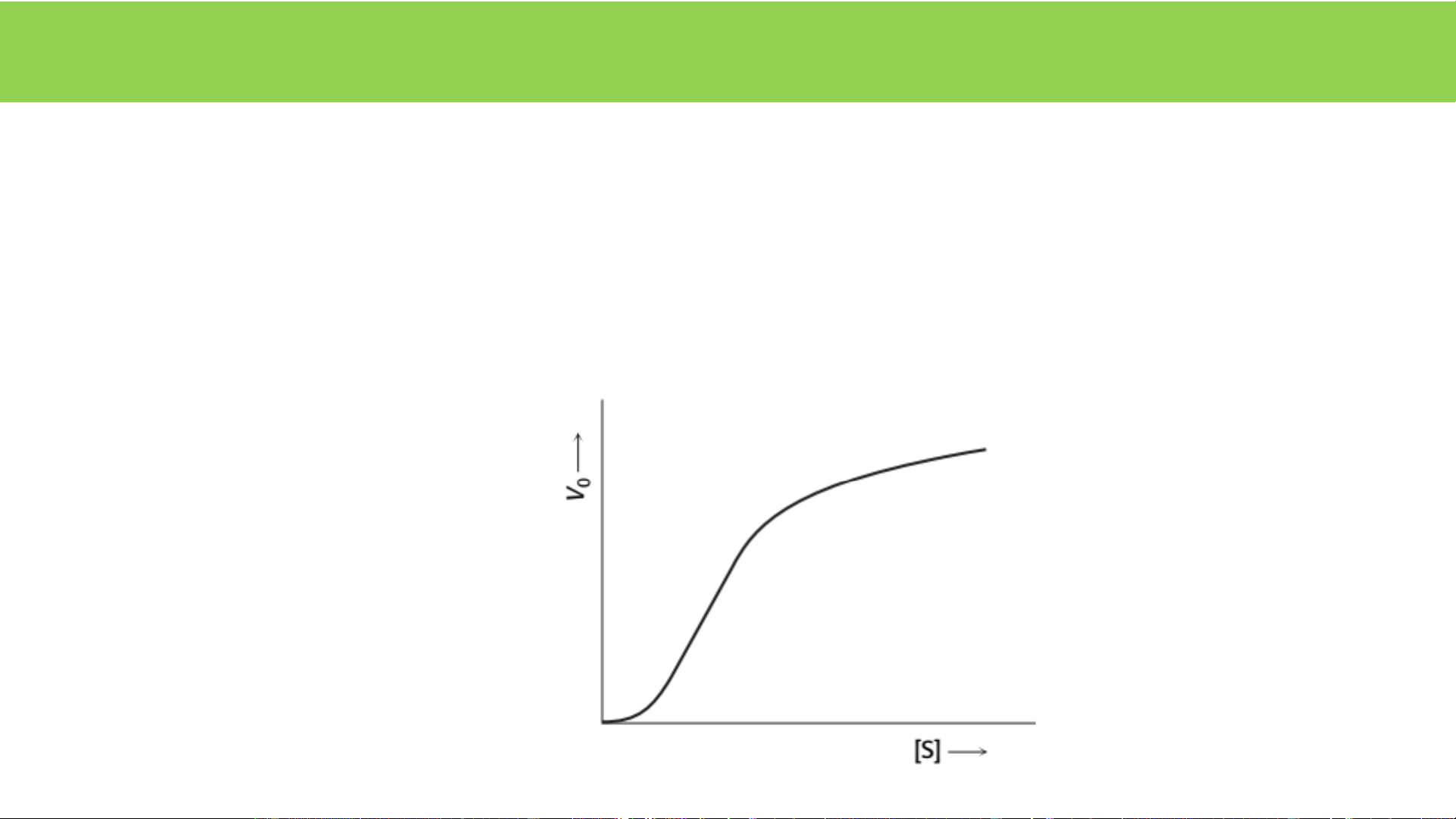
4. Các enzym không tuân theo động học M-M
Enzym dị lập thể: E nhiều tiểu đv, E nhiều TTHĐ, E có vị trí DLT
- S gắn vào 1 TTHĐ => thay đổi TTHĐ khác trong E, hoặc
- Phân tử điều hòa gắn vào vị trí DLT => thay đổi TTHĐ
điều hòa đáp ứng nhanh nhu cầu của tế bào
E dị lập thể có vai trò điều hòa quan trọng trong các con đường chuyển hóa đầu ban độ ốcT Nồng độ cơ chất
III. Các yếu tố ảnh hưởng đến hoạt động enzym Một số khái niệm
• Hoạt độ enzym: là khả năng xúc tác phản ứng của enzym • Đơn vị hoạt độ:
- U (UI) - Đơn vị quốc tế (đơn vị tiêu chuẩn): 1 U = lượng E
xt chuyển hóa 1 µmol S sau 1 phút (µmol/phút) ở đk tiêu chuẩn
- Katal (kat): 1 kat = lượng E xt chuyển hóa 1 mol S sau 1
giây (mol/giây) ở đk tiêu chuẩn; 1 kat =? U
- Hoạt độ riêng: U/mg, U/ml - Hoạt độ phân tử (k
số chuyển hóa): số phân tử S được cat
chuyển hóa bởi 1 phân tử E trong 1 đv t/g (giây)
III. Các yếu tố ảnh hưởng đến hoạt động của enzym S và E 100 • Nồng độ cơ chất • Tăng nhiệt độ 10°C: • Nồng độ
tốc độ phản ứng tăng 2 lần enzym • Nhiệt độ 50
• Nhiệt độ thích hợp: 35-45°C (37oC)
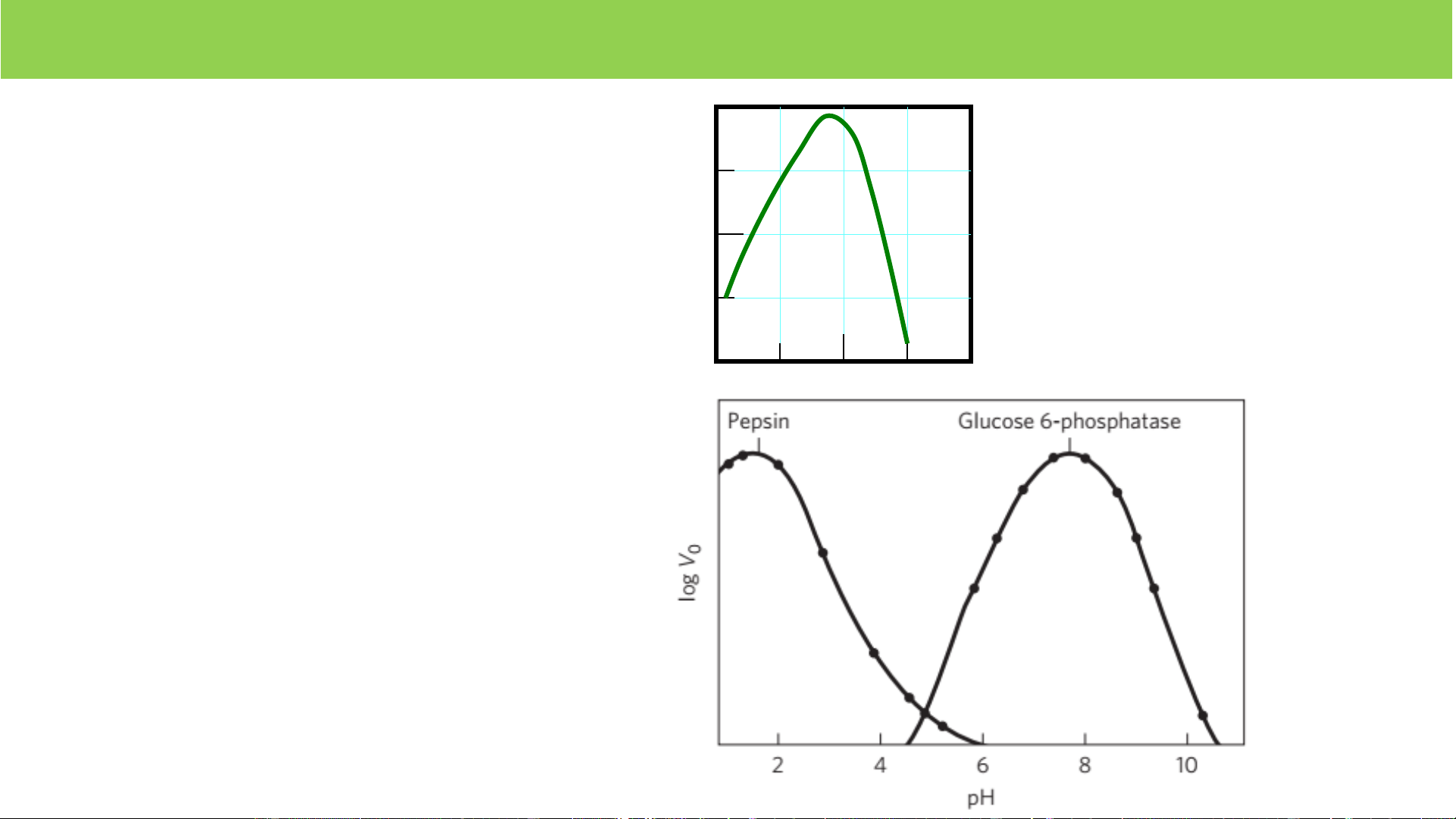
• pH môi trường (trypsin 7,8)
• Ngoại lệ: Papain 70-80oC • Chất hoạt hóa (Cl-) 20 40 60 toC • Chất ức chế 1,6 7,8 • Ánh sáng • Tia xạ • Sóng siêu âm
IV. Điều hòa hoạt động enzym Điều hòa enzym
Thay đổi hoạt tính E
Thay đổi số lượng E (1,2,3,4) (5)
1. Điều hòa dị lập thể 2. Tạo isozym
3. Tạo liên kết cộng hóa trị thuận nghịch
4. Loại bỏ bỏ một phần enzym (phân cắt protein)
5. Điều hòa sinh tổng hợp enzym
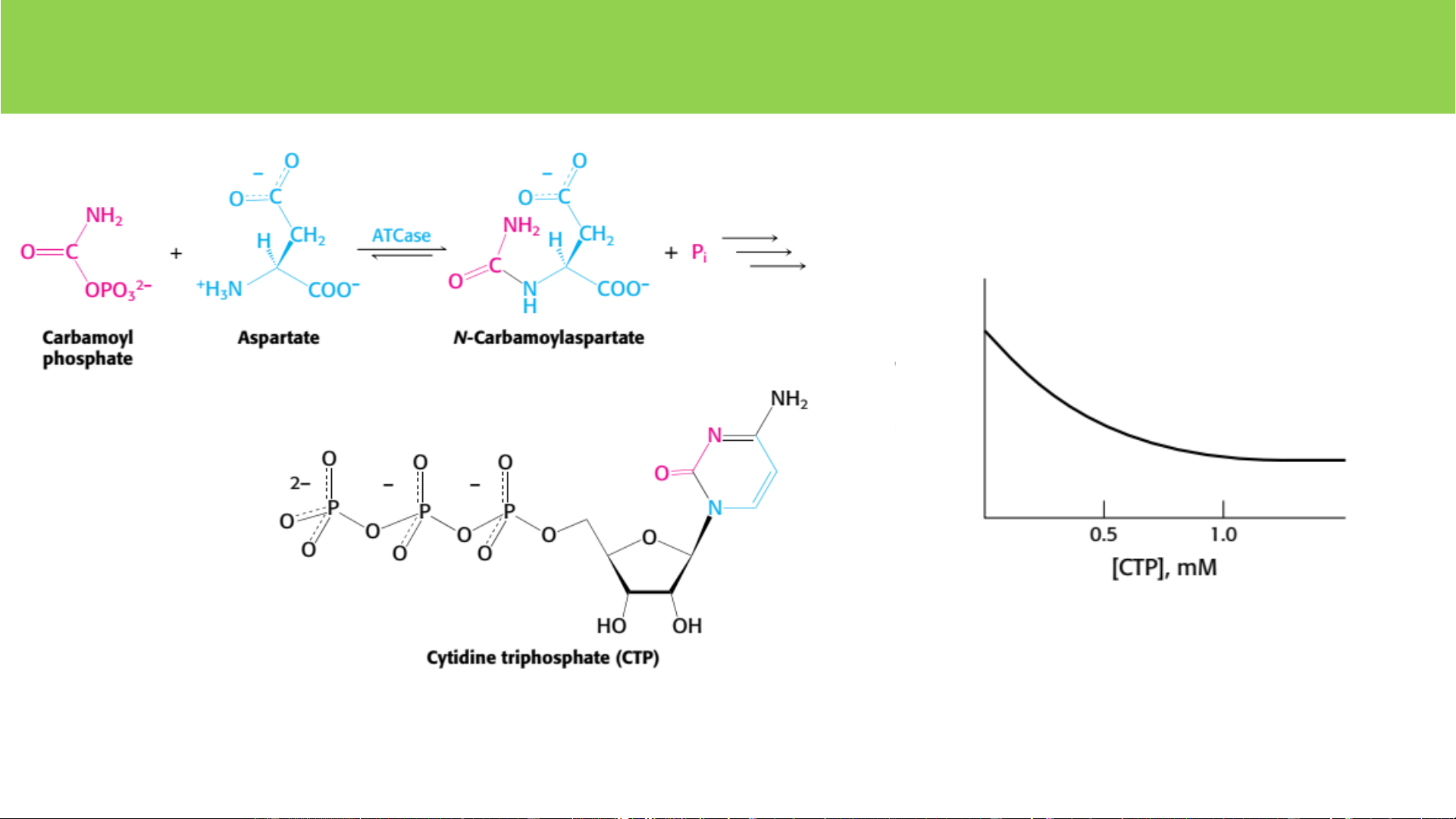
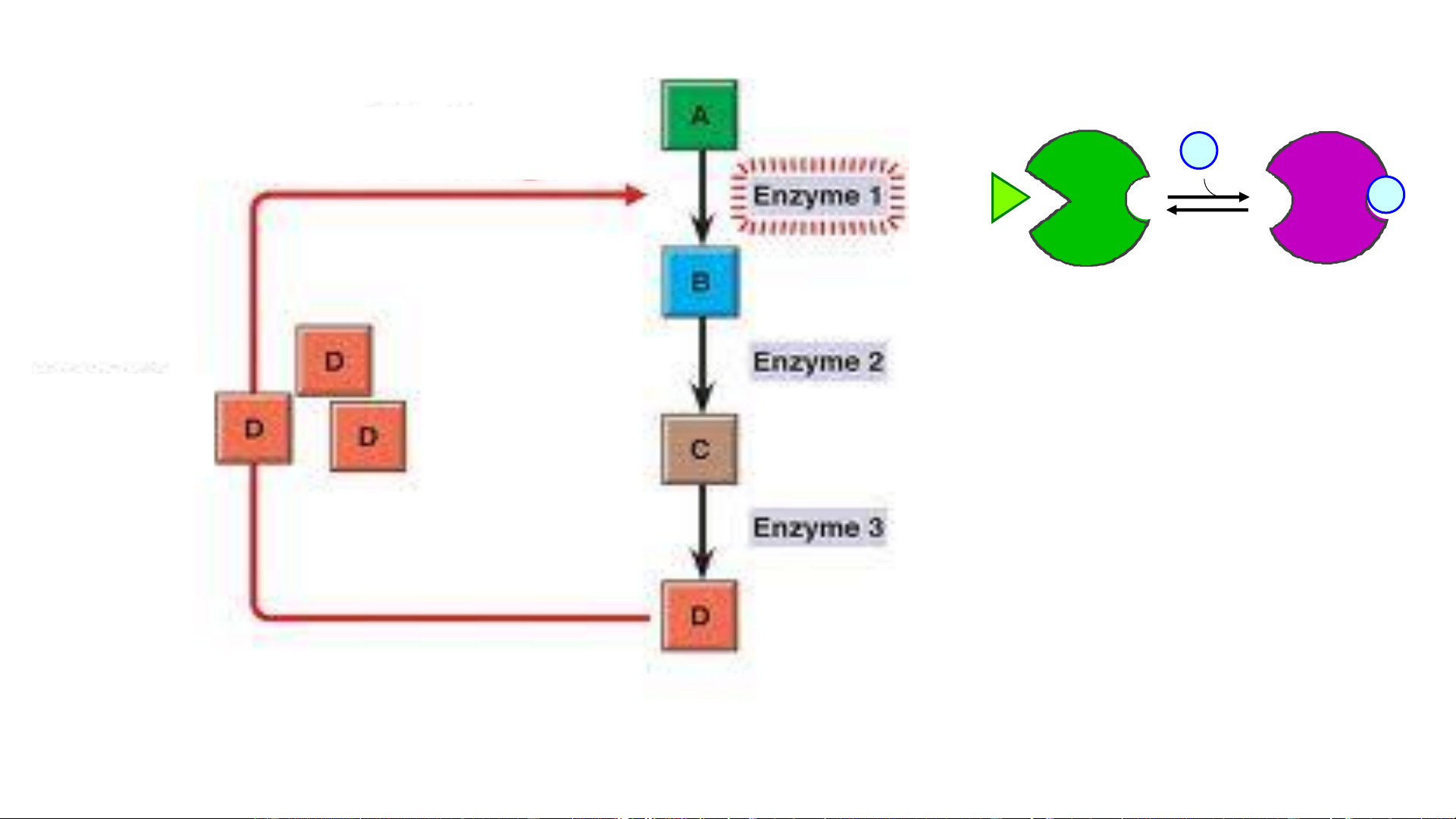
1. Điều hòa dị lập thể TTHĐ - N ta part thành as yl ạot độ ốc arbamo T c
Ghi chú: ATCase - Aspartate transcarbamoylase Feedback (-) (điều hòa ngược âm tính) o D x S D Chất điều hòa D tạo ra quá nhiều 2. Tạo isozym (isoenzym)
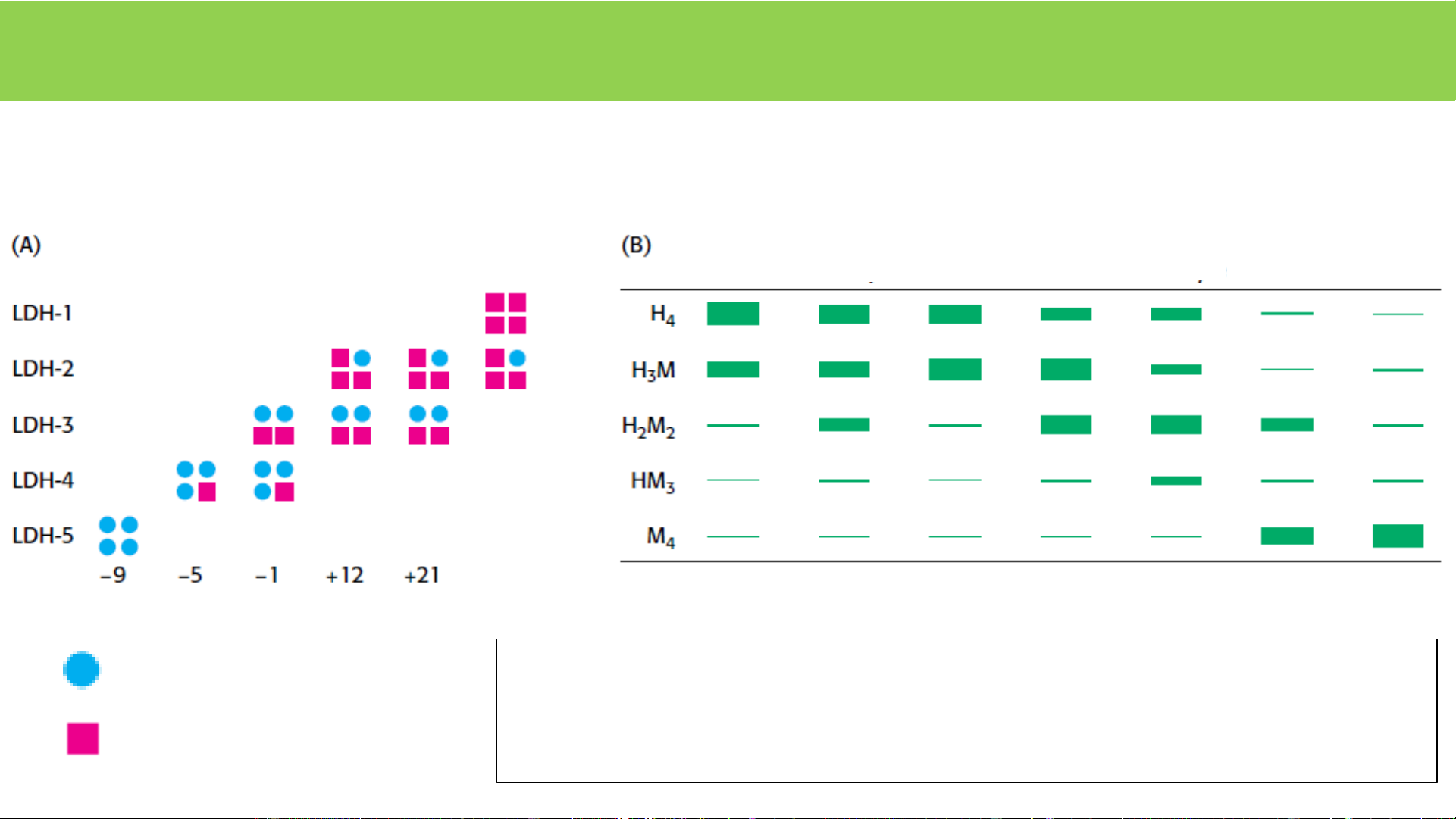
Lactat dehydrogenase tim chuột cống
Lactat dehydrogenase ở các cơ quan
ở các độ tuổi khác nhau
khác nhau của chuột cống Hồng Bạch Cơ Gan Tim Thận Não cầu cầu Chuột trưởng thành Tiểu đv H (H-heart)
isozym : Các E cùng xúc tác 1 pư nhưng tồn tại ở
các dạng phân tử ≠, trong cùng một cơ thể, ở các mô ≠ , Tiểu đv M (M-muscle)
cơ quan ≠ , giai đoạn phát triển ≠
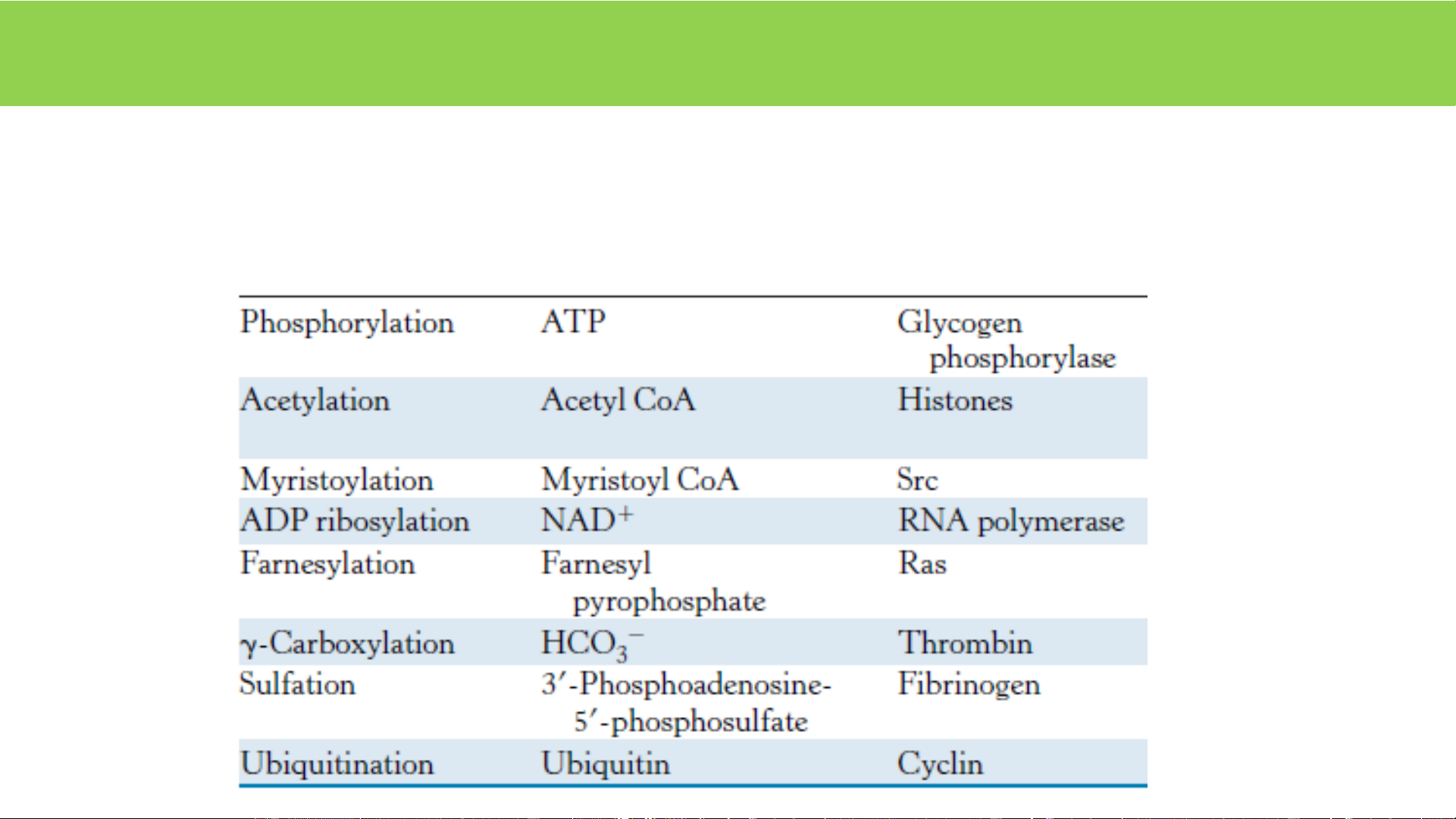
3. Tạo liên kết cộng hóa trị Ví dụ Kiểu biến đổi Chất cho nhóm VD E bị biến đổi
4. Loại bỏ một phần enzym (zymogen hoặc proenzym) • Enzym tiêu hóa
• Enzym trong quá trình đông máu
• Enzym của quá trình chết theo chương trình Ví dụ: Enzym tiêu hóa Vị trí tổng hợp Zymogen Enzym hoạt động Dạ dày Tụy Tụy Tụy
5. Điều hòa sinh tổng hợp enzym
• Cảm ứng, ức chế sinh tổng hợp enzym: thường thông qua điều
hòa quá trình phiên mã (Xem chương Protein)
• Yếu tố điều hòa: Hormon (Xem chương Hormon)
• Đặc điểm: chậm nhưng kinh tế (tiết kiệm nguyên liệu để tổng
hợp enzym-chỉ tổng hợp khi cần thiết)
V. Ứng dụng của enzym trong Y Dược
• Xét nghiệm enzym trong chẩn đoán bệnh
• Sử dụng enzym trong các xét nghiệm hóa sinh
• Sử dụng enzym làm thuốc
• Sử dụng thuốc tác dụng trên enzym
• Sử dụng enzym để tổng hợp dược chất
Vai trò của enzym trong Y dược
• Bệnh lý chuyển hóa di truyền: >100 bệnh
Galactose máu (E: galactose-1-phosphate uridyltransferase),
không dung nạp sữa (E: lactase), tan máu (E: G6PD) =>
• Thiếu hụt enzym do phẫu thuật dạ dày, tụy
• Chẩn đoán bệnh: ALT, AST, LDH, CK, ALP, ACP
• Thuốc là enzym: urokinase, nattokinase, α-chymotrypsin, asparaginase
• Thuốc tác dụng trên enzym: > 300 thuốc, tác dụng trên >70 enzym
(người, vi khuẩn, virus, nấm)




