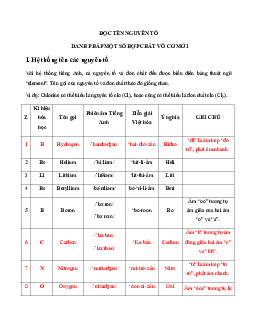
Preview text:
Giải Hóa 10 Kết nối tri thức
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố
trong một chu kì và trong một nhóm.
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Câu 1 trang 35 SGK Hóa 10 Kết nối tri thức
Dựa vào Bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br.
Hướng dẫn trả lời câu hỏi
Dựa vào bảng 6.1, số electron lớp ngoài cùng của nguyên tử các nguyên tố Li, Al, Ar, Ca, Si,
Se, P, Br lần lượt là 1, 3, 8, 2, 4, 6, 5, 7.
Câu 2 trang 35 SGK Hóa 10 Kết nối tri thức
Nêu vị trí trong bảng tuần hoàn của các nguyên tố có Z = 8, Z = 11; Z = 17 và Z = 20. Xác
định số electron hóa trị của nguyên tử các nguyên tố đó.
Hướng dẫn trả lời câu hỏi Số electron hóa Cấu hình e Ô Chu kì Nhóm trị Z = 8 1s22s22p4 8 2 VIA 6 Z = 11 1s22s22p63s1 11 3 IA 1 Z = 17 1s22s22p63s23p5 17 3 VIIA 7 Z = 20 1s22s22p63s23p64s2 20 4 IIA 2
II. Bán kính nguyên tử
Câu 3 trang 36 SGK Hóa 10 Kết nối tri thức
Dựa vào bảng tuần hoàn, hãy so sánh và giải thích sự khác nhau về bán kính nguyên tử của
a) lithium (Z = 3) và potassium (Z = 19).
b) calcium (Z = 20) và selenium (Z = 34).
Hướng dẫn trả lời câu hỏi
a) Bán kính nguyên tử potassium lớn hơn bán kính nguyên tử lithium do Li và K thuộc
nhóm IA, điện tích hạt nhân của potassium lớn hơn điện tích hạt nhân của lithium, nhưng Li
có 2 lớp electron còn K có 4 lớp electron nên lực hút giữa hạt nhân với các electron lớp
ngoài cùng của potassium nhỏ hơn.
b) Bán kính của calcium lớn hơn bán kính của selenium do Ca và Se cùng thuộc chu kì 4,
lực hút giữa điện tích hạt nhân với các electron lớp ngoài cùng của Ca nhỏ hơn so với Se III. Độ âm điện
Câu 4 trang 37 SGK Hóa 10 Kết nối tri thức
Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là Ca, Mg, P, S. Hãy giải
thích sự sắp xếp này dựa trên sự biến đổi độ âm điện theo chu kì và nhóm A.
Hướng dẫn trả lời câu hỏi
Nguyên tố Mg và Ca cùng thuộc nhóm IIA. Trong một nhóm, theo chiều tăng của điện tích
hạt nhân độ âm điện giảm dần nên độ âm điện của Mg > Ca.
Ba nguyên tố Mg, P, S cùng thuộc chu kì 3. Trong một chu kì, theo chiều tăng của điện tích
hạt nhân độ âm điện tăng dần nên độ âm điện của Mg < P < S.
⇒ Thứ tự độ âm điện tăng dần là Ca < Mg < P < S.
Câu 5 trang 37 SGK Hóa 10 Kết nối tri thức
Almelec là hợp kim của aluminium với một lượng nhỏ magnesium và silicon (98,8%
aluminium; 0,7% magnesium và 0,5% silicon). Almelec được sử dụng làm dây dẫn điện cao
thế do nhẹ, dẫn nhiệt tốt và bền. Dựa vào bảng tuần hoàn các nguyên tố hóa học, hãy:
a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử của các nguyên tố hóa học trong almelec.
b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec.
Hướng dẫn trả lời câu hỏi
a) Các nguyên tố hóa học trong almelec là Al, Mg, Si.
Ba nguyên tố này đều thuộc chu kì 3, theo thứ tự điện tích tăng dần Mg (Z = 12), Al (Z =
13), Si (Z = 14) thì bán kính nguyên tử giảm từ Mg > Al > Si vì lực hút giữa hạt nhân với
các electron lớp ngoài cùng tăng.
⇒ Thứ tự tăng dần về bán kính nguyên tử là Si < Al < Mg.
b) Ba nguyên tố này đều thuộc chu kì 3, theo thứ tự điện tích tăng dần Mg (Z = 12), Al (Z =
13), Si (Z = 14) thì độ âm điện tăng từ Mg < Al < Si vì khi số electron lớp ngoài cùng tăng,
điện tích hạt nhân tăng dẫn đến lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
⇒ Thứ tự độ âm điện giảm dần là Si > Al > Mg.
IV. Tính kim loại và tính phi kim
Câu 6 trang 39 SGK Hóa 10 Kết nối tri thức
Dựa vào bảng tuần hoàn các nguyên tố hóa học, sắp xếp các nguyên tố Ba, Mg, Ca, Sr theo
thứ tự giảm dần tính kim loại và giải thích.
Hướng dẫn trả lời câu hỏi
Dựa vào bảng tuần hoàn, ta nhận thấy 4 nguyên tố này thuộc nhóm IIA, theo chiều tăng dần
điện tích hạt nhân Mg (Z = 12), Ca (Z = 20), Sr (Z = 38), Ba (Z = 56) thì tính kim loại tăng dần.
⇒ Thứ tự giảm dần tính kim loại là Ba, Sr, Ca, Mg. Giải thích:
Từ Mg đến Ba tuy điện tích hạt nhân tăng dần, nhưng bán kính nguyên tử tăng nhanh làm
cho lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm dẫn đến khả năng nhường
electron tăng nên tính kim loại tăng.
Vậy chiều giảm dần tính kim loại là từ Ba đến Mg.
Câu 7 trang 39 SGK Hóa 10 Kết nối tri thức
Trong các nguyên tố O, F, Cl, Se, nguyên tố có tính phi kim mạnh nhất là A. O. B. F. C. Se. D. Cl
Hướng dẫn trả lời câu hỏi
Trong một nhóm, tính phi kim giảm dần theo chiều tăng của điện tích hạt nhân.
F (Z = 9) và Cl (Z = 17) đều thuộc nhóm VIIA nên tính phi kim của F > Cl.
O (Z = 8) và Se (Z = 34) đều thuộc nhóm VIA nên tính phi kim của O > Se.
Trong một chu kì, tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân.
O (Z = 8) và F (Z = 9) đều thuộc chu kì 2 nên tính phi kim của F > O.
--------------------------------
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến
Trung học phổ thông nhanh nhất, chính xác nhất.