





Preview text:
Giải Hóa 9 bài 16: Tính chất hóa học của kim loại
A. Lý thuyết Hóa 9 bài 16
1. Tác dụng với phi kim
a) Tác dụng với oxi: Hầu hết kim loại (trừ Au, Pt, Ag,...) tác dụng với oxi ở nhiệt độ
thường hoặc nhiệt độ cao, tạo thành oxit. o 2Mg + O t 2 2MgO o 3Fe + 2O t 2 Fe3O4
b) Tác dụng với phi kim khác (Cl., S,...): Nhiều kim loại tác dụng với nhiều phi kim, tạo thành muối.
Tác dụng với Cl2: tạo muối clorua (kim loại có hóa trị cao nhất) o Cu + Cl t 2 CuCl2
Tác dụng với lưu huỳnh: khi đun nóng tạo muối sunfua (trừ Hg xảy ra ở nhiệt độ thường) Hg + S → HgS
2. Tác dụng với dung dịch axit
a. Tác dụng với dung dịch HCl và H2SO4 loãng (trừ Cu, Ag, Au, Pt) Fe + HCl → FeCl2 + H2
Zn + H2SO4 loãng → ZnSO4 + H2
b. Tác dụng với axit H2SO4 đặc nóng và HNO3 đặc nóng
2Ag + H2SO4 đặc → Ag2SO4 + SO2 ↑ + 2H2O
2Al + 6H2SO4 đặc → Al2(SO4)3 + 3SO2↑ + 6H2O
Lưu ý: Al, Fe, Cr không tác dụng với H2SO4 đặc nguội
3. Tác dụng với dung dịch muối
Kim loại hoạt động mạnh hơn (trừ Na, K, Ba,...) tác dụng với muối của kim loại yếu
hơn, tạo thành muối và kim loại mới.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
B. Giải Bài Tập Hóa 9 trang 51
Bài 1 Trang 51 SGK hóa 9
Kim loại có những tính chất hoá học nào? Lấy thí dụ và viết các phương trình hoá
học minh hoạ với kim loại magie.
Hướng dẫn giải bài tập
Các em tham khảo phần lý thuyết ở mục A phía trên.
Bài 2 Trang 51 SGK hóa 9
Hãy viết các phương trình hoá học theo các sơ đồ phản ứng sau đây:
a) .......... + HCl → MgCl2 + H2;
b) ......... + AgNO3 → Cu(NO3)2 + Ag;
c) ......... + ............ → ZnO; d) ........ + Cl2 → CuCl2 e) ....... + S → K2S.
Hướng dẫn giải bài tập
Hãy viết các phương trình hoá học theo các sơ đồ phản ứng sau đây:
a) Mg + 2HCl → MgCl2 + H2↑;
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓; c) 2Zn + O2 → 2ZnO; d) Cu + Cl2 → CuCl2 e) 2K + S → K2S
Bài 3 Trang 51 SGK hóa 9
Viết các phương trình hoá học của các phản ứng xảy ra giữa các cặp chất sau đây:
a) Kẽm + Axit sunturic loãng;
b) Kẽm + Dung dịch bạc nitrat; c) Natri + Lưu huỳnh; d) Canxi + Clo.
Hướng dẫn giải bài tập
a) Zn + H2SO4 → ZnSO4 + H2↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag↓ c) 2Na + S → Na2S d) Ca + Cl2 → CaCl2
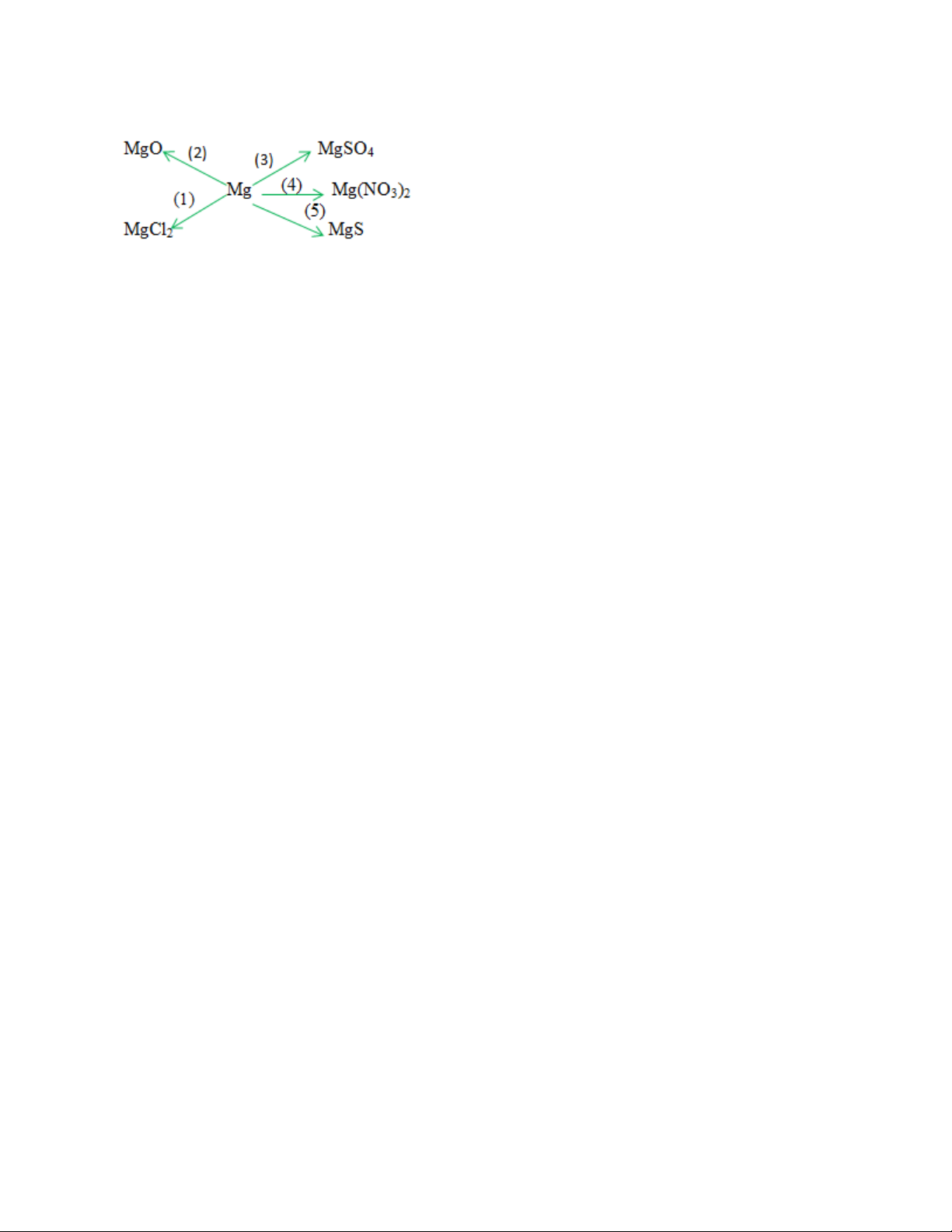
Bài 4 Trang 51 SGK hóa 9
Dựa vào tính chất hoá học của kim loại, hãy viết các phương trình hoá học biểu
diễn các chuyển đổi sau đây:
Hướng dãn giải bài tập
Có thể có các phương trình hóa học sau: 1) Mg + Cl2 → MgCl2 2) 2Mg + O2 → 2MgO
3) Mg + H2SO4 → MgSO4 + H2↑
4) Mg + Cu(NO3)2 → Mg(NO3)2 + Cu↓ 5) Mg + S → MgS
Bài 5 Trang 51 SGK hóa 9
Dự đoán hiện tượng và viết phương trình hoá học khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Hướng dẫn giải bài tập
a) Khói màu nâu đỏ tạo thành: 2Fe + 3Cl2 → 2FeCl3
b) Dung dịch CuCl2 →FeCl2 + Cu↓
c) Dung dịch CuSO4 nhạt màu, kim loại màu đỏ bám ngoài viên kẽm: Zn + CuSO4 → ZnSO4 + Cu↓
Bài 6 Trang 51 SGK hóa 9
Ngâm một lá kẽm trong 20g dung dịch muối đồng sunfat 10% cho đến khi kẽm
không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng
độ phần trăm của dung dịch sau phản ứng.
Hướng dẫn giải bài tập
Ta có: mCuSO4 = 20.0,1 = 2(g) => nCuSO4 = 0,0125 (mol)
PTHH: Zn + CuSO4 → ZnSO4 + Cu↓ 1 mol 1 mol 1 mol
0,0125 mol 0,0125 mol 0,0125 mol
=> mZn = n.M = 0,0125. 65 = 0,81 (g)
mZnSO4 = n.M = 0,0125. 161= 2,01 (g)
mdd sau pư = mddCuSO4 + mZn – mCu giải phóng
Nồng độ % dung dịch ZnSO4 là: C% = (2,01/20).100% = 10,05 (%)
Bài 7 Trang 51 SGK hóa 9
Ngâm một lá đồng trong 20ml dung dịch bạc nitrat cho tới khi đồng không thể tan
thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng
tăng thêm 1,52g. Hãy xác định nổng độ mol của dung dịch bạc nitrat đã dùng (giả
thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Hướng dẫn giải bài tập
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓ Theo PTHH:
1 mol Cu tác dụng với 2 mol AgNO3 thì khối lượng tăng 152g
x mol..................................1,52g => x = 0,02 mol AgNO3
Nồng độ dung dịch AgNO3: CMAgNO3 = n/V = 0,02/0,02 = 1 (M)
C. Trắc nghiệm Hóa 9 bài 16
Câu 1. Dãy nào dưới đây gồm các dung dịch muối tác dụng được với kim loại Mg? A. ZnCl2, Fe(NO3)2 và CuSO4 B. CaCl2, NaCl và Cu(NO3)2 C. CaCl2, NaNO3 và FeCl3 D. Ca(NO3)2, FeCl2 và CuSO4
Câu 2. Để làm sạch dung dịch muối Cu(NO3)2 có lẫn muối AgNO3, có thể dùng kim loại nào sau đây? A. Mg B. Ag C. Cu D. Fe
Câu 3. Dãy gồm các kim loại phản ứng được với H2SO4 loãng A. Al, Fe và Cu B. Al, Zn và Fe C. Zn, Cu và Ag D. Zn, Al và Cu
Để xem toàn bộ câu hỏi trắc nghiệm Hóa 9 bài 16 kèm đáp án tại: Trắc nghiệm hóa 9
bài 16: Tính chất hóa học của axit
D. Giải sách bài tập hóa 9 bài 16
Ngoài các dạng câu hỏi bài tập sách giáo khoa hóa 9 bài 16 Tính chất hóa học của
kim loại, để củng cố nâng cao kiến thức bài học cũng như rèn luyện các thao tác kĩ
năng làm bài tập. Các bạn học sinh cần bổ sung làm thêm các câu hỏi bài tập sách
bài tập. Để hỗ trợ bạn đọc trong quá trình học tập cũng như làm bài tập. VnDoc
biên soạn hướng dẫn giải chi tiết bài tập SBT hóa 9 bài 16 tại: Giải SBT Hóa 9 bài 16:
Tính chất hóa học của kim loại




