





Preview text:
Giải Bài tập Hóa 9 bài 18: Nhôm
A. Tóm tắt lý thuyết Hóa 9 bài 18
I. Tính chất vật lí
Nhôm là kim loại màu trắng bạc, dẻo, dẫn điện và dẫn nhiệt tốt. Nhôm là kim
loại nhẹ (D = 2,7g/cm3), mềm, nóng chảy ở 660°C.
II. Tính chất hóa học
1. Tính chất của một kim loại
a) Tác dụng với oxi và một số phi kim. 4Al + 3O2 → 2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững,
lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước. 2Al + 3Cl2 → 2AlCl3
b) Tác dụng với axit (HCl, H2SO4 loãng,..) 2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội,
e) Tác dụng với dung dịch muối của kim loại yếu hơn.
AI + 3AgNO3 → Ag(NO3)3 + 3Ag
2. Tính chất hóa học riêng của nhôm.
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
III. Sản xuất nhôm
Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3.
Sau khi đã loại bỏ tạp chất, người ta điện phân Al2O3 nóng chảy (có pha thêm
chất criolit có tác dụng làm giảm nhiệt độ nóng chảy của nhôm oxit), thu được nhôm.
B. Giải bài tập SGK Hóa trang 57, 58
Bài 1 SGK Hóa 9 trang 58 TÍNH CHẤT CỦA NHÔM ỨNG DỤNG CỦA NHÔM 1 Làm dây dẫn điện 2
Chế tạo máy bay, ô tô, xe lửa .... 3
Làm dụng cụ gia đình: nồi xoong,...
Hướng dẫn giải bài tập TÍNH CHẤT CỦA NHÔM ỨNG DỤNG CỦA NHÔM 1 Tính dẫn điện Làm dây dẫn điện
2 Nhẹ, có tính dẻo, dễ dát mỏng
Chế tạo máy bay, ô tô, xe lửa .... 3 Dẫn nhiệt tốt
Làm dụng cụ gia đình: nồi xoong,...
Bài 2 SGK Hóa 9 trang 58
Thả một mảnh nhôm vào các ống nghiệm chứa các dung dịch sau:
a) MgSO4; b) CuCl2; c) AgNO3; d) HCl.
Cho biết hiện tượng xảy ra. Giải thích và viết phương trình hoá học.
Hướng dẫn giải bài tập
a) Không có phản ứng, vì Al hoạt động hóa học kém hơn Mg, không đẩy được magie ra khỏi muối.
b) Có chất rắn màu đỏ bám vào lá nhôm, màu xanh lam của dung dịch nhạt dần.
Vì Al hoạt động mạnh hơn Cu, nên đẩy đồng ra khỏi dung dịch muối, tạo thành
Cu (màu đỏ) bám vào lá nhôm.
2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
c) Có chất rắn màu trắng bám vào lá nhôm. Vì Al hoạt động hóa học mạnh hơn
Ag, nên đẩy bạc ra khỏi muối, tạo thành Ag (màu trắng) bám vào lá nhôm.
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓
d) Có khí thoát ra, nhôm bị hòa tan dần. Vì nhôm đứng trước hiđro nên phản
ứng với axit HCl, tạo thành muối nhôm clorua, tan và giải phóng khí hiđro.
2Al + 6HCl → 2AlCl3 + 3H2↑
Bài 3 SGK Hóa 9 trang 58
Có nên dùng xô, chậu, nồi nhôm để đựng vôi, nước vôi tôi hoặc vữa xây dựng không? Hãy giải thích.
Hướng dẫn giải bài tập
Không nên. Vì vôi, nước vôi hoặc vữa xây dựng đều có chứa Ca(OH)2 là chất
kiềm, chất này sẽ phá hủy dần các đồ vật bằng nhôm do có xảy ra các phản ứng.
Al2O3 + Ca(OH)2 →Ca(AlO2)2 + H2O
2Al + Ca(OH)2 + H2O →Ca(AlO2)2 + 3H2
Bài 4 SGK Hóa 9 trang 58
Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để
làm sạch muối nhôm? Giải thích và viết phương trình hoá học.
a) AgNO3; b) HCl; c) Mg; d)Al; e) Zn.
Hướng dẫn giải bài tập
Để làm sạch muối nhôm, ta phải loại bỏ đồng ra khỏi dung dịch và không đưa tạp chất khác vào.
Chất đó là nhôm, vì Al hoạt dộng hóa học mạnh hơn Cu, đẩy đồng ra khỏi dung
dịch, tạo thành đồng kim loại Cu. 2Al + 3CuCl2 → 2AlCl3 + 3Cu
Bài 5 SGK Hóa 9 trang 58
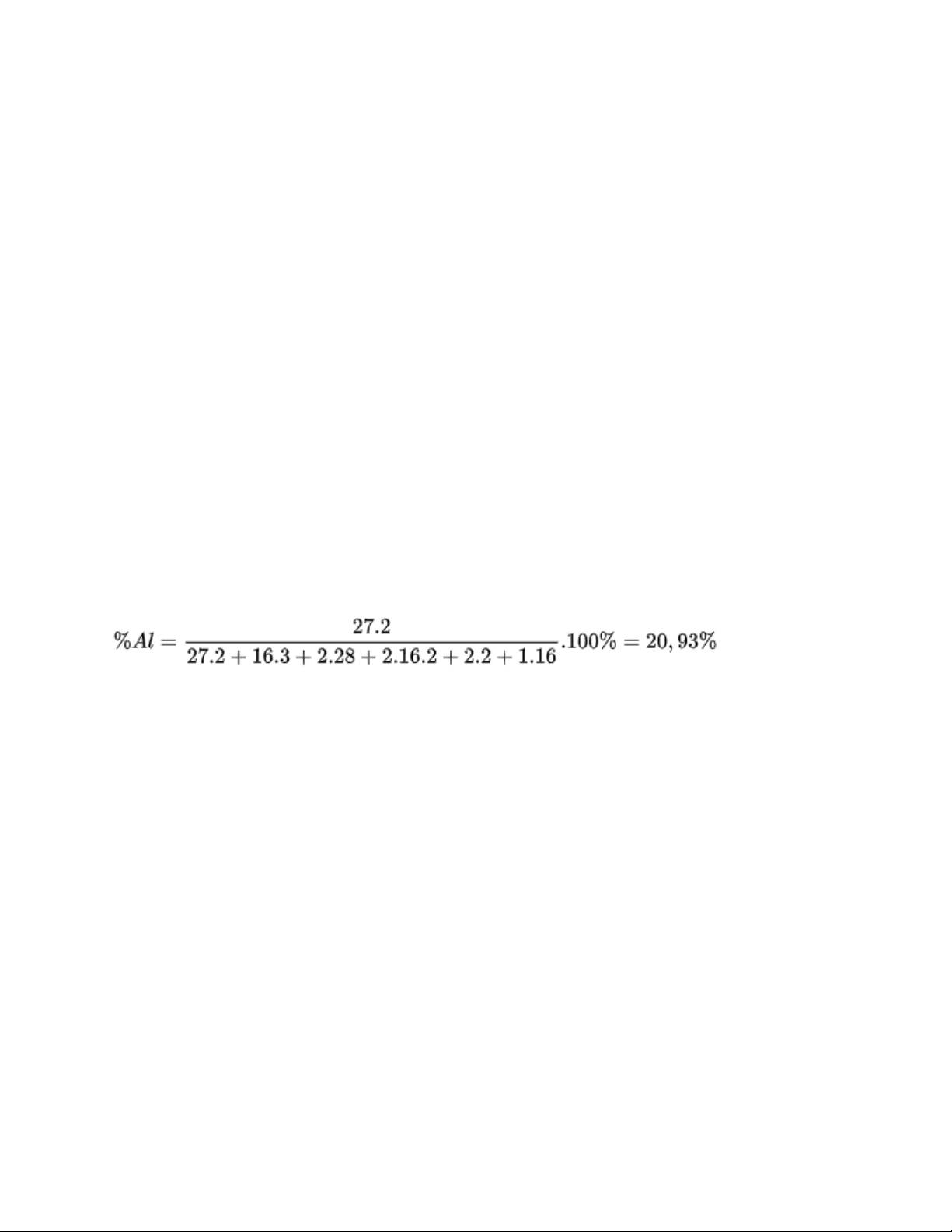
Thành phần hoá học chính của đất sét là: Al2O3. 2SiO2.2H2O. Hãy tính phần trăm
khối lượng của nhôm trong hợp chất trên.
Hướng dẫn giải bài tập
Bài 6 SGK Hóa 9 trang 58
Để xác định thành phần phần trăm khối lượng của hỗn hợp A gồm bột nhôm và
bột magie, người ta thực hiện hai thí nghiệm sau:
Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng hết với dung dịch H2SO4 loãng dư,
thu được 1568 ml khí ở điều kiện tiêu chuẩn.
Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư, sau
phản ứng thấy còn lại 0,6 gam chất rắn.
Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Hướng dẫn giải bài tập
Ở thí nghiệm 2: Chỉ có Al tác dụng với dung dịch NaOH và bị hòa tan hết vì NaOH dư.
Chất rắn còn lại là Mg = 0,6 gam hay = 0,6 : 24 = 0,025 mol
Ở thí nghiệm 1: Số mol H2 = 1,568 : 22,4 = 0,07 mol. Gọi x là số mol Al. Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 x → 1,5x (mol) Mg + H2SO4 → MgSO4 + H2 0,025 → 0,025 (mol)
Theo hiđro, ta có: 1,5x + 0,025 = 0,07 => x = 0,03 mol = nAl
Khối lượng của hỗn hợp: m = mMg + mAl = 0,6 + 0,03.27 = 1,41 gam
%Mg = 0,6.1,41 x 100% = 42,55%; %Al = 100% – 42,55% = 57,45%.
C. Giải SBT Hóa 9 bài 18
VnDoc hướng dẫn giải bài tập sách bài tập Hóa 9 bài 18 tại: Giải Sách bài tập Hóa học 9 bài 18: Nhôm
D. Bài tập Hóa 9 bài 18
Câu 1. Dãy nào dưới đây gồm các dung dịch muối tác dụng được với kim loại Mg? A. ZnCl2, Fe(NO3)2 và CuSO4 B. CaCl2, NaCl và Cu(NO3)2 C. CaCl2, NaNO3 và FeCl3 D. Ca(NO3)2, FeCl2 và CuSO4
Câu 2. Để làm sạch dung dịch muối Cu(NO3)2 có lẫn muối AgNO3, có thể dùng kim loại nào sau đây? A. Mg B. Ag C. Cu D. Fe
Câu 3. Dãy gồm các kim loại phản ứng được với H2SO4 loãng A. Al, Fe và Cu B. Al, Zn và Fe C. Zn, Cu và Ag D. Zn, Al và Cu
Câu 4. Dãy kim loại phản ứng được với nước ở nhiệt độ thường A. Na, Fe, K B. Na, K, Li C. Na, Li, Mg D. Na, li, Fe
Câu 5. Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch NaOH B. H2O và dung dịch HCl C. Dung dịch NaOH và H2O D. Dung dịch CuCl2 và H2O




