









Preview text:
Lớp Chào Các Em 10 CÁC HOẠT ĐỘNG 3 1 4 2 HÌNH THÀNH LUYỆN VẬN DỤNG KHỞI KIẾN THỨC TÌM TÒI TẬP ĐỘNG KHỞI ĐỘNG KHỞI Đ I Đ ỘNG
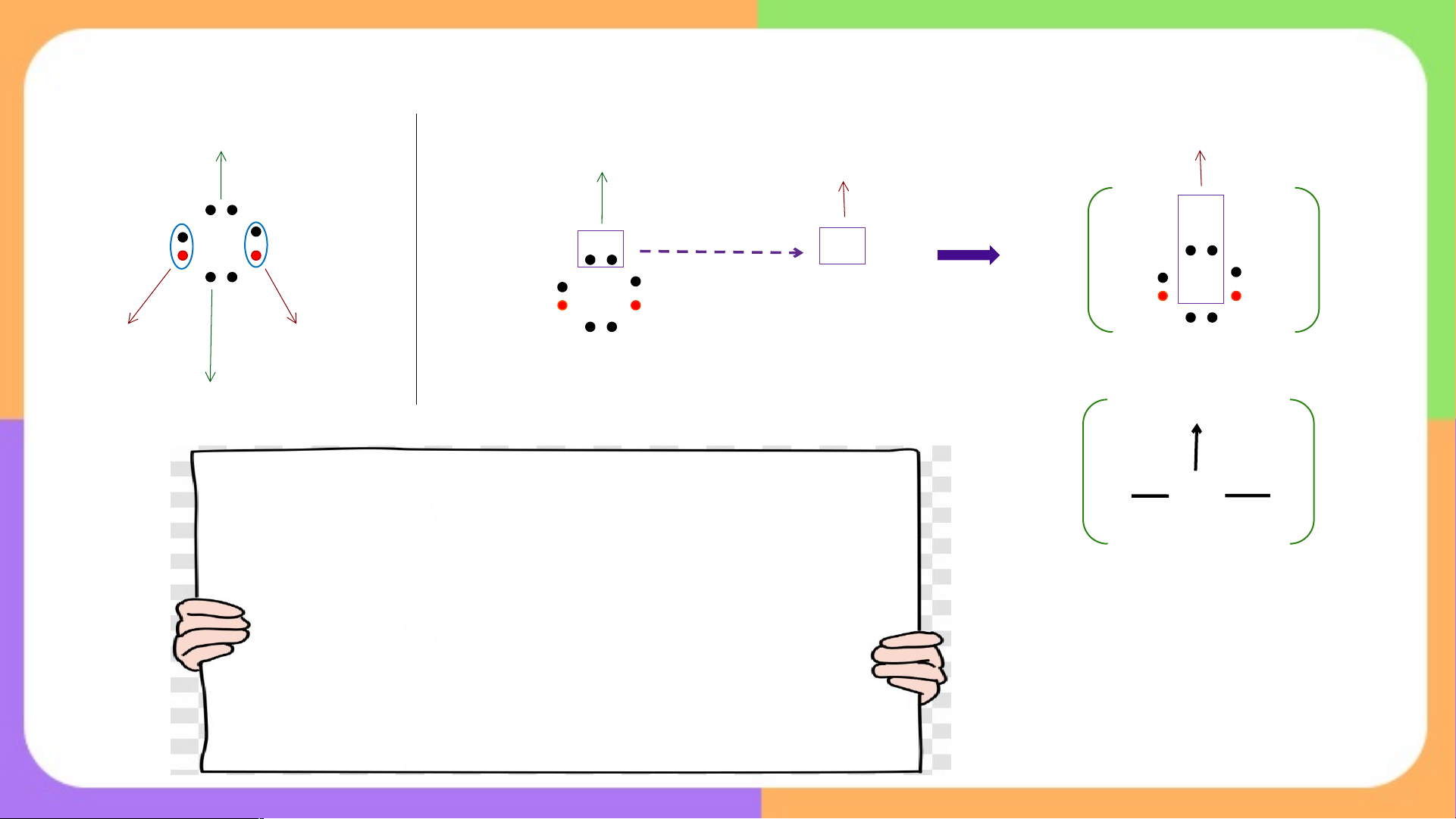
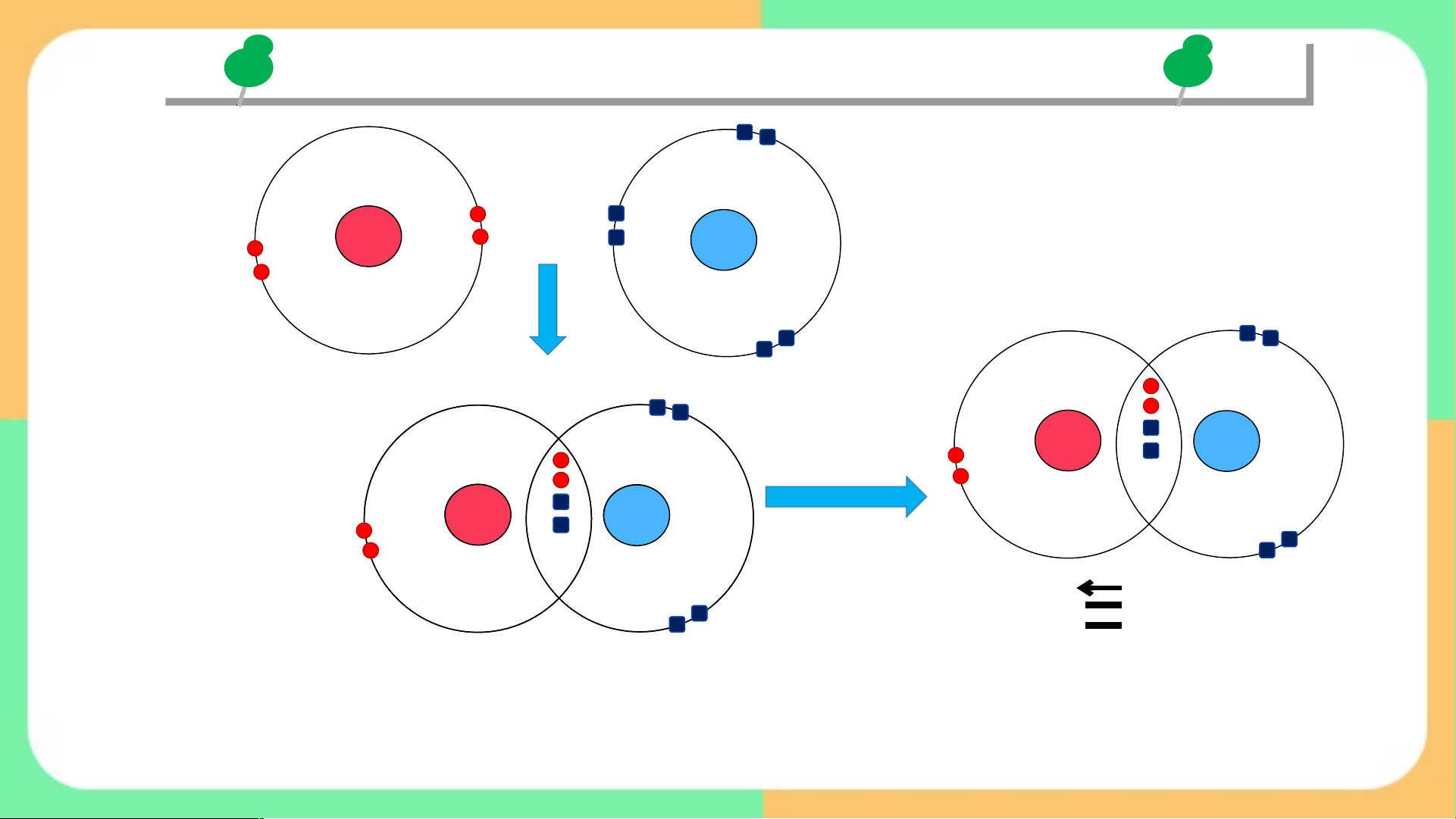
Đề xuất những cách thức khác nhau để
các nguyên tử tham gia liên kết có thể tạo
được cặp electron dùng chung ? ĐÁP Á Á N
Để có được đôi electron dùng chung, các nguyên tử tham gia liên kết có thể
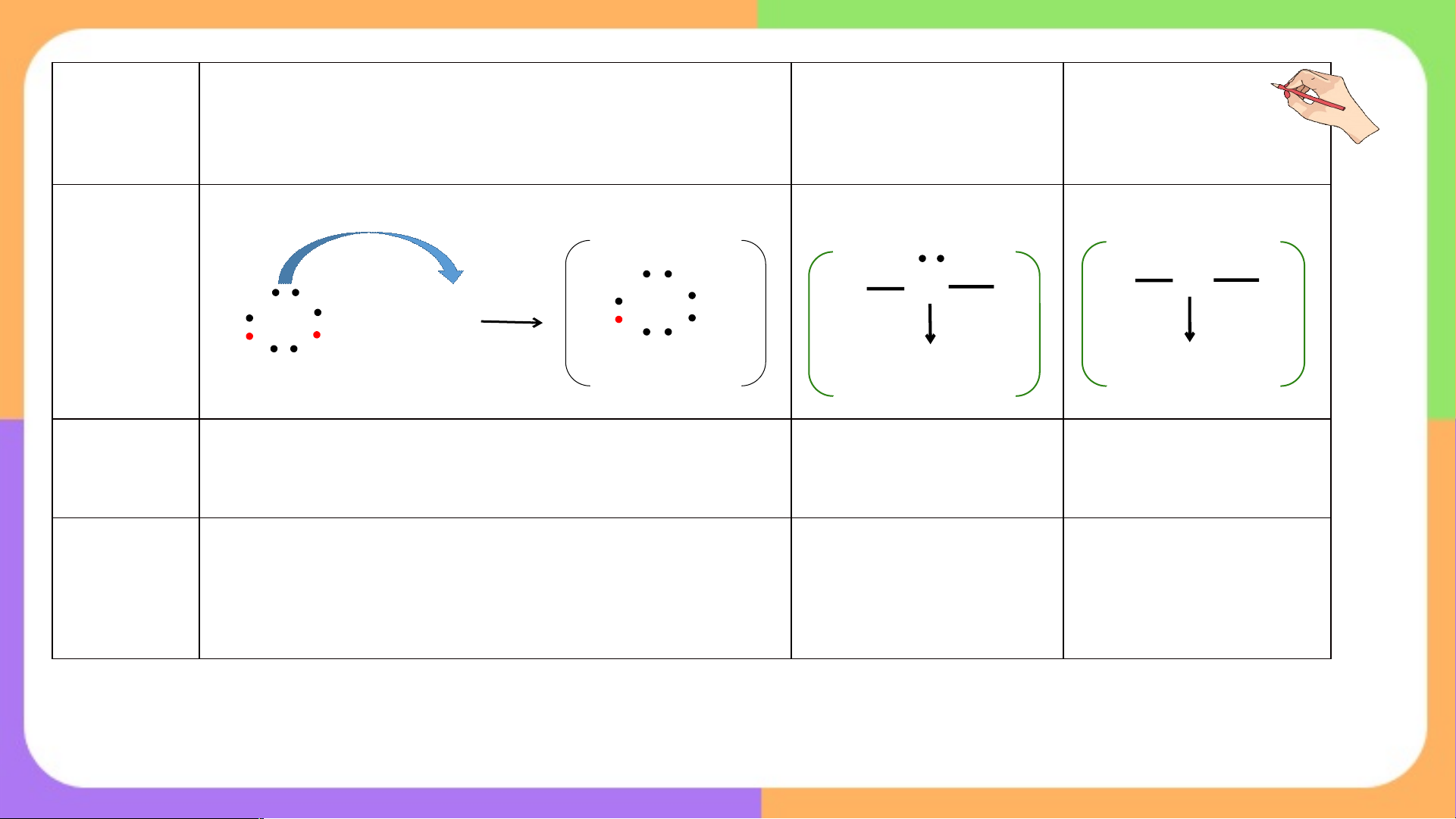
Liên kết cộng hóa trị Cách 1 A e e B
Mỗi nguyên tử đưa ra số electron độc thân bằng nhau để góp chung e Cách 2 X e Y Liên kết cho nhận
Một nguyên tử đưa ra đôi electron của nó và dùng chung với nguyên
tử còn lại → Liên kết cho - nhận (liên kết phối trí) BÀI 10
LIÊN KẾT CỘNG HÓA TRỊ
Tiết 3,4. LIÊN KẾT CHO – NHẬN. PHÂN BIỆT
CÁC LOẠI LIÊN KẾT DỰA VÀO ĐỘ ÂM ĐIỆN HOẠT
HÌNH THÀNH KIẾN THỨC ĐỘNG PHT số 1
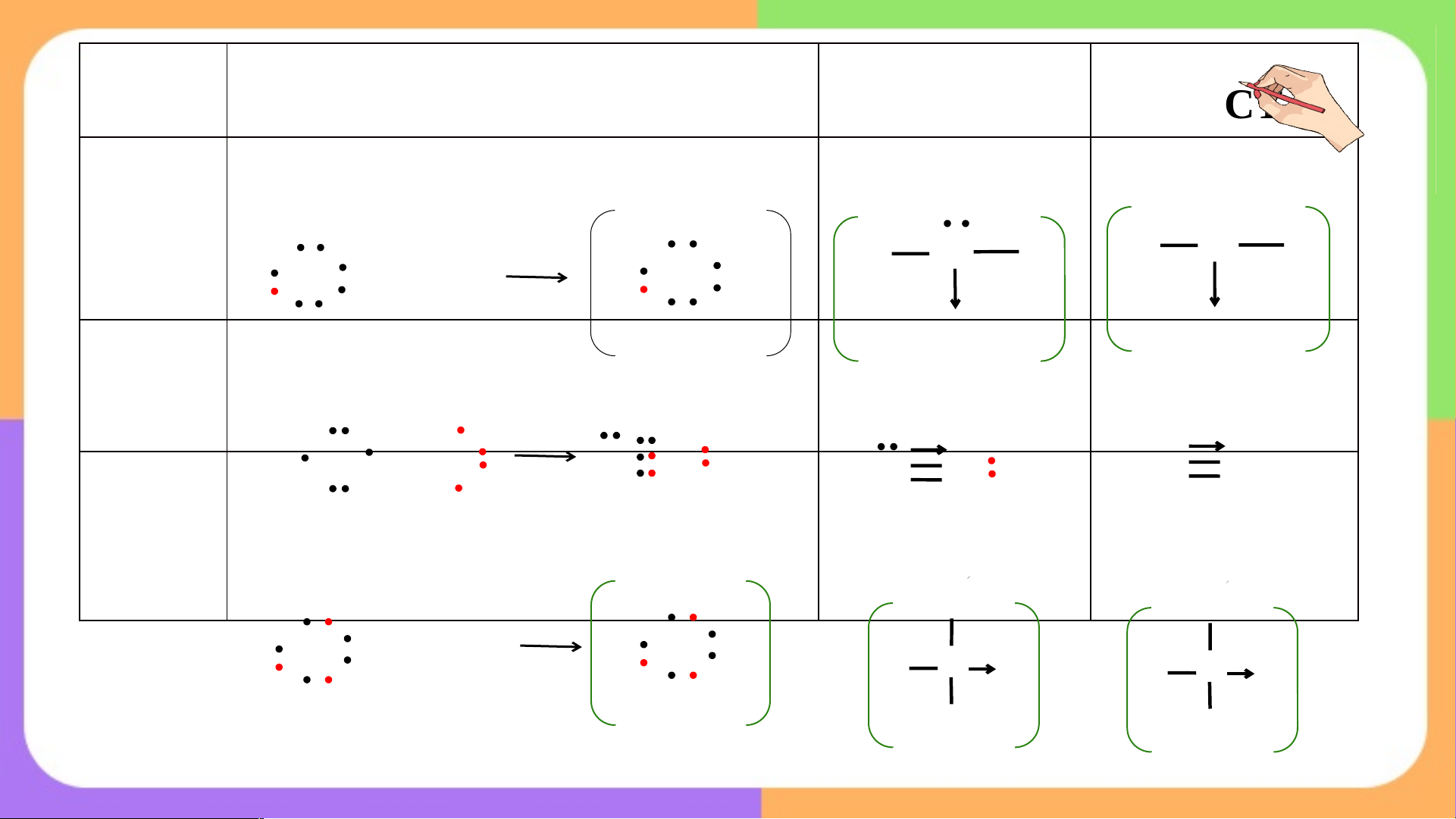
Câu 1: Đọc ví dụ 1 trang 61 SGK, xem hình 10.4, từ đó hãy
cho biết các nguyên tử tham gia liên kết cần thỏa điều kiện gì
để tạo được liên kết cho – nhận?
Câu 2: Viết công thức electron, CTCT của H O+, CO, NH + biết 3 4
chúng có liên kết cho – nhận?
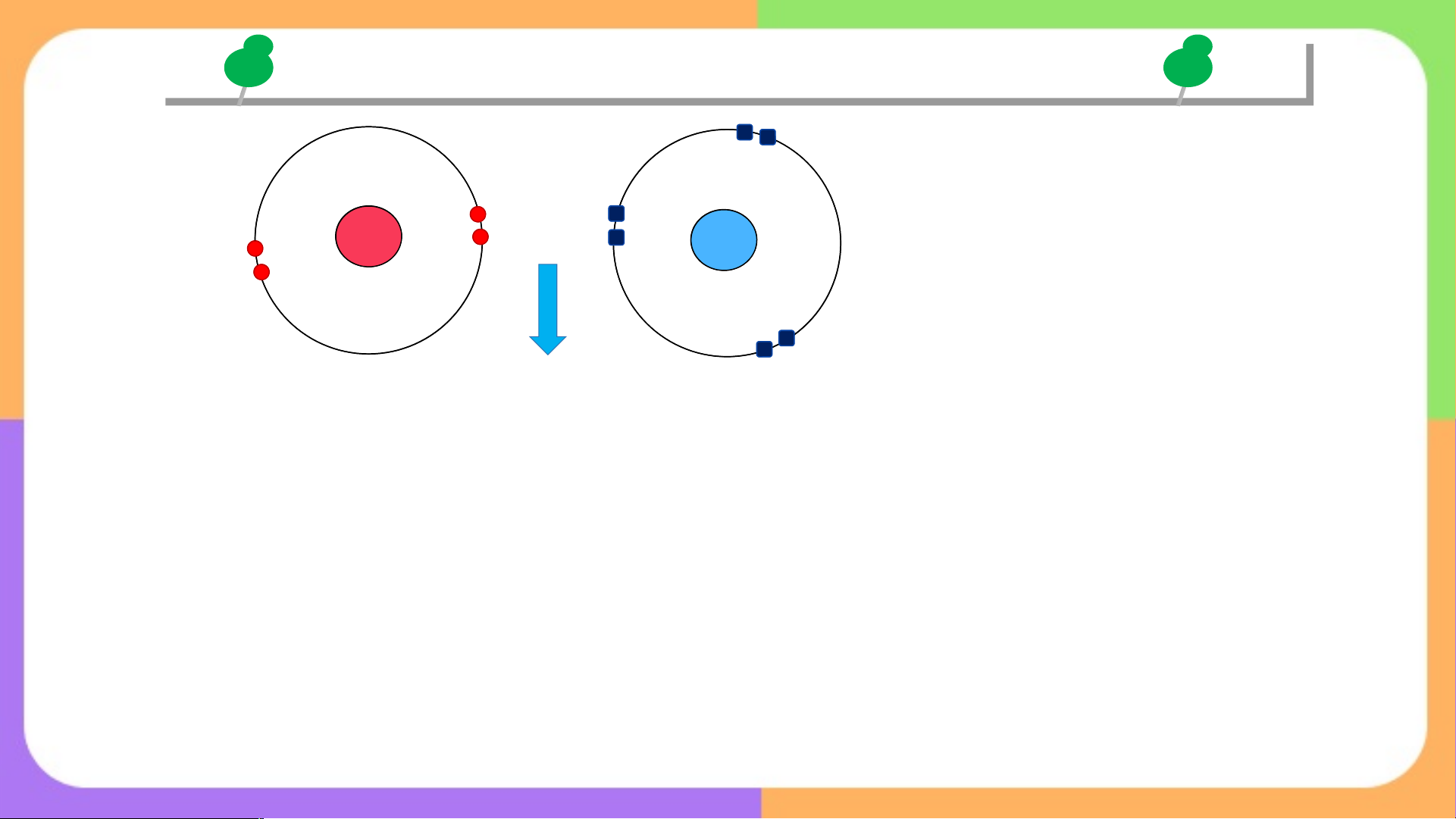
THẾ NÀO LÀ LIÊN KẾT CHO NHẬN cặp e chưa LK cặp e chưa LK LK cho nhận orbital trống + H O H H H O H H+ H O H cặp e LK cặp e LK cặp e chưa LK H +
- Điều kiện tạo liên kết cho – nhận: H O H
Trong phân tử, nguyên tử “cho” phải có
cặp electron chưa tham gia liên kết, Hydronium ion
nguyên tử “nhận” phải có obital trống.
- Biểu diễn liên kết cho – nhận: dấu
mũi tên hướng từ nguyên tử “cho” sang nguyên tử “nhận”
BÀI 10- LIÊN KẾT CỘNG HÓA TRỊ
II. LIÊN KẾT CHO – NHẬN 1. Khái niệm
Liên kết cho – nhận là trường hợp đặc biệt của liên kết cộng hóa trị, trong đó
cặp electron chung chỉ do một nguyên tử đóng góp.
2. Điều kiện tạo liên kết cho – nhận
Trong phân tử, nguyên tử “cho” phải có cặp electron chưa tham gia liên
kết, nguyên tử “nhận” phải có obital trống.
3. Biểu diễn liên kết cho – nhận
Dấu mũi tên hướng từ nguyên tử “cho” sang nguyên tử “nhận” Phân Công thức
tử/ ion Sự hình thành liên kết – CT e CTCT Lewis + + + H O H H O H H O+ O H H + H+ H O H 3 H H H CT e CO NH + 4 SỰ HÌNH THÀNH L L IÊN KẾT C C O 4 electron 6 electron C O SỰ HÌNH THÀNH L L IÊN KẾT C C O 6 electron 4 electron C O Quy tắc Quy tắc octet octet C O C O 6 electron 8 electron C O
1 LK đôi CHT, 1LK cho - nhận Phân Công thức
tử/ ion Sự hình thành liên kết – CT e Lewis CTCT + + + + H O H H O H H O+ H O H + H H O H 3 H H H CT e CO O + C O C O C O C CT e NH + 4 H H + H H + + + H N + H H N H H N H H N H H H H H PHT số 2
Câu 1: Độ âm điện đặc trưng cho khả năng gì của nguyên tử đó ?
Câu 2: Vì sao các phân tử Cl , O , N có liên kết CHT không phân cực; 2 2 2
các phân tử HCl, NH , CO có liên kết CHT phân cực? 3 2
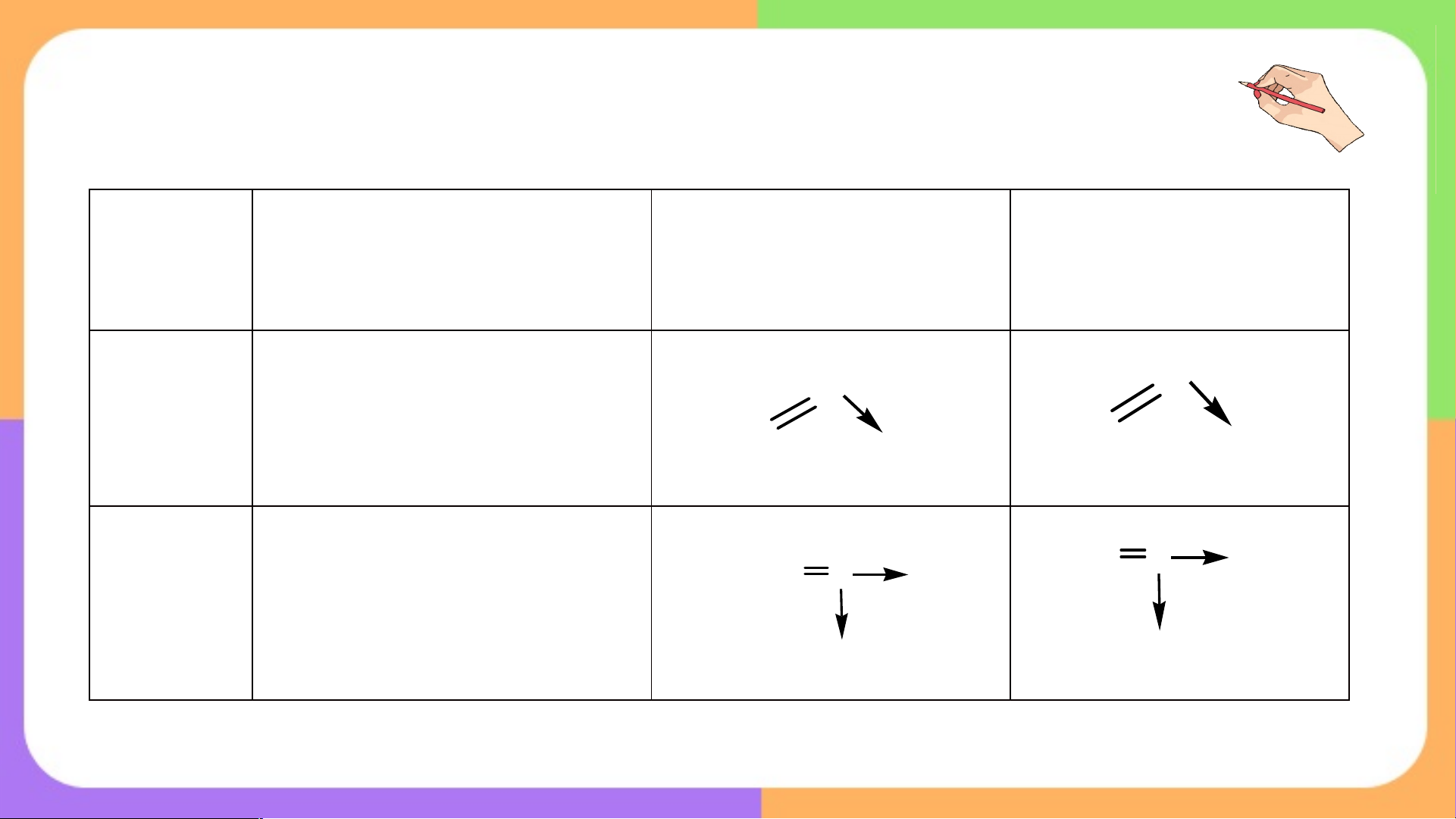
Câu 3. Hoàn thành bảng sau Liên kết CHT Liên kết CHT Liên kết ion không phân cực phân cực Hiệu độ âm điện Đặc điểm Ví dụ
Độ âm điện đặc trưng cho khả năng
hút electron của nguyên tử đó khi
tham gia tạo liên kết → Nguyên tử có
độ âm điện càng lớn → hút (kéo) electron càng mạnh.
• Trong các phân tử Cl , N , O 2 2 2
liên kết cộng hóa trị được tạo bởi
các nguyên tử giống nhau (Có
cùng độ âm điện) → đôi electron
chung nằm giữa 2 nguyên tử (không
bị lệch về nguyên tử nào) → Liên
Câu 1: Độ âm điện
kết CHT không phân cực. đặc trưng cho khả
•Trong phân tử HCl, NH , CO : 3 2 năng gì của nguyên
các đôi electron chung đều bị lệch 1 2
về phía nguyên tử có độ âm điện lớn E 0 tử ? E 0 G G
hơn → Liên kết CHT phân cực. PA PA
4. Hiệu độ âm điện (Dc) và loại liên kết tương ứng Liên kết CHT Liên kết CHT Liên kết ion không phân phân cực cực Hiệu độ âm điện 0 ≤ Dc< 0,4 0,4 ≤ Dc< 1,7 Dc³1,7 Đôi electron Đôi electron Các nguyên tử
chung không bị chung bị lệch về cho và nhận hẳn Đặc điểm lệch về phía
phía nguyên tử có electron tạo ion nguyên tử nào
độ âm điện lớn dương và ion âm. hơn Các ion trái dấu hút nhau. Ví dụ
Cl , O , N , CH , HCl, NH , CO , MgO, NaCl, K O, 2 2 2 4 3 2 2 … … L Y N U Ệ T P Ậ PHT số 3
Câu 1: Viết CT electron, CT Lewis, CTCT của SO , SO biết 2 3
chúng có liên kết cho – nhận.
Câu 2: Dựa vào bảng độ âm điện của các nguyên tử 6.1/44
SGK, sắp xếp các phân tử HBr, CaCl , C H , H , MgO theo 2 2 6 2
trình tự tăng dần của sự phân cực liên kết? Chỉ rõ từng loại liên
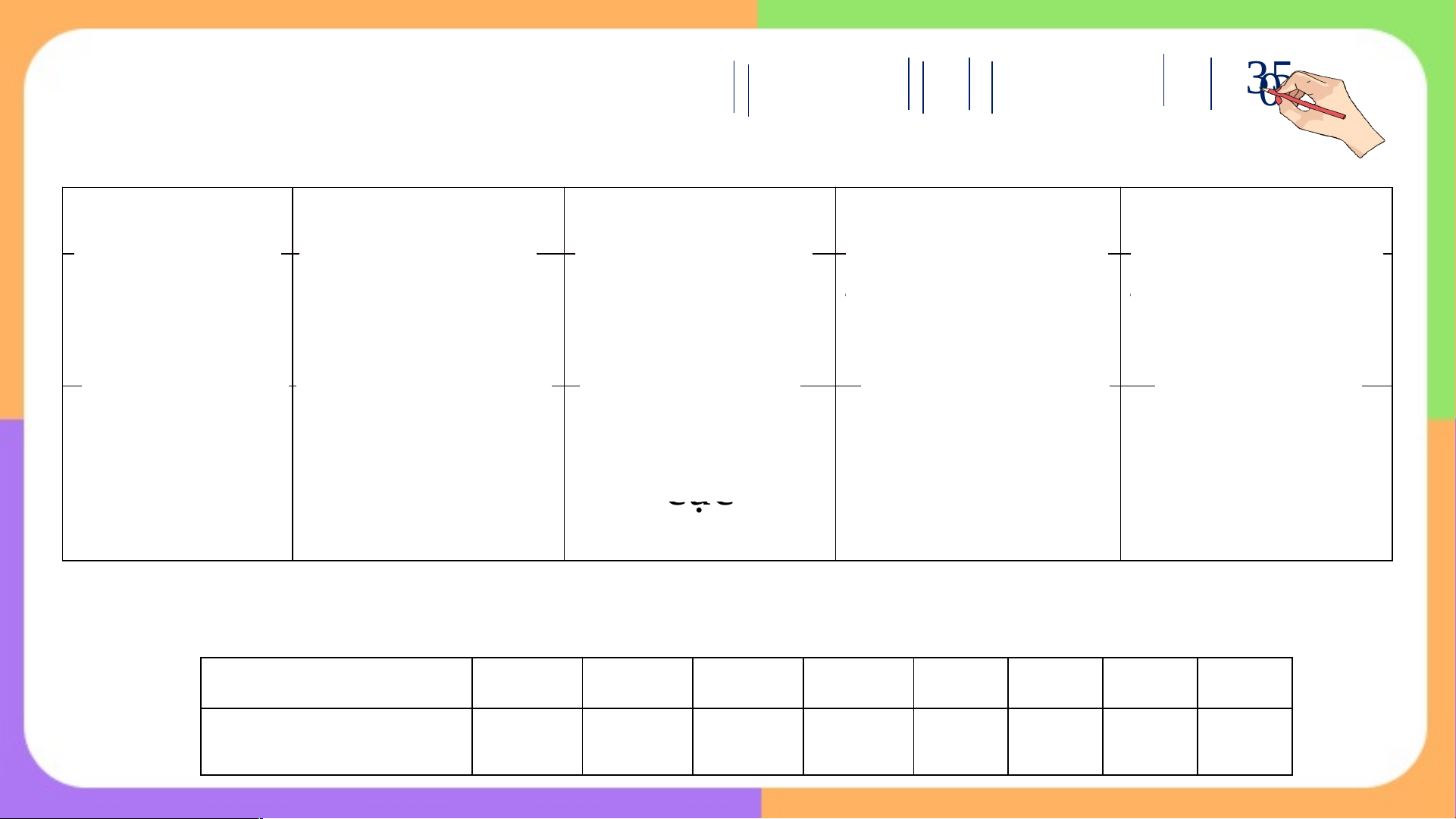
kết trong các phân tử đó? Câu 1: CTPT CT electron CT Lewis CTCT .. .. .. S . .. . S S SO . . . .. 2 ..O O .. . .. ..O.. .O . .. O O .. . . .. .. O ... S . .. .. .. .. O S O S O .. .. O SO .. O .. 3 ..O.. .. ..O.. .. O C H Δχ Δχ == χ - χ = 2, - = 5 2,5 - 2 5 ,2 - 2 = 0,35 ,55 = 0 2 4 C -H C- C Câu 2: CC HC H C H HBr MgO CaCl 2 2 4 2 Δχ = 0 Δχ = 0,35 Δχ = 0,76 Δχ = 2,13 Δχ = 2,16 H-H C-H H-Br Mg-O Ca-Cl Δχ = 0 C-C CHT CHT không CHT phân Ion Ion không cực phân cực phân cực
Độ phân cực tăng dần: H < C H < HBr < MgO < CaCl 2 2 4 2 Nguyên tố Br O C H Mg Ca F Cl Độ âm điện 2,96 3,44 2,55 2,2 1,31 1,00 3,98 3,16 VẬN DỤNG
Sodium chloride (NaCl) tan được trong nước hay trong dầu hoả ? Giải thích ? DẶN DÒ Đọc trước mục:
4. Sự hình thành liên kết ϭ,
π và năng lượng liên kết Học và nắm
vững sự hình thành Làm BT 4 liên kết cho nhận (SGK – T66
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25




