











Preview text:
CHƯƠNG 3: LIÊN KẾT HOÁ HỌC
BÀI 11. LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC
VAN DER WAALS (tiết 1) I. MỞ ĐẦU
Hãy quan sát đoạn video sau và cho biết hiện tượng đặc biệt có trong video là gì ? Và giải
thích hiện tượng đó ?
Hãy quan sát đoạn video sau và cho biết hiện tượng đặc biệt có trong video là gì ? Và giải thích hiện tượng đó ?
Tại sao nhện nước có thể di chuyển trên mặt nước? Lời giải chi tiết:
- Giữa các phân tử nước hình thành lực liên kết hydrogen
=> Liên kết hydrogen giữa các phân tử nước trên bề
mặt nước và giữa các phân tử nước trên bề mặt và lớp
nước bên dưới tạo ra sức căng bề mặt cho nước
- Chân của con nhện nước gồm các chất kị nước
(không phân cực), phân tử các chất nảy đẩy nước khiến
cho chân của nhện nước không bị nước bao bọc và tụt
xuống dưới nước. Vì vậy chúng có thể di chuyển trên
bề mặt nước mà không làm vỡ bề mặt nước CÂU HỎI ĐẦU BÀI
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận
electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử
dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một
loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
II. LIÊN KẾT HYDROGEN
H:Giữa liên kết S–H và liên kết O–H, liên kết nào phân cực mạnh hơn? Vì sao? TRẢ LỜI
Nguyên tử bị thiếu bao nhiêu electron thì bỏ ra bấy nhiêu electron để góp chung
electron với các nguyên tử khác => Đạt cấu hình eleectron bền vững của khí hiếm Ví dụ:
- Nguyên tử O cần nhận thêm 2 electron => Bỏ ra 2 electron để góp chung
- Nguyên tử Cl và H cần nhận thêm 1 electron => Mỗi nguyên tử bỏ ra 1 electron để góp chung
- Nguyên tử N cần nhận thêm 3 electron => Bỏ ra 3 electron để góp chung
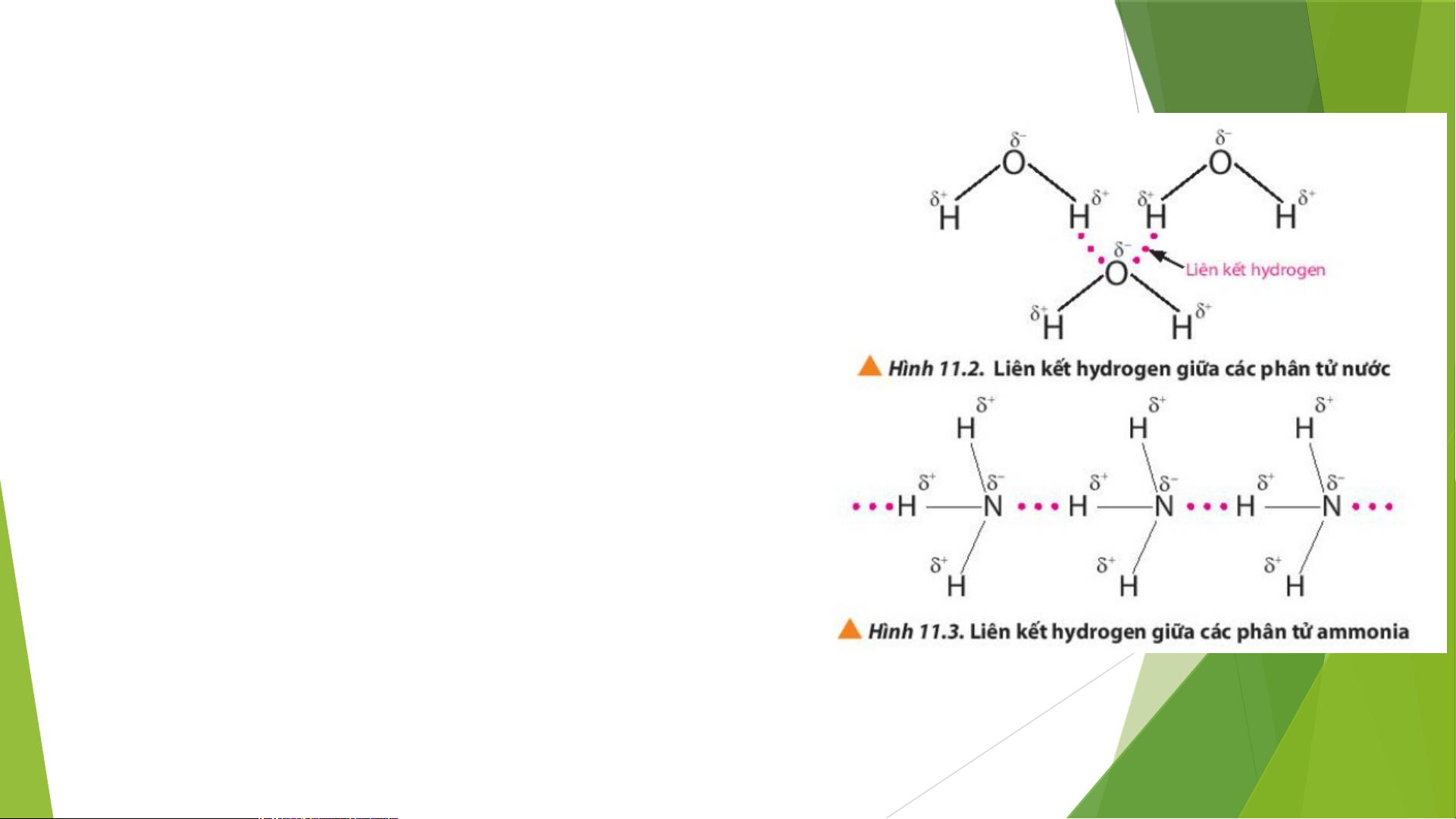
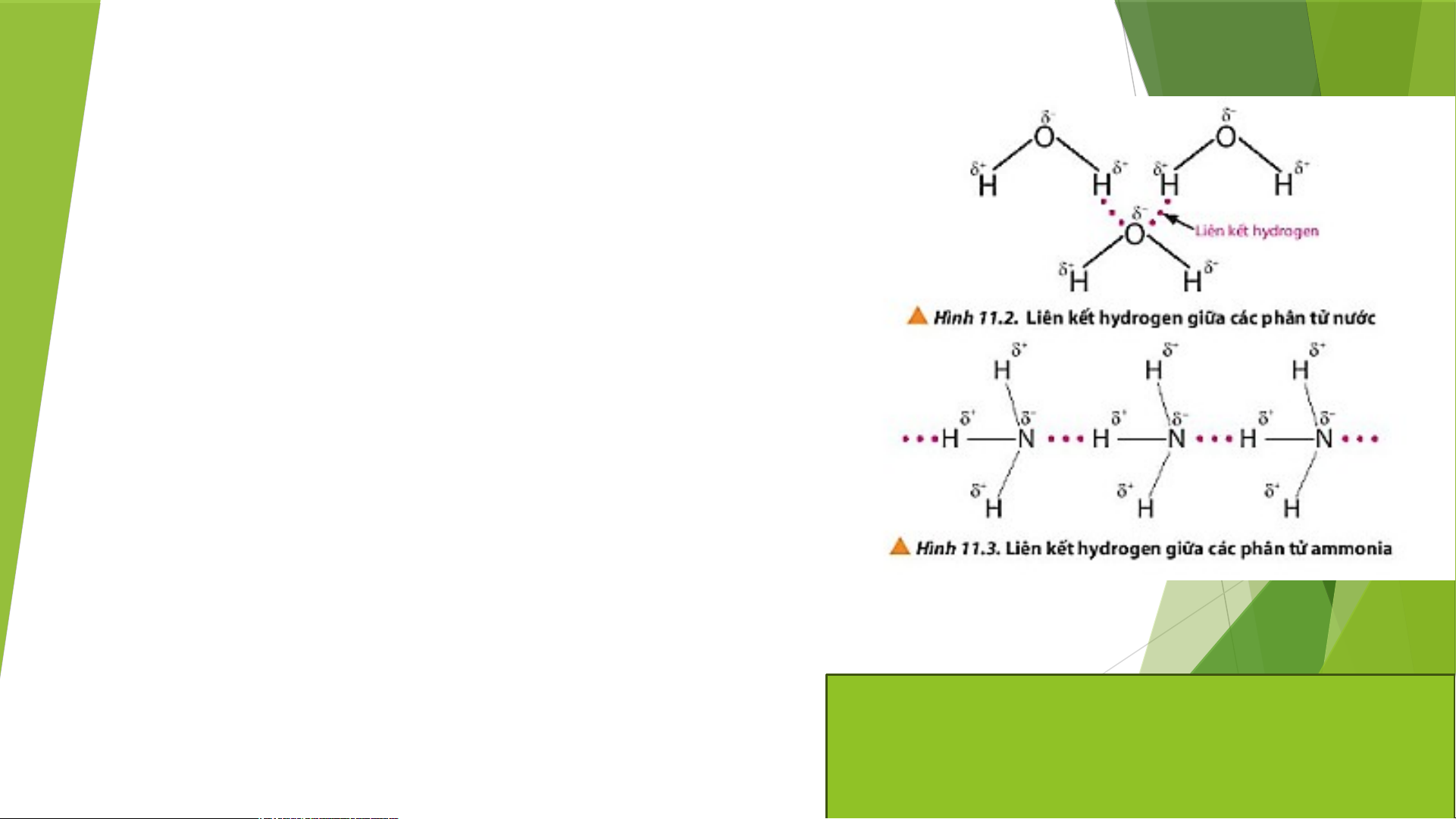
2. Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử?
->Liên kết hydrogen là một loại liên kết yếu, được hình
thành giữa nguyên tử H (đã liên kết với một nguyên tử
có độ âm điện lớn, thường là F, O, N) với một nguyên
tử khác có độ âm điện lớn (thường là F, O, N) còn cặp
electron hóa trị chưa tham gia liên kết
3. So sánh độ bền của liên kết hydrogen với liên kết
cộng hóa trị và liên kết ion
Liên kết hydrogen < Liên kết cộng hóa trị < Liên kết ion
II. LIÊN KẾT HYDROGEN
1. Tìm hiểu về liên kết hydrogen
-Liên kết hydrogen là một loại liên kết yếu, được
hình thành giữa nguyên tử H (đã liên kết với một
nguyên tử có độ âm điện lớn, thường là F, O, N)
với một nguyên tử khác có độ âm điện lớn (thường
là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
- Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử
có độ âm điện lớn như F, O, N,…
?Điều gì đã khiến H O có nhiệt độ sôi
+ Nguyên tử F, O, N,… liên kết với hydrogen 2 cao hơn H S? Giải thích
phải có ít nhất một cặp electron hóa trị chưa liên 2
H O có nhiệt độ sôi cao hơn H S do H O kết 2 2 2
có liên kết hydrogen liên phân tử còn
H S không có liên kết hydrogen 2
Tìm hiểu vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
So với các hợp chất có cấu trúc phân tử tương tự, các hợp
chất có liên kết hydrogen đều có nhiệt độ sôi cao hơn do
tạo được liên kết hydrogen liên phân tử và tan tốt hơn trong
nước do tạo được liên kết hydrogen với các phân tử nước.
Nước là một hợp chất có nhiệt độ nóng chảy và nhiệt độ
sôi cao hơn so với nhiều hợp chất có cùng cấu trúc phân tử
nhưng không tạo được liên kết hydrogen giữa các phân tử với nhau.
Ngoài ra, nước còn là một dung môi tốt, không chỉ hoà tan
được nhiều hợp chất ion, mà còn hoà tan được nhiều hợp
chất có liên kết cộng hoá trị phân cực. Đặc biệt, các hợp
chất có thể tạo liên kết hydrogen với nước thường tan tốt
trong nước. Hầu hết các phản ứng hoá học quan trọng đối
với sự sống đều diễn ra ở môi trường nước bên trong tế bào.
4. So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích Phương pháp giải:
- Liên kết hydrogen làm phân tử có nhiệt độ sôi cao và tan tốt trong nước Lời giải chi tiết:
- Phân tử NH có khả năng liên kết hydrogen liên phân tử do N có độ âm điện cao 3
- Phân tử CH không có khả năng liên kết hydrogen liên phân tử do C có độ âm điện 4 thấp
=> Phân tử NH có nhiệt độ sôi cao hơn và khả năng hòa tan trong nước tốt hơn soi 3 với CH4 Phương pháp giải:
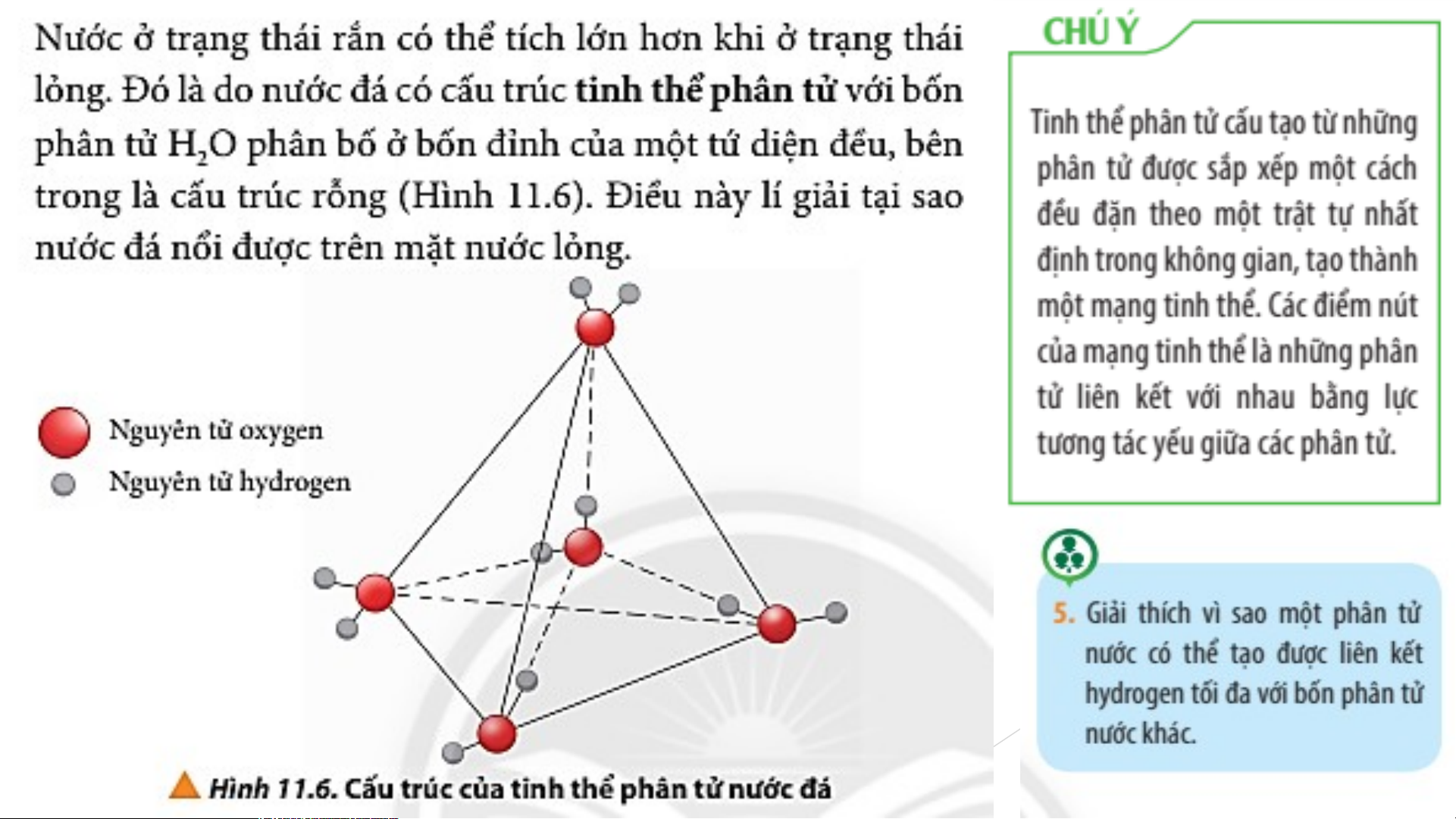
Phân tử nước có 2 H liên kết với O và O có 2 cặp electron hóa trị chưa tham gia liên kết Lời giải chi tiết:
- Trong phân tử nước có 2 nguyên tử H liên kết với O => 2 nguyên tử H này tham gia
liên kết hydrogen với 2 nguyên tử O của 2 phân tử nước khác
- Nguyên tử O còn 2 cặp electron hóa trị chưa tham gia liên kết => Mỗi cặp electron
hóa trị sẽ liên kết hydrogen với nguyên tử H của phân tử nước khác
=> Một phân tử nước có thể tạo được liên kết hydrogen tối đa với 4 phân tử nước
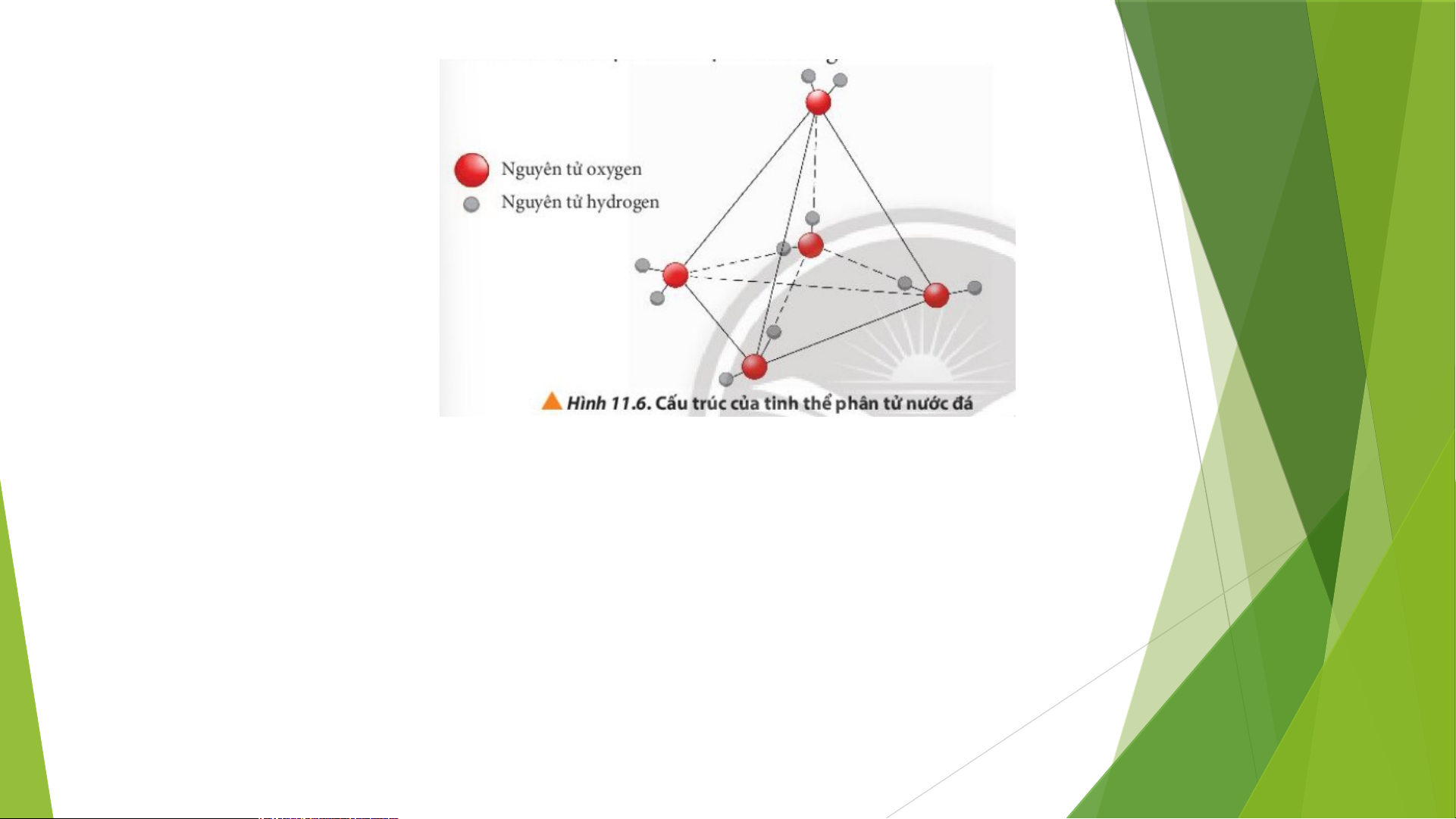
?Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh? Lời giải chi tiết:
Khi cho vào ngăn đá của tủ lạnh, nước chuyển thành trạng thái rắn có cấu trúc tinh thể
phân tử với 4 phân tử H O phân bố ở bốn đỉnh của một tứ diện đều, bên trong là rỗng 2 Lời giải chi tiết:
Khi cho vào ngăn đá của tủ lạnh, nước chuyển thành trạng thái rắn có cấu trúc tinh thể
phân tử với 4 phân tử H O phân bố ở bốn đỉnh của một tứ diện đều, bên trong là rỗng 2
2. Tìm hiểu vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
- Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước
II. Tương tác van der Waals
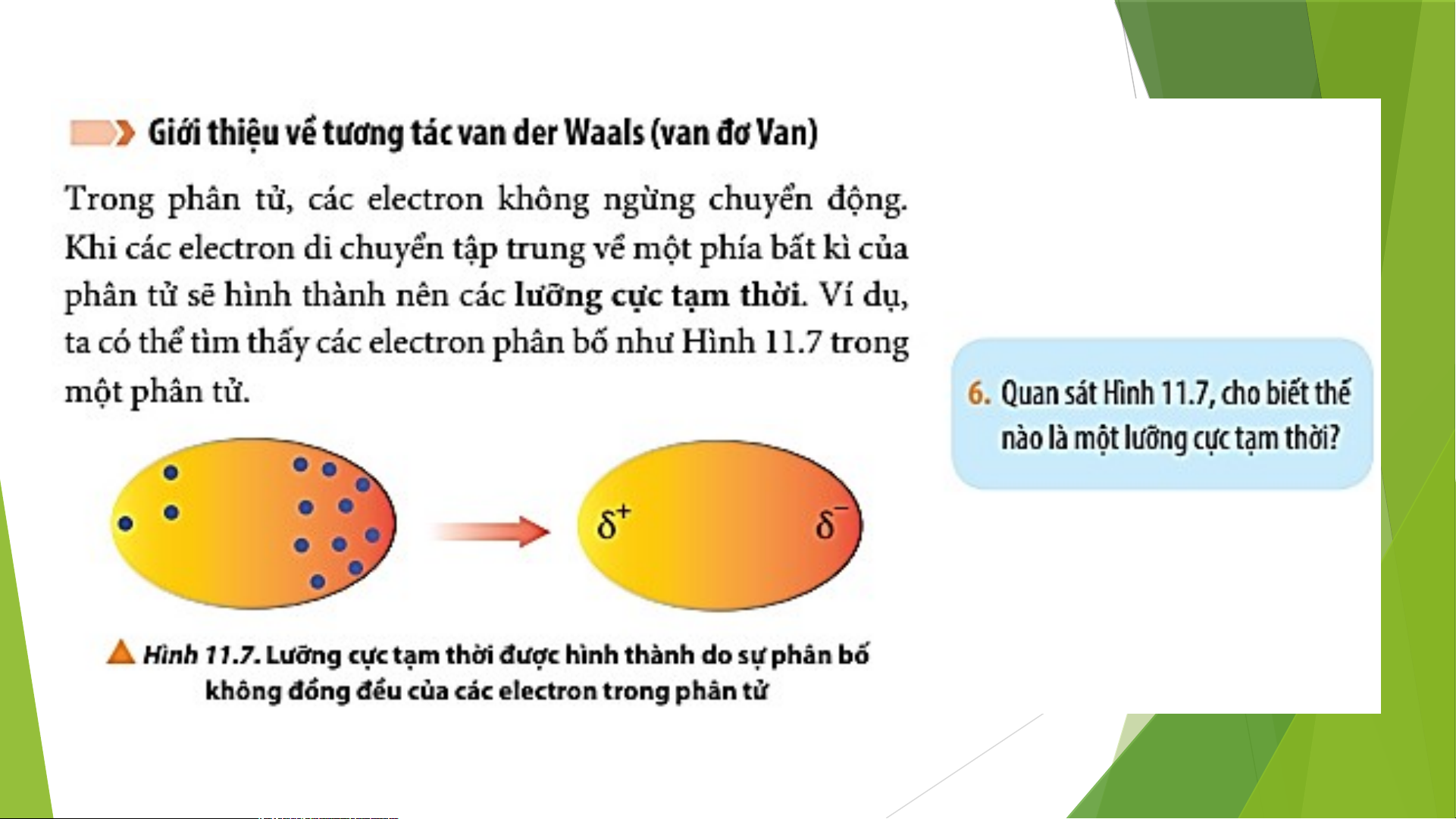
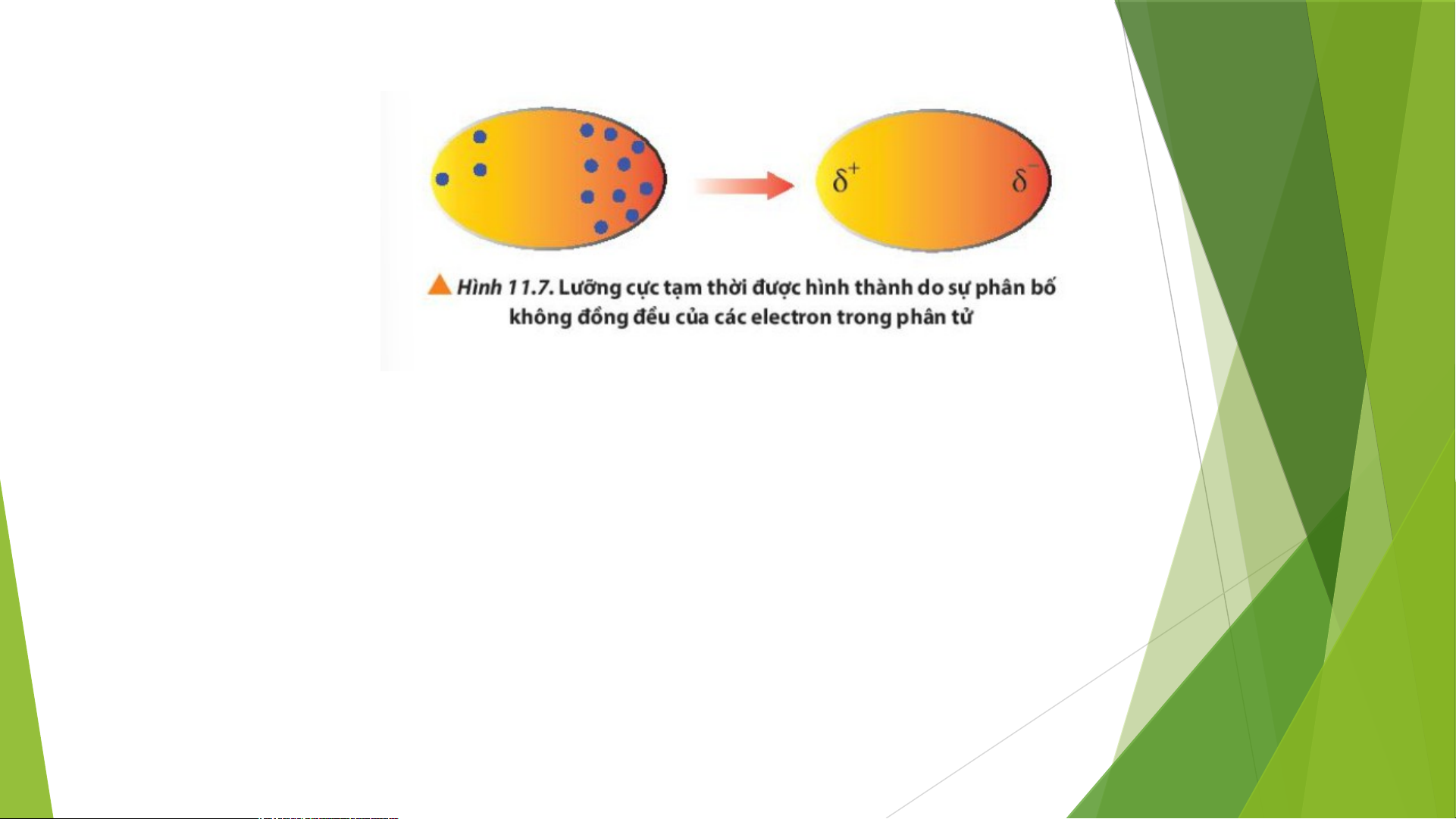
1. Giới thiệu về tương tác van der Waals (van đơ Van)
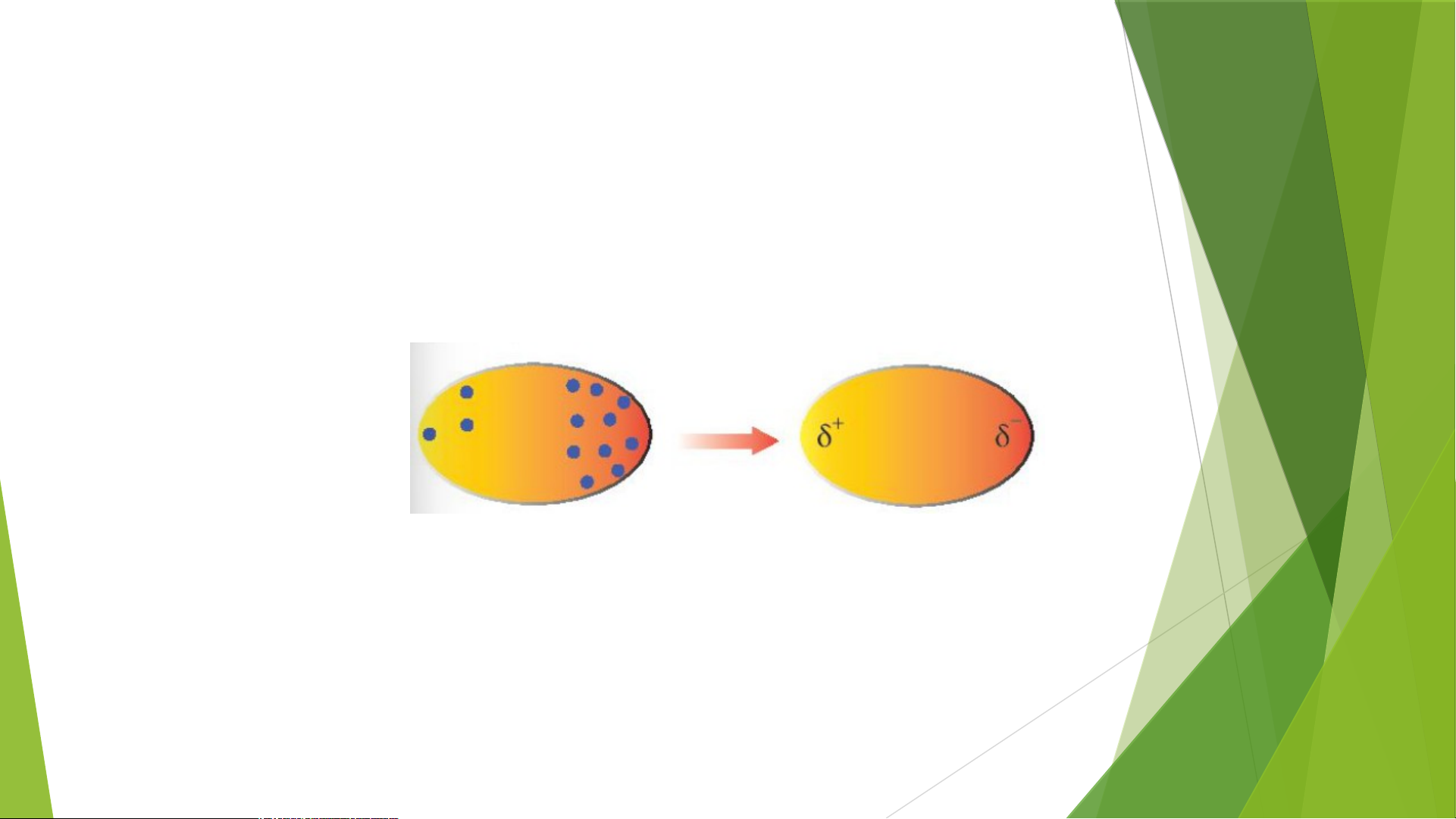
6. Quan sát Hình 11.7, cho biết thế nào là một lưỡng cực tạm thời? Lời giải chi tiết:
Trong phân tử, các electron chuyển động không ngừng
=> Khi các electron di chuyển tập trung về một phía bất kì của phân
tử sẽ hình thành nên các lượng cực tạm thời, bên nào tập trung
nhiều electron hơn thì mang điện tích âm và ngược lại
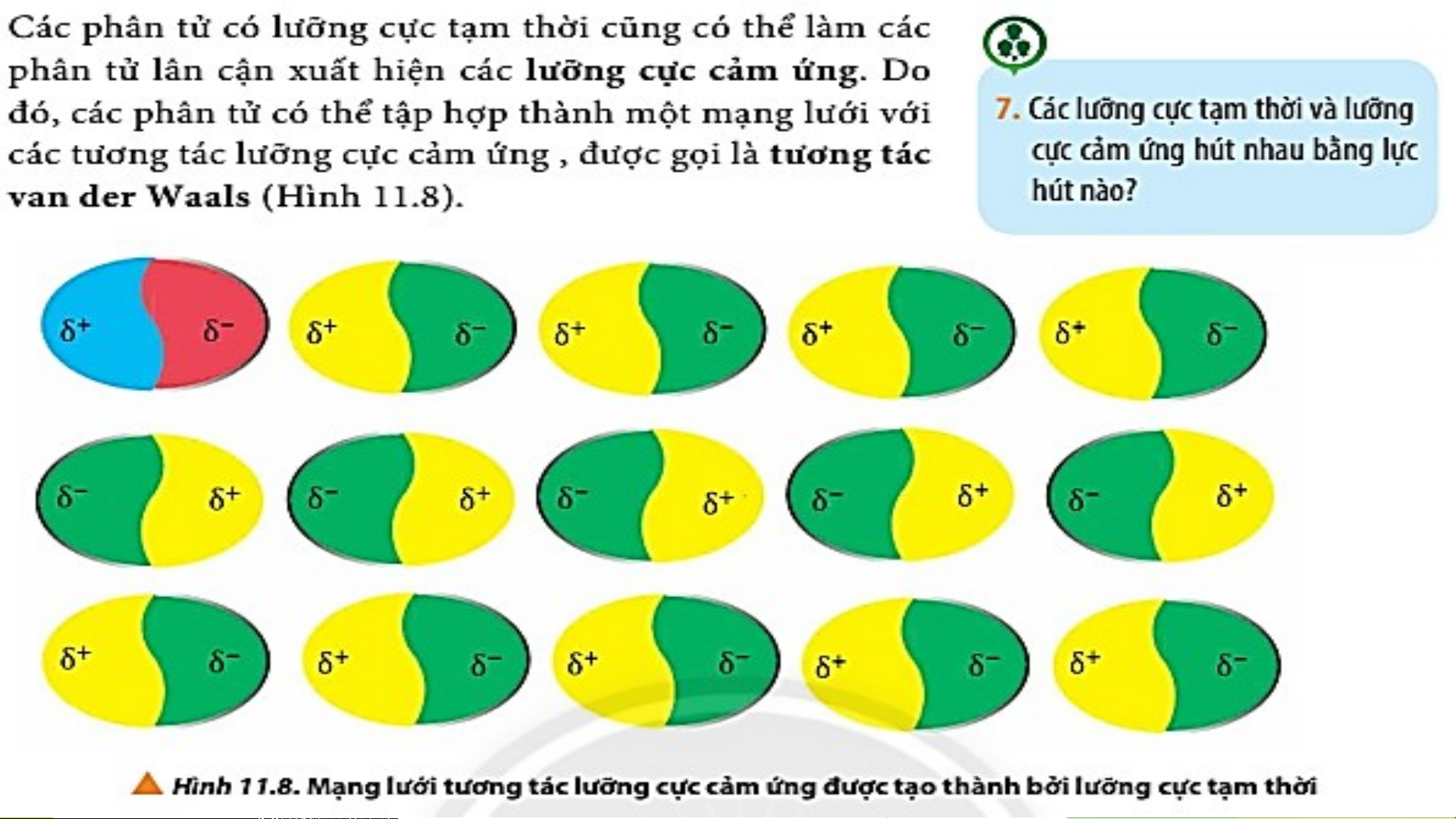
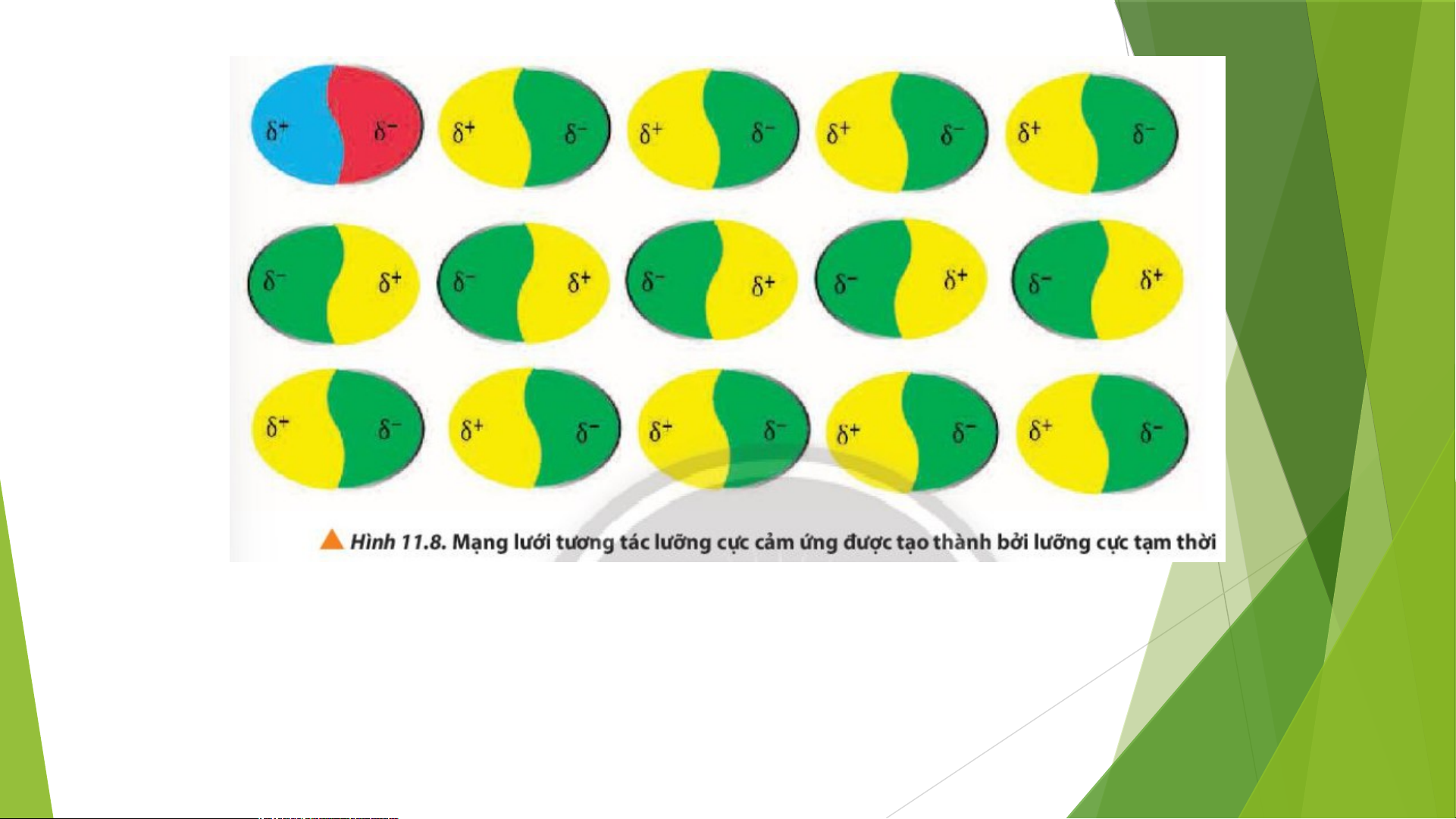
7. Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
-> Các lưỡng cực tạm thời và lưỡng cực cảm ứng
hút nhau bằng lực ngược dấu
III. Tương tác van der Waals
1. Giới thiệu về tương tác van der Waals (van đơ Van)
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử - Bản chất:
+ Trong phân tử, các electron không ngừng chuyển động. Khi các electron di chuyển
tập trung về một phía bất kì của phân tử sẽ hình thành nên các lưỡng cực tạm thời:
+ Các phân tử có lưỡng cực tạm thời cũng có thể làm các phần tử lân
cận xuất hiện các lưỡng cực cảm ứng. Do đó, các phân tử có thể tập
hợp thành một mạng lưới với tương tác lưỡng cực cảm ứng, được gọi là tương tác van der Waals
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
8. Giải thích xu hướng biến
đổi bán kính nguyên tử, nhiệt
độ nóng chảy và nhiệt độ sôi
của các nguyên tố khí hiếm trong Bảng 11.1
->Tương tác van der Waals
làm tăng nhiệt độ nóng chảy
và nhiệt độ sôi của các chất.
Khi khối lượng phân tử
tăng, kích thước phân tử
tăng thì tương tác van der Waals tăng
2. Ảnh hưởng của tương tác van
der Waals đến nhiệt độ nóng
chảy, nhiệt độ sôi của các chất
- Tương tác van der Waals tăng
theo sự tăng của số electron trong
phân tử. Làm tăng nhiệt độ nóng
chảy, nhiệt độ sôi của các chất
BÀI TẬP SÁCH GIÁO KHOA
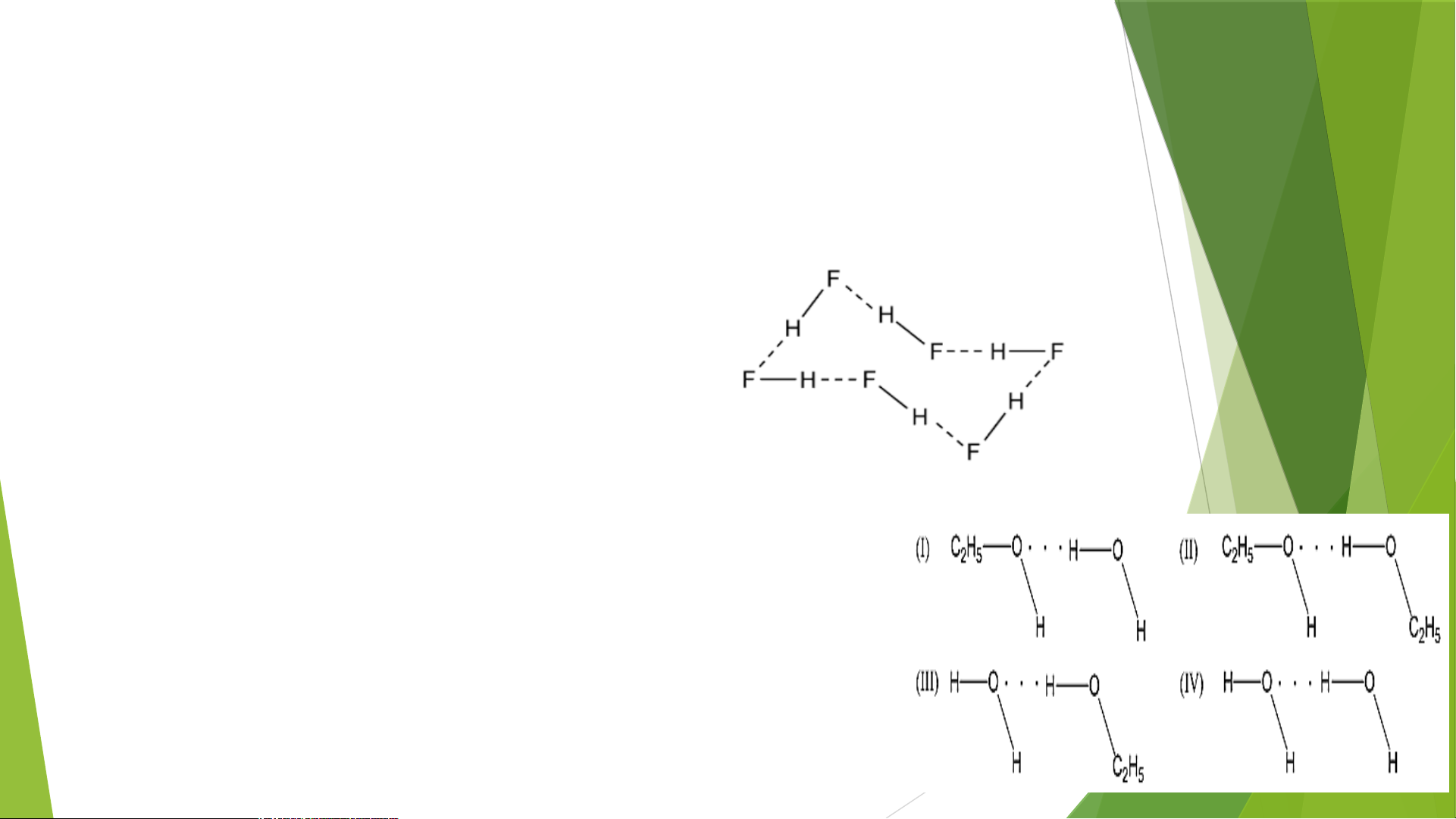
Bài 4: Biểu diễn liên kết hydrogen giữa các phân tử: a) Hydrogen fluoride Phương pháp giải:
b) Ethanol (C H OH) và nước 2 5
Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa
nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn,
thường là F, O, N) với một nguyên tử khác có độ âm điện lớn
Lời giải chi tiết:
(thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
a) Hydrogen fluoride: Nguyên tử H của phân tử
HF này liên kết với nguyên tử F của phân tử HF
khác (biểu diễn bằng 3 nét gạch ---)
b) Ethanol (C H OH) và nước 2 5
- Ethanol (C H OH) và nước tồn tại 4 kiểu liên kết hydrogen 2 5 như sau
+ H của C H OH liên kết hydrogen với O của H O (I) 2 5 2
+ H của C H OH này liên kết hydrogen với O của C H OH 2 5 2 5 khác (II)
+ H của H O liên kết hydrogen với O của C H OH (III) 2 2 5
+ H của H O này liên kết hydrogen với O của H O khác 2 2 (IV)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22




