













Preview text:
Fe + O →…→ Fe O 2 2 3 Chương 4.
PHẢN ỨNG OXI HÓA – KHỬ [O] Tyrosinase o-quinon Bài 15.
PHẢN ỨNG OXI HÓA – KHỬ NỘI DUNG BÀI HỌC 1 Số oxi hóa
2 Chất oxi hóa, chất khử, phản ứng oxi hóa - khử
3 Lập phương trình hóa học của phản ứng oxi hóa - khử
4 Phản ứng oxi hóa - khử trong thực tiễn I. Số oxi hóa
1. Khái niệm: Số oxi hóa là điện tích quy ước của
nguyên tử trong phân tử khi coi tất cả các
electron liên kết đều chuyển hoàn toàn về phía
nguyên tử có độ âm điện lớn hơn.
* Quy ước: dấu (+/-) + số +1 -1 +1 -2 +1 -2 0 -4 +1 NaCl K S H O O CH 2 2 2 4 + - + 2- + * Vd:
Na – Cl K – S – K H H O H O O H C H H
2. Quy tắc xác định số oxi hóa:
1 Đơn chất Số oxi hóa của nguyên tố bằng 0
2 Hợp chất Tổng số oxi hóa của các nguyên tố bằng 0 3 Ion
Tổng số oxi hóa của các nguyên
tố bằng điện tích của ion -2
4 Hợp chất O (trừ OF , peoxit…) 2 +1
H (trừ hiđrua kim loại)
Ví dụ: Xác định số oxi hóa của các nguyên
tố trong các chất và ion sau? 0 -3 +1 +2 Cl NH Ca2+ 2 3 +1 +3 -2 +2 -1 +1 -1 HNO OF H O 2 2 2 2 +1 -1 +1 +4 -2 +1 +1 -2 NaH H SO HClO 2 3 +1 +3 -2 +2 -1 +7 -2 NaClO MnCl MnO - 2 2 4 +1+5 -2 -3 +1 -3 +1 +5 -2 HPO 2- NH + NH NO 4 4 4 3
II. Chất oxi hóa, chất khử, phản ứng oxi hóa - khử Ví dụ: 0 0 +3 -2 Fe + O → Fe O 2 2 3 Chất Chất khử oxi hóa
Chất khử: là chất nhường electron
Chất oxi hóa: là chất nhận electron Quá trình: 0 +3 0 -2 Fe - 3e → Fe O + 4e → O 2 2 Quá trình oxi hóa Quá trình khử
Quá trình khử (sự khử) là quá trình nhận electron.
Quá trình oxi hóa (sự oxi hóa) là quá
trình nhường electron.
Phản ứng oxi hóa khử là phản ứng hóa
học xảy ra đồng thời quá trình khử và quá trình oxi hóa.
Phản ứng oxi hóa khử là phản ứng hóa
học trong đó có sự chuyển electron từ chất
khử sang chất oxi hóa.
Bài 2: Trong các phản ứng dưới đây phản
ứng nào là phản ứng oxi hóa khử? +2 -2 0 0 +1 -2 a. ZnO + H → Zn + H O 2 2 0 0 +8/3 -2 b. 3Fe + 2O → Fe O 2 3 4 c. CaCO → CaO + CO 3 2
d. Na CO + CaCl → 2NaCl + CaCO 2 3 2 3
* LẬP PHƯƠNG TRÌNH HÓA HỌC
CỦA PHẢN ỨNG OXI HÓA – KHỬ Nguyên tắc:
e(chất khử nhường)=
e(chất oxi hóa nhận) - e + e
* Các bước để cân bằng phản ứng oxi hóa khử:
Bước 1: Xác định số oxi hóa của các nguyên tố
trong phản ứng để tìm chất oxi hóa và chất khử.
Bước 2: Viết quá trình oxi hóa và quá trình khử.
Bước 3: Tìm hệ số thích hợp cho chất oxi hóa
và chất khử sao cho tổng electron cho = tổng số electron nhận.
Bước 4: Đặt các hệ số của chất oxi hóa và chất
khử vào phương trình phản ứng. Từ đó tính ra
hệ số các chất khác có mặt trong phương trình hóa học.
VD: Hãy cân bằng các phương trình phản ứng sau 1. Fe + O → Fe O 2 2 3 2. Na + Cl → NaCl 2
3. Mg + HNO → Mg(NO ) + NO + H O 3 3 2 2
4. KMnO + HCl → KCl + MnCl + Cl + H O 4 2 2 2
5. Al + HNO → Al(NO ) + NH NO + H O 3 3 3 4 3 2
6. FeO + H SO → Fe (SO ) + H S + H O 2 4 2 4 3 2 2
7. Cu + H O + CO + O → Cu(OH) + CuCO 2 2 2 2 3 0 0 +3 -2 F 4 e + O 3 → Fe 2 O
Bước 1. Xác định số Chất Ch 2 ất 2 3 oxi hóa khử oxi hóa → chất oxi hóa, Sự oxi hóa: Fe 0 2 - 6e → Fe +3 2 2 chất khử 0 -2
Bước 2. Viết sự oxi Sự khử: O + 4e → 2 O 2 3 hóa, sự khử
Bước 3. Xác định hệ số
Bước 4. Điền hệ số vào phương trình và cân bằng 0 0 +1 -1
Bước 1. Xác định số oxi hóa N 2 a + Cl → N 2 aCl
→ chất oxi hóa, chất khử 2 Chất Chất khử oxi hóa
Bước 2. Viết sự oxi hóa, sự khử Sự oxi hóa: Na 0 - 1e → Na
+1 2 Bước 3. Xác định hệ số 0 Sự khử: Cl + 2e → 2 Cl -1 2
1 Bước 4. Điền hệ số vào
phương trình và cân bằng 0 +1 +5 -2 +2 +5 -2 +2 -2 +1 -2 Mg + HNO 3 8 → Mg(NO 3 ) + N 2 O + H 4 O 3 3 2 2 Chất Chất khử oxi hóa Sự oxi hóa: Mg 0 - 2 e → Mg +2 3 Sự khử: N +5 + 3e → +2 N 2 +1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2 K 2 MnO + 1 H 6 C l → K 2 Cl + MnC 2 l + C 5 l + H 8 O 4 2 2 2 Chất Chất oxi hóa khử -1 0 Sự oxi hóa: Cl 2 - 2e → Cl 2 5 +7 Sự khử: Mn + 5e → M + n 2 2 Bài làm: 5. A 8 l + H 30 NO → A 8 l(NO ) + N 3 H NO + H 9 O 3 3 3 4 3 2 6. F 8 eO + 1 H 3 SO → F 4 e (SO ) + H S + 1 H 2 O 2 4 2 4 3 2 2 2
7. Cu + H O + CO + O → Cu(OH) + CuCO 2 2 2 2 3
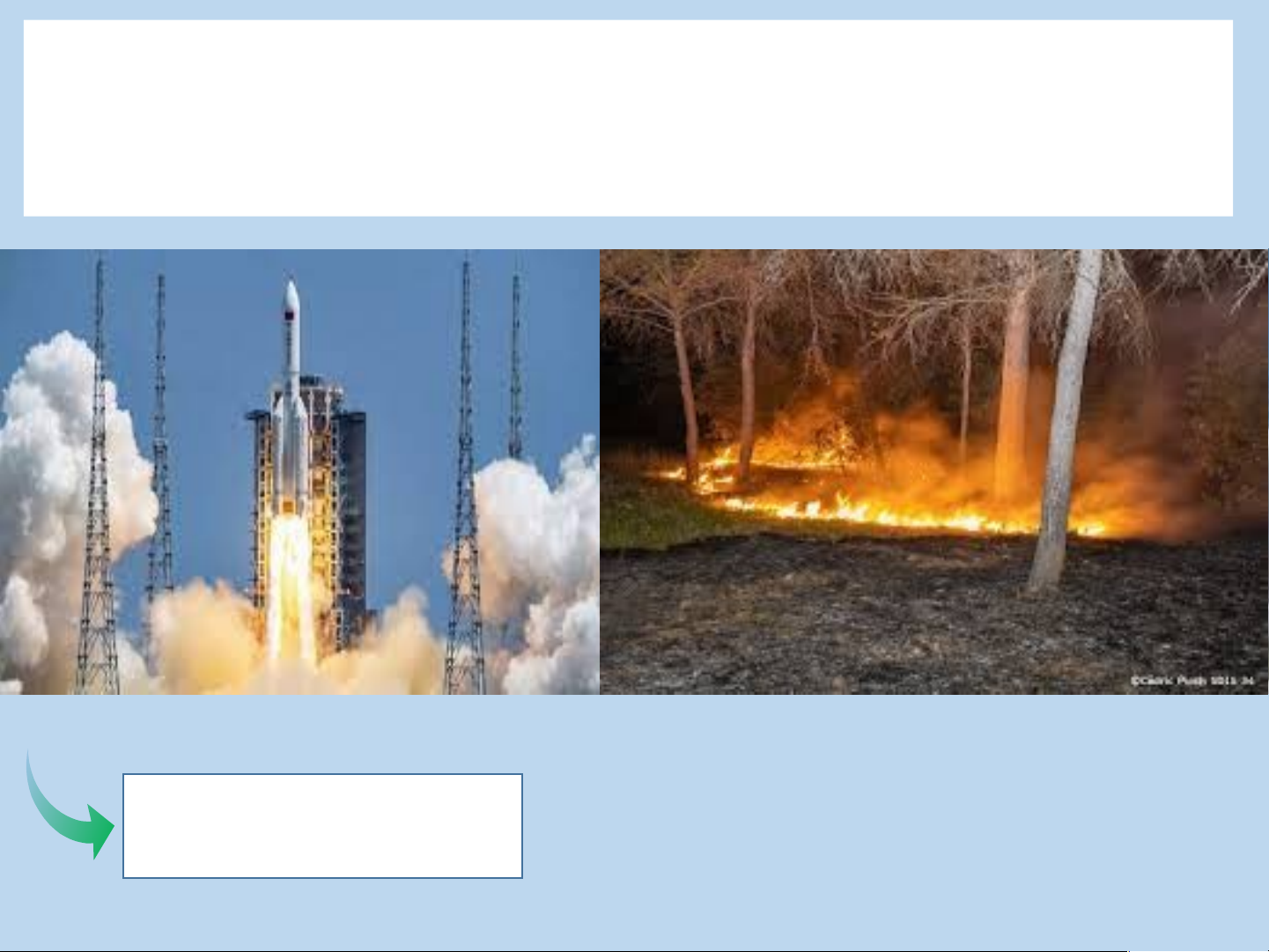
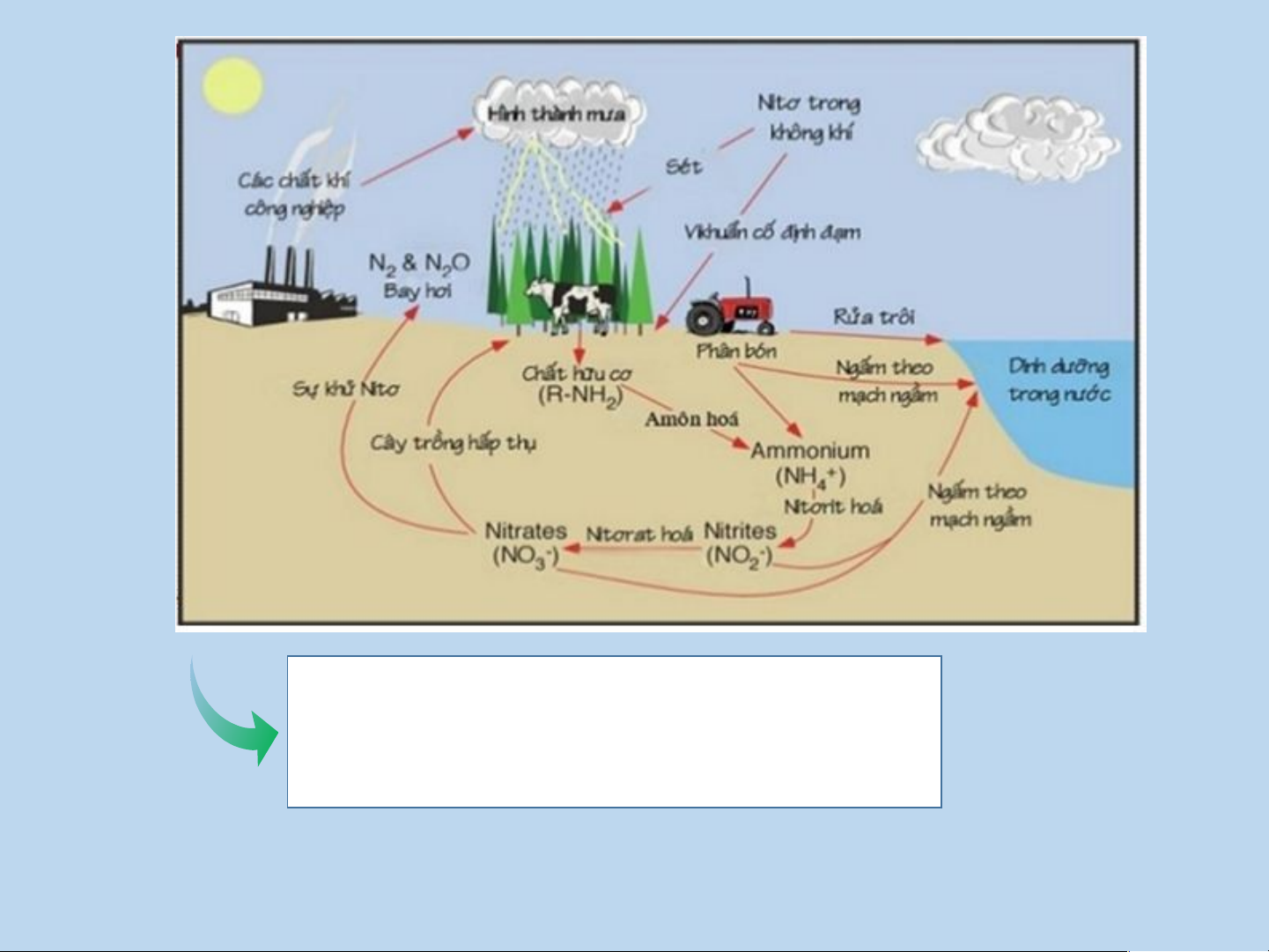
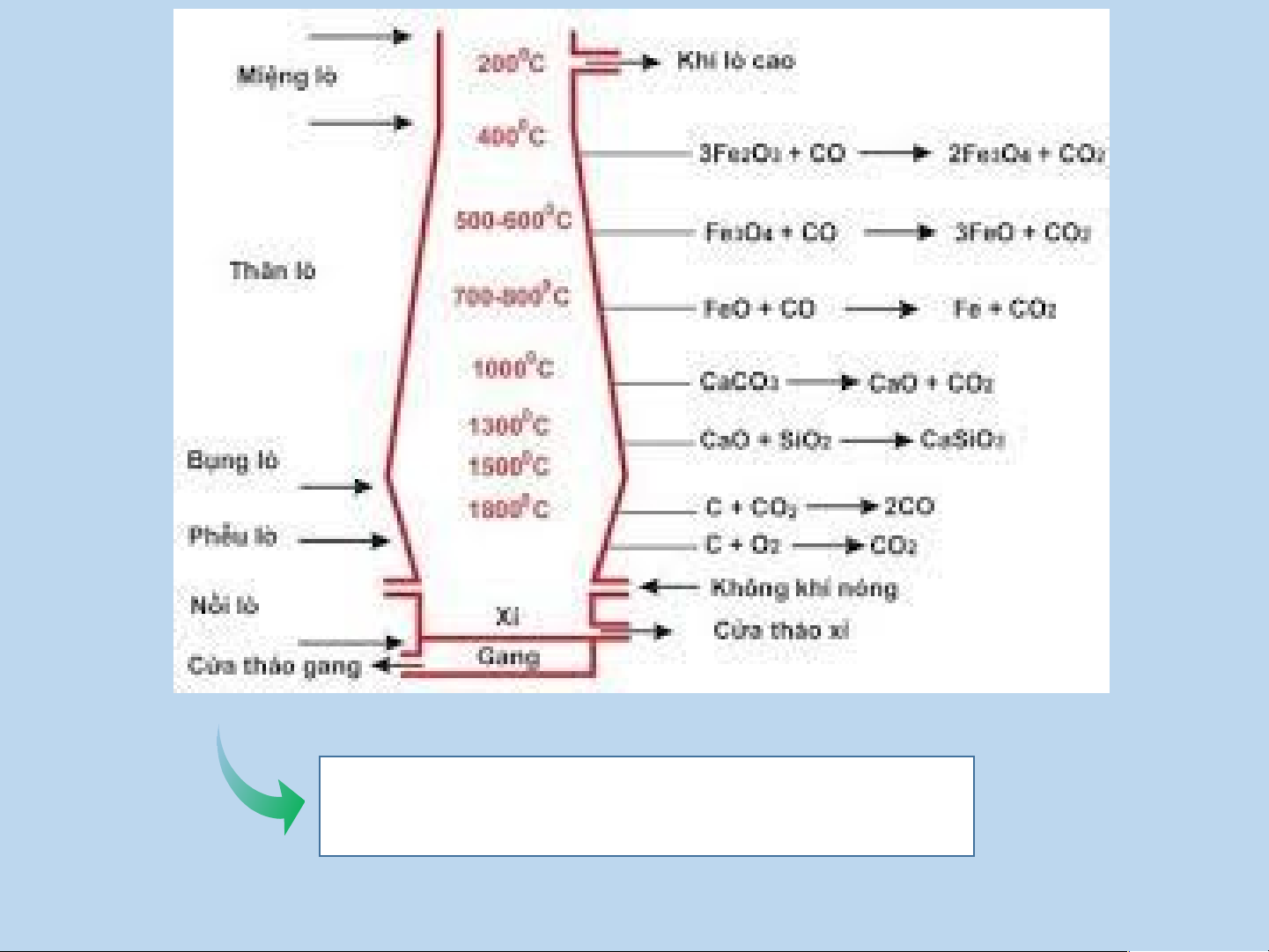
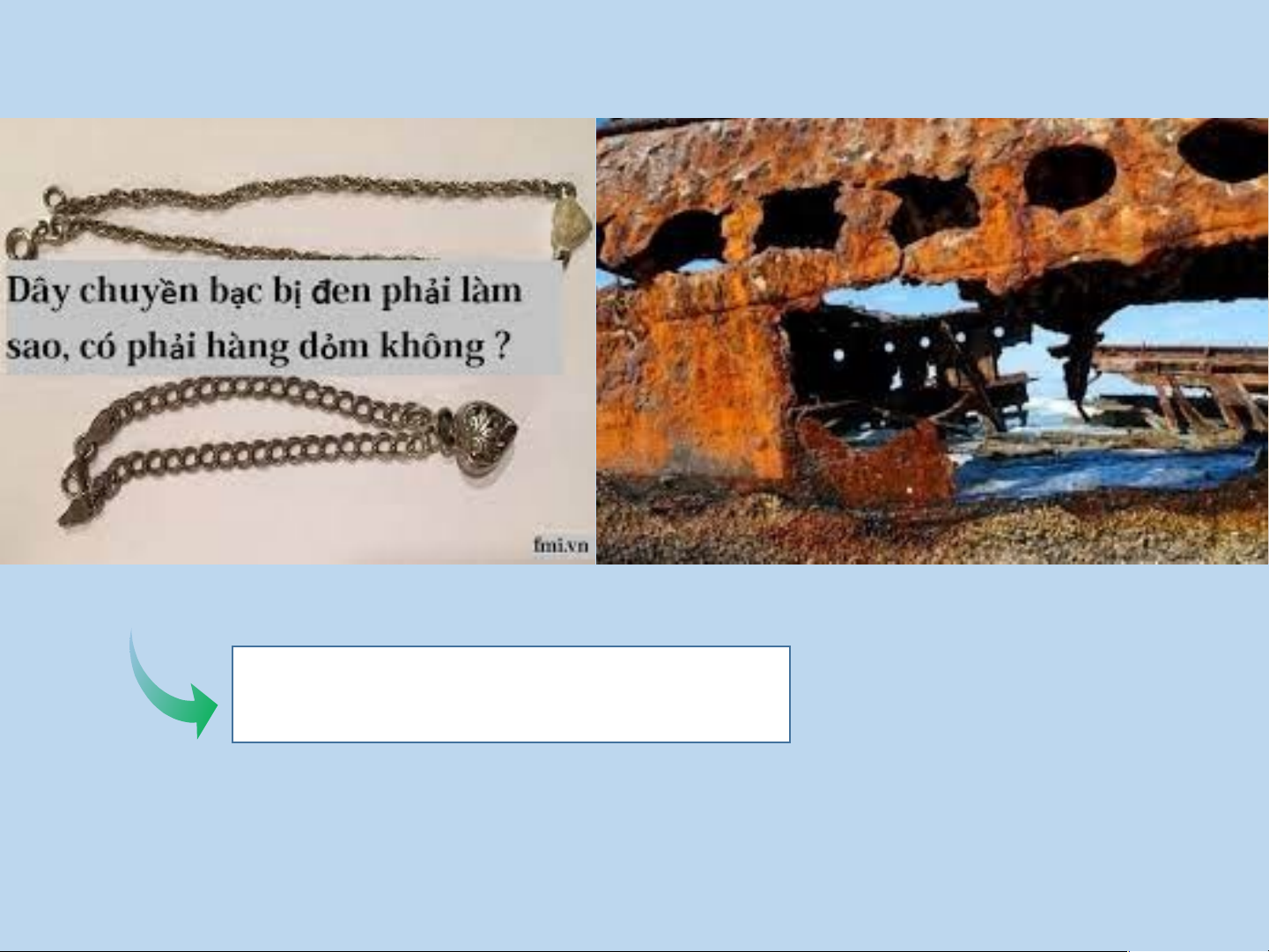
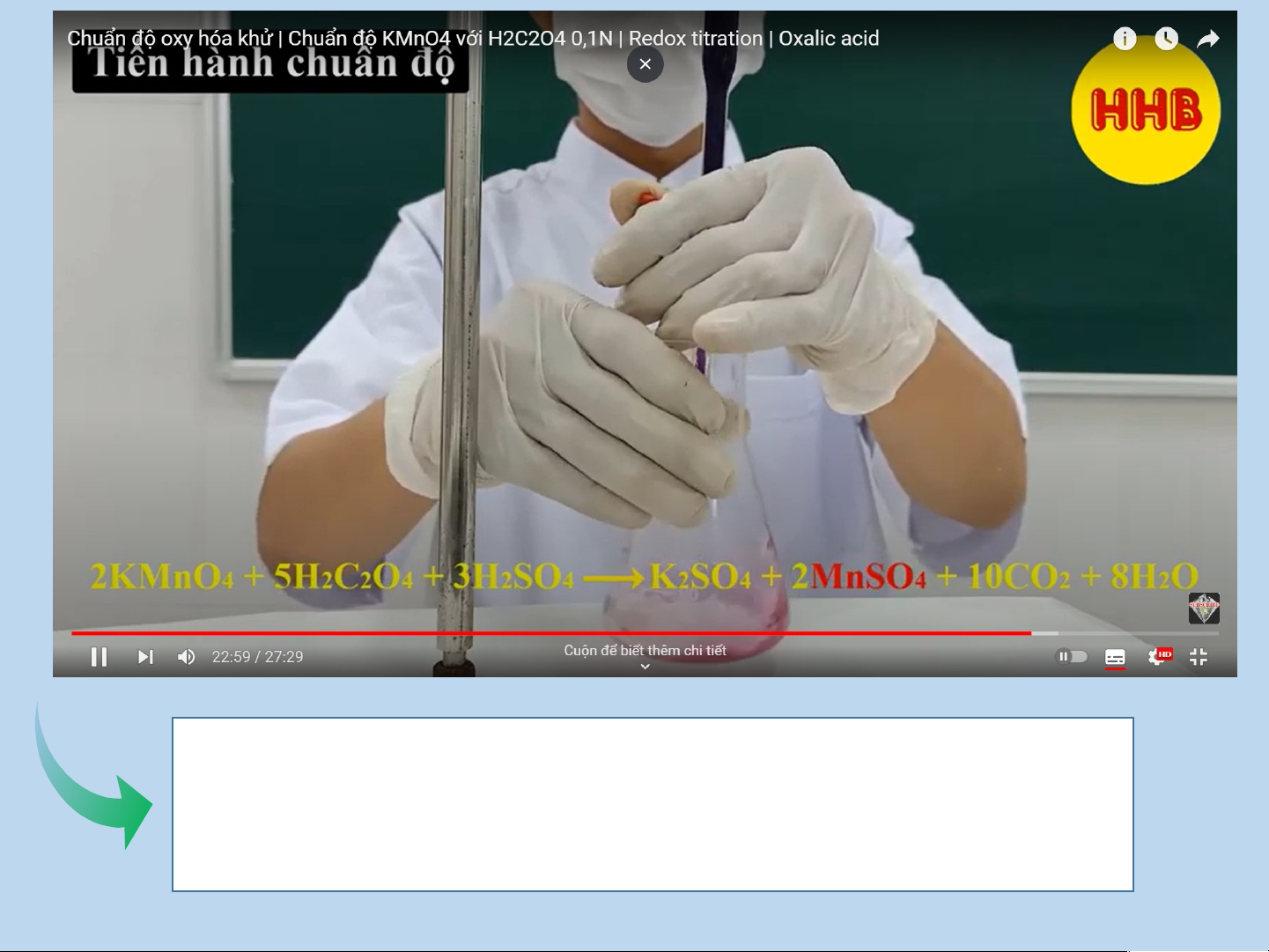
IV. PHẢN ỨNG OXI HÓA – KHỬ TRONG THỰC TIỄN Sự cháy
Chuyển hóa các chất trong tự nhiên
Sản xuất hóa chất
Sự han gỉ kim loại
Xác định nồng độ 1 chất bằng
phản ứng oxi hóa – khử LUYỆN TẬP Câu 1
Số oxi hóa của Mn trong KMnO là 4 +5 B +7 -7 +3 Câu 2
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận A electron neutron proton cation Câu 3
Dấu hiệu để nhận ra một phản ứng oxi
hóa – khử là dựa trên sự thay đổi đại
lượng nào sau đây của nguyên tử ? Số khối B Số oxi hóa Số hiệu Số mol Câu 4
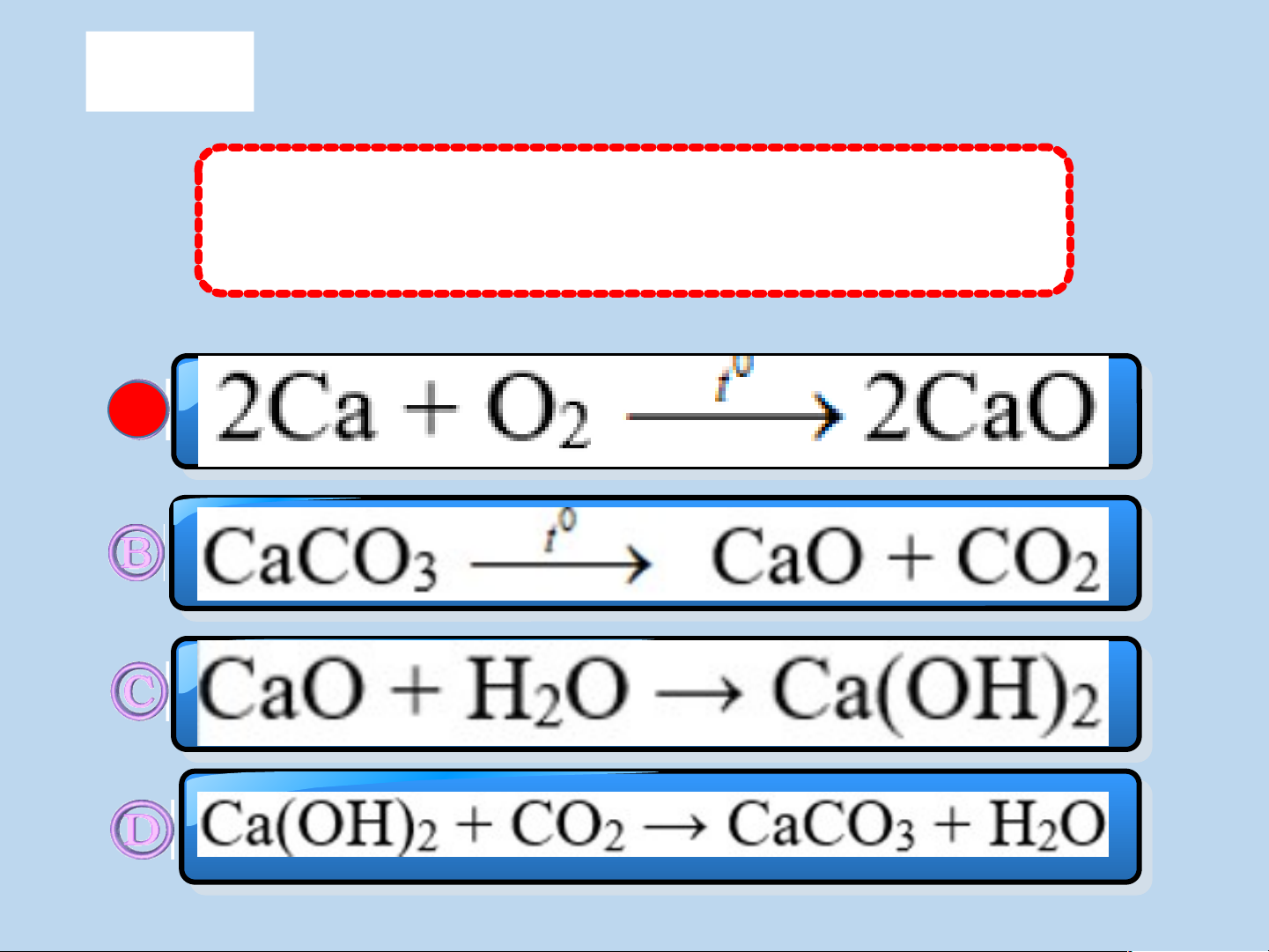
Phản ứng nào sau đây là phản ứng oxi hóa khử ? A Câu 5 4 3 C 2 1
Document Outline
- Slide 1
- Số oxi hóa
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27




