
































Preview text:
CHÀO MỪNG CÁC EM
ĐẾN VỚI TIẾT HỌC HÔM NAY!
Trong lò luyện gang, xảy ra phản ứng oxi hóa khử theo sơ đồ sau: Fe O + CO → Fe + CO 2 3 2
Về bản chất, phản ứng oxi hóa
khử là gì? Dựa vào đâu để nhận
ra loại phản ứng đó? Làm thế
nào để lập phương trình hóa học của phản ứng trên?
BÀI 15: PHẢN ỨNG OXI HÓA – KHỬ NỘI DUNG BÀI HỌC 1. Số oxi hoá
2. Chất oxi hoá, chất khử, phản ứng oxi hoá – khử
3. Lập phương trình hoá học của phản ứng oxi hoá – khử
4. Phản ứng oxi hoá – khử trong thực tiễn 1. Số oxi hoá 1.1 Khái niệm Thảo luận nhóm
Hoạt động nhóm đôi để trả lời câu hỏi:
• Khái niệm số oxi hóa là gì?
• Cách biểu diễn số oxi hóa như thế nào?
Khái niệm: Số oxi hóa là điện tích quy ước của nguyên
tử trong phân tử khi coi tất cả các electron liên kết đều
chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Cách biểu diễn số oxi hóa: Số oxi hóa được viết ở
dạng đại số, dấu viết trước số viết sau. VD: Xét phân tử NaCl :
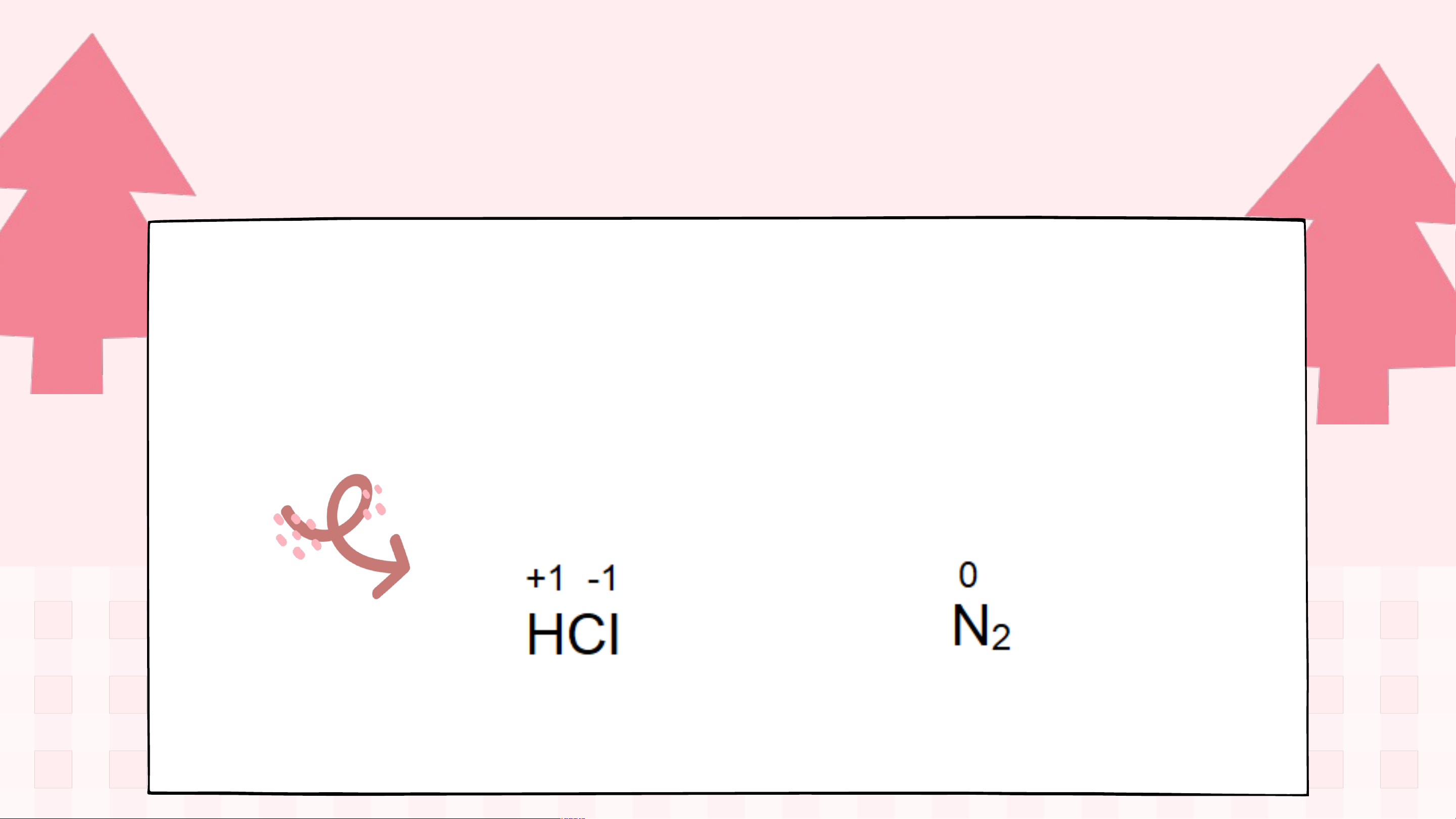
Thảo luận nhóm đôi
Tìm số oxi hoá của phân tử HCl và N2
1.2. Quy tắc xác định số oxi hoá
Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0. VD:
Quy tắc 2: Trong phân tử hợp chất thông thường, số oxi hóa
của hydrogen là +1, của oxygen là -2, các kim loại điển hình có
số oxi hóa dương và có giá trị bằng số electron hóa trị.
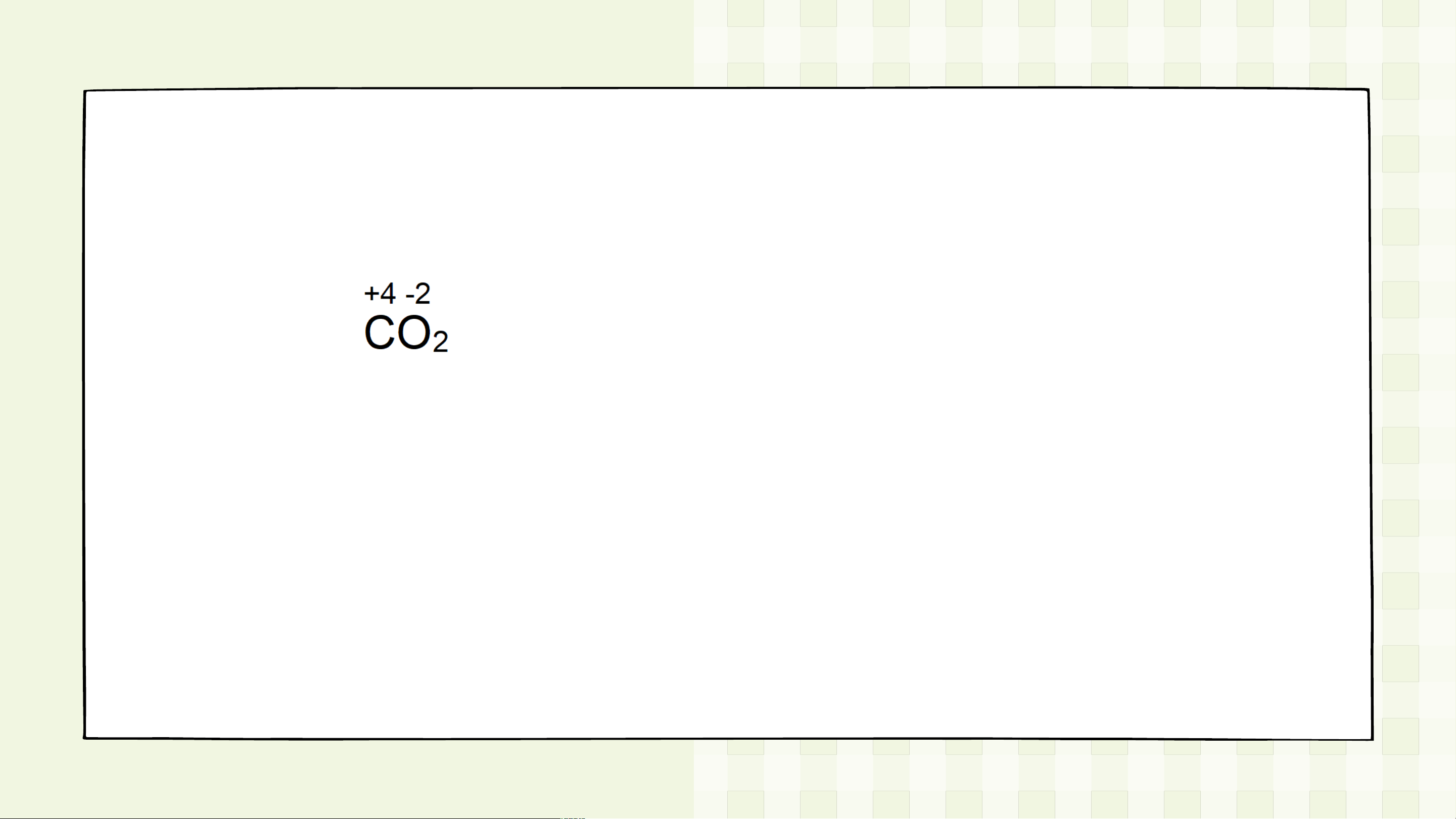
Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0 VD:
Tổng số oxi hoá = (+4).1 + (-2).2 = 0
Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên
tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi
hóa của các nguyên tử bằng điện tích ion.
VD: ion Cl- có số oxi hóa là -1
Các bước xác định số oxi hóa
Bước 1: Xác định chất cần xác định là đơn chất, hợp chất hay ion.
• TH1: Là đơn chất → áp dụng quy tắc 1
• TH2: Là hợp chất/ion → bước 2:
Bước 2: Xác định số oxi hóa của các nguyên tố số có số oxi hoá thường không đổi.
Bước 3:Đặt số oxi hoá của nguyên tố còn lại là x, Áp dụng QT3 hoặc QT4 để tìm x.
Thảo luận nhóm đôi
Câu 1. Xác định số oxi hoá của nguyên tử Fe và S trong các chất sau:
a. Fe, FeO, Fe O , Fe(OH) , Fe O 2 3 3 3 4
b. S, H S, SO , SO , H SO , Na SO 2 2 3 2 4 2 3 Đáp án
1. Số oxi hóa của nguyên tử Fe trong Fe, FeO, Fe O , 2 3
Fe(OH) , Fe O lần lượt là 0, +2, +3, +3, +8/3 3 3 4
2. b) Số oxi hóa của nguyên tử S trong S, H S, SO , SO , 2 2 3
H SO , Na SO lần lượt là 0, -2, +4, +6, +6, +4. 2 4 2 3
2. Chất oxi hoá, chất khử, phản ứng oxi hoá – khử
2.1. Chất oxi hoá, chất khử Thảo luận nhóm
Tìm hiểu Ví dụ 1, áp dụng viết quá trình khử, oxi hoá của
các nguyên tử, phân tử trong Ví dụ 2, 3 SGK trang 73
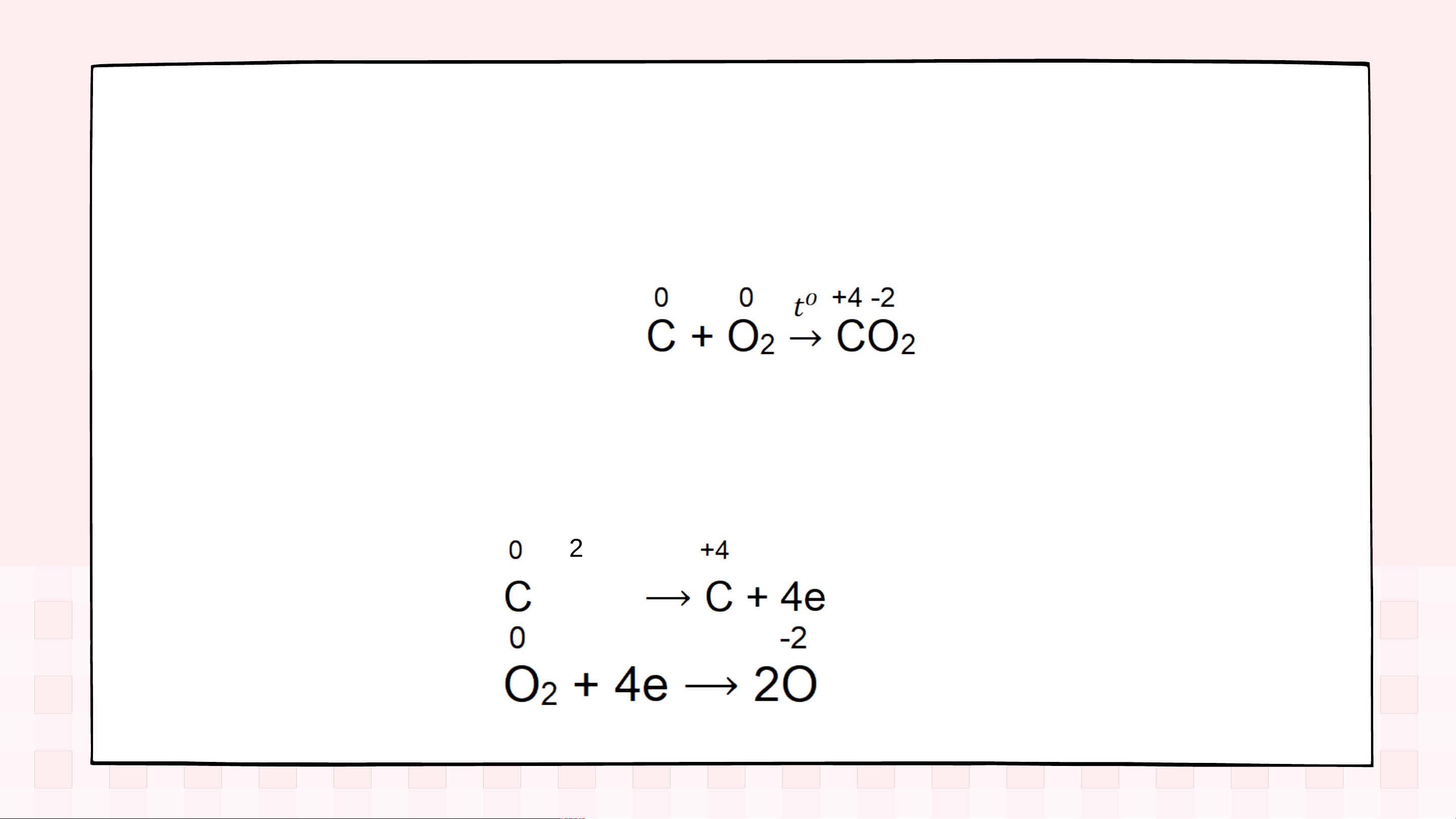
Ví dụ 1: Đưa mẩu than gỗ nóng đỏ vào bình đựng khí O , 2 mẩu than cháy sáng.
Trong phản ứng trên, nguyên tử C nhường 4 electron, là
chất khử; phân tử O nhận 4 electron, là chất oxi hoá. 2 (quá trình oxi hoá) (quá trình khử) Ví dụ 2:
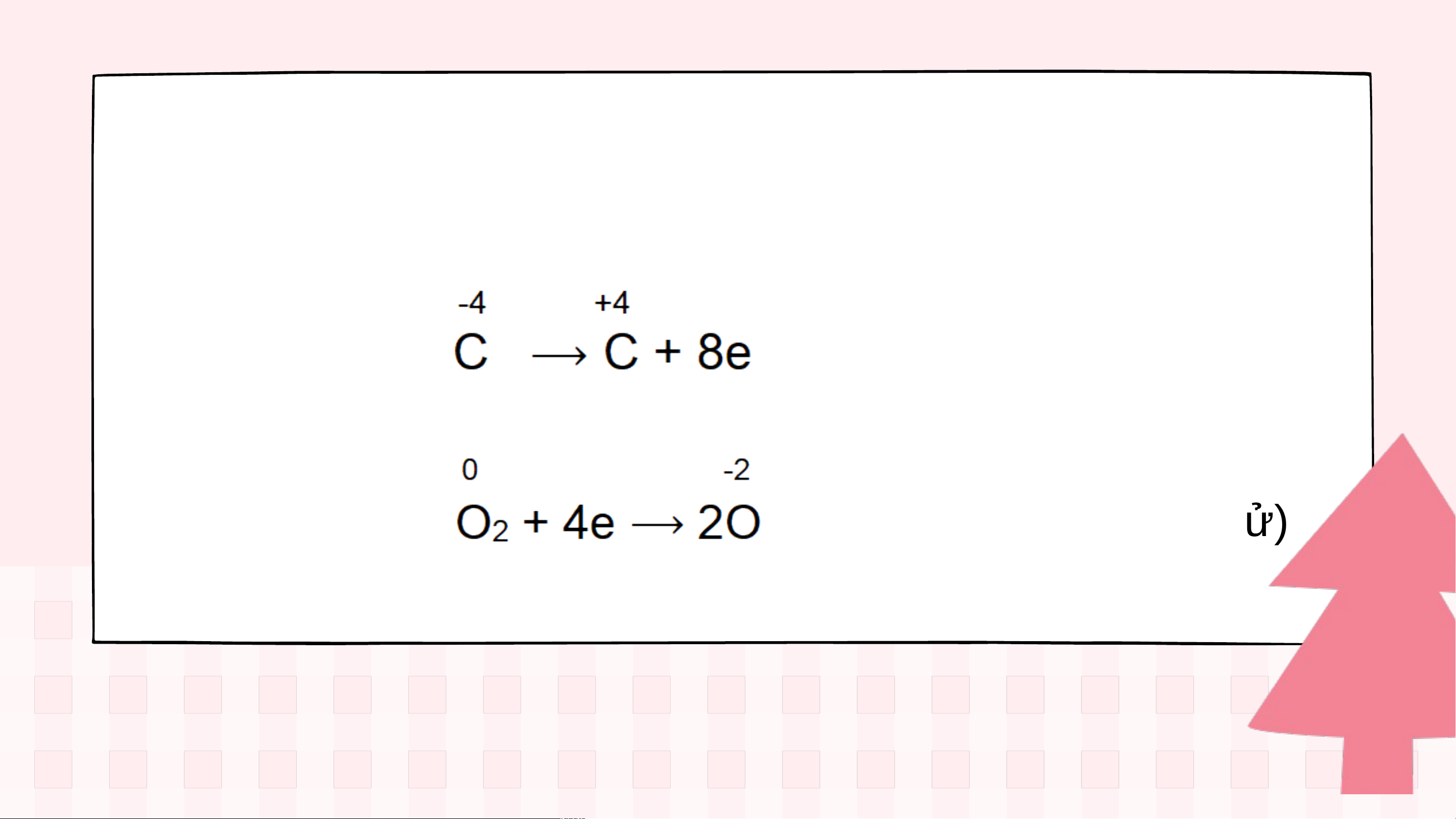
Nguyên tử C nhường 8 electron, C là chất khử: (quá trình oxi hóa)
Phân tử O nhận 4 electron, là chất oxi hoá: 2 (quá trình khử) Ví dụ 2:
Nguyên tử C nhận 2 electron, C là chất khử: (quá trình oxi hóa)
Phân tử O nhận 4 electron, là chất oxi hoá: 2 (quá trình khử) Kết luận
• Chất khử là chất nhường electron
• Chất oxi hóa là chất nhận electron
• Quá trình oxi hóa là quá trình chất khử nhường electron
• Quá trình khử là quá trình chất oxi hóa nhận electron.
Thí nghiệm: Xác định chất oxi hóa, chất khử
Chuẩn bị: đinh sắt, dung dịch CuSO , dung dịch H SO loãng, ống nghiệm 4 2 4 Thực hiện:
Thí nghiệm 1: Cho đinh sắt vào ống nghiệm đựng dung dịch CuSO4
Thí nghiệm 2: Cho đinh sắt vào ống nghiệm đựng dung dịch H SO 2 4
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Viết quá trình oxi hoá, quá trình khử.
2. Xác định chất oxi hoá, chất khử trong hai phản ứng trên. Đáp án 1. Thí nghiệm 1:
Quá trình oxi hoá: Quá trình khử: Thí nghiệm 2:
Quá trình oxi hoá: Quá trình khử: 2.
Thí nghiệm 1: Chất khử là Fe, chất oxi hóa là CuSO . 4
Thí nghiệm 2: Chất khử là Fe, chất oxi hóa là H SO . 2 4 Ví dụ 2:
Nguyên tử C nhận 2 electron, C là chất khử: (quá trình oxi hóa)
Phân tử O nhận 4 electron, là chất oxi hoá: 2 (quá trình khử)
2.2. Phản ứng oxi hóa khử.
• Phản ứng oxi hóa khử là phản ứng hóa học xảy ra đồng
thời quá trình nhường electron và quá trình nhận electron.
• Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự
thay đổi số oxi hóa của các nguyên tử.
Thảo luận nhóm đôi
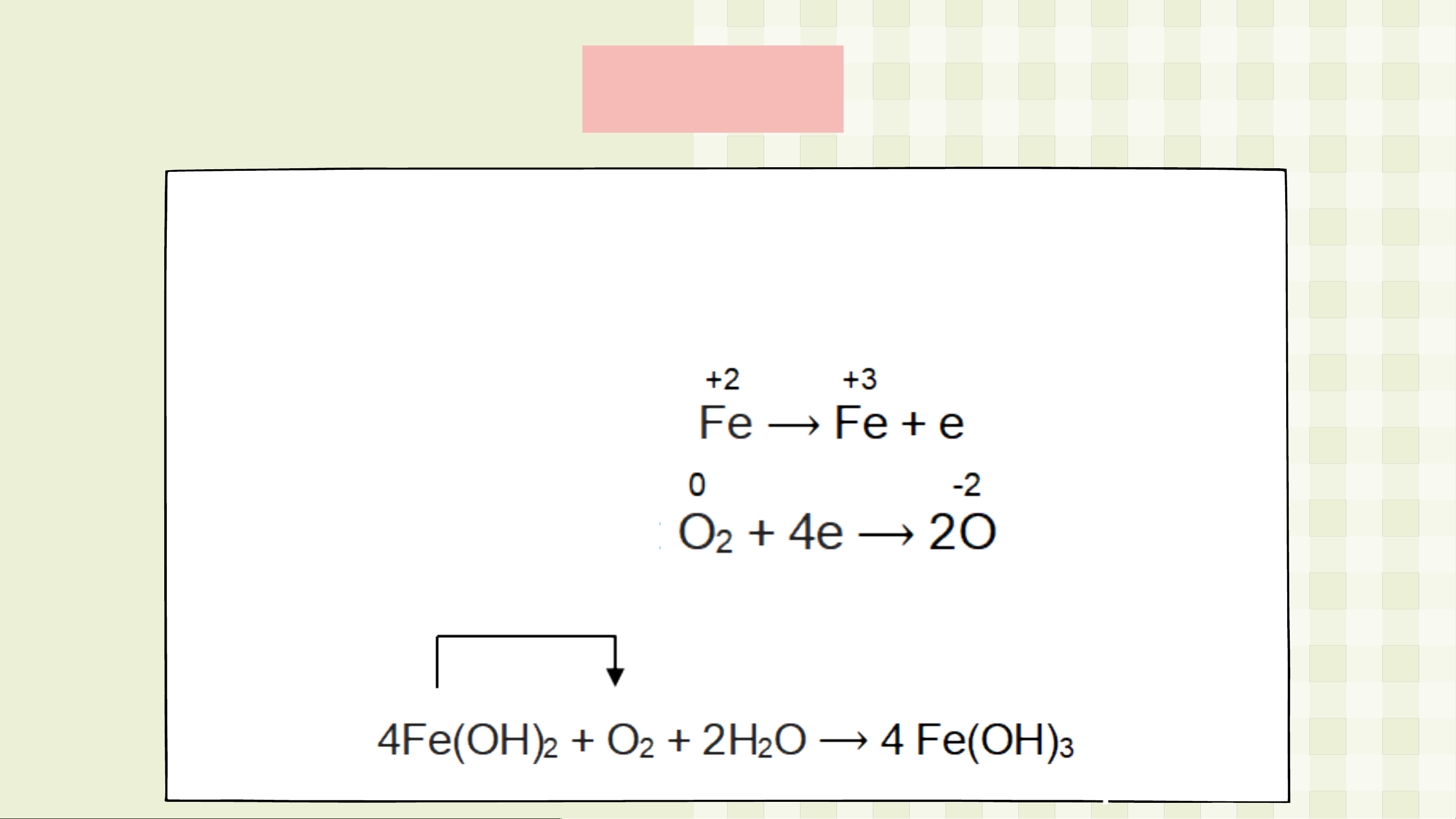
Câu 2. Trong không khí ẩm, Fe(OH) màu trắng xanh 2
chuyển dần sang Fe(OH) màu nâu đỏ: 3 Fe(OH) + O + H O ⟶ Fe(OH) 2 2 2 3
a) Hãy xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Viết quá trình oxi hoá, quá trình khử.
c) Dùng mũi tên biểu diễn sự chuyển electron từ chất khử sang chất oxi hóa. Đáp án
a) Số oxi hóa của Fe tăng từ +2 lên +3.
Số oxi hóa của O (O ) giảm từ 0 xuống -2. 2 b) Quá trình oxi hóa: Quá trình khử: c)
3. Lập phương trình hóa học của
phản ứng oxi hóa - khử. Thảo luận nhóm
Hãy nêu nuyên tắc của phương pháp thăng bằng electron và
nêu ví dụ cách lập phương trình của phản ứng oxi hóa khử
• Nguyên tắc của phương pháp: Tổng số electron chất khử
thường bằng tổng số electron chất oxi hóa nhận.
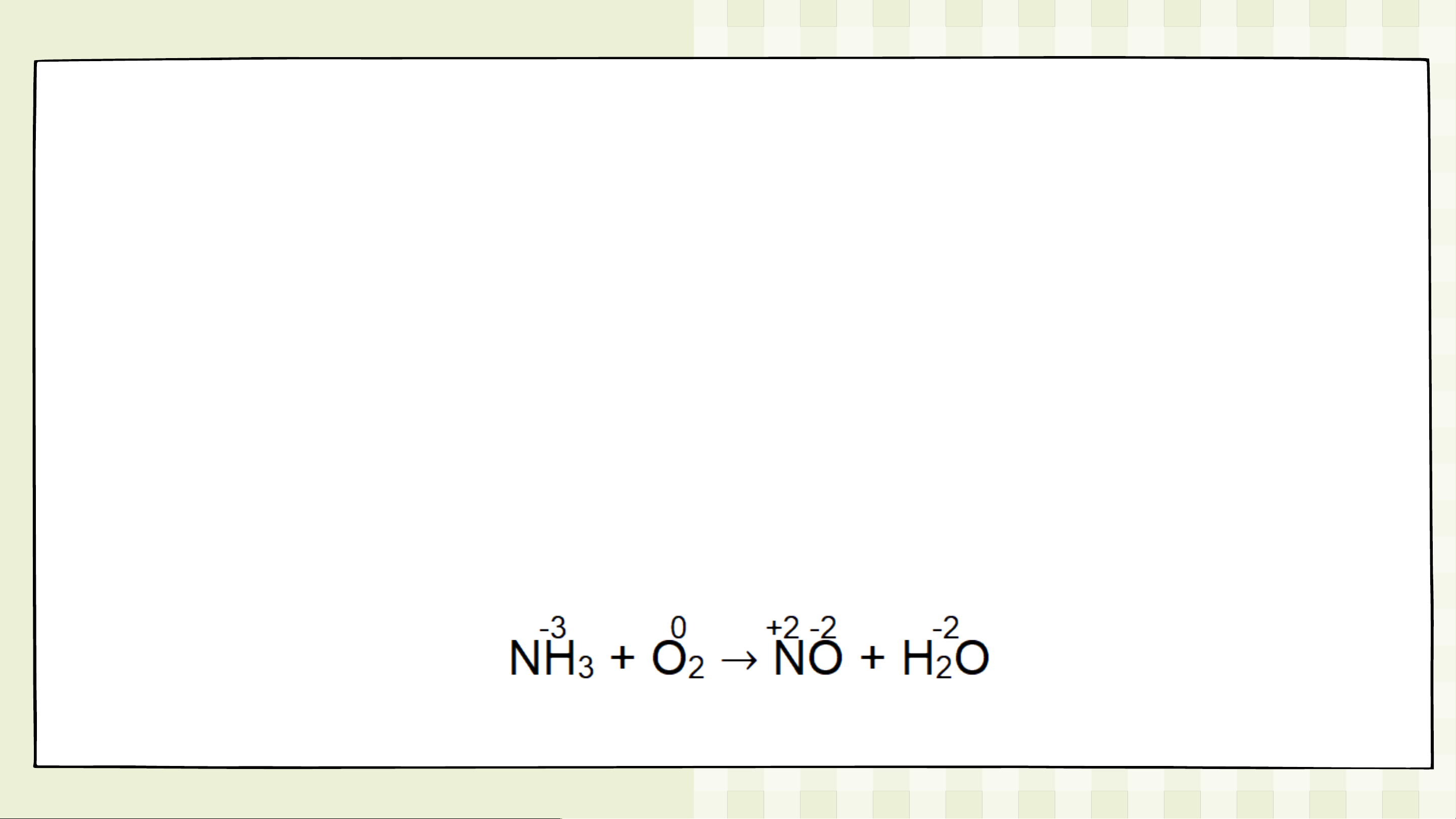
• Ví dụ: Lập phương trình hóa học cho phản ứng sau: NH + O NO + H O 3 2 2
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, xác
định chất oxi hóa, chất khử.
Bước 2: Viết quá trình oxi hóa và quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá dựa
trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng
số electron chất oxi hoá nhận.
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng
nguyên tử các nguyên tố còn lại. 4NH + 5O → 4NO + 6H O. 3 2 2
Thảo luận nhóm đôi
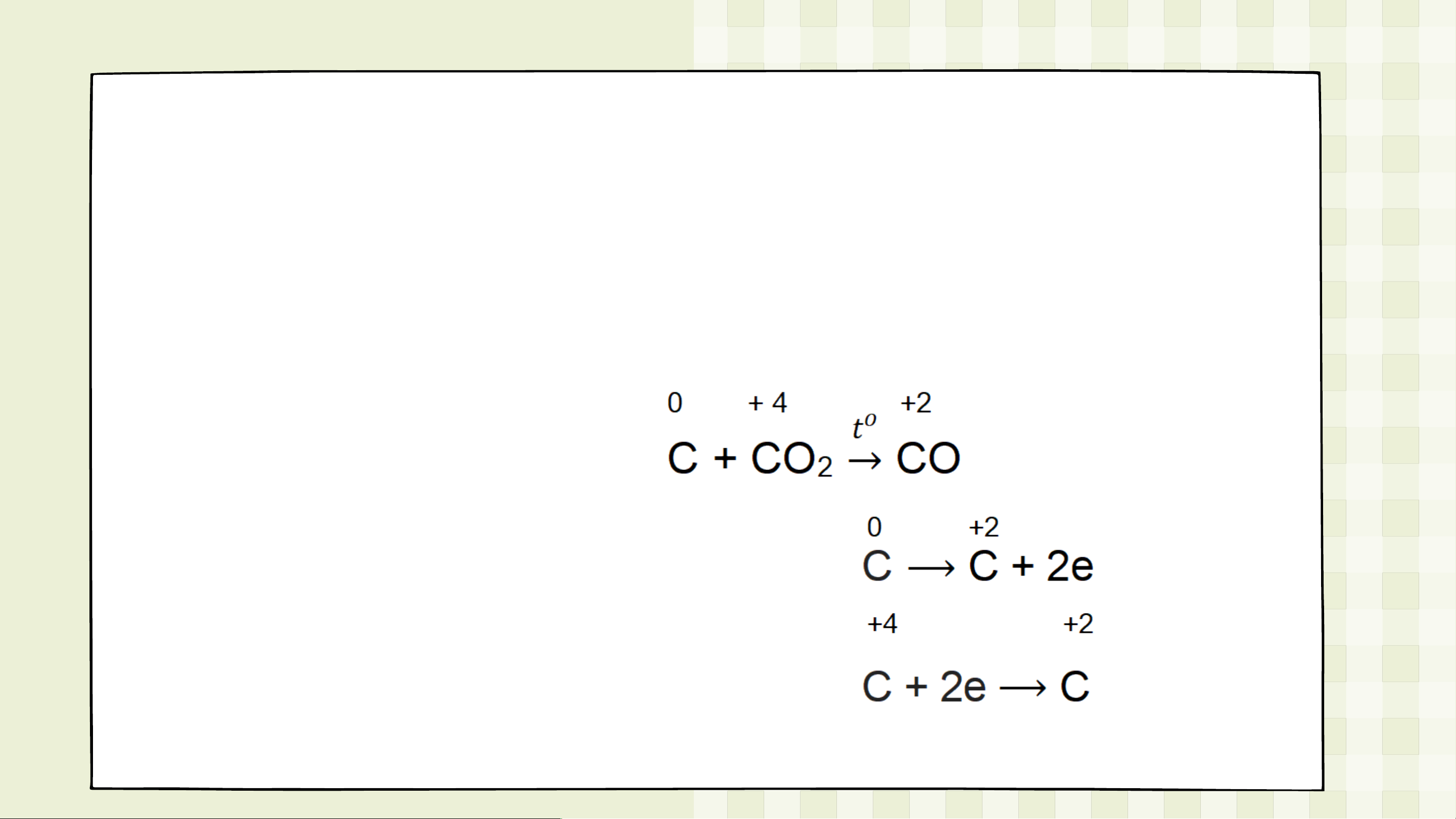
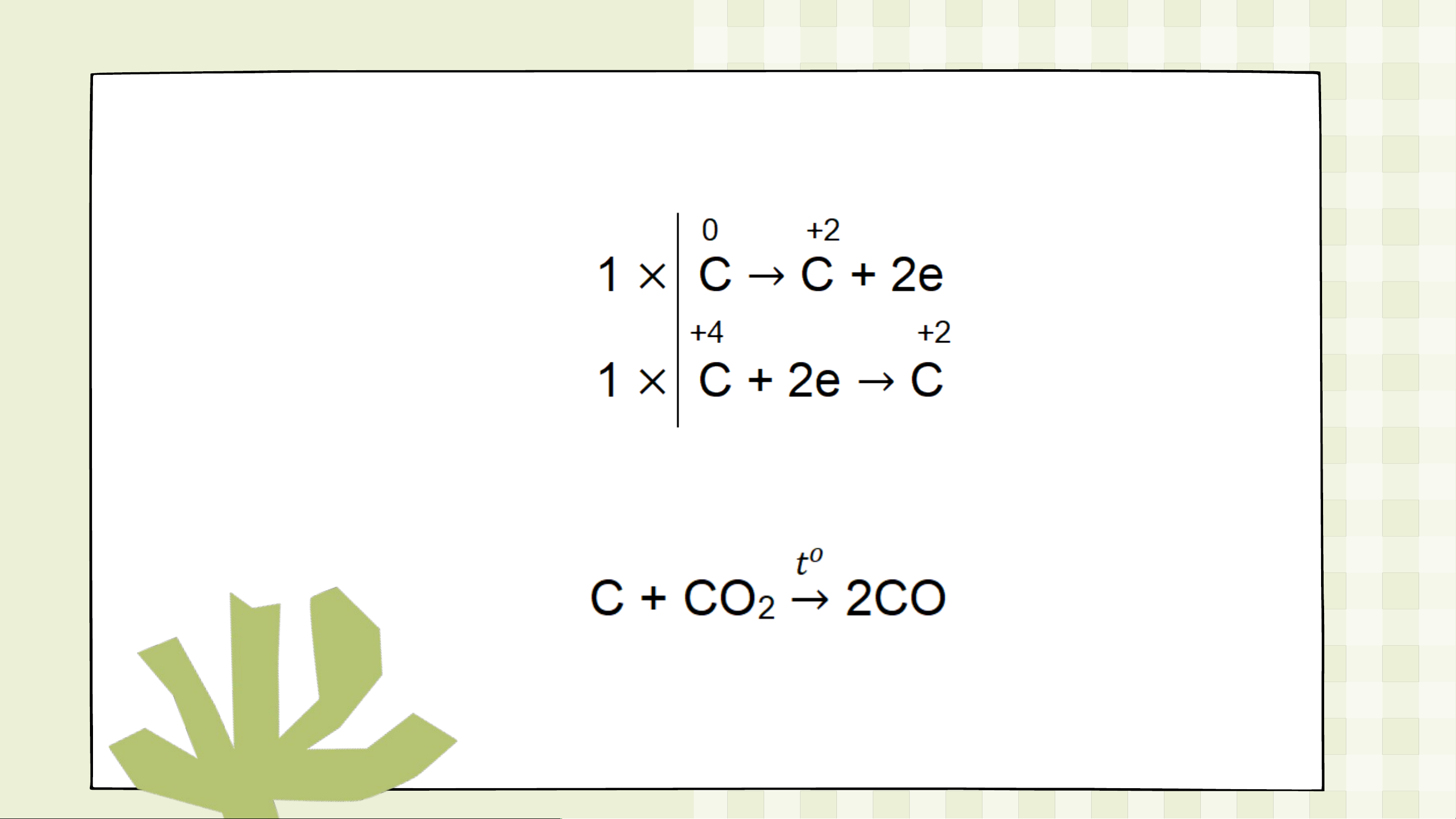
Câu 3: Xét các phản ứng hóa học xảy ra trong công nghiệp: a) Al(OH) Al O + H O 3 2 3 2 b) C + CO CO 2
Phản ứng nào là phản ứng oxi hóa – khử? Lập phương trình
hóa học của phản ứng oxi hóa – khử theo phương pháp thăng bằng electron. Đáp án
• Phản ứng b) là phản ứng oxi hóa – khử do có sự
thay đổi số oxi hóa của các nguyên tử.
• Cân bằng phản ứng b) Bước 1:
Bước 2: Chất khử là C Chất oxi hóa là CO . 2 Bước 3: Bước 4:
4. Phản ứng oxi hoá – khử trong thực tiễn Hoạt động nhóm 4
Hoàn thành phiếu học tập số 1 Đáp án Câu 1:
a, C là chất khử, O2 là chất oxi hóa
b, C là chất khử, O2 là chất oxi hóa
Các yếu tố tạo nên sự cháy: Chất cháy (nhiên liệu), Chất oxi hóa (O ), 2
thường có sự tỏa nhiệt và phát sáng.
Các phương pháp dập lửa
• Ngăn cách oxy với chất cháy: phủ đất cát, bọt chữa cháy, chăn nệm ướt,…
• Làm lạnh thu nhiệt: CO , N , nước. 2 2
• Giảm nồng độ oxy quanh đám cháy: sử dụng bình chữa cháy(CO , N 2 2) Câu 2: 4Fe + 3O + xH O ⟶ 2Fe O .xH O 2 2 2 3 2
Để bảo vệ đồ vật bằng kim loại: • Lau chùi thường xuyên
• Rửa sạch, lau khô sau sử dụng • Quét sơn • Ngâm trong dầu • Để nơi khô ráo Câu 3: (1) S + O SO 2 2 (2) 4FeS + 11O 2Fe2O + 8SO 2 2 3 2 (3) 2SO + O 2SO 2 2 3 (4) SO + H O → H SO 3 2 2 4
Các phản ứng 1, 2, 3 là phản ứng oxi hóa khử. Đáp án Câu 4:
Tia sét tạo ra lửa điện, tạo điều kiện cho N phản ứng với O tạo ra NO,
sau đó NO bị oxi hóa tạo NO - trong nước mưa cung cấp đạm cho cây 3 lúa phát triển mạnh. N + O 2NO 2 2 2NO + O → 2NO 2 2 4NO + O + 2H O → 4HNO 2 2 2 3 LUYỆN TẬP
Câu 1: Số oxi hóa là số đặc trưng cho đại lượng nào sau
đây của nguyên tử trong phân tử? A. Hóa trị B. Điện tích C.Khối lượng D. Số hiệu
Câu 2: Trong hợp chất SO , số oxi hóa của sulfur (lưu huỳnh) là 3 A. +2 B. 3+ C.+5 D. +6
Câu 3: Phản ứng nào sau đây là phản ứng oxi hóa – khử? A. 2Ca + O 2CaO 2 B. CaCO CaO + CO 3 2 C. CaO + H O → Ca(OH) 2 2
D. Ca(OH) + CO2 → CaCO + H O 2 3 2
Câu 4: Tham gia vào phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là A. chất khử B. acid C.chất oxi hóa D. base
Câu 5: Trong phản ứng:
3Cu + 8HNO → 3Cu(NO ) + 2NO + 4H O. 3 3 2 2 2
Số phân tử HNO đóng vai trò là chất oxi hóa là: 3 A. 8 B. 6 C. 2 D. 4 VẬN DỤNG
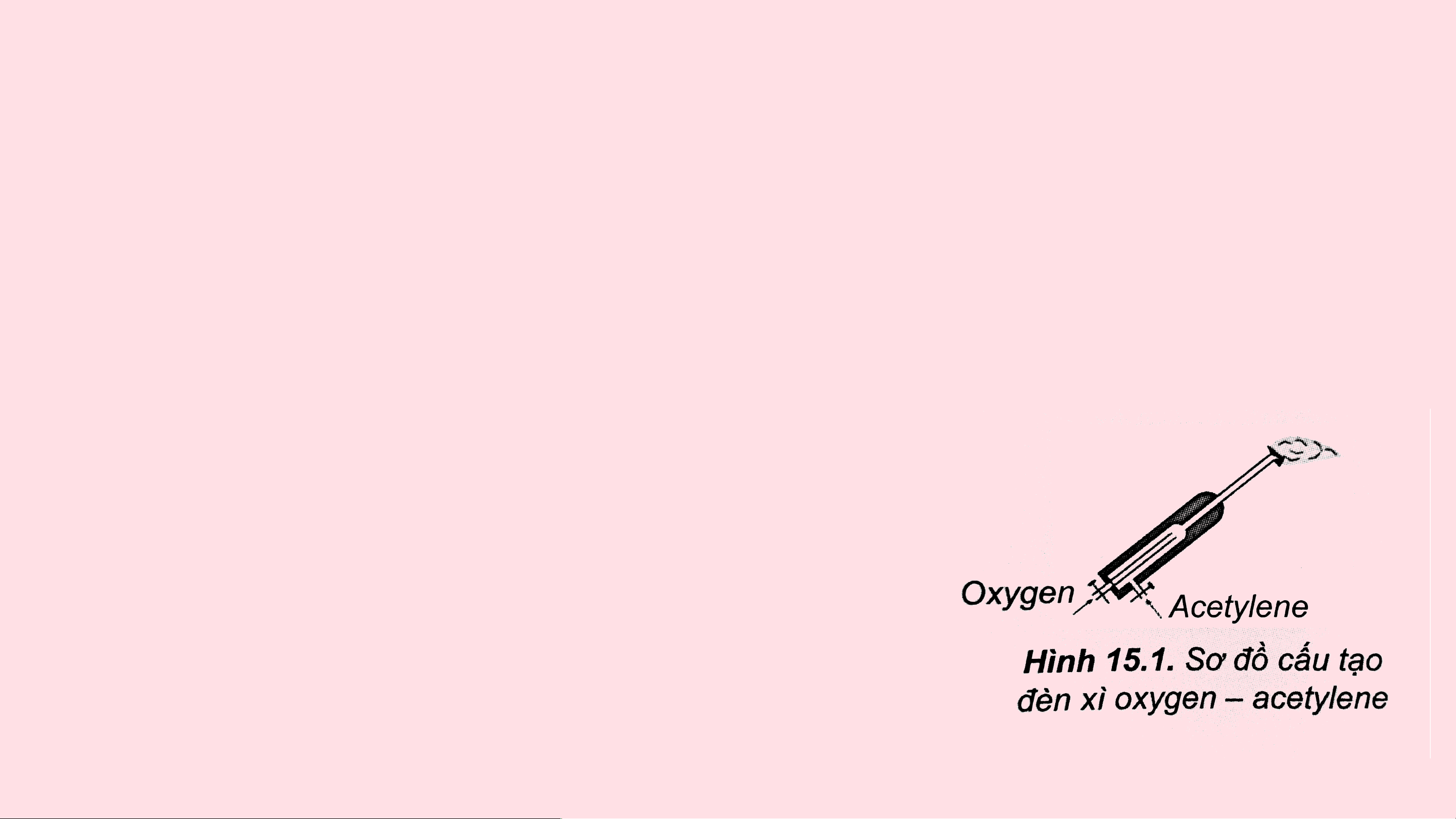
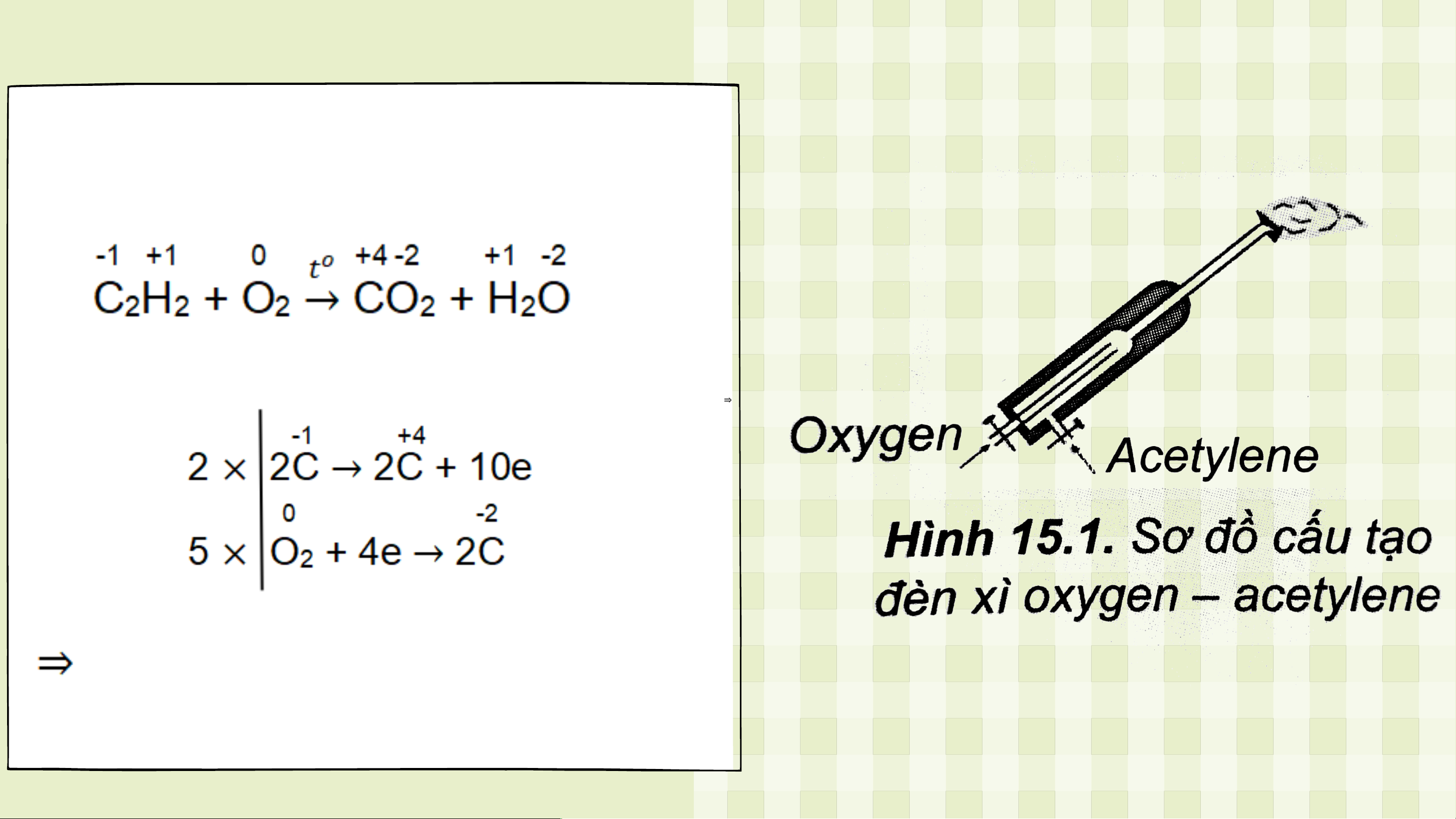
Câu 6: Đèn xì oxygen – acetylene có cấu tạo gồm hai ống dẫn khí: một ống
dẫn khí oxygen, một ống dẫn khí acetylene (Hình 15.1). Khi đèn hoạt động,
hai khí này được trộn vào nhau để thực hiện phản ứng đốt cháy theo sơ đồ:
Phản ứng toả nhiệt lớn, tạo ra ngọn lửa có nhiệt
độ cao nên được dùng dễ hàn cắt kim loại.
Hãy xác định chất oxi hóa, chất khử và lập
phương trình hoá học của phản ứng trên theo
phương pháp thăng bằng electron Đáp án
Chất oxi hoá là O , chất khử là C H 2 2 2 2C H + 5O → 4CO + 2H O 2 2 2 2 2
HƯỚNG DẪN VỀ NHÀ Ghi nhớ Hoàn thành Chuẩn bị kiến thức bài tập bài bài 16 trong bài trong sbt. CẢM ƠN CÁC EM
ĐÃ LẮNG NGHE BÀI GIẢNG!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45




