




















Preview text:
CHƯƠNG 7. NHÓM VIIA
Bài 17. TÍNH CHẤT VẬT LÝ VÀ HÓA HỌC CÁC ĐƠN CHẤT NHÓM VIIA
Khi nhạc nổi lên, các HS
trong lớp sẽ lần lượt chuyền mũ cho nhau theo hang ngang, từ trên
xuống dưới. Nhạc dừng, HS nào đang giữ mũ sẽ
phải kể tên một nguyên
tố halogen hoặc một hợp chất trong tự nhiên có chứa halogen mà em biết.
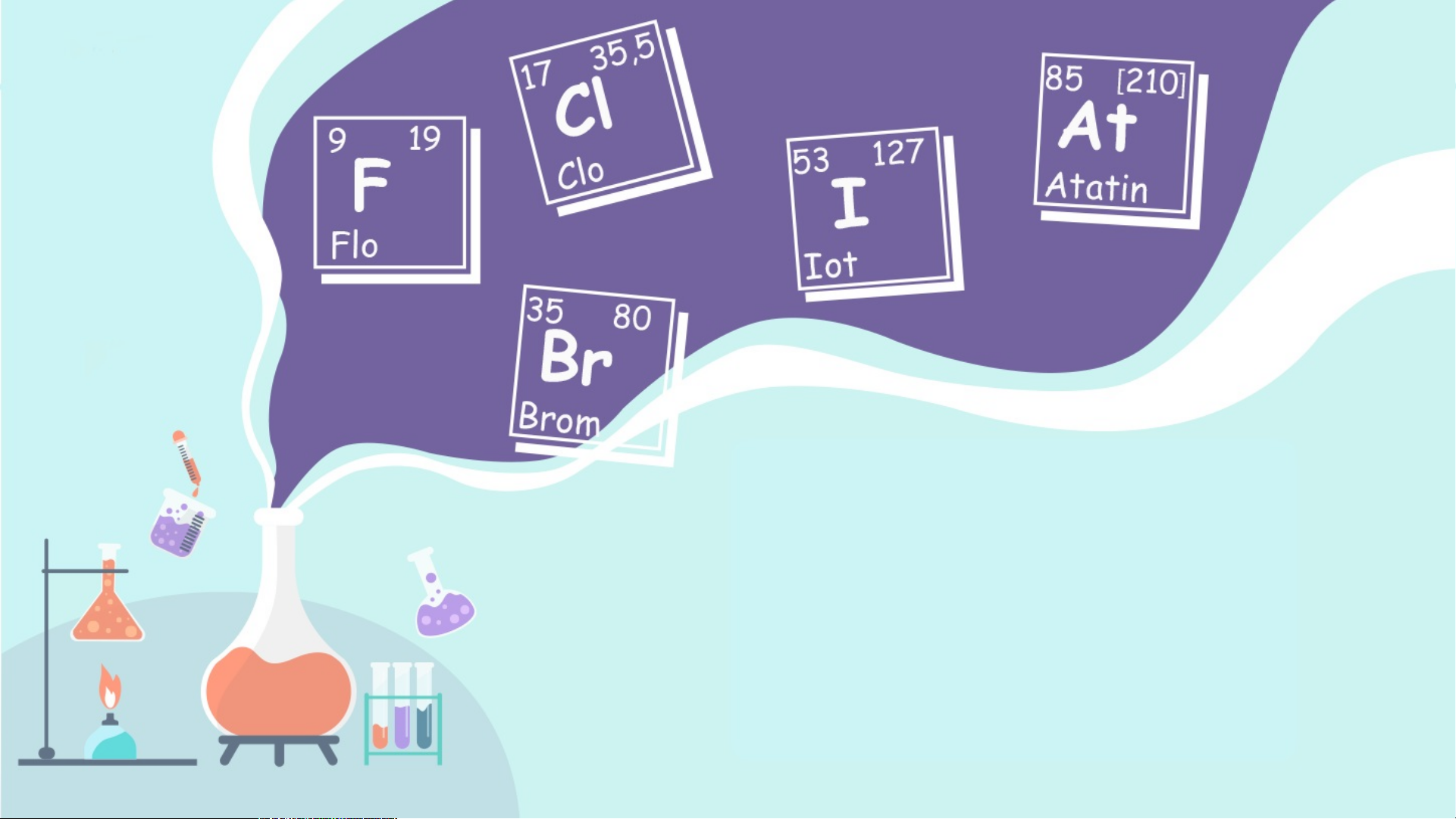
I. Trạng thái tự nhiên. Các F Cl Br I 2 2 2 2 nguyên tố nhóm halogen
- Trong tự nhiên, các halogen tồn tại ở
dạng hợp chất, chủ yếu là các muối halide. Trạng thái Quặng Nước biển, Quặng Quặng
- Clo là nguyên tố halogen chiếm hàm
tự nhiên fluorite CaF , quặng halite bromargytite iodargyrite 2 lượng lớn nhất. fluorapatite NaCl (muối AgBr AgI Ca (PO ) F, mỏ), syvite 5 4 3 cryolite KCl… Na AlF 3 6 Criolite Flourite
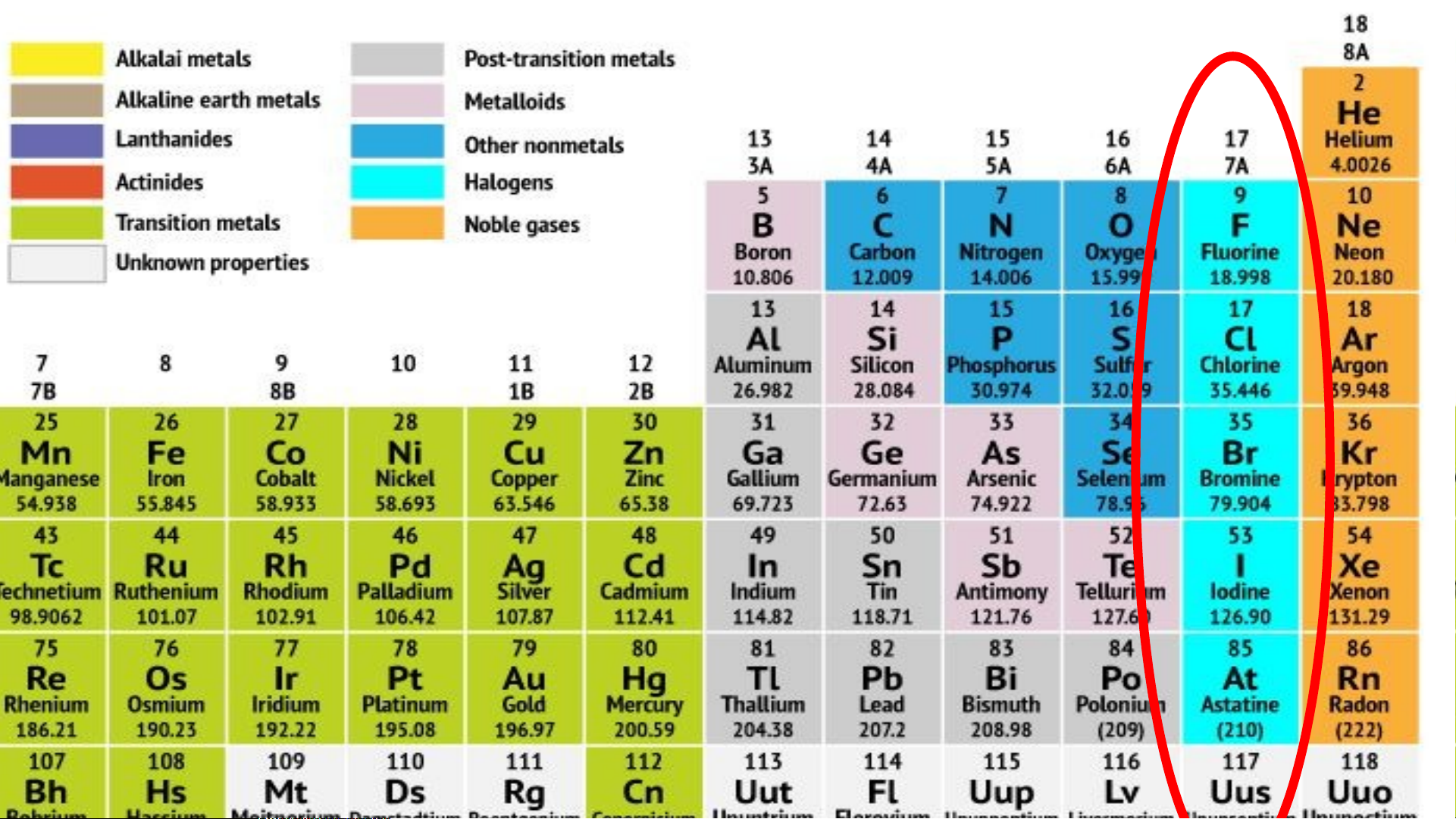
II. VỊ TRÍ – CẤU HÌNH ELECTRON NGUYÊN TỬ
Các nguyên tố nhóm F Cl Br I 2 2 2 2 halogen Vị trí Ô số 9 Ô số 17 Ô số Ô số chu kì chu kì 35 53 2 3 chu kì chu kì 4 5
Cấu hình electron 1s22s22 [Ne]3s2 [Ar] [Kr] p5 3p5 3d104s2 4d105s2 4p5 5p5
III. TÍNH CHẤT VẬT LÝ Chia lớp làm 8 nhóm. Các nhóm tìm hiểu về tính chất vật lý của flourum, chlorum, bromum, iodum và hoàn thành phiếu số 2. GV sẽ gọi bất kì để trả lời. Đặc điểm F Cl Br I 2 2 2 2 Trạng thái (state) Gas Gas Liquid Solid Màu sắc Lục nhạt Vàng lục Nâu đỏ Đen tím
Nhiệt độ nóng chảy -219,6 -101,0 -7,3 113,6 (oC) Nhiệt độ sôi (oC) -1 88,1 -3 4,1 -5 9,2 1 89,5 Độ âm điện 3, 98 3 ,16 2 ,96 2, 66
IV. Tính chất hóa học - Cấu hình electron: ns2np5
-> dễ nhận 1e -> tính oxi hóa mạnh
- Tạo liên kết cộng hóa trị trong các hợp chất. 1. Fluorine Người Tác nhân
tìm hiểu phản ứng tính chất Tính chất PTHH HOẠT với ĐỘNG và viết Fluorum NHÓM PTHH HS… Iron Zinc HS… Hidroxide. Sulfur. HS……. Hidrogen oxide. 2. Chlorine
Người ghi Tác nhân
hiện tượng phản ứng Hiện tượng
Phương trình hóa học và PTHH với Chlorum HS………. Iron HS………. Copper HS………. Hidrogen HS…….... Giấy màu. HS…….... DD NaOH 3. Bromine và Iodine
Người ghi Tác nhân hiện phản ứng Hiện tượng
Phương trình hóa học tượng và với quan sát được đề xuất PTHH Bromum HS Lá ………. aluminium HS DD sulfur ………. dioxide
Người ghi Tác nhân hiện Hiện tượng
Phương trình hóa học phản ứng tượng và quan sát được đề xuất với iodum PTHH HS …… Lá aluminium HS……… Nhiệt độ HS……… Hồ tinh bột .
4. So sánh phản ứng của các halogen với hydrogen
Khả năng phản ứng của các halogen với hydrogen thay
đổi thế nào khi đi từ F2 đến I2? H2 + F2 2HF askt H Khả năng phản 2 + Cl2 2HCl to H ứng với hydrogen 2 + Br2 2HBr
giảm dần khi đi từ 350-500oC, Pt H2 + I2 2HI florine đến iodine.
5. Phản ứng với dung dịch muối halide NaBr + Cl2 -> NaCl + Br2 NaI + Cl2 -> NaCl + I2
I2 làm hồ tinh bột hóa xanh.
Các halogen đứng trước (trừ florine) sẽ đẩy
được các halogen đứng sau ra khỏi muối. V. Ứng dụng Quan sát video sau và ghi nhớ các thông tin về ứng dụng của halogen. 15 phút DẶN DÒ
Luyện tập viết các PTHH chứng minh tính
chất của các halogen.
Vẽ lại sơ đồ tư duy bản thân tâm đắc nhất trong tiết vào vở.
Tìm hiểu về hydrogen halide và một số
phản ứng đặc trưng của ion halide.
Document Outline
- CHƯƠNG 7. NHÓM VIIA
- Slide 2
- I. Trạng thái tự nhiên.
- Slide 4
- Slide 5
- II. VỊ TRÍ – CẤU HÌNH ELECTRON NGUYÊN TỬ
- III. TÍNH CHẤT VẬT LÝ
- Slide 8
- IV. Tính chất hóa học
- Slide 10
- Slide 11
- 2. Chlorine
- Slide 13
- 3. Bromine và Iodine
- Slide 15
- Slide 16
- 4. So sánh phản ứng của các halogen với hydrogen
- 5. Phản ứng với dung dịch muối halide
- Slide 19
- V. Ứng dụng
- Slide 21
- 15 phút
- Slide 23
- DẶN DÒ
- Slide 25




