
















Preview text:
CHÀO MỪNG CÁC EM
ĐẾN VỚI TIẾT HỌC HÔM NAY!
Từ rất lâu, các nhà khoa học đã nghiên
cứu các mô hình nguyên tử và cập nhật
chúng thông qua việc thu thập những
dữ liệu thực nghiệm. Nguyên tử gồm
những hạt cơ bản nào? Cơ sở nào để
phát hiện ra các hạt cơ bản đó và chúng có tính chất gì?
CHƯƠNG 1: CẤU TẠO NGUYÊN TỬ
BÀI 2: THÀNH PHẦN CỦA NGUYÊN TỬ NỘI DUNG BÀI HỌC 01 02 03 Thành phần cấu tạo Sự tìm ra electron Sự khám phá hạt nhân nguyên tử nguyên tử 04 05 Cấu tạo hạt nhân
Kích thước và khối lượng nguyên tử nguyên tử
1. Thành phần cấu tạo nguyên tử
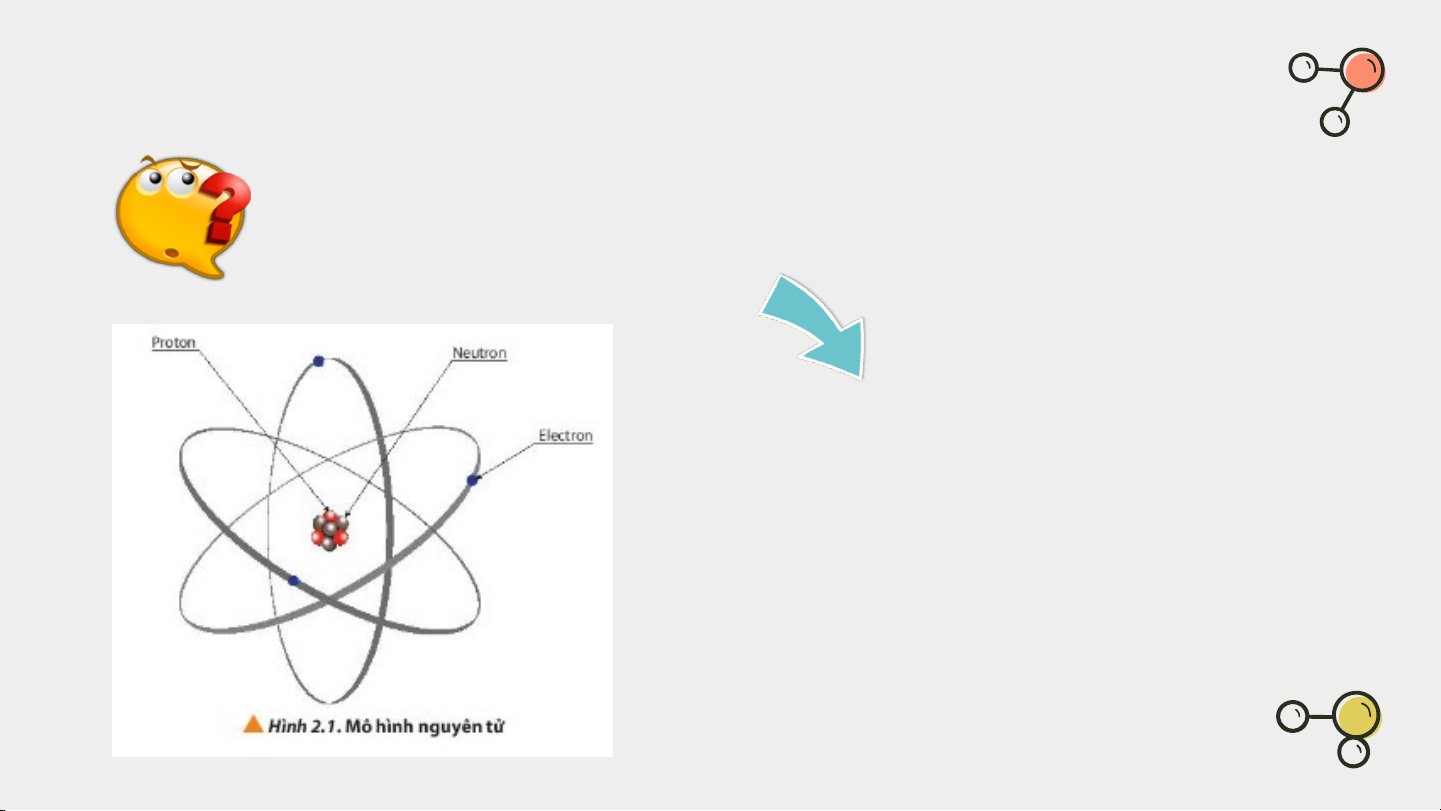
Quan sát hình 2.1 và cho biết các thành phần nguyên tử
gồm những loại hạt nào? Nguyên tử gồm:
Hạt nhân chứa proton, neutron.
Vỏ nguyên tử chứa electron.
2. Sự tìm ra electron
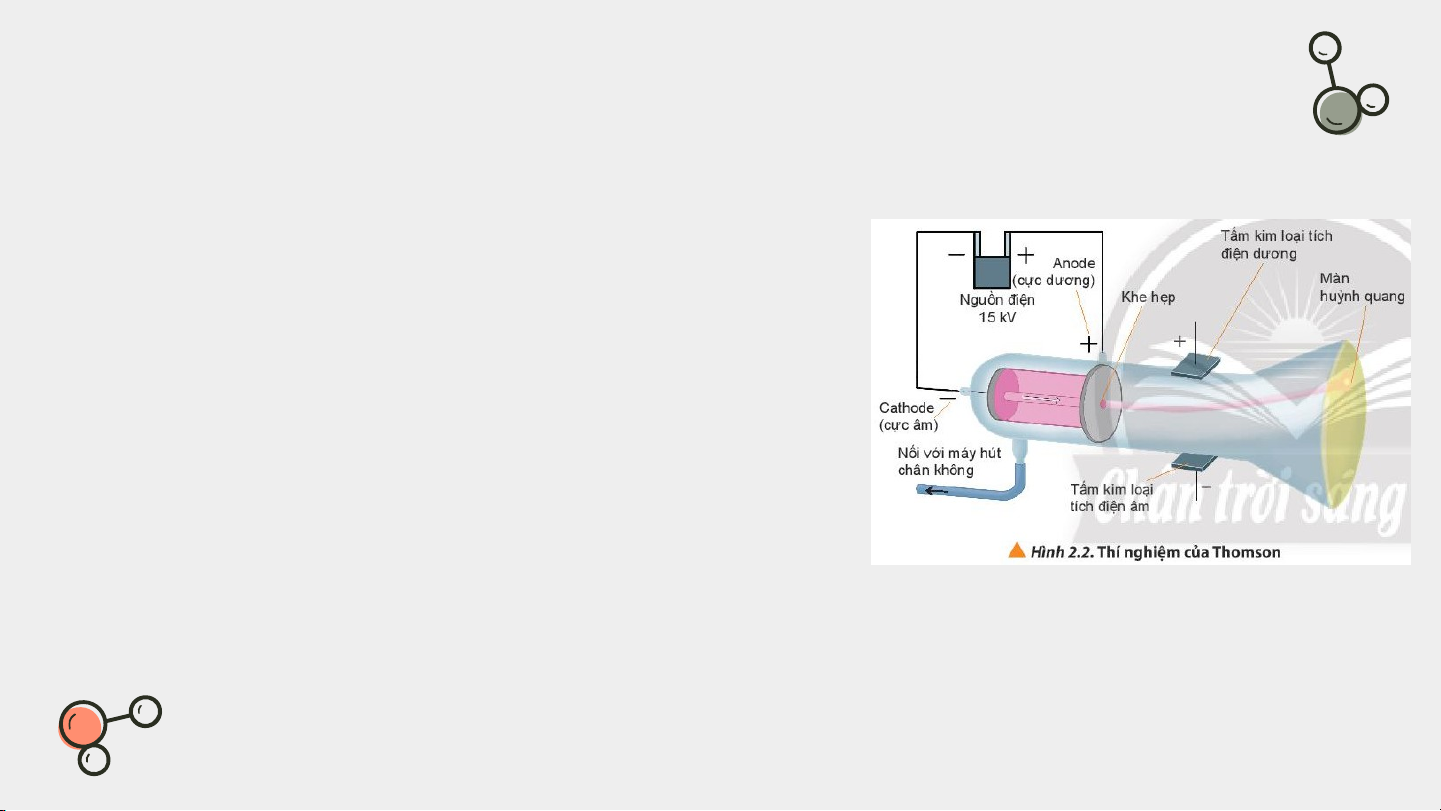
Đọc thông tin SGK, tìm hiểu thí Hình 2.2
của Thomson và trả lời câu hỏi:
Em hãy cho biết vai trò của màn huỳnh quang trong thí nghiệm.
Quan sát hình 2.2, giải thích vì sao tia âm
cực bị hút về cực dương của trường điện.
Nết đặt một chong chóng nhẹ trên đường đi của tia âm cực thì chong chóng
sẽ quay. Từ hiện tượng đó, hãy nêu kết luận về tính chất của tia âm cực?
Vai trò của màn huỳnh quang: Dùng để
hứng các tia phát ra từ cực âm
Giải thích: Tia âm cực tích điện âm nên bị
hút về cực dương của trường điện
Kết luận về tính chất tia âm cực: Tia âm
cực là một loại hạt có khối lượng và truyền theo đường thẳng.
Cả lớp cùng quan sát video về
thí nghiệm của Thomson và so
sánh với kết quả vừa tìm được.
3. Sự khám phá hạt nhân nguyên tử
Cả lớp cùng theo dõi thí nghiệm của Rutherford thông qua video sau đây
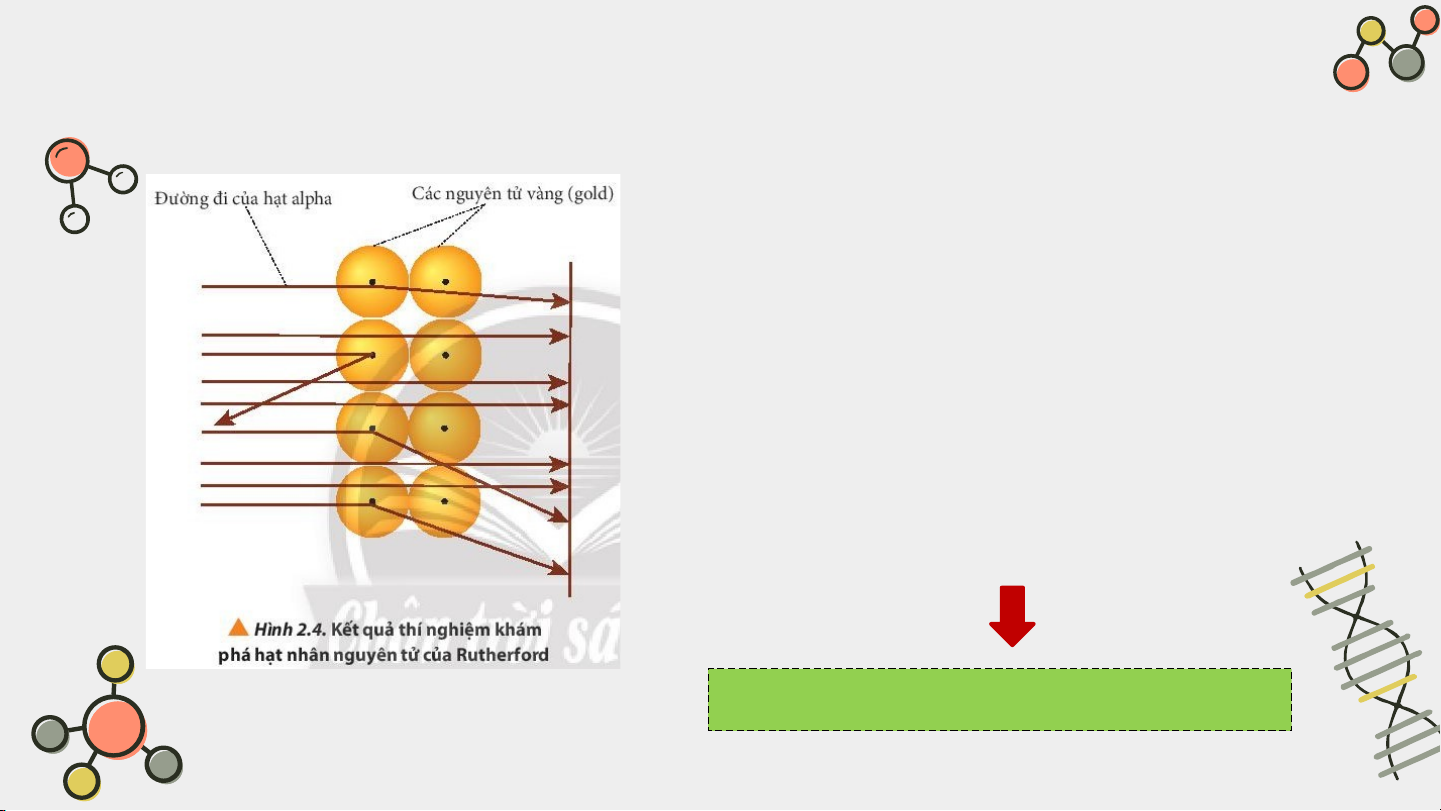
Sau khi quan sát thí nghiệm, em hãy cho biết
các hạt α có đường đi như thế nào? Giải thích?
Các hạt alpha hầu hết đều xuyên thẳng qua lá vàng.
Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt
nhân mang điện tích dương có kích thước rất nhỏ so
với kích thước nguyên tử nên các hạt alpha có thể đi xuyên qua.
Quan sát kết quả thí nghiệm của Rutherford và trả lời câu hỏi:
Ở hình 2.4, kết quả thí nghiệm
khám phá hạt ngân nguyên tử của
Rutherford, nguyên tử oxygen có
8 electron. Em hãy cho biết hạt
nhân của nguyên tử này có điện tích là bao nhiêu?
Nguyên tử này có điện tích là 8 KẾT LUẬN
Nguyên tử có cấu tạo rỗng,
Nguyên tử trung hoà về điện:
gồm hạt nhân ở trung tâm và
số đơn vị điện tích dương của
lớp vỏ ở các electron chuyển
hat nhân bằng số đơn vị điện
động xung quanh hạt nhân.
tích âm của các electron trong nguyên tử.
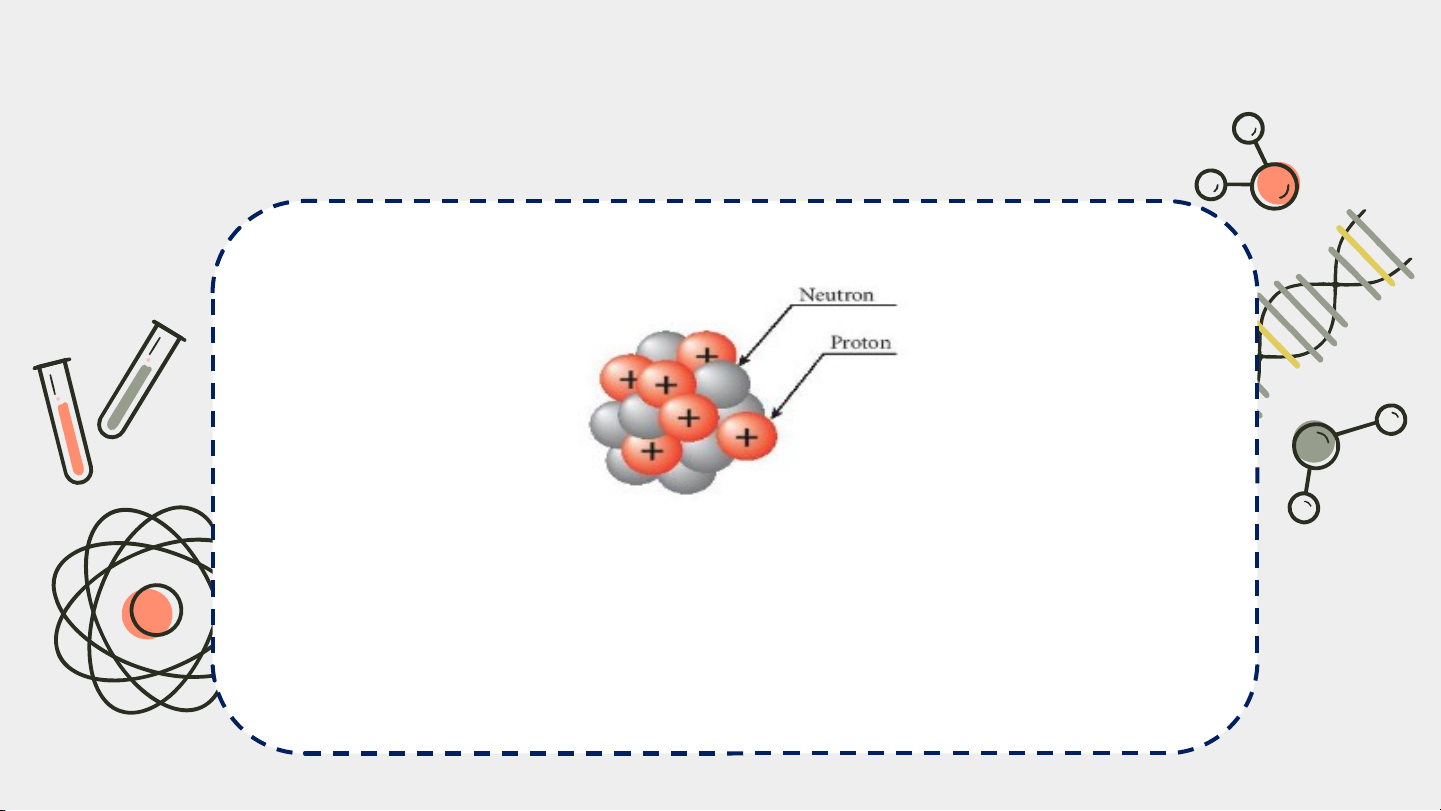
4. Cấu tạo hạt nhân nguyên tử
Đọc thông tin mục 4 SGK trang 16, 17 và trả lời câu hỏi:
Hạt nhân gồm có những loại hạt nào? Các loại hạt đó mang điện tích gì?
proton (+1) và neutron (không mang điện)
Nguyên tử natri (sodium) có điện tích hạt nhân là +11. 11 1
Cho biết số proton và số electron trong nguyên tử này?
Em hãy rút ra kết luận về khối lượng của proton và neutron? gần bằng nhau KẾT LUẬN
Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron
Proton mang điện tích dương (+1)
Neutron không mang điện
Proton và neutron có khối lượng gần bằng nhau.
5. Kích thước và khối lượng nguyên tử
a. So sánh kích thước nguyên tử và hạt nhân nguyên tử
Đọc thông tin mục 5 trang 17
SGK và trả lời câu hỏi:
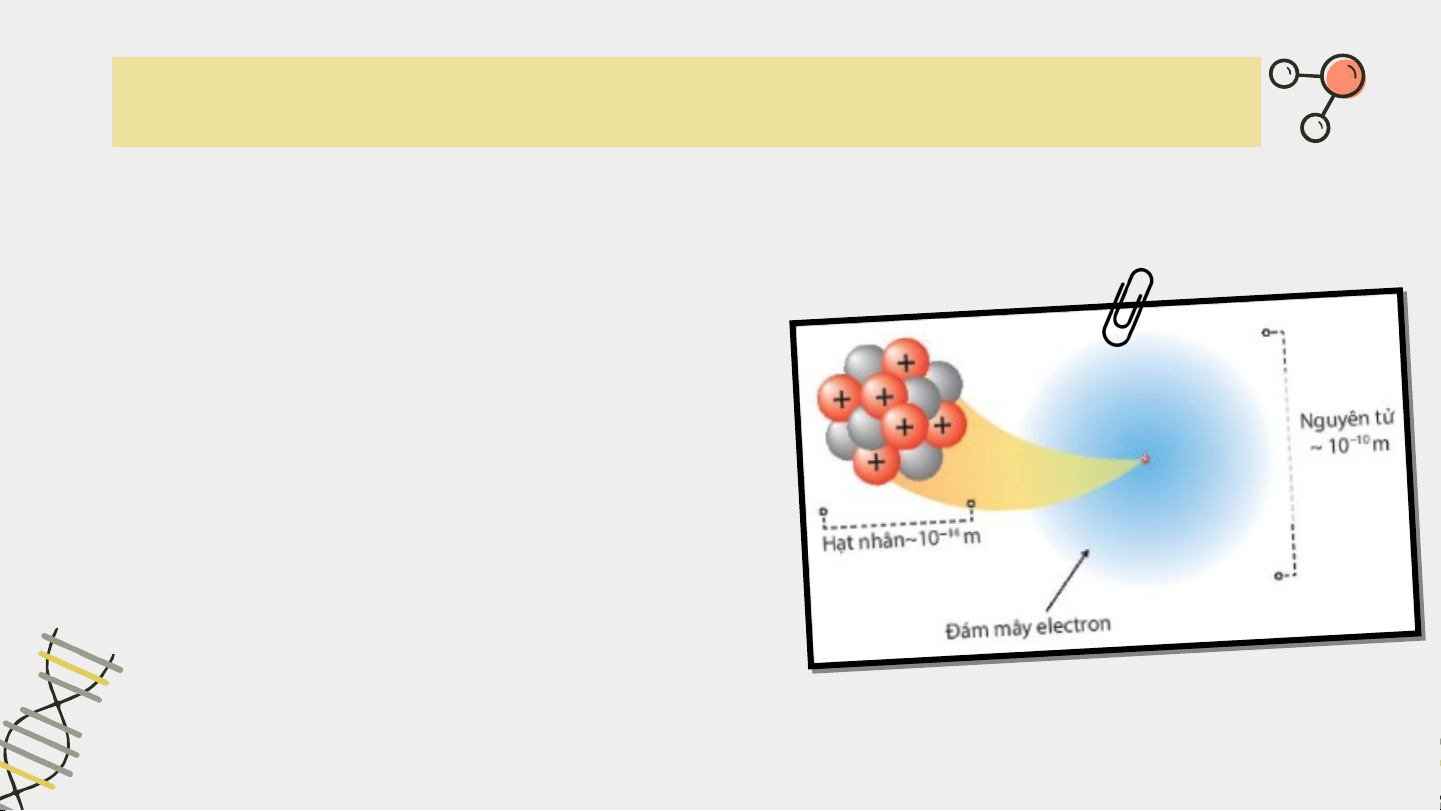
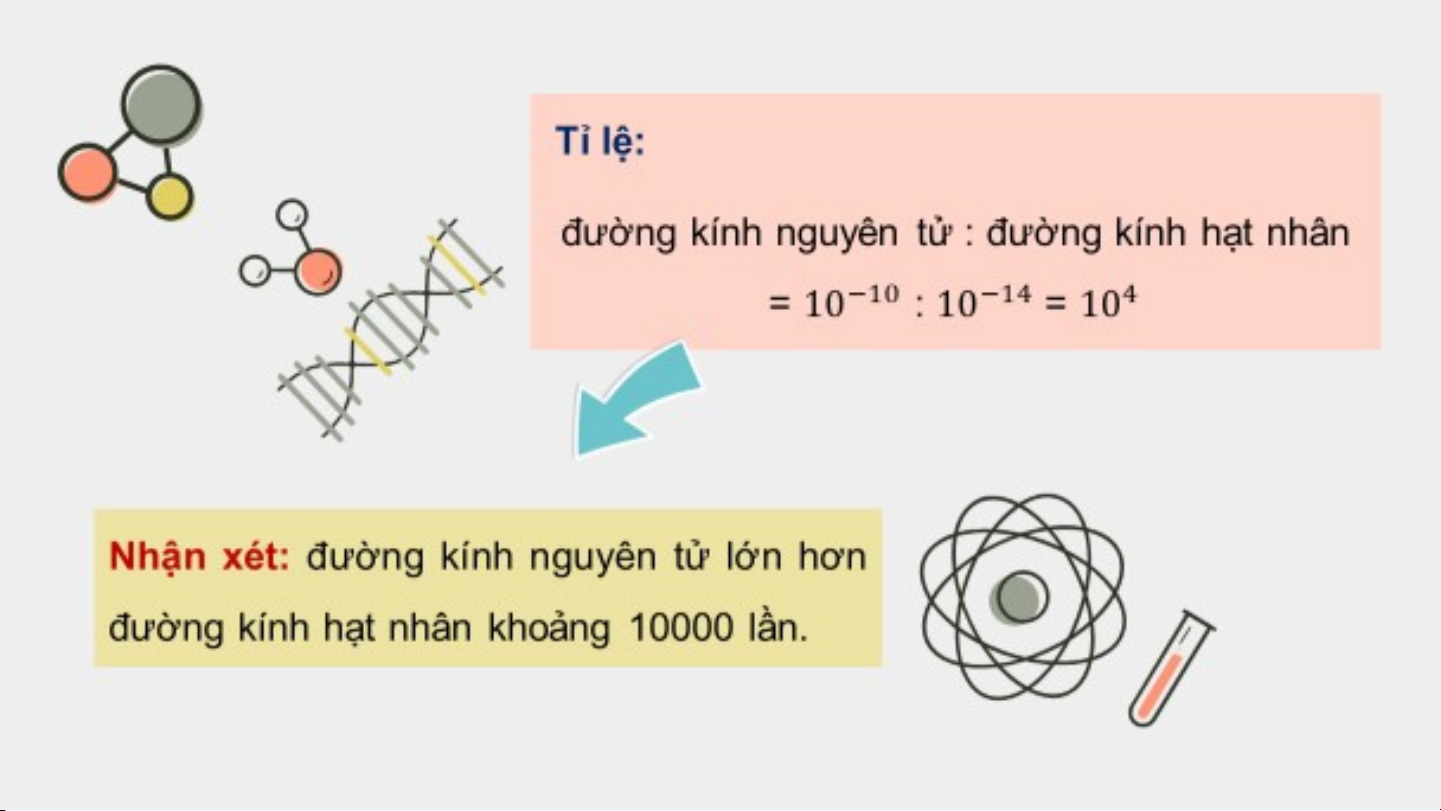
Quan sát Hình 2.6, hãy lập tỉ lệ
giữa đường kính nguyên tử và
đường kính hạt nhân của nguyên
tử carbon. Từ đó, rút ra nhận xét.
Để biểu thị kích thước nguyên tử, ta sử dụng đơn vị nào?
Đơn vị nanomet (nm) hay angstrom (Å)
1 nm = m; 1 Å = m; 1nm = 10 Å KẾT LUẬN
Nếu xem nguyên tử như một quả cầu, trong đó các
electron chuyển động rất nhanh xung quanh hạt nhân
thì nguyên tử đó có đường kính khoảng m và đường
kính hạt nhân khoảng m. Như vậy, đường kính của
nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
b. Tìm hiểu khối lượng của nguyên tử
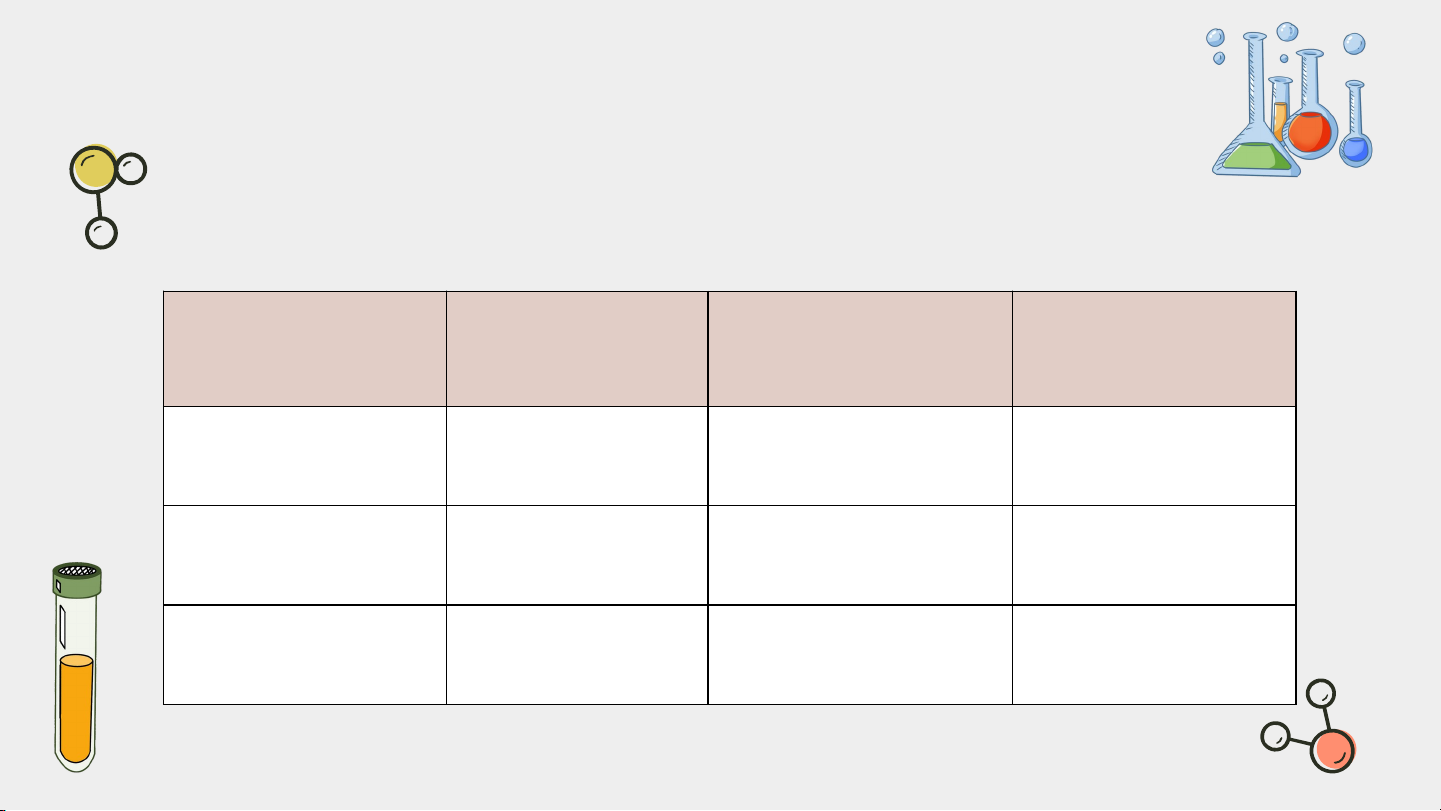
Bảng 2.1. Một số tính chất của các loại hạt cơ bản trong nguyên tử Điện tích Khối lượng Khối lượng Hạt tương đối (amu) (g) p + 1 ≈ 1 1,673 × n 0 ≈ 1 1,675 × e - 1 ≈ 0,00055 9,11 ×
Thảo luận cặp đôi:
Dựa vào Bảng 2.1, hãy lập tỉ lệ
khối lượng của một proton với
khối lượng của một electron.
Kết quả này nói lên điều gì?
Tỉ lệ: = 1840 (lần)
Kết quả này cho thấy khối lượng của các hạt
electron không đáng kể so với khối lượng của
proton và neutron, do đó khối lượng của
nguyên tử gần bằng khối lượng của hạt nhân. KẾT LUẬN
Khối lượng của nguyên tử gần bằng
khối lượng hạt nhân do khối lượng
của các electron không đáng kể so với
CREDITS: This presentation template was created
by Slidesgo, including icons by Flaticon, and
khối lượng của proton và neutron.
infographics & images by Freepik. LUYỆN TẬP
Câu 1. Hãy cho biết dữ kiện nào trong thí nghiệm của Rutherford
chứng minh nguyên tử có cấu tạo rỗng.
Hầu hết các hạt alpha đều xuyên thẳng qua lá
vàng điều đó chứng tỏ nguyên tử có cấu tạo rỗng
nên các hạt alpha có thể đi xuyên qua lá vàng.
Câu 2. Thông tin nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu
B. Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu
C. Neutron không mang điện, khối lượng gần bằng 1 amu
D. Nguyên tử trung hòa điệ, có kích thước lớn hơn nhiều so với
hạt nhân, nhưng có khối lượng gần bằng khối lượng hạt nhân. VẬN DỤNG Bài 4 (SGK - tr.19)
a) Cho biết 1g electron có bao nhiêu hạt ?
b) Tính khối lượng của 1 mol electron (biết hằng số Avogadro có giá trị là 6,022 x ) Giả i i
a) Vì 1 hạt electron nặng 9,11 × 10-28 g nên 1 g electron
có số hạt là: = 1,098 × 1027 (hạt) VẬN DỤNG Bài 4 (SGK - tr.19)
a) Cho biết 1g electron có bao nhiêu hạt ?
b) Tính khối lượng của 1 mol electron (biết hằng số Avogadro có giá trị là 6,022 x ) Giả i i
b) 1 mol electron có chứa số hạt là 6,022 × 1023 hạt
Do đó 1 mol electron có khối lượng là:
6,022 × 1023 × 9,11 × 10-28 = 5,486 × 10-4 (g)
HƯỚNG DẪN VỀ NHÀ Hoàn thành bài tập trong SBT Ghi nhớ các kiến thức đã học Đọc trước bài sau -
Bài 3: Nguyên tố hóa học CẢM ƠN CÁC EM
ĐÃ LẮNG NGHE BÀI GIẢNG!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- 05
- 1. Thành phần cấu tạo nguyên tử
- 2. Sự tìm ra electron
- Slide 7
- Slide 8
- Slide 9
- 3. Sự khám phá hạt nhân nguyên tử
- Slide 11
- Slide 12
- Slide 13
- KẾT LUẬN
- 4. Cấu tạo hạt nhân nguyên tử
- KẾT LUẬN
- 5. Kích thước và khối lượng nguyên tử
- Slide 18
- Slide 19
- KẾT LUẬN
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- LUYỆN TẬP
- Slide 27
- Slide 28
- VẬN DỤNG
- VẬN DỤNG
- HƯỚNG DẪN VỀ NHÀ
- CẢM ƠN CÁC EM ĐÃ LẮNG NGHE BÀI GIẢNG!