















Preview text:
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI.
PHIẾU HỌC TẬP SỐ 01 U KÍ HIỆU SỐ HIỆU TÊN
TIÊU CHÍ ĐÁNH GIÁ U TIÊU CHÍ ĐIỂM TỐI ĐA ĐIỂM ĐẠT Chu đáo, cẩn thận 1 đ Kết quả đúng hết 5 đ
Hợp tác, nghiêm túc làm việc 1 đ Thuyết trình tốt 2 đ Nộp bài sớm 1 đ NHIỆM VỤ 01 U Hãy ghi kí hiệu 5 nguyên tố, số hiệu nguyên tử và đọc tên các nguyên tố có trong nhãn “nước khoáng
thiên nhiên”. Đại diện nhóm lên báo cáo kết quả - qua Zalo nhóm Bài 2
NGUYÊN TỐ HÓA HỌC U I
NGUYÊN TỐ HÓA HỌC.
II KÍ HIỆU NGUYÊN TỬ. II ĐỒNG VỊ. I I NGUYÊN TỬ KHỐI V
I NGUYÊN TỐ HÓA HỌC.
Nguyên tố hóa học là tập hợp các nguyên tử có cùng
số proton trong hạt nhân nguyên tử.
Vì số proton P = số hiệu nguyên tử Z
Nguyên tố hóa học là tập hợp các nguyên tử có cùng
số đơn vị điện tích hạt nhân. I
NGUYÊN TỐ HÓA HỌC.
Các electron quyết định tính chất hóa học của các nguyên tử
Vì số proton = số electron
Các nguyên tử của một nguyên tố hóa học có tính chất giống nhau. KẾT LUẬN :
1. Nguyên tố hóa học là tập hợp các nguyên tử có
cùng số đơn vị điện tích hạt nhân.
2. Các nguyên tử của một nguyên tố hóa học có tính
chất hóa học giống nhau. 3. …. LUYỆN TẬP U
Câu hỏi 1 (trang 17): Cho các nguyên tử sau: L (Z = 8; A = 16),
D (Z = 9; A = 19), E (Z = 8; A = 18), G (Z = 7; A = 15). Trong các
nguyên tử trên, các nguyên tử nào thuộc cùng một nguyên tố
hóa học? Phân tích và giải thích Ng. tử L D E G L và E thuộc cùng 1 nguyên tố hóa Z 8 9 8 7 học, vì chúng có A 16 19 18 15 cùng số đơn vị điện tích hạt nhân Bài 2
NGUYÊN TỐ HÓA HỌC U I
NGUYÊN TỐ HÓA HỌC.
II KÍ HIỆU NGUYÊN TỬ. II ĐỒNG VỊ. I I NGUYÊN TỬ KHỐI V I
I KÍ HIỆU NGUYÊN TỬ.
Kí hiệu nguyên tử helium cho ta biết được những thông tin gì? KẾT LUẬN :
1. Nguyên tố hóa học là tập hợp các nguyên tử có
cùng số đơn vị điện tích hạt nhân.
2. Các nguyên tử của một nguyên tố hóa học có tính
chất hóa học giống nhau.
3. Kí hiệu nguyên tử cho biết kí hiệu nguyên tố, số
khối, số proton, số electron, số neutron. 4. …. NHIỆM VỤ 02 U
Câu hỏi 2 (trang 18): Kí hiệu của một nguyên tử cho biết
những thông tin gì? Cho ví dụ
Câu hỏi 3 (trang 18): hãy biểu diễn kí hiệu của một số nguyên tử sau:
a) Nitrogen (số proton = 7 và số neutron = 7).
b) Phosphorus (số proton = 15 và số neutron = 16).
c) Copper (số proton = 29 và số neutron = 34). Bài 2
NGUYÊN TỐ HÓA HỌC U I
NGUYÊN TỐ HÓA HỌC.
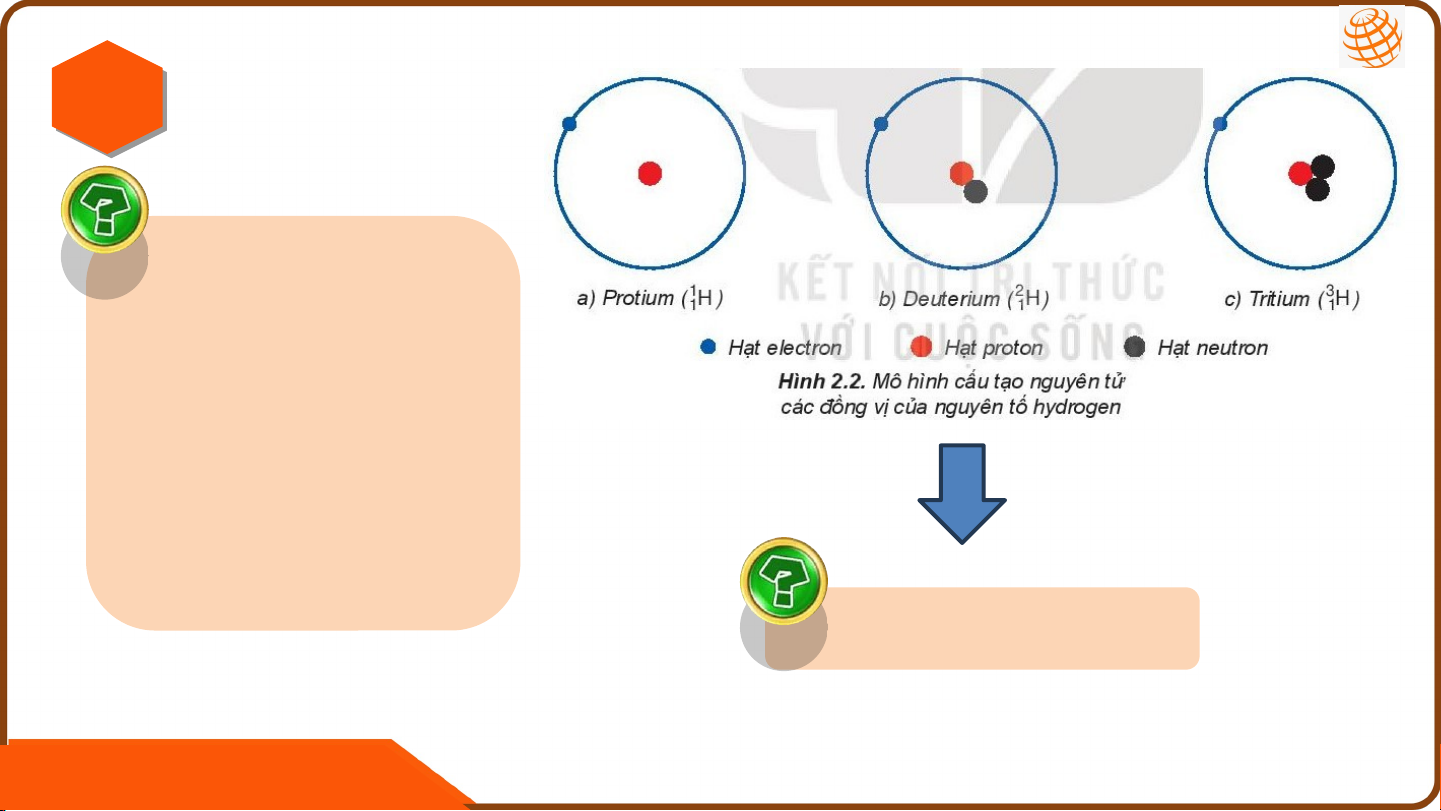
II KÍ HIỆU NGUYÊN TỬ. II ĐỒNG VỊ. I I NGUYÊN TỬ KHỐI V II ĐỒNG VỊ. I Quan sát hình 2.2 SGK trang 18 chỉ ra sự khác nhau giữa các nguyên tử cùng loại này. Đồng vị là gì? KẾT LUẬN :
1. Nguyên tố hóa học là tập hợp các nguyên tử có
cùng số đơn vị điện tích hạt nhân.
2. Các nguyên tử của một nguyên tố hóa học có tính
chất hóa học giống nhau.
3. Kí hiệu nguyên tử cho biết kí hiệu nguyên tố, số
khối, số proton, số electron, số neutron.
4. Đồng vị là những nguyên tử có cùng số proton
nhưng có số neutron khác nhau. NHIỆM VỤ 03 U
Câu hỏi 4 (trang 18): Xác định thành phần nguyên tử (số
proton, neutron, electron) của mỗi đồng vị sau: a) , , b) , , , Bài 2
NGUYÊN TỐ HÓA HỌC U I
NGUYÊN TỐ HÓA HỌC.
II KÍ HIỆU NGUYÊN TỬ. II ĐỒNG VỊ. I I NGUYÊN TỬ KHỐI V I NGUYÊN TỬ KHỐI V
1. NGUYÊN TỬ KHỐI:
Nguyên tử khối là khối lượng tương đối của nguyên tử,
được tính xấp xỉ số khối của hạt nhân Nguyên tử khối của He là: A = 4 I NGUYÊN TỬ KHỐI V
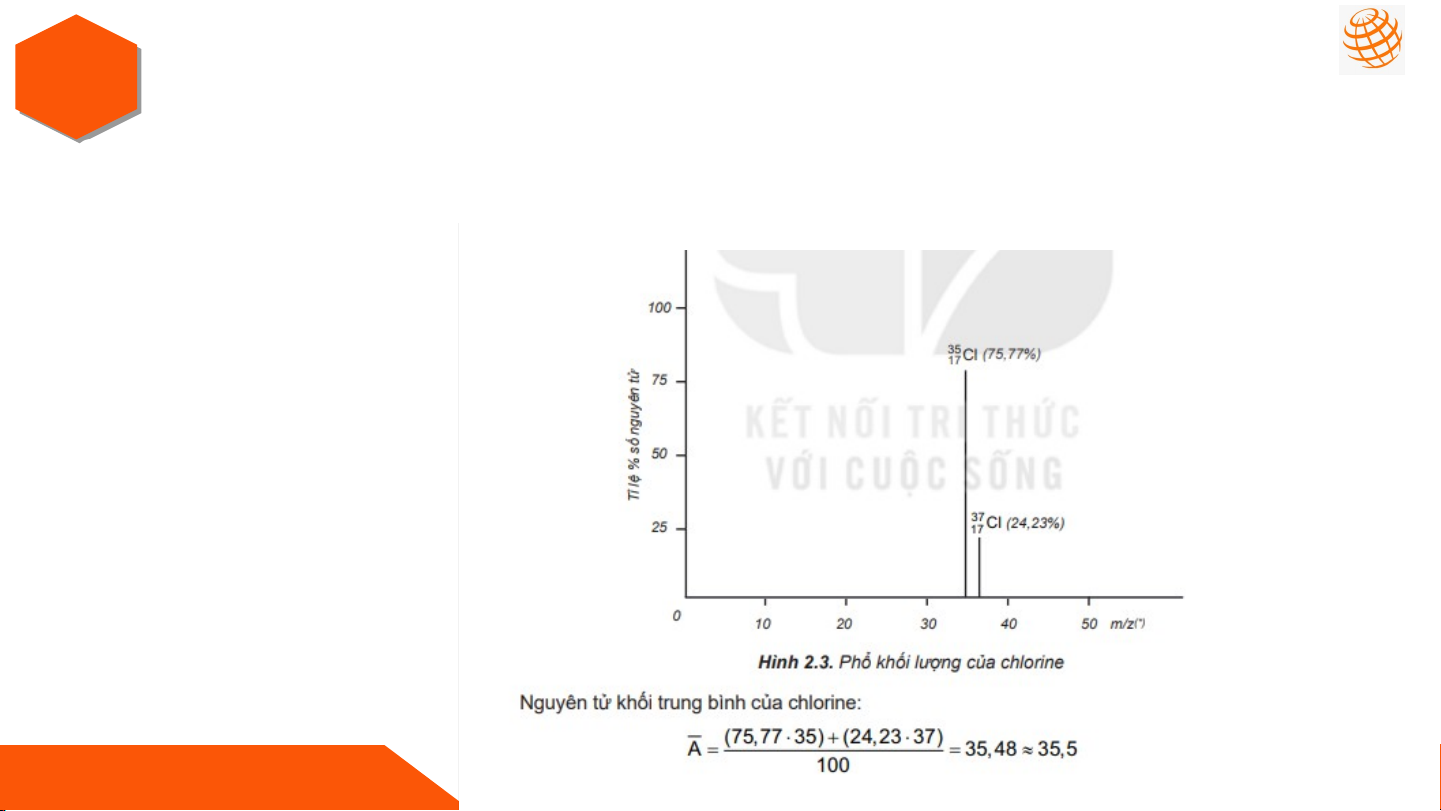
2. NGUYÊN TỬ KHỐI TRUNG BÌNH:
Nguyên tử khối của một nguyên tố là nguyên tử khối trung
bình của hỗn hợp các đồng vị của nguyên tố đó I NGUYÊN TỬ KHỐI V
2. NGUYÊN TỬ KHỐI TRUNG BÌNH:
KẾT LUẬN : (cần nhớ và hiểu rõ)
1. Nguyên tố hóa học là tập hợp các nguyên tử có
cùng số đơn vị điện tích hạt nhân ...
2. Các nguyên tử của một nguyên tố hóa học có tính
chất hóa học giống nhau. ...
3. Kí hiệu nguyên tử cho biết kí hiệu nguyên tố, số
khối, số proton, số electron, số neutron. ...
4. Đồng vị là những nguyên tử có cùng số proton
nhưng có số neutron khác nhau. ...
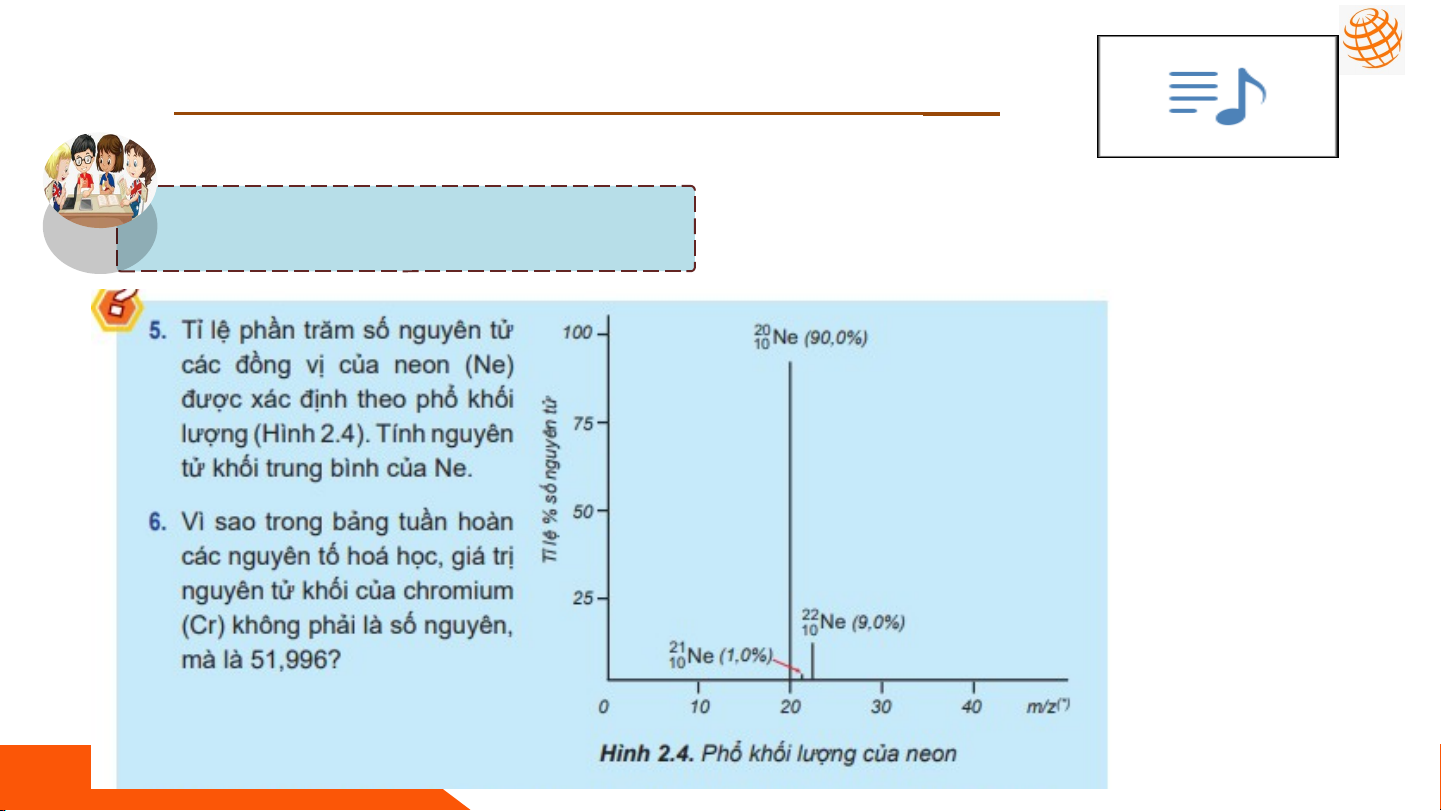
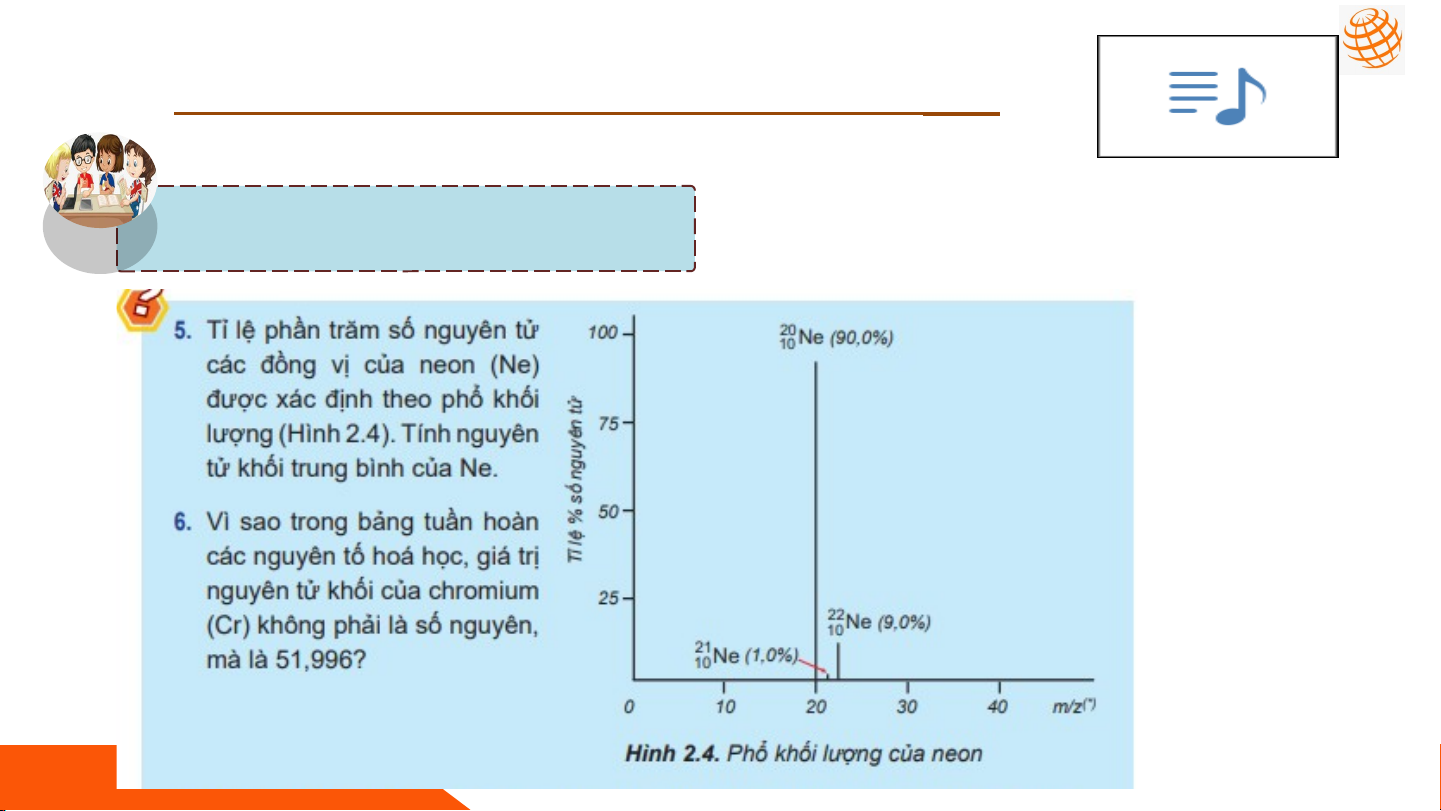
5. Công thức tính nguyên tử khối trung bình ... NHIỆM VỤ 04 U Câu hỏi 5 (trang 20): NHIỆM VỤ 04 U Câu hỏi 6 (trang 20): NHIỆM VỤ 04 U Câu hỏi 7 (trang 20):
Document Outline
- CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI.
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28




