















Preview text:
BÀI 6
XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH
CHẤT CỦA NGUYÊN TỬ CÁC NGUYÊN
TỐ TRONG MỘT CHU KÌ VÀ TRONG MỘT NHÓM
CHÀO MỪNG CÁC EM ĐẾN VỚI
BÀI HỌC NGÀY HÔM NAY! KHỞI ĐỘNG Hãy dự đoán
• Trong một chu kì, bán kính nguyên tử của các
nguyên tố tăng hay giảm dần?
• Trong một nhóm, bán kính của nguyên tử của các
nguyên tố tăng hay giảm dần? BÀI 6
XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH
CHẤT CỦA NGUYÊN TỬ CÁC NGUYÊN
TỐ TRONG MỘT CHU KÌ VÀ TRONG MỘT NHÓM NỘI DUNG BÀI HỌC
Cấu hình electron nguyên tử của các I. nguyên tố nhóm A II. Bán kính nguyên tử III. Độ âm điện IV.
Tính kim loại và tính phi kim
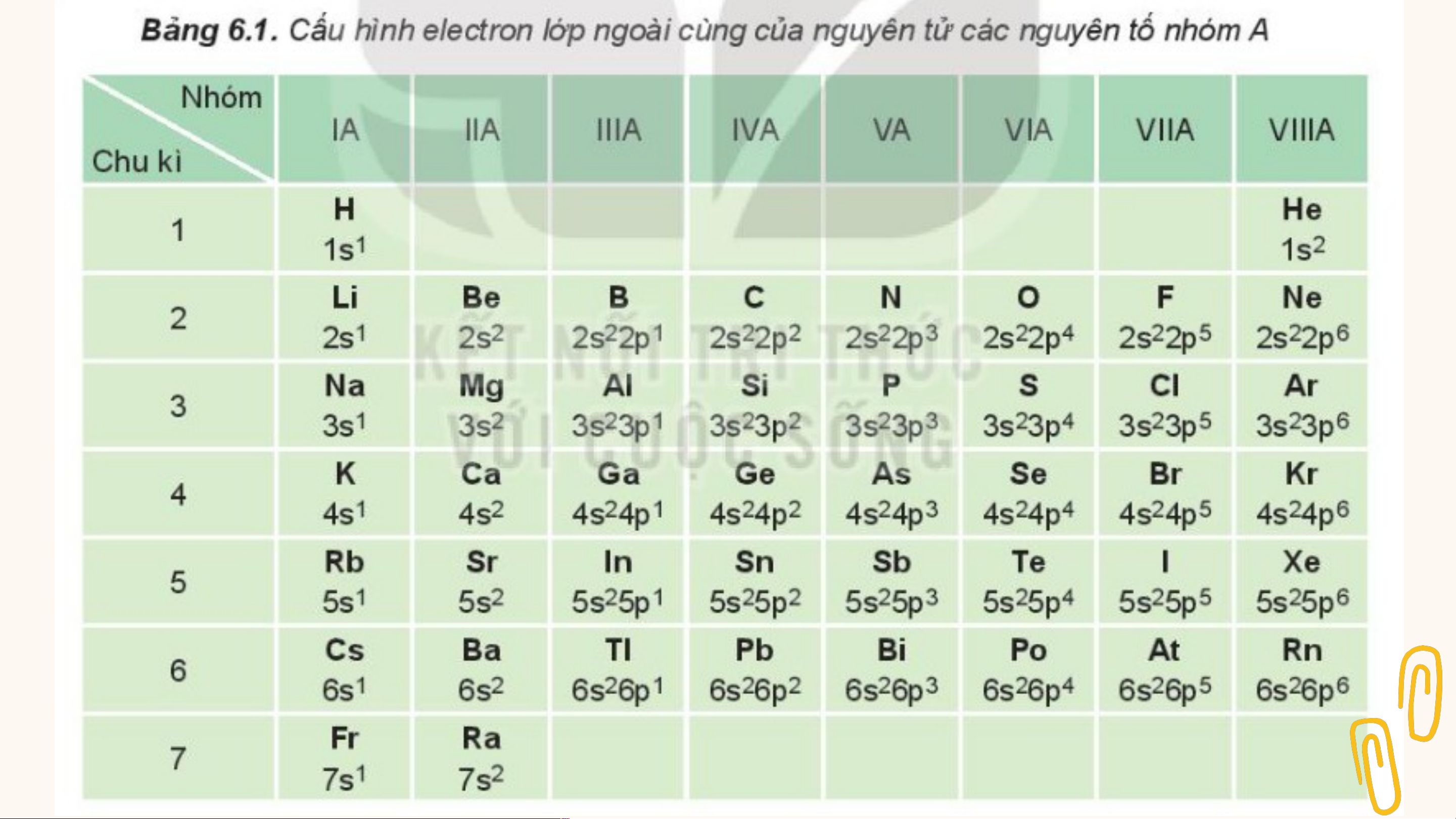
I. Cấu hình electron nguyên tử
của các nguyên tố nhóm A Sự S g ự iống n biến hau đổi củ tu a số elect ần hoàn ro c n ủ a chóa
ấu trị dẫn hình e đ l ến ectr sự on tươ lớ n p g n tự goài Nhóm A gồm các nh c au ùn v g ề tín là h ch ng ấ uy t hóa ên h
nh ọc củ ân a sự nguyên tố nhóm s và p. các ng biến đ u ổi ytê un tố ần t hrong oàn cù v n ề g tính chất các nh ng óm uy A. ên tố.
Sau mỗi chu kì, cấu hình electron lớp N V h ì ó sam o A c g ác ồm ng cá uyê c n n t g ố t u r yên ong t c ố n ùng ào m ột
ngoài cùng có lặp lại không? Điều trong 4 loại n nhóm guyê thì c n ó títố s, nh p chấ ,t d, f ?
này dẫn đến sự biến đổi như thế nào hóa học tương tự nhau?
về tính chất của các nguyên tố?
Câu 1: Dựa vào bảng 6.1, cho
biết số electron lớp ngoài cùng
của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br.
Số elctron lớp ngoài cùng của nguyên tử
các nguyên tố: Li = 1; Al = 3; Ar = 8; Ca = 2; Si = 4; Se = 6; P = 5; Br = 7. Lesson For Today
Câu 2: Nêu vị trí trong bảng tuần hoàn của các nguyên
tố có Z= 8, Z=11, Z= 17 và Z=20. Xác định số electron
hóa trị của nguyên tử các nguyên tố đó
Vị trí trong bảng tuần hoàn Số electron Nguyên tố Ô Chu kì Nhóm hóa trị Z= 8 8 2 VIA 2 Z=11 11 3 IA 1 Z= 17 17 3 VIIA 7 Z= 20 20 4 IIA 2
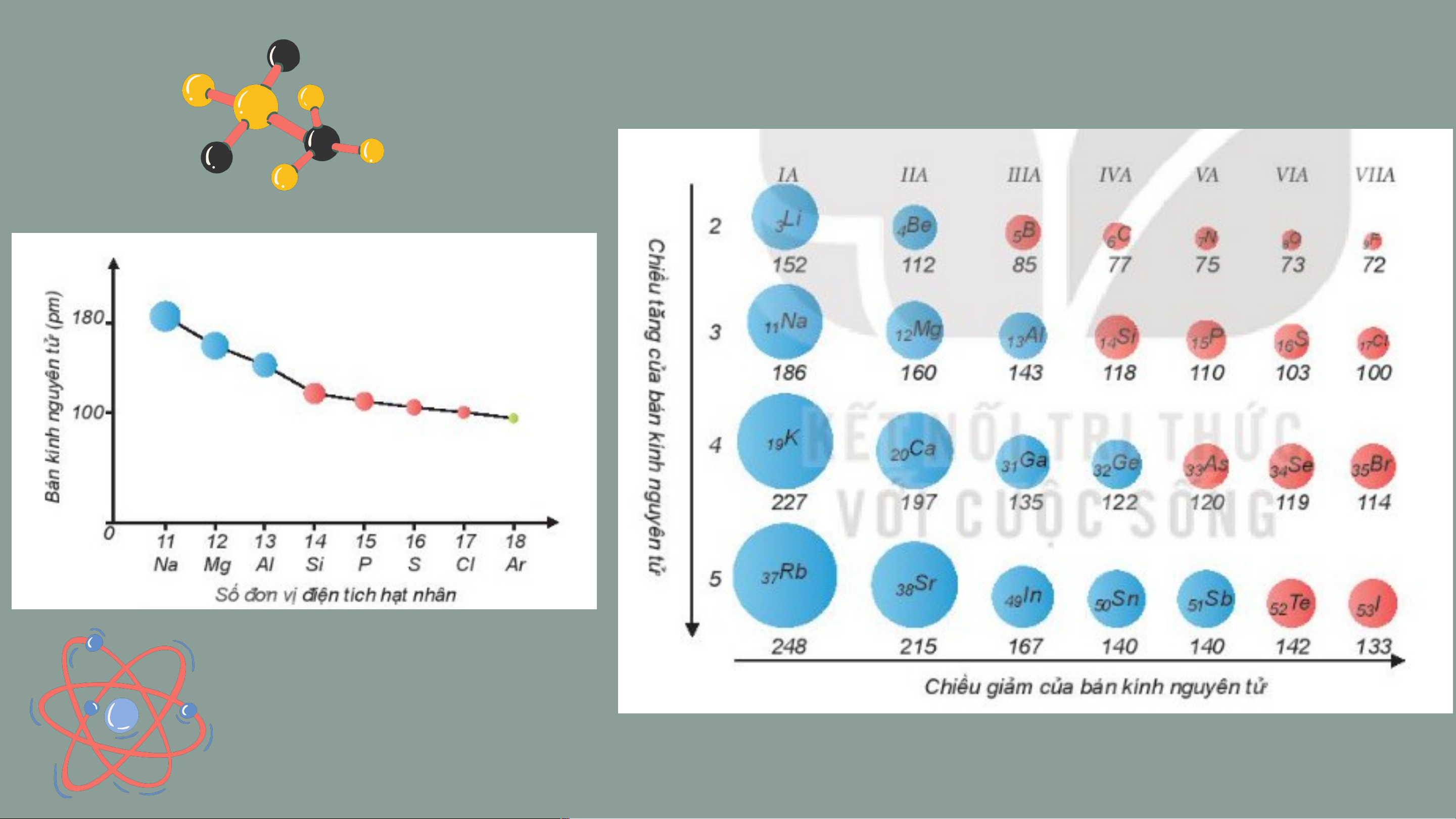
II. Bán kính nguyên tử
Electron chuyển động hỗn loạn xung quanh hạt nhân, vậy
làm thế nào để xác định được bán kính của một nguyên tử? 2r
Bán kính nguyên tử được xác định bằng một nửa khoảng cách
trung bình giữa hai hạt nhân trong chất rắn đơn chất hoặc
trong phân tử hai nguyên tử giống nhau.
Nhận xét xu hướng biến đổi bán kính tăng dần hay giảm dần trong
một chu kì, trong một nhóm A.
• Trong một chu kì, bán kính nguyên tử giảm dần
theo chiều tăng dần của điện tích hạt nhân.
• Trong một nhóm A, bán kính nguyên tử tăng
dần theo chiều tăng dần của điện tích hạt nhân.
Giải thích nguyên nhân xu hướng biến đổi bán kính dựa vào lực hút
tĩnh điện giữa hạt nhân, các electron và số lớp electron.
• Do trong một chu kì điện tích hạt nhân tăng, số lớp electron
không đổi nên lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng theo.
• Do trong một nhóm A, theo chiều từ trên xuống dưới số lớp
electron tăng dần, bán kính nguyên tử của các nguyên tố tăng
theo, mặc dù điện tích hạt nhân tăng nhanh.
Câu 3: Dựa vào bảng tuần hoàn hãy so sánh và
giải thích sự khác nhau về bán kính nguyên tử của:
a, lithium (Z=3) và potassium (Z=19)
b, calcium (Z=20) và selenium (Z-34) Đáp án
a, Lithium < potassium (cùng nhóm IA).
Trong nhóm IA, K có 4 lớp electron > Li có 2 lớp
electron, lực hút giữa hạt nhân với electron lớp ngoài
cùng của K < Li nên bán kính nguyên tử K > Li.
b, Calcium > selennium (cùng chu kì 4).
Trong chu kì 4, Se có 34 điện tích dương hạt nhân và 6
electron lớp ngoài cùng, lực hút giữa hạt nhân với
electron lớp ngoài cùng của Se > Ca ( có 20 điện tích
dương và 2 electron lớp ngoài cùng) nên bán kính nguyên tử Se < Ca. III. Độ âm điện Độ âm điện là gì ? Độ âm điện ( )
ꭓ là đại lượng đặc trưng cho khả năng hút
electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
Nhận xét xu hướng biến đổi giá trị độ âm điện trong một chu kì, trong một nhóm A
• Trong một chu kì, độ âm điện
tăng dần từ trái qua phải.
• Trong một nhóm, độ âm điện
giảm từ trên xuống dưới.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20




