


















Preview text:
BÀI 7
Định luật tuần hoàn NỘI DUNG BÀI HỌC I. QU Q A U N A N HỆ H GI G ỮA I ỮA VỊ V Ị TRÍ TR Í NG N U G Y U ÊN Y ÊN TỐ T Ố VÀ V À CẤ C U Ấ U T Ạ T O Ạ N O G N U G Y U ÊN Y ÊN TỬ C TỬ Ủ C A Ủ N A Ó N . II. I QU Q A U N A N HỆ H Ệ GI G Ữ I A A VỊ V TR T Í R VÀ V À TÍ T NH N H CH C Ấ H T Ấ T CỦ C A Ủ A N G N U G Y U Ê Y N Ê N TỐ . TỐ III I . SO . SÁ SO N SÁ H N H T Í T NH N C H H C Ấ H T Ấ T H Ó H A Ó H A Ọ H C Ọ C Ủ C A Ủ A MỘT MỘ N T G N U G Y U Ê Y N Ê N T Ố T Ố V Ớ V I Ớ C Á C C Á N G N U G Y U Ê Y N Ê N TỐ TỐ LÂN LÂ C N Ậ C N Ậ . N
Bài 7: Định luật tuần hoàn
“ Tính chất của các đơn chất, thành phần
và tính chất các hợp chất của các nguyên
tố hoá học đều biến thiên tuần hoàn theo
chiều tăng của số đơn vị điện tích hạt
nhân Z của các nguyên tố”
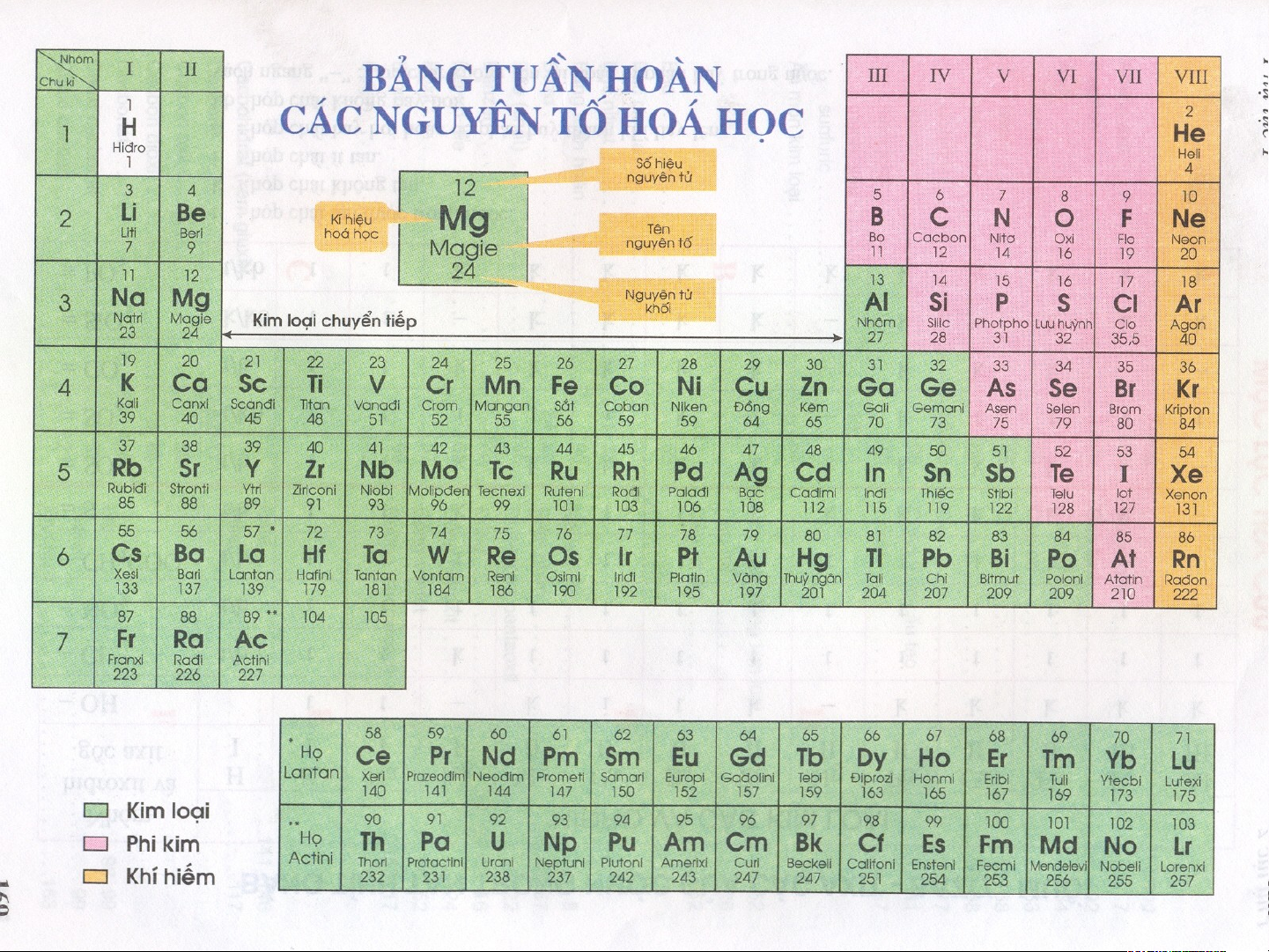
Bảng hệ thống tuần hoàn của Professor Thoedor Benfey I. Q I. U Q A U N A H N Ệ H G Ệ IỮ G A IỮ A V Ị V T Ị R T Í N R G Í N UY U Ê Y N Ê N T Ố T Ố V À V C À Ấ C U Ấ U TẠ T O Ạ N G N U G Y U Ê Y N Ê N T Ử T C Ử Ủ C A Ủ N A Ó N . Ó BÀI TẬP 1 BÀI TẬP 2
Nguyên tố có STT 20, chu kì 4, Cấu hình electron nguyên tử của nhóm IIA. Hãy cho biết:
một nguyên tố là:
- Số proton, số electron trong 1s22s22p63s23p5 nguyên tử?
Hãy cho biết vị trí của nguyên tố
- Số lớp electron trong nguyên tử? đó trong bảng tuần hoàn?
-Số eletron lớp ngoài cùng trong nguyên tử? số thứ tự 20 có 20 proton, 20 electron Chu kỳ 4 có 4 lớp e Nhóm IIA có 2e lớp ngoài cùng
Cấu hình e: 1s22s22p63s23p5
có 17 electron có 3 lớp e có 7e lớp ngoài cùng có 17 electron
số thứ tự ô nguyên tố 17 Chu kỳ 3 có 3 lớp e có 7e lớp ngoài cùng và là nguyên Nhóm VIIA tố p
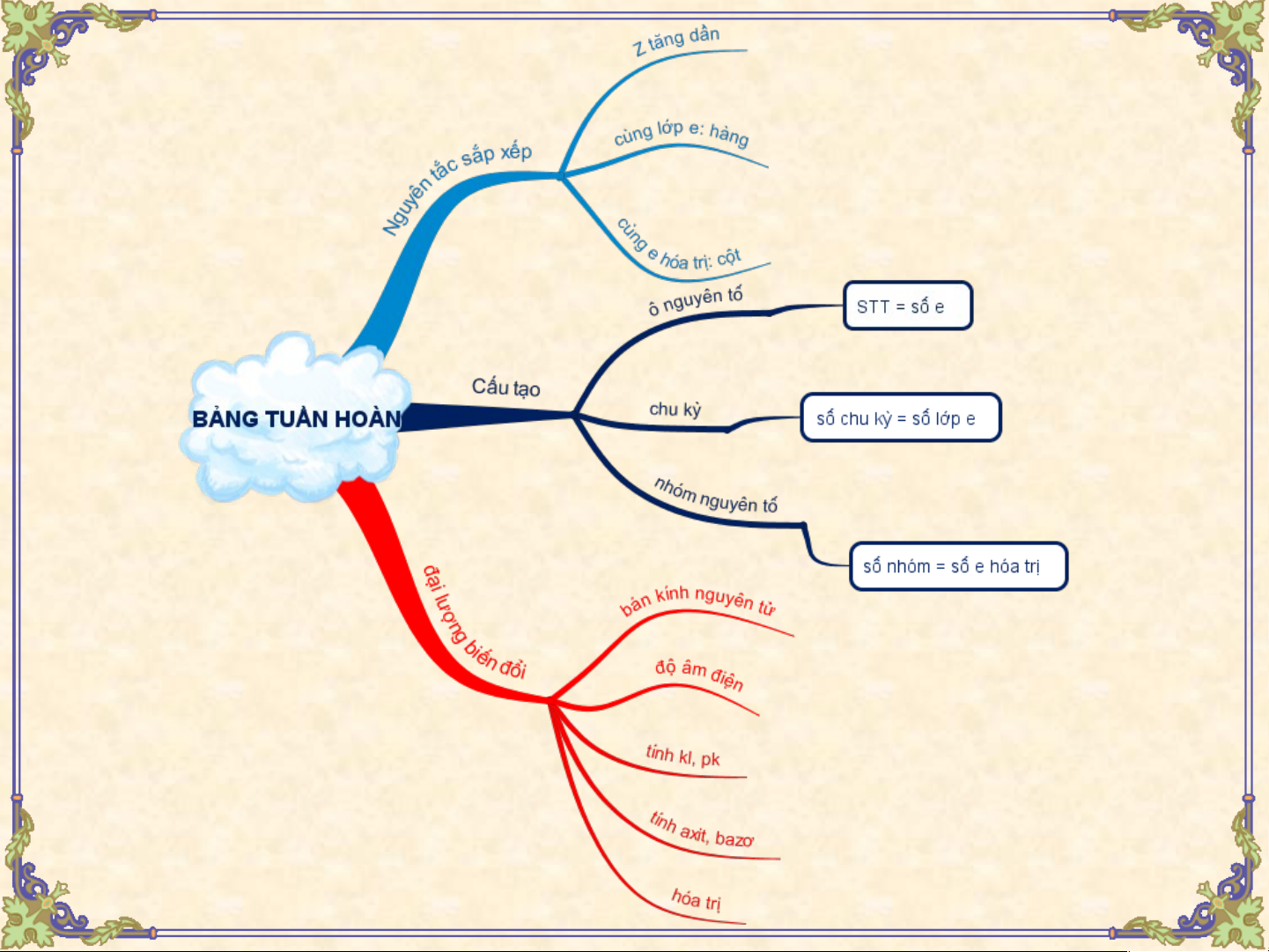
I. QUAN HỆ GIỮA VỊ TRÍ NGUYÊN TỐ Text in here
VÀ CẤU TẠO NGUYÊN TỬ CỦA NÓ Vị V trí r của củ mộ m t nguy t ên t ê ố
Cấu tạo nguyên tử t ro
r ng bảng t uần hoàn - S T S T T của nguy ên t ê ố - Số proton, số electron - S ố S thứ t t ự c hứ t ủ ự c a chu kỳ a c - Số lớp electron - S ố S thứ t t ự c hứ t ủ ự c a nhóm a nhóm A - Số electron lớp ngoài cùng
II. QUAN HỆ GIỮA VỊ TRÍ VÀ TÍNH CHẤT CỦA NGUYÊN TỐ
Bài tập 3 : Nguyên tố N có STT 7, chu kì 2, nhóm VA và
nguyên tố Al có STT 13, chu kì 3, nhóm III A
Hãy cho biết các tính chất của nguyên tố N và Al:
- Là kim loại hay phi kim? Vì sao?
- Hóa trị cao nhất trong hợp chất với oxi là?
- Hóa trị trong hợp chất với hidro là?
- Công thức oxit cao nhất?
- Công thức hợp chất khí với hidro ? Số e ngoài cùng Nhóm Kim loại Phi kim Công thức oxi cao nhất Hợp chất khí với hidro Hidroxit tương ứng Số e ngoài 5 3 4 2 cùng Nhóm VA IIIA IVA IIA Kim loại x x Phi kim x x Công thức oxi N O Al O CO MgO 2 5 2 3 2 cao nhất Hợp chất khí NH CH 3 4 với hidro Hidroxit tương HNO Al(OH) H CO Mg(OH) 3 3 2 3 2 ứng
II. QUAN HỆ GIỮA VỊ TRÍ VÀ TÍNH
CHẤT CỦA NGUYÊN TỐ
Vị trí của một nguyên tố
trong bảng tuần hoàn Tính Hóa Công Hóa trị Công Công thức kim trị thức trong thức của loại, cao oxit hợp hợp hiđroxit và phi nhất cao chất chất tính axit kim với nhất khí với khí với hay bazơ oxi hiđro hiđro của chúng III. SO S O ÁNH TÍN ÁNH H C H HẤ H T H T ÓA H HỌ ÓA C HỌ CỦA MỘ ỦA T MỘ N T GU G YÊN TỐ TỐ V ỚI Ớ NGUYÊN TỐ TỐ LÂ L N CẬN Nhóm IA IIA IIIA IVA VA VIA VIIA Chu kì 2 3 4 5 6
So sánh tính phi kim của F, Cl, Br, I Nhóm T Tính phi kim giảm dần VIIA ính F>Cl>Br>I Chu kỳ 2 F phi ki Chu kỳ 3 Cl m Tính phi kim tăng dần giảm Chu kỳ 4 Br dầ I nầ Chu kì 5 I
So sánh tính phi kim của Si, Cl, P, S Nhóm IVA Nhóm VA Nhóm Nhóm VIA VIIA Chu kỳ 3 Si P S Cl Tính phi ín h phi kim k im tăng n dần Tính phi kim tăng dần
Si
Tính phi kim giảm dần Cl>S>P>Si
So sánh tính kim loại của Al, Mg, Na Nhóm IA Nhóm IIA Nhóm IIIA Chu kỳ 3 Na Mg Al Tính í nh kim lo kim ại giảm dần Tính kim loại giảm dần Na>Mg>Al Tính kim loại tăng dần
AlSo sánh tính kim loại của K, Na, Li, Rb Nhóm IA T Tính kim loại giảm ín dần h Rb>K>Na>Li Chu kỳ 2 Li kim lo Chu kỳ 3 Na ạ Tính kim loại tăng dần iạ tăn Chu kỳ 4 K g dầ Linầ Chu kì 5 Rb
Ví dụ : So sánh tính chất hoá học của nguyên tố P với
các nguyên tố lân cận T í T VA n VA í h n h p h a i x i HNO k N t 3 i m gi ả g m iả m dần
3 H SiO H PO H SO 3 Si d P S 2 3 3 4 2 4 ần
Tính phi kim tăng dần Tính axit tăng dần
H PO có tính axit mạnh hơn
P có tính phi kim mạnh hơn Si 3 4
H SiO nhưng yếu hơn
nhưng yếu hơn N và S 2 3 HNO và H SO 3 2 4
Ví dụ : So sánh tính chất hoá học của nguyên tố Na với các
nguyên tố lân cận
Tính bazơ giảm dần
Tính kim loại giảm dần NaO Mg(OH) Al(OH) T 2 3 T í í n H n IA h h b k a i z KOH m ơ Na Mg Al l t o ă ạ n i g t d ă ầ n n g 4 K d ần Na> Mg>Al KOH>NaOH
NaOH>Mg(OH) > Al(OH) Na 2 3
KOH>NaOH>Mg(OH) > Al(OH) K>Na>Mg>Al 2 3 Tổng Kết Lưu huỳnh có Hóa trị cao 16 32,06 Phi tính kim loại nhất của lưu HT cao 2,58 hay phi kim? S kim 1 huỳnh trong nhất trong Lưu huỳnh hợp chất với [ V N ị e] Tr 3sí 2 c 3 ủ
p5a nguyên tố Lưu huỳnh (S) oxit: 6 oxi ( Z = Hó 1 a 6 t ) , rị cÔ ủ 1 a 6, lư c u hu kỳ 3, nhóm VIA Công thức oxit HT trong huỳnh trong cao nhất HC với SO3 HC với Hidro? 2 Công thức hợ Côp n c g h t ấ h t hidr 3 o: 2 ức khí với Hid h ro id r c o ủa xit cao lưu huỳ n n h h ất? của lưu H S huỳnh ? 4 2 SO và H SO 3 2 4 5 H SO 2 4 có tính axit hay bazo? SO4 SO và H2 3 có tính axit 6 7 Bà B i tập i t c ập ủn ủ g n c ố Bài 1: T : r T o r ng n bảng tuầ
t n hoàn, nguyên tố X có số s thứ tự t là l 16, nguyên n tố X thuộc th : A. Chu Chu kì k 3, nhóm IVA V B. Chu kì Chu kì 4, nhó , nh m V m IA I C. Chu Chu kì k 3, nhóm V nhóm IA D. Chu Chu kì k 4, nhóm IVA V Bà B i tập i t c ập ủn ủ g n c ố Bài i2: Dãy nguyên n tố đượ đ c xếp p theo chiề h u u giảm dần tính
iảm dần tính kim lo k ại là l : A. Li,i Na, K, Rb. B. B. F, . F Cl,l Br, I r . C. O, S, Se, T , e T . D. Na, Mg, Al, , Cl. Bà B i tập i t c ập ủn ủ g n c ố
Bài 3. Xếp theo chiều tăng dần tính bazơ của các
hiđroxit sau: KOH; Mg(OH) ; Al(OH) ; NaOH. 2 3
A. KOH; Mg(OH) ; Al(OH) ; NaOH. 2 3
B. NaOH, KOH, Mg(OH) ; Al(OH) 2 3
C. Al(OH) Mg(OH) ; NaOH, KOH 3, 2
D. Mg(OH) ; ; NaOH, KOH, Al(OH) 2 3 Bà B i tập i t c ập ủn ủ g n c ố
Bài 4: Nguyên tử nguyên tố R có tổng số
hạt là 34, số hạt mang điện hơn nhiều số
hạt không mang điện là 10. Kí hiệu và vị
trí của R trong bảng tuần hoàn là :
A. Na, chu kì 3, nhóm IA.
B. Mg, chu kì 3, nhóm IIA.
C. F, chu kì 2, nhóm VIIA.
D. Ne, chu kì 2, nhóm VIIIA. Bà B i tập i t c ập ủn ủ g n c ố
Bài i 5: Nguyên tố R thuộ th c nhó nh m VIA A tro tr ng bảng tuầ t n n hoàn. Tr T ong r hợ h p chất t của R với i hiđr hi o, đr có 5,882% hiđr hiđ o r về khố kh i ilượng n . Tìm . Tìm R? A. Oxi (Z ( = 8) B. Lưu huỳnh ( Z ư = 16) C. Cro r m m (Z ( = 24) D. Selen (Z ( = 34)
CẢM ƠN QUÝ THẦY CÔ
VÀ CÁC EM HỌC SINH
Document Outline




