











Preview text:
CHÀO MỪNG CÁC EM
ĐẾN VỚI BUỔI HỌC HÔM NAY KHỞI ĐỘNG Tình huống:
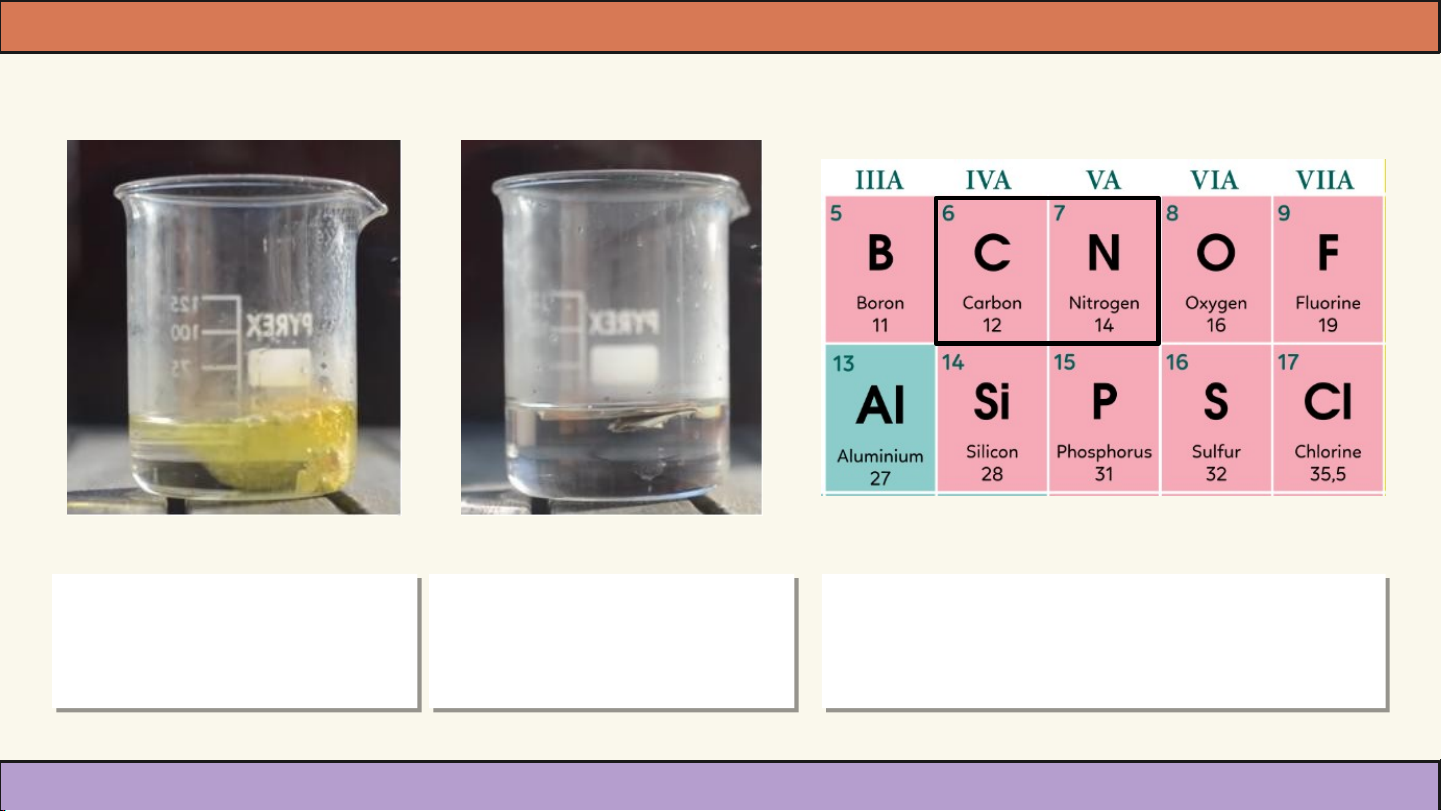
Bạn Nam làm thí nghiệm hóa học cho iron (Fe) vào 2 ống nghiệm chứa
ứa dung dịch các loại acid H CO và HNO . Nam thấy rằng Fe
2 CO3 và HNO3 . Nam thấy rằng Fe 2 3 3
phản ứng với HNO rất mạnh mẽ sinh rất nhiều bọt khí và dung dịch
3 rất mạnh mẽ sinh rất nhiều bọt khí và dung dịch 3
đổi màu vàng nhưng lại không phản ứng với H CO . Chứng tỏ acid 2 CO3 . Chứng tỏ acid 2 3
HNO mạnh hơn acid H CO rất nhiều. Liệu rằng điều này có liên
3 mạnh hơn acid H2 CO3 rất nhiều. Liệu rằng điều này có liên 3 2 3
quan đến vị trí của C, N trong bảng tuần hoàn? Cốc chứa dung dịch Cốc chứa dung dịch
Hai nguyên tố C, N trong bảng HNO khi thả Fe vào H CO khi thả Fe vào
tuần hoàn nguyên tố hoá học 3 khi thả Fe vào H2 CO3 khi thả Fe vào
tuần hoàn nguyên tố hoá họ 3 2 3
Bài 7: Xu hướng biến đổi
thành phần và một số tính chất
của hợp chất trong một chu kì NỘI DUNG BÀI HỌC
THÀNH PHẦN CỦA CÁC OXIDE I VÀ HYDROXIDE
TÍNH CHẤT CỦA OXYDE VÀ II HYDROXIDE 0 1
I. THÀNH PHẦN CỦA CÁC OXIDE VÀ HYDROXIDE
Nhắc lại hóa trị cao nhất của các nguyên tố nhóm A trong
hợp chất oxygen, bằng cách điền vào bảng sau: Nhóm
Hóa trị cao nhất trong hợp chất với oxygen IA I IIA II IIIA III IVA IV VA V VIA VI VIIA VII
HOẠT ĐỘNG CẶP ĐÔI
Lập công thức hóa học của oxide và hydroxide các nguyên tố chu kì 2, 3 (trừ O
và F) với hóa trị cao nhất, bằng cách điền vào bảng: Oxide Hydroxide Nhóm CK 2 CK 3 CK 2 CK 3 IA Li O Na O 2 2 LiOH NaOH IIA IIA IVA VA VIA VIIA Oxide Hydroxide Nhóm CK 2 CK 3 CK 2 CK 3 IA Li O Na O 2 2 LiOH NaOH IIA B eO M gO Be( OH) Mg(OH) 2 2 IIA B O Al O H BO Al(OH) 2 3 2 3 3 3 3 IVA CO SiO H CO H SiO 2 2 2 3 2 3 VA N O P O HNO H PO 2 5 2 5 3 3 4 VIA S O H SO 3 2 4 VIIA Cl O H ClO 2 7 4
CH1 (SGK tr.40): Nguyên tố gallium thuộc nhóm IIIA và nguyên tố
selenium thuộc nhóm VIA của bảng tuần hoàn. Viết công thức hóa học
của oxide, hydroxide (ứng với hóa trị cao nhất) của hai nguyên tố trên. Oxide Hydrox droxide Ga O và SeO Ga(OH) và H SeO 2 O3 và SeO Ga(OH)3 và H2Se 2 3 3 3 2 4 0 2
II. TÍNH CHẤT CỦA OXIDE VÀ HYDROXIDE
1. Phản ứng của oxide với nước
Quan sát video thí nghiệm phản ứng của oxide với nước nêu
hiện tượng và trả lời câu hỏi:
Khi có các oxide Na O, MgO, P O vào nước thì có hiện 2 2 5 tượng gì?
Màu giấy quỳ tím khi nhúng vào dung dịch sản phẩm thay đổi như thế nào?
1. Phản ứng của oxide với nước
Quan sát video thí nghiệm phản ứng của oxide với nước nêu
hiện tượng và trả lời câu hỏi:
Viết phương trình hóa học của các phản ứng xảy ra trong thí nghiệm trên.
So sánh tính axit – base của các oxide và hydroxide
tương ứng dựa vào màu sắc của quỳ tím. Thí nghiệm Na O + H O 2 2
Câu 1. X là nguyên tố nhóm IIIA. Công thức oxide ứng
với hóa trị cao nhất của X là: A. XO B. XO2 C. X O D. X O 2 2 3
HƯỚNG DẪN VỀ NHÀ Hoàn thành phần “Em
Ôn lại kiến thức đã học có thể”
Soạn bài 8: Định luật tuần hoàn. Ý nghĩa của
bảng tuần hoàn các nguyên tố hóa học CẢM ƠN CÁC EM ĐÃ
LẮNG NGHE BÀI GIẢNG
Document Outline
- Slide 1
- KHỞI ĐỘNG
- Slide 3
- Slide 4
- NỘI DUNG BÀI HỌC
- 01
- Slide 7
- HOẠT ĐỘNG CẶP ĐÔI
- Slide 9
- Slide 10
- 02
- 1. Phản ứng của oxide với nước
- 1. Phản ứng của oxide với nước
- Slide 14
- Slide 15
- Slide 16
- HƯỚNG DẪN VỀ NHÀ
- Slide 18




