















Preview text:
HCl Nh N ó h m ó 2 m Thành viên
Nội dung Thuyết trình PowerPoin t Ngọc Trinh Quốc Anh Phương Linh Khánh Chi Khánh Lâm Quang Minh Cảnh Đăng An Khánh Cấu t C ạo ạ p hân tử I. Hydrogen chloride Tính chất Tí T nh ch h c ất ấ vật lí Hydrochloric acid Tín Tí h ch h c ất h óa h óa ọc Đi Đ ều chế Muối Chloride Io I n Chl n C ori r de Ứng dụng Nhận bi N ết 0 Hyd 1 rogen chloride
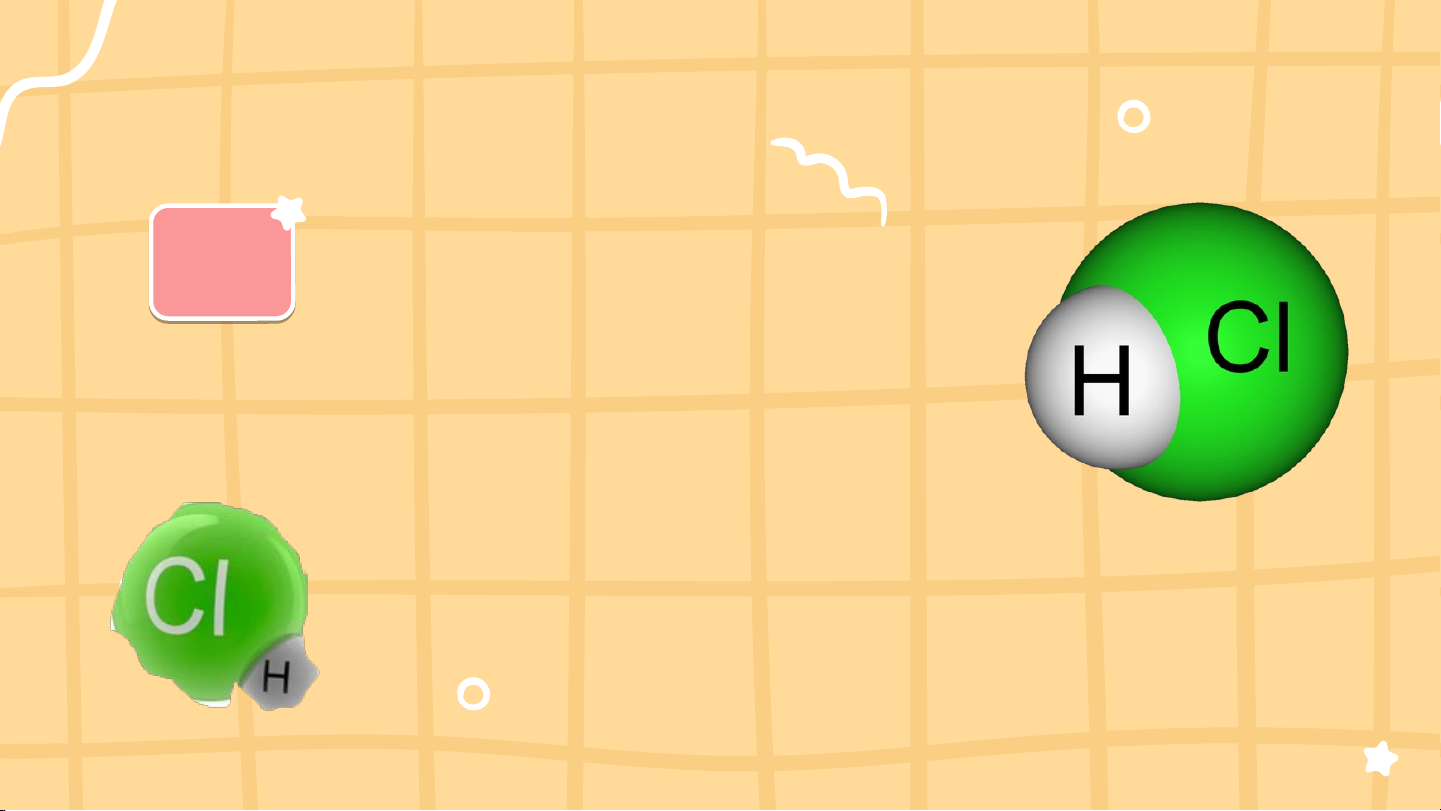
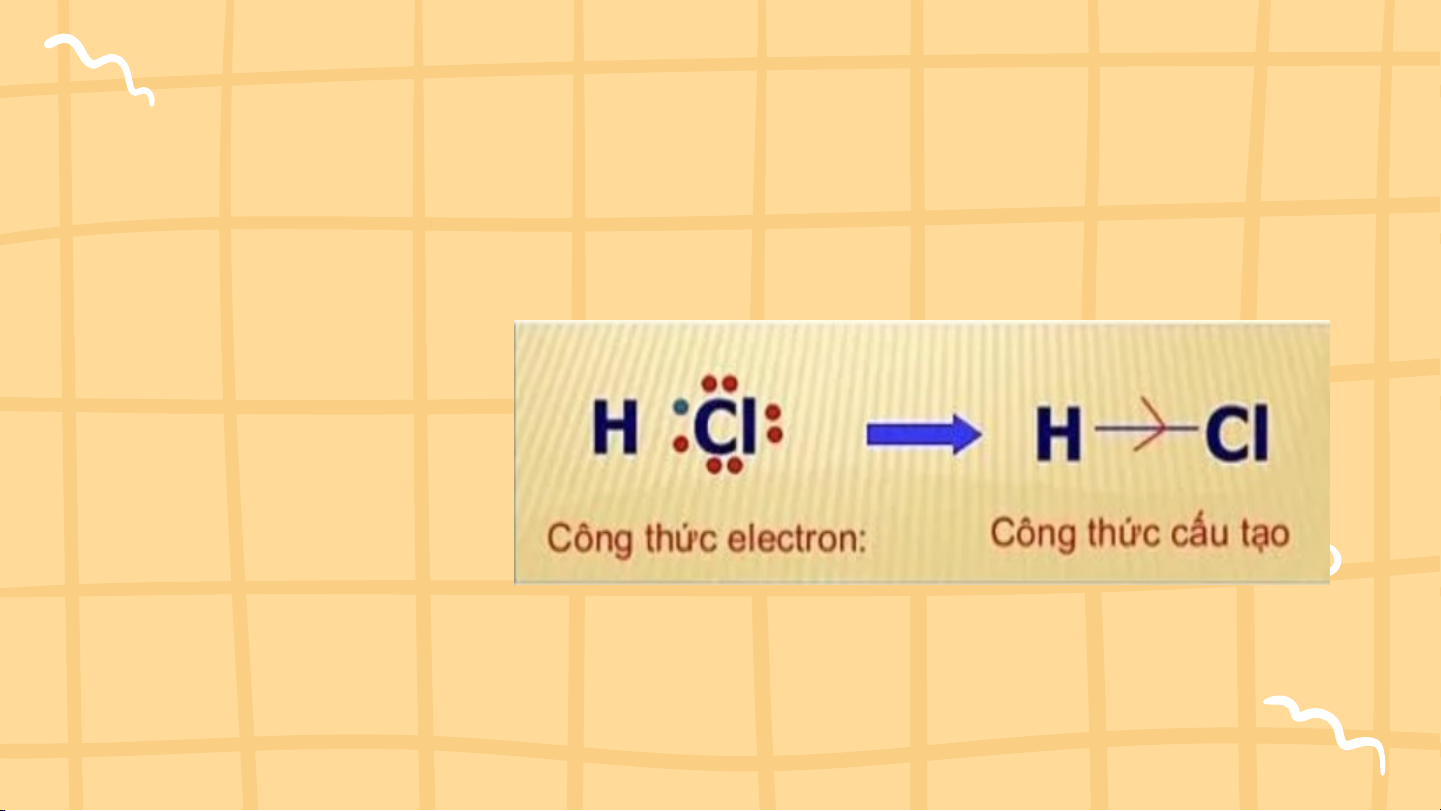
1.Cấu tạo phân tử: CTPT: HCl (M = 36,5) HCl CT cấu tạo: 2,2 3,16
Hydrogen chloride là hợp chất có liên kết cộng hóa trị phân cực 2.Tính chất:
Là chất khí, không màu tại nhiệt độ phòng , mùi xốc, rất độc
Nặng hơn không khí (d = 1,26). Nhiệt độ sôi: -85 . N ℃ hiệt độ nóng chảy: -114℃
Tan nhiều trong nước dung dịch axit clohidric H O HCl 2 HCl (khí) (dung dịch) Hidrogen chloride Axit clohidric 0 Hyd 2 rochloric acid
1.Tính chất vật lí: Là chất lỏng, không Đặc nhất đạt màu, tới nồng độ mùi xốc 37% Axit HCl đặc “bốc khói” trong không khí ẩm II. AXIT CLOHIDRIC
Video 1: Tác dụng với quỳ tím Video 2: Tác dụng với kim loại (trước H) Video 3: Tác dụng với kim loại(sau H)
2.Tính chất hóa học: a) Tính acid mạnh:
* Làm quỳ tím chuyển sang màu ….. đỏ
* Tác dụng với kim loại (đứng t r ư ớc H
) Muối (KL hóa trị thấp) +H2
Li K Na Ba Ca Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au 0 -1 +2 0 +1 -1 Vd: Fe + H Cl 2 FeCl + H 2 2 C. Oxi hóa Cu + HCl
Video 4: Tác dụng với oxide base
Video 5: Tác dụng với base Video 6: Tác dụng với muối
* Tác dụng với oxide base, base : Muối + H O 2 Vd: CuO + 2HCl CuCl + H O 2 2 Vd: NaOH + HCl NaCl + H O 2
* Tác dụng với muối: Muối mới + Axit mới
(Đk: sản phẩm phải có kết tủa hoặc khí hoặc chất điện li yếu (H O)) 2 Vd: CaCO + HCl 2 CaCl + CO + H O 3 2 2 2
HCl tác dụng được với các kim loại sau H khi có mặt chất oxi hoá:
2Cu + 4HCl + O 2CuCl (aq) + 2H O 2 2 2
Đặc biệt, hỗn hợp HCl/HNO (3:1) được gọi là nước 3
cường toan và hoà tan được Au, Pt
b) Hydrochloric acid có tính khử:
Các số oxi hóa của Chlorine: -1 0 +1 +3 +5 +7 HCl
- Tác dụng với các chất oxi hóa mạnh như: MnO , KMnO , … 2 4 +4 -1 to +2 0 MnO + HCl 4 MnCl + Cl + 2H O 2 (đặc) 2 2 2 C. Oxi hóa C. khử Axit mạnh
Kết luận: Hydrochloric acid có tính Oxi hóa ( ở ion H+) Khử ( ở ion Cl-) 3. Điều chế :
a) Trong phòng thí nghiệm: - Phương pháp sulfate: NaCl + H SO < 250oC (s) 2 4(Concentrated) NaHSO + HCl 4 Sodium hydrogen sulfate ≥ 400oC NaCl + H SO 2Na SO + 2HCl (rắn) 2 4 (Concentrated) 2 4 Sodium sulfate
Dẫn khí Hydrogen chloride qua nước tạo thành dung dịch Hydrochloric acid
b) Công nghiệp: - Phương pháp tổng hợp: to H + Cl 2 HCl 2 2
Hấp thụ khí Hydrogen chloride qua
nước tạo thành dung dịch Hydrochloric acid 0 3 Mu i c ố hloride
1.Một số muối chloride: - CTTQ: MCln
( Với M là kim loại, n là hóa trị của kim loại)
- Đa số các muối clorua đều tan ( trừ AgCl không tan và CuCl, PbCl ít tan) 2
2. Nhận biết ion chloride:
- Dùng AgNO để nhận biết ion chloride. 3
- Hiện tượng xuất hiện kết tủa trắng. NaCl + AgNO NaNO + AgCl 3 3 Trắng HCl + AgNO HNO + AgCl 3 3 Trắng 0 4
Ứng dụng c a ủ Hydrogen chloride - Loại bỏ gỉ thép.
- Sản xuất các hợp chất hữu cơ như
vinyl chloride và dichloroethane để sản xuất PVC - Điều chế nước Javen
- Điều chỉnh pH của nước cần xử lí Câ C u 1:
Kim loại nào sau đây tác dụng với
dung dịch axit HCl loãng và tác dụng
với khí clo cho cùng loại muối chloride kim loại ? A. F A e . F B. Zn C. C C u . C D. D A . g A
Trong dãy chất dưới đây, dãy gồm các chất Câ C u 2:
tác dụng được với dung dịch HCl là A. F A e . F O , KMnO , Cu B. CuO B , M . CuO nO , M , Cu 2 2 3 , KMnO4 , Cu 2 3 4 C. N C a . N OH O , C H a , C CO , Ag D. M D nO . M , Zn , Mg(OH) 2 , Zn , Mg(OH 3 Ag 3 2 2
Để nhận biết ion halide ta có thể dùng chất Câ C u 3: nào dưới đây A. A Q . ùy t Q ím B. B T . hủ h y tinh C. N C a . N OH O D. D A . gN A O gN 3
Document Outline
- Slide 1
- Thành viên
- Slide 3
- 01
- Slide 5
- Slide 6
- Slide 7
- 02
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- 03
- Slide 25
- Slide 26
- 04
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32




