























Preview text:
KHỞI ĐỘNG Sợi dây không dịch
Một cuộc thi kéo co đang diễn ra …… chuyển. Vì sao? Vậy các phản ứng hoá học có tồn tại trạng thái cân bằng không?
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
PHIẾU HỌC TẬP SỐ 1 Cho các phản ứng:
- Phản ứng điều chế khí oxygen từ KMnO4 5 phút (1)
- Phản ứng của Cl tác dụng với nước 2 (2)
Câu hỏi thảo luận:
1) Em hãy cho biết phản ứng (1) có xảy ra theo chiều ngược lại được không?
2) Phản ứng (2) có đặc điểm gì khác với phản ứng (1)?
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
1 PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HÓA HỌC
Em hãy nêu khái niệm phản ứng một chiều? Viết một số
PTHH của phản ứng một chiều mà em biết?
Em hãy nêu khái niệm phản ứng thuận nghịch?
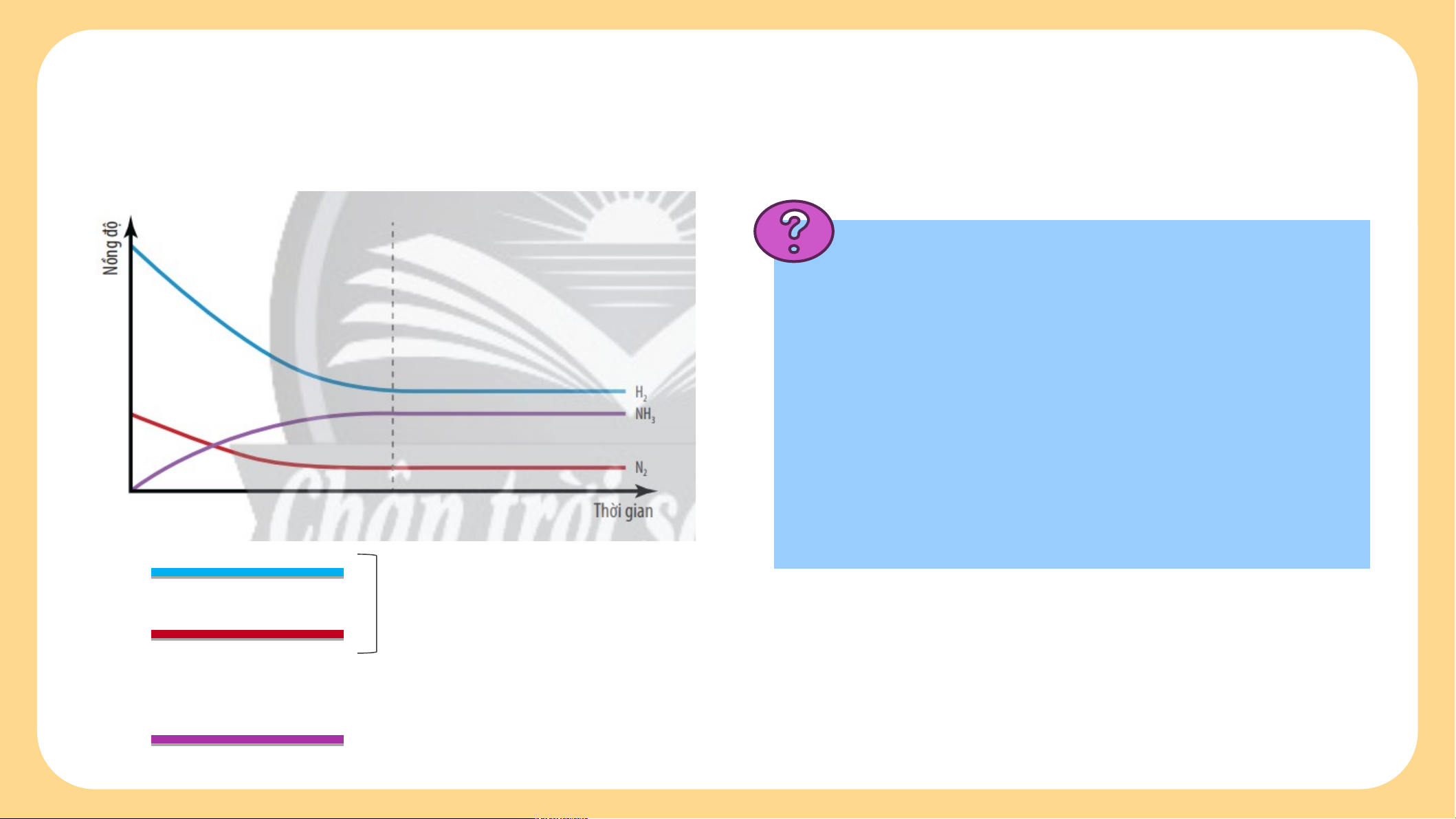
Trên thực tế có các phản ứng sau: H + O → H O (1) 2 2 2 (2) Vậy có thể viết: được không? Tại sao? N (g) + 3H (g) 2NH (g) 2 2 3
Nhận xét sự biến thiên
nồng độ của các chất trong
hệ phản ứng theo thời gian
(với điều kiện nhiệt độ không đổi). Chất phản ứng Sản phẩm
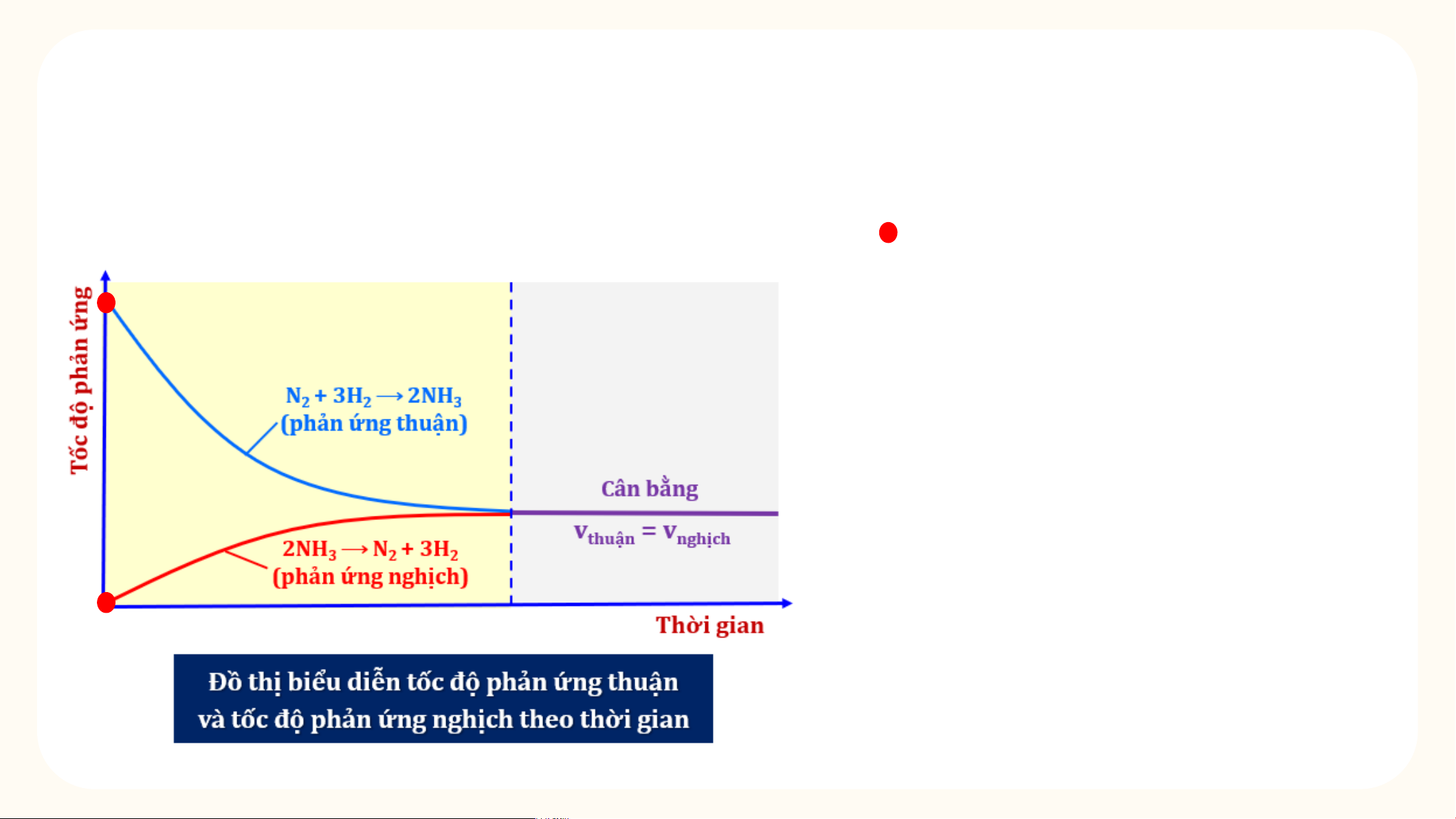
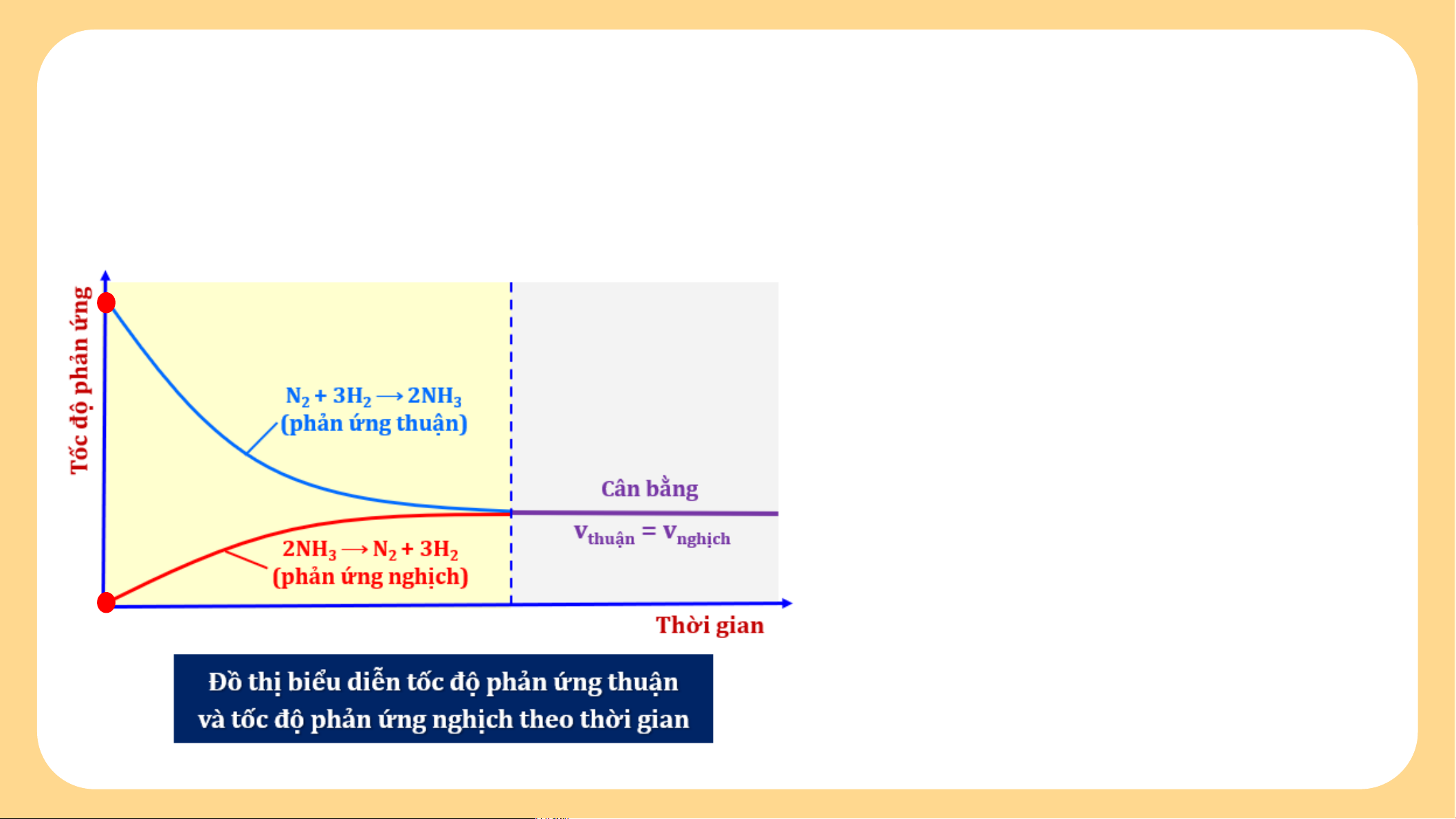
Quan sát và nhận xét về tốc độ của phản ứng thuận và tốc
độ của phản ứng nghịch theo thời gian trong điều kiện nhiệt độ không đổi?
Tại thời điểm ban đầu: T c ố đ ộ ph n ả n ứ g thu n ậ đ t ạ l n ớ nh t ấ (v = max) sau t đó gi m ả d n ầ do n n ồ g đ ộ các ch t ấ tham gia gi m ả d n ầ . Đ ng ồ th i ờ , t c ố đ ộ ph n ả n ứ g ngh c ị h b n ằ g 0 (v = 0) n sau đó tăng d n ầ do n n ồ g đ ộ NH tăng d n ầ . 3
Quan sát và nhận xét về tốc độ của phản ứng thuận và tốc
độ của phản ứng nghịch theo thời gian trong điều kiện nhiệt độ không đổi? Khi v = v t n → Ph n ả n ứ g đ t ạ tr ng ạ thái cân b n ằ g
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
1 PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HÓA HỌC
Thế nào là cân bằng hóa học?
Cho phát biểu: Khi v = v thì phản ứng dừng lại là đúng t n hay sai?
Em hãy viết biểu thức định luật tác dụng khối lượng đối
với phản ứng thuận và phản ứng nghịch của phản ứng: N (g) + 3H (g) 2NH (g) 2 2 3
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
2 HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH
Giao nhiệm vụ:
Thảo luận theo nhóm (6 – 8 nhóm) hoàn thành phiếu học tập số 2
(Câu hỏi số 5, 6 SGK trang 7). Thời gian: 10 phút
PHIẾU HỌC TẬP SỐ 2
Sử dụng dữ liệu Bảng 1.1, hãy tính tỉ số của biểu thức:
trong 5 thí nghiệm. Nhận xét giá trị thu được từ các
thí nghiệm khác nhau. (Điền kết quả vào bảng) Thí nghiệm 1 2 3 4 5 Thí nghiệm 1 214,89 2 214,51 3 217,61 4 217,16 5 215,78
PHIẾU HỌC TẬP SỐ 2
Viết các phương trình tính tốc độ của phản ứng thuận và tốc độ
của phản ứng nghịch ở trạng thái cân bằng của phản ứng thuận
nghịch sau, biết phản ứng thuận và phản ứng nghịch đều là phản ứng đơn giản:
Lập tỉ lệ giữa hằng số tốc độ của phản ứng thuận và hằng số
tốc độ phản ứng nghịch ở trạng thái cân bằng.
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
2 HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH
Đối với hệ phản ứng thuận nghịch tổng quát dạng:
Hằng số cân bằng : Trong đó
là nồng độ mol/l của các chất A, B, C, D ở trạng thái cân bằng
a, b, c, d là hệ số tỉ lượng các chất trong phương trình hóa học
Ví dụ: Cho phản ứng sau: C(s) + CO (g) 2CO(g) 2
Biểu thức tính hằng số cân bằng sẽ là:
Nêu lưu ý khi viết biểu diễn nồng độ các chất trong
biểu thức hằng số cân bằng?
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
2 HẰNG SỐ CÂN BẰNG CỦA PHẢN ỨNG THUẬN NGHỊCH Chất r n ắ không xu t ấ hi n ệ trong bi u ể th c ứ hằng số cân b n ằ g
Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ
và bản chất của phản ứng.
Tìm hiểu ý nghĩa của hằng số cân bằng?
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
3 SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC Giao nhiệm vụ:
Thảo luận theo nhóm (6 – 8 nhóm) hoàn thành phiếu học tập số 3
(Câu hỏi số 7, 8, 9 SGK trang 8).
Thí nghiệm 1: Quan sát video Hiện tượng xảy ra?
Thí nghiệm 2: HS thực hiện Hiện tượng xảy ra? THÍ NGHIỆM 1 Hiện tượng
Sự chuyển dịch cân bằng màu của khí trong Tăng nhiệt độ
chuyển dịch theo chiều THÍ
ống nghiệm đậm dần
tạo ra NO (nâu đỏ) 2 NGHIỆM 1 Giảm nhiệt độ màu của khí trong
chuyển dịch theo chiều
ống nghiệm nhạt dần tạo ra N O (không màu) 2 4 THÍ màu hồng của dung chuyển dịch theo chiều NGHIỆM Tăng nhiệt độ dịch trong bình (1) 2 tạo ra NaOH đậm dần
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
3 SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
Sự chuyển dịch cân bằng hóa học là gì?
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
4 CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
Giao nhiệm vụ: Đọc SGK, thảo luận cặp đôi Cho biết:
+ Những yếu tố ảnh hưởng đến cân bằng hóa học.
+ Phát biểu nguyên lí Le Chatelier.
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
4 CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
Tìm hiểu ảnh hưởng của nhiệt độ đến cân bằng hóa học
Giao nhiệm vụ: Thảo luận cặp đôi Hoàn thành
câu hỏi số 10, 11 SGK trang 9
Chiều chuyển dịch cân
Chiều chuyển dịch cân
bằng (thuận/nghịch)
bằng (tỏa nhiệt/thu nhiệt) Tăng nhiệt độ nghịch thu nhiệt Giảm nhiệt độ thuận toả nhiệt
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
4 CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
Tìm hiểu ảnh hưởng của áp suất đến cân bằng hóa học Khi đẩy hoặc Khi đẩ y hoặc kéo pit ké – o pit tông thì số m t ol khí c ông thì số m ủa ol khí c hệ thay đổi hệ t như hay đổi thế nào? thế
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
4 CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
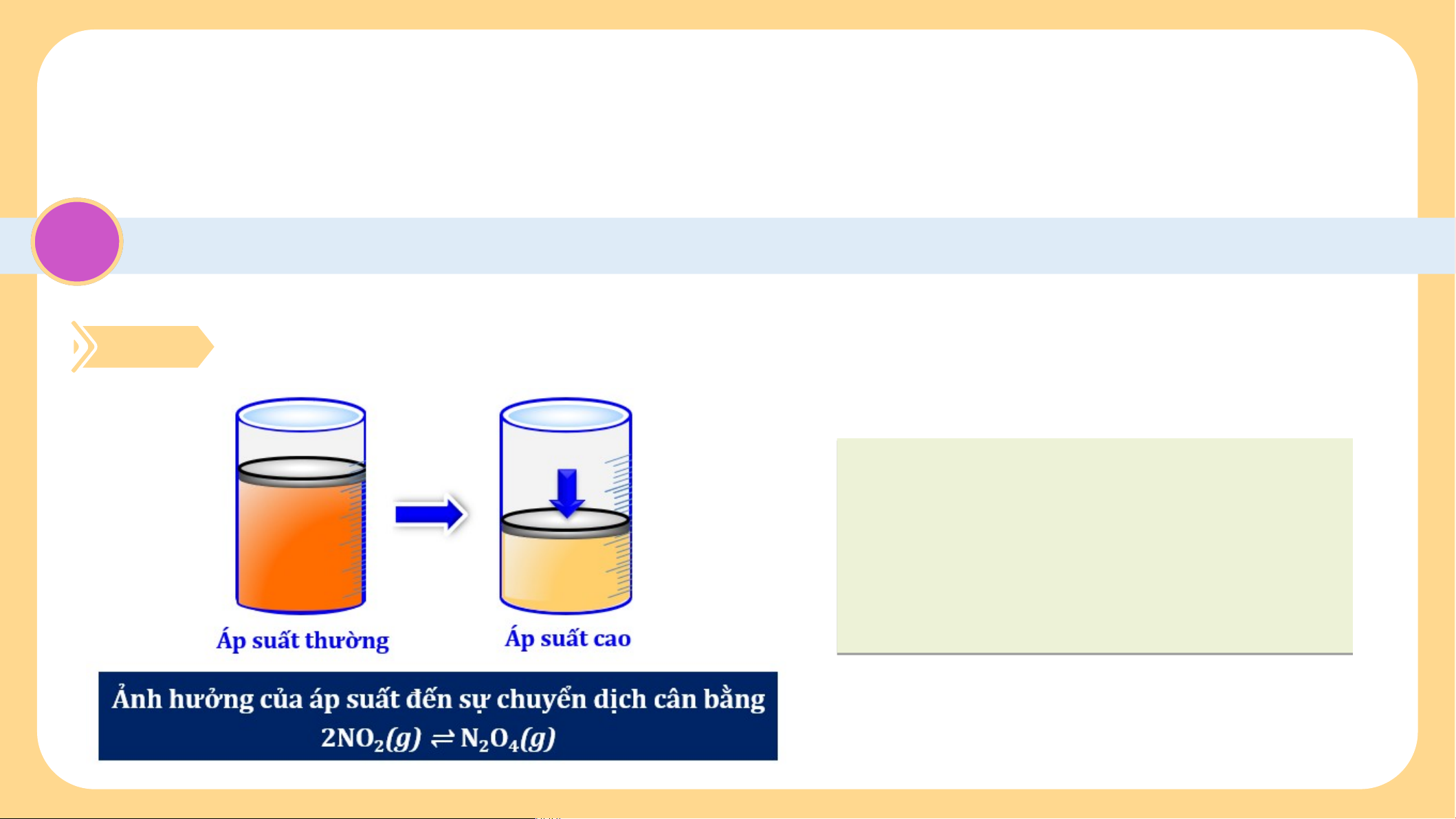
Tìm hiểu ảnh hưởng của áp suất đến cân bằng hóa học
Xét phản ứng: H (g) + I (g) 2HI ⇌ (g) 2 2
Khi tăng hoặc giảm áp suất có ảnh hưởng đến cân
bằng trên không? Vì sao?
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC
4 CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
Tìm hiểu ảnh hưởng của nồng độ đến cân bằng hóa học
Hãy cho biết cân bằng chuyển dịch theo chiều nào khi
thêm một lượng khí CO vào hệ cân bằng:
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC LUYỆN TẬP
Câu 1 Hằng số cân bằng K của một phản ứng thuận nghịch phụ thuộc vào yếu C tố nào sau đây? A. Nồng độ. B. nhiệ B
t độ C. Áp suất. D. Chất xúc tác.
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC LUYỆN TẬP
Câu 2 Câu 2: Yếu tố nào sau đây luôn luôn không làm chuyển dịch cân bằng của hệ phản ứng?
A. Nồng độ. B. nhiệt độ C. Áp suất. D. C D hất xúc tác.
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC LUYỆN TẬP Câu 3
Viết biểu thức tính K cho các phản ứng sau C
CHƯƠNG I – CÂN BẰNG HÓA HỌC
BÀI 1 - KHÁI NIỆM VỀ CÂN BẰNG HÓA HỌC VẬN DỤNG
Trong các hang động đá vôi thường xảy ra hiện tượng hình thành thạch
nhũ và xâm thực của nước mưa vào đá vôi theo phương trình hóa học sau CaCO + H O + CO ⇌ Ca(HCO ) 3 2 2 3 2
Hãy giải thích các quá trình này.
Document Outline
- Slide 1
- CHƯƠNG I – CÂN BẰNG HÓA HỌC
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- PHIẾU HỌC TẬP SỐ 2
- Slide 12
- PHIẾU HỌC TẬP SỐ 2
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30



