



























Preview text:
Bài giảng hóa học Sách: Ch 11 ân trời sáng tạo 1 BÀI 2
CÂN BẰNG TRONG DUNG DỊCH NƯỚC 2
01 SỰ ĐIỆN LI, CHẤT ĐIỆN LI,
CHẤT KHÔNG ĐIỆN LI
NỘI 02 THUYẾT BRONSTED – LOWRY VỀ ACID - BASE DUNG
03 KHÁI NIỆM VỀ pH. CHẤT CHỈ THỊ ACID – BASE
04 CHUẨN ĐỘ ACID – BASE
Ý NGHĨA THỰC TIỄN CÂN BẰNG
05 TRONG DUNG DỊCH NƯỚC CỦA
ION Al 3+, Fe 3+ và CO 2- 3 3
01 SỰ ĐIỆN LI, CHẤT ĐIỆN LI,
CHẤT KHÔNG ĐIỆN LI 4
1. SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
a) Thí nghiệm hiện tượng điện li
1. Hãy nhắc lại khái niệm dòng điện
2. Đèn sáng cho thấy dung dịch
NaCl dẫn điện, chứng tỏ trong
dịch có hạt mang điện. Đó có thể
là loại hạt nào (electron, cation, anion hay phân tử NaCl)?
3. Hãy giải thích sự tạo thành hạt mang điện đó. 5
1. SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
a) Thí nghiệm hiện tượng điện li
Dung dịch dẫn điện: HCl, NaOH, NaCl.
Các chất không dẫn điện: NaCl khan, nước cất, dung dịch saccarozo, dung dịch etanol.
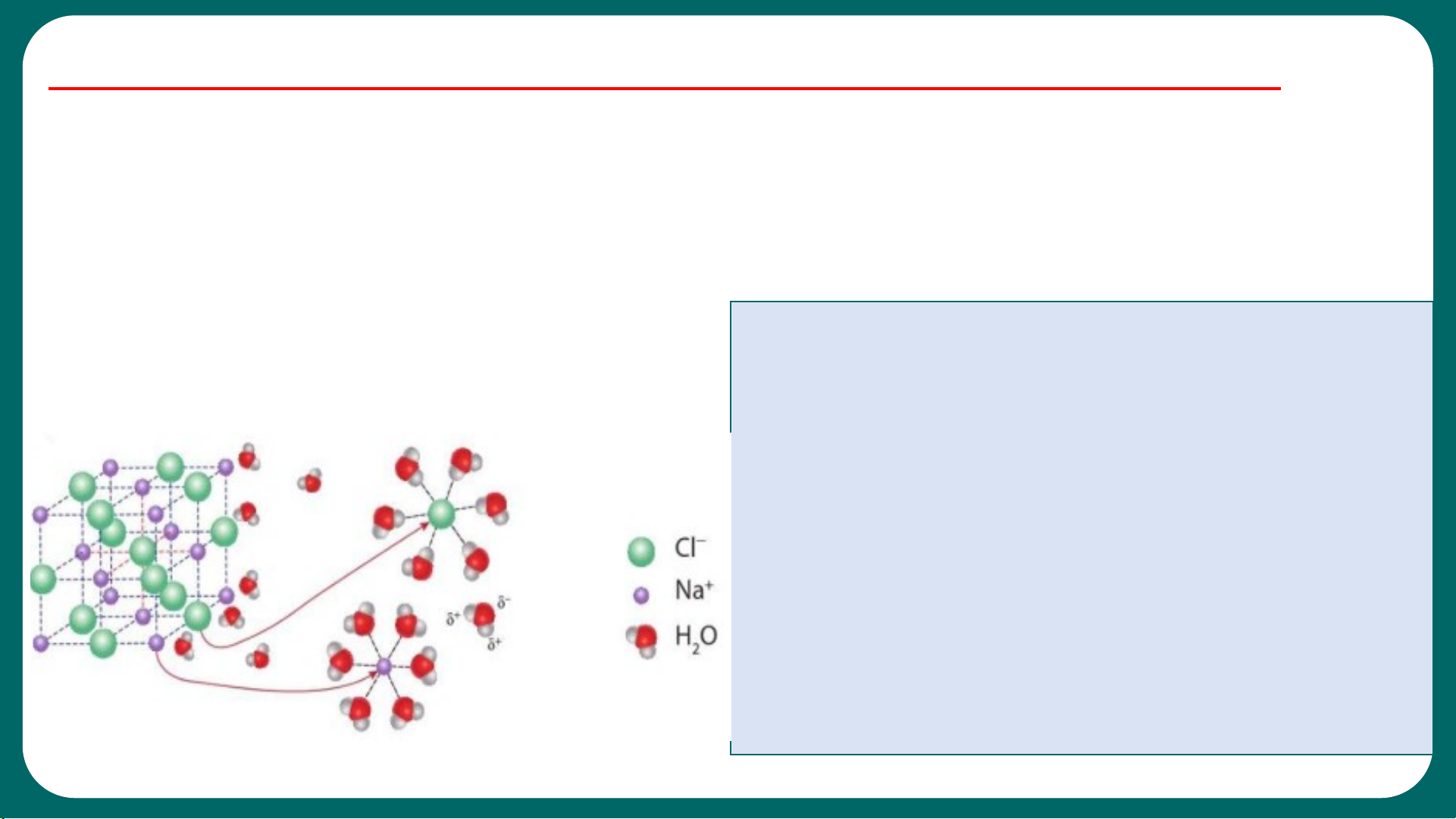
H O là một phân tử có cực. Khi cho
b) Giải thích hiện tượng dẫn điện 2
NaCl tinh thể vào nước, xảy ra quá
trình tương tác giữa các phân tử nước
có cực và các ion của muối, kết hợp với
sự chuyển động không ngừng của các
phân tử nước làm cho các ion Na+ và
Cl- của muối tách dần khỏi tinh thể và
hoà tan vào nước, gọi là quá trình điện
li hay sự điện li. NaCl gọi là chất điện li. 6
1. SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
a) Thí nghiệm hiện tượng điện li
Dung dịch dẫn điện: HCl, NaOH, NaCl.
Các chất không dẫn điện: NaCl khan, nước cất, dung dịch saccarozo, dung dịch etanol.
b) Giải thích hiện tượng dẫn điện
Chất điện li là chất khi tan trong nước phân li thành các ion.
Quá trình phân li các chất khi trong nước thành ion gọi là sự điện li. 7
1. SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
a)Thí nghiệm hiện tượng điện li
Dung dịch dẫn điện: HCl, NaOH, NaCl.
Các chất không dẫn điện: NaCl khan, nước cất, dung dịch saccarozo, dung dịch etanol.
b) Giải thích hiện tượng dẫn điện
c) Phân loại các chất điện li
+ Chất điện li mạnh: phân li hoàn toàn thành ion trong nước.
VD: dd NaCl, dd HCl, dd NaOH, …
+ Chất điện li yếu: phân li một phần thành ion trong nước. VD: CH COOH, HF, …. 3 8 Như vậy, Chất điện li mạnh Chất điện li yếu Chất không điện li
Khi tan trong nước điện li hoàn toàn
Khi tan trong nước điện li một phần Là các chất khi tan trong nước thành ion. thành ion. không phân li ra ion.
Axit mạnh: HCl, HNO , H SO , HClO , COOH, HClO, H PO , , Cl ,… 3 2 4 4 Axit yếu: CH3 3 4 Các khí: SO2 2 … H S, HF… 2
Đường: C H O (glucozơ), 6 12 6
Bazơ mạnh: KOH, NaOH, Ca(OH) , 2
Bazơ yếu (là các bazơ không C H O (saccarozơ),… 12 22 11 Ba(OH) , LiOH. tan): Mg(OH) ,… 2 2
Ancol: C H OH (ancol etylic), 2 5
Muối (hâu hết): NaCl, NH NO , , 4 3
Một số muối đặc biệt: HgCl2 … CuSO , CH COONa,… Hg(CN) ,… 4 3 2 Phương trình điện li Phương trình điện li HCl H+ + Cl- CH COOH H+ + CH COO- 3 3 (mũi tên 1 chiều) (mũi tên 2 chiều)
Trong dd HCl có chứa: H+ và Cl-.
Trong dd CH COOH có chứa: H+, 3
CH COO- và CH COOH không phân 3 3 li. 9 02 THUYẾT BRONSTED
– LOWRY VỀ ACID – BASE 10
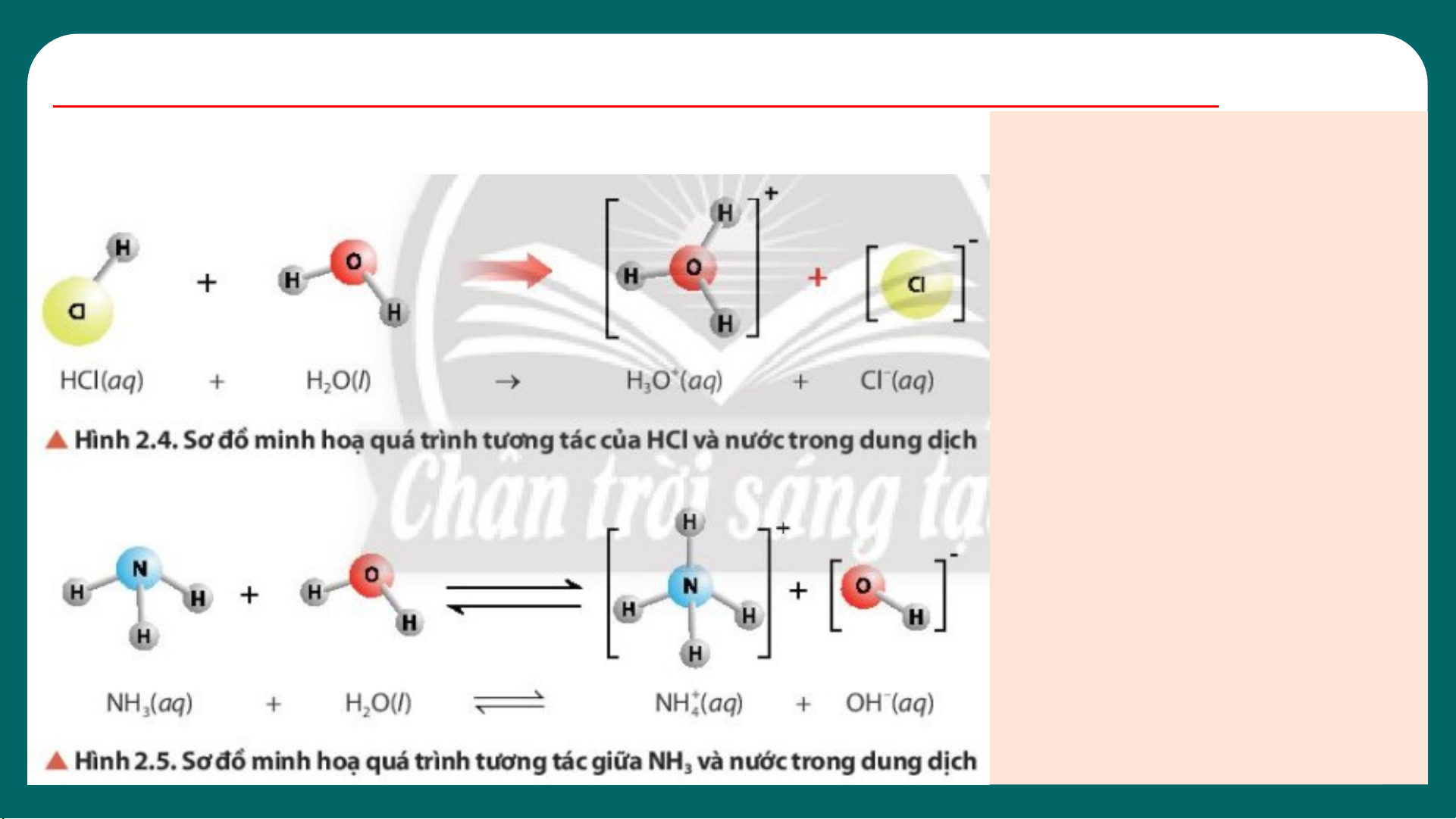
2. THUYẾT BRONSTED – LOWRY VỀ ACID – BASE 1)Quan sát hình 2.4 và 2.5, cho biết chất nào nhận H+, chất nào cho H+. 2)Nhận xét về vai trò acid – base của phân tử H O trong 2 các cân bằng ở hình 2.4, 2.5. 11
Trong dung dịch NaHCO có các cân bằng sau: 3
HCO - + H O H O+ + CO 2- (1) 3 2 3 3 HCO - + H O H CO + OH- (2) 3 2 2 3
Nhận xét về vai trò acid – base của phân tử H O trong các cân bằng 2 (1) và (2).
Thuyết Bronsted – Lowry:
Acid là chất cho proton (H+), base là chất nhận proton.
Acid và base có thể là phân tử hoặc ion. 12 03 KHÁI NIỆM pH.
CHẤT CHỈ THỊ ACID – BASE 13
3. KHÁI NIỆM pH. CHẤT CHỈ THỊ ACID – BASE a) Khái niệm pH
1. Nước có phải là chất điện li không? Viết phương trình điện li (nếu có).
2. Tích số ion của nước là gì? Ở 25oC, nó có giá trị bằng bao nhiêu?
3. pH là gì? Nêu biểu thức tính pH.
4. Tính pH của dung dịch có nồng độ H+ là 10-2 M.
5. Tính pH của dung dịch có nồng độ OH- là 10-4 M. 14
3. KHÁI NIỆM pH. CHẤT CHỈ THỊ ACID – BASE a) Khái niệm pH
1. Nước có phải là chất điện li không? Viết PT điện li (nếu có).
Nước là chất điện li rất yếu. H O H+ + OH- 2
2. Tích số ion của nước là gì? Ở 25oC, nó có giá trị bằng bao nhiêu?
Là hằng số ở nhiệt độ xác định, có giá trị bằng K = [H+].[OH-] = 10-14 w
3. pH là gì? Nêu biểu thức tính pH. pH = -log[H+]
4. Tính pH của dung dịch có nồng độ H+ là 10-2 M. pH = -log[H+] = -log(10-2) = 2
5. Tính pH của dung dịch có nồng độ OH- là 10-4 M. [H+] = = 10-10 M
pH = -log[H+] = -log(10-10) = 10 15
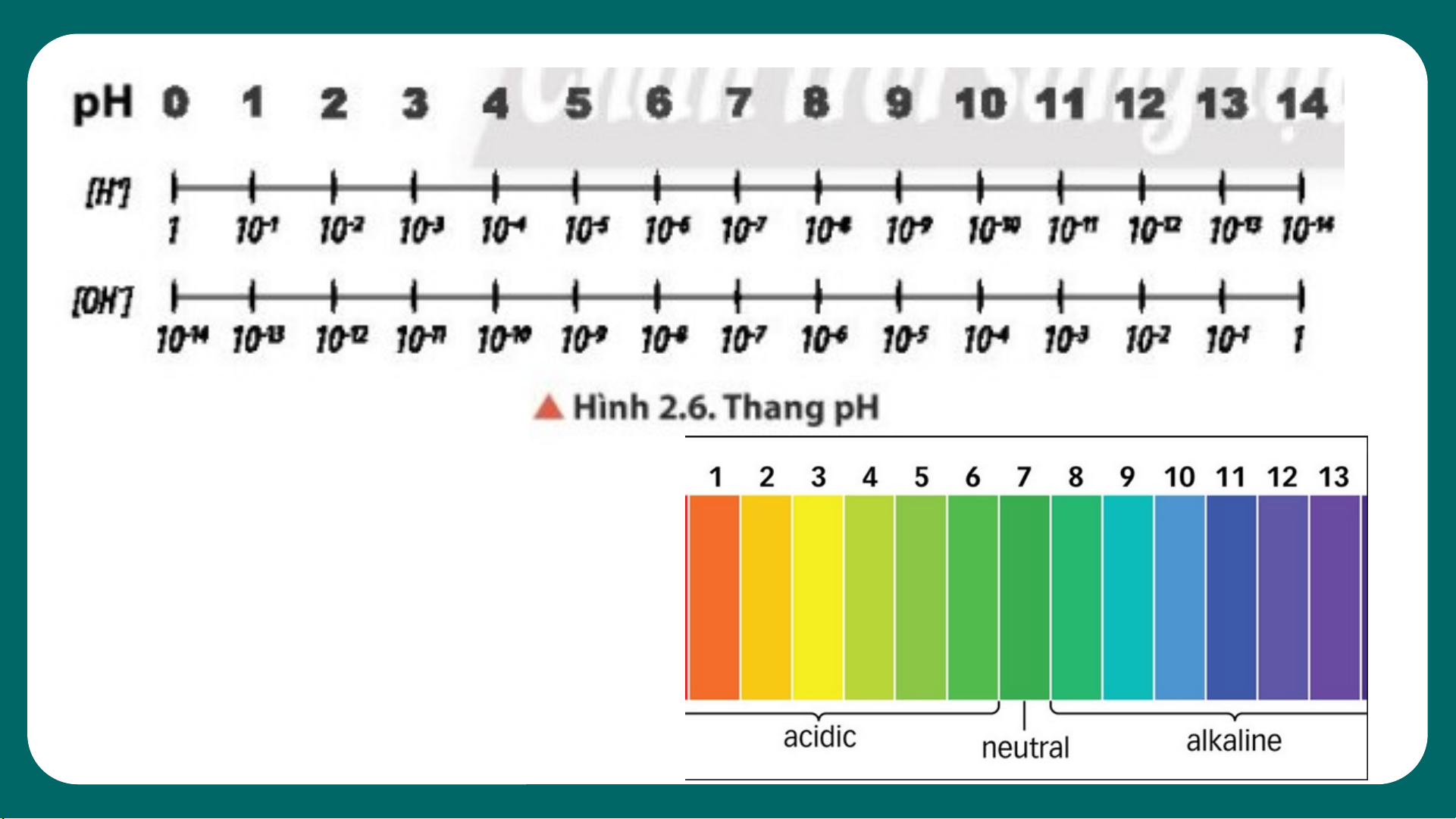
Quan sát hình 2.6, cho biết
khoảng giá trị nào trong
thang pH tương ứng với môi
trường của dung dịch là acid, base hay trung tính. 16
1.Pha 500 mL dung dịch HCl 0,2 M vào
500 mL nước. Tính pH của dung dịch thu được.
2.Tính khối lượng NaOH cần để pha
100 mL dung dịch NaOH có pH = 12. Lời giải 1)
Thể tích sau khi pha loãng là 1 lít. Lời giải 2)
Nồng độ dd HCl sau khi pha loãng là:
pOH = 14 – 12 = 2 [OH-]=10-2 = 0,01 M ==0,1 M 0,01.0,1=10-3mol HCl H+ + Cl- NaOH Na+ + OH- 0,1 0,1 (mol) 0,001 0,001 (mol) [H+] = 0,1 M pH = 1 = 0,001.40 = 0,04 (gam) 17
3. KHÁI NIỆM pH. CHẤT CHỈ THỊ ACID – BASE
b) Ý nghĩa của pH trong thực tiễn
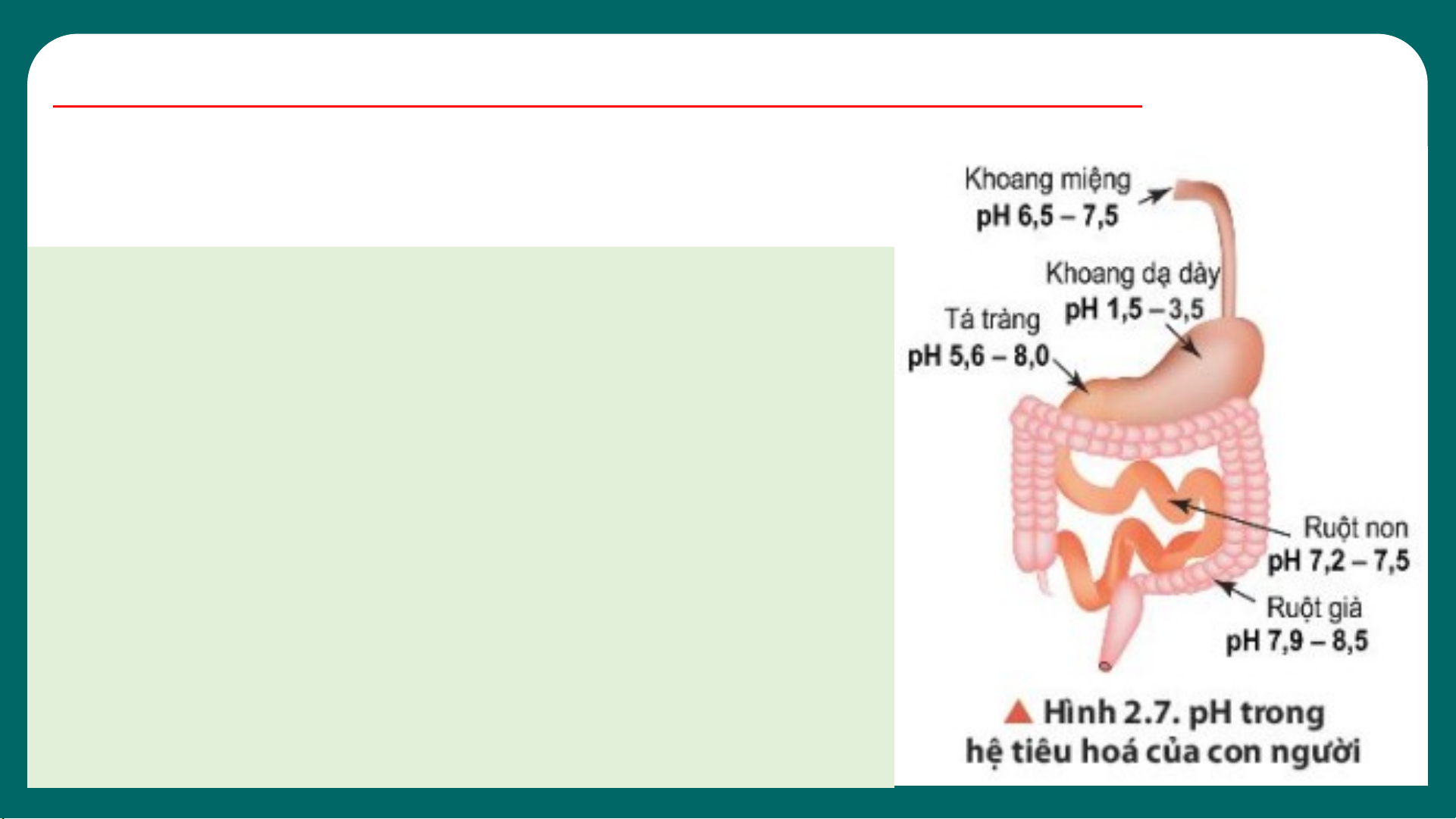
1. Quan sát hình 2.7, cho biết khoảng pH
thấp nhất và cao nhất ở các cơ quan
trong hệ tiêu hóa của con người.
2. Đất chua là đất có độ pH dưới 6,5. Để
cải thiện đất trồng bị chua, người nông
dân có thể bổ sung chất nào trong các
chất sau vào đất: CaO, P O ? Giải thích. 2 5 18
c) Chất chỉ thị acid – base
Trong phòng thí nghiệm, có những cách nào để xác định một chất là
dung dich acid, base hay trung tính? 19 Hoa đậu biếc CHẤT CHỈ THỊ Hoa dâm Bắp cải bụt TRONG tím TỰ NHIÊN Hoa cẩm tú cầu 20
04 CHUẨN ĐỘ ACID – BASE 21
4. CHUẨN ĐỘ ACID – BASE
Quan sát đoạn video sau và cho biết:
a) Phương pháp chuẩn độ acid – base 1. Nguyên tắc chuẩn độ 2. Thao tác tiến hành 22
4. CHUẨN ĐỘ ACID – BASE
Quan sát đoạn video sau và
a) Phương pháp chuẩn độ acid – base cho biết: 1.Nguyên tấc chuẩn độ 2.Thao tác tiến hành
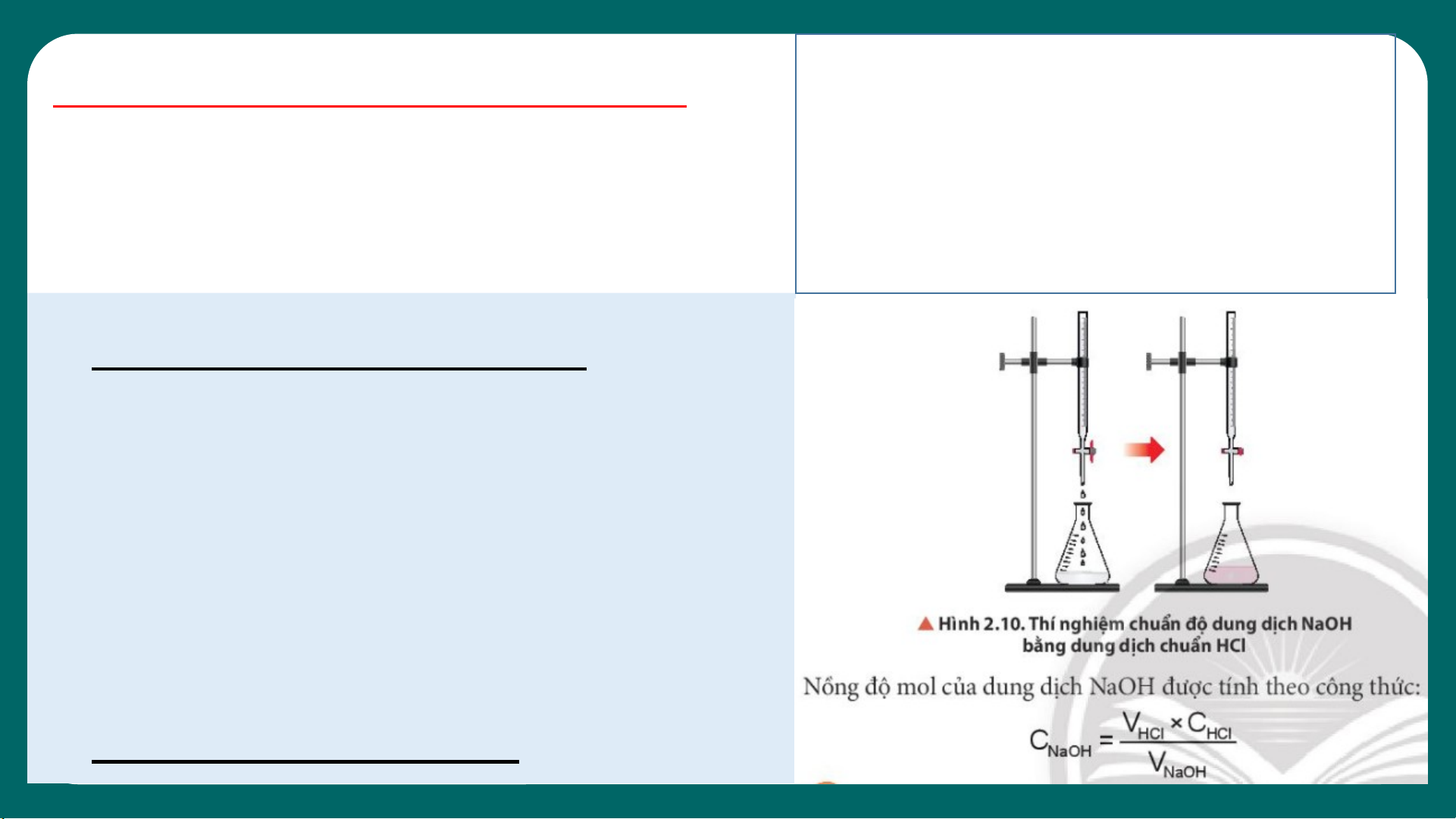
1. Nguyên tắc chuẩn độ:
Dùng dung dịch acid/base đã
biết chính xác nồng độ làm dung
dịch chuẩn để xac định nồng độ
của dd acid/base chưa biết nồng độ. 2. Thao tác tiến hành: 23
Ý NGHĨA THỰC TIỄN 05 CÂN BẰNG TRONG DUNG DỊCH NƯỚC CỦA ION Al3+, Fe3+ và CO 2- 3 24 C2H2 + O2 → CO2 + H2O 25
5. Ý NGHĨA THỰC TIỄN CÂN BẰNG TRONG DUNG
DỊCH NƯỚC CỦA ION Al3+, Fe3+ và CO 2- 3
a) Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+ Fe3+
Trong video trên, người ta đã dùng chất gì để lắng chất bẩn xuống?
Cách tiến hành? Kết quả thu được? PHÈN NHÔM KAl(SO ) 12H O 4 2 2
KAl(SO ) 12H O K+ + Al3+ + 2SO 2- + 12 H O 4 2 2 4 2 Al3+ + 3H O Al(OH) + 3H+ 2 3
Khi hòa tan vào nước, phèn nhôm phân li ra ion Al3+ Ion I M3+ on M3 th ủy th phâ n phâ
rồi tạo thành kết tủa Al(OH) ở dạng keo có khả năng 3 cho m cho ôi ôi tr ường a cid ci
hấp phụ các chất rồi lắng xuống đáy cốc. 26
Áp dụng kiến thức đã học, hãy giải thích vì sao khi bảo quản
dung dịch muối M3+ trong PTN, người ta thường nhỏ thêm
vài giọt dung dịch acid vào trong lọ đựng dung dịch muối? Trả lời: C2H2 + O2 → CO2 + H2O
Khi bảo bảo quản dung dịch muối M3+ trong PTN , người ta thường
nhỏ thêm vài giọt dung dịch acid vào trong lọ đựng dung dịch muối
để hạn chế sự tạo thành kết tủa M(OH) do khi them acid 3
[H+] tăng cân bằng thủy phân M3+ trong nước chuyển
theo chiều nghịch bảo quản được M3+. 27
b) Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO 2- 3 Trong nước, Na CO phân li: 2 3 Na CO 2Na+ + CO 2- 2 3 3 CO 2- HCO - + OH- 3 3 CO 2- bị thủy phân 3 cho môi trường base. 28 LUYỆN TẬP
CÂU 1. Chất nào sau đây dẫn điện được? A. KCl rắn, khan. B. Dung dịch C H OH. 2 5
C. Dung dịch glucozơ C H O . 6 12 6 D. Dung dịch KBr. 29 LUYỆN TẬP
CÂU 2. Trong các chất sau, chất nào không phải là chất điện li ? A. NaHCO . B. H SO . 3 2 4 C. KOH. D. C H O H. 2 5 30 LUYỆN TẬP
CÂU 3. Trong các chất sau, chất nào là chất điện li yếu? A . CH COOH. B. C H OH. 3 2 5 C. NaOH. D. H SO . 2 4 31 LUYỆN TẬP
CÂU 4. Dung dịch HCl 10-2 M có pH bằng: A. 2. B. 3. C. 10. D. 5. 32 LUYỆN TẬP
CÂU 5. Viết phương trình điện li của các chất: H SO , 2 4 Ba(OH) , Al (SO ) . 2 2 4 3 H SO → 2H+ + SO 2- 2 4 4 GIẢI Ba(OH) → Ba2+ + 2OH- 2 Al (SO ) → 2Al3+ + 3SO 2- 2 4 3 4 33 LUYỆN TẬP
CÂU 6. Một dung dịch có [OH-] = 2,510-10 M. Tính pH
và xác định môi trường của dung dịch này. GIẢI [H+] = = 410-5 M
pH = -log[H+] = -log(410-5) = 4,4 34 LUYỆN TẬP
CÂU 7. Một mẫu dịch vị có pH =2,5. Xác định nồng độ
mol của ion H+ trong mẫu dịch vị đó. GIẢI
[H+] = 10-pH = 10-2,5 = 3,1610-3 M 35 THANK YOU 36
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36



