





















Preview text:
Khởi Động
Trong y khoa, gây mê là phương pháp làm bệnh nhân mất ý
thức, phục hồi được sau một thời gian , không đau và đảm bảo F Cl
an toàn trong suốt quá trình phẫu thuật. F C C H Br
Halothane (CF -CHBrCl) 3 F
được dùng làm thuốc gây mê
phù hợp cho nhiều độ tuổi
ít ảnh hưởng đến sức khỏe bệnh nhân
trong và sau phẫu thuật.
Khi cầu thủ bị thương, chỗ bị thương sẽ rất
đau đớn. Nhân viên tế dùng phương pháp
làm lạnh cục bộ bằng cách phun chất làm
lạnh tức thời trên chỗ bị thương. Chất làm
lạnh ở đây là ethyl chloride C H Cl hay gọi 2 5 là chloroethane.
Halothane và ethyl chloride là dẫn xuất halogen của hydrocarbon, có
tính chất đặc trưng và ứng dụng thực tiễn. Dẫn xuất halogen của
hydrocarbon là gì? Có những tính chất và ứng dụng trong lĩnh vực nào? Bài 15: DẪN XUẤT HALOGEN 1. KHÁI NIỆM
2. ĐỒNG PHÂN VÀ DANH PHÁP
NỘI DUNG 3. TÍNH CHẤT VẬT LÍ BÀI HỌC 4. TÍNH CHẤT HÓA HỌC 5. ỨNG DỤNG 6. CỦNG CỐ 01 KHÁI NIỆM
Tìm hiểu khái niệm dẫn xuất halogen
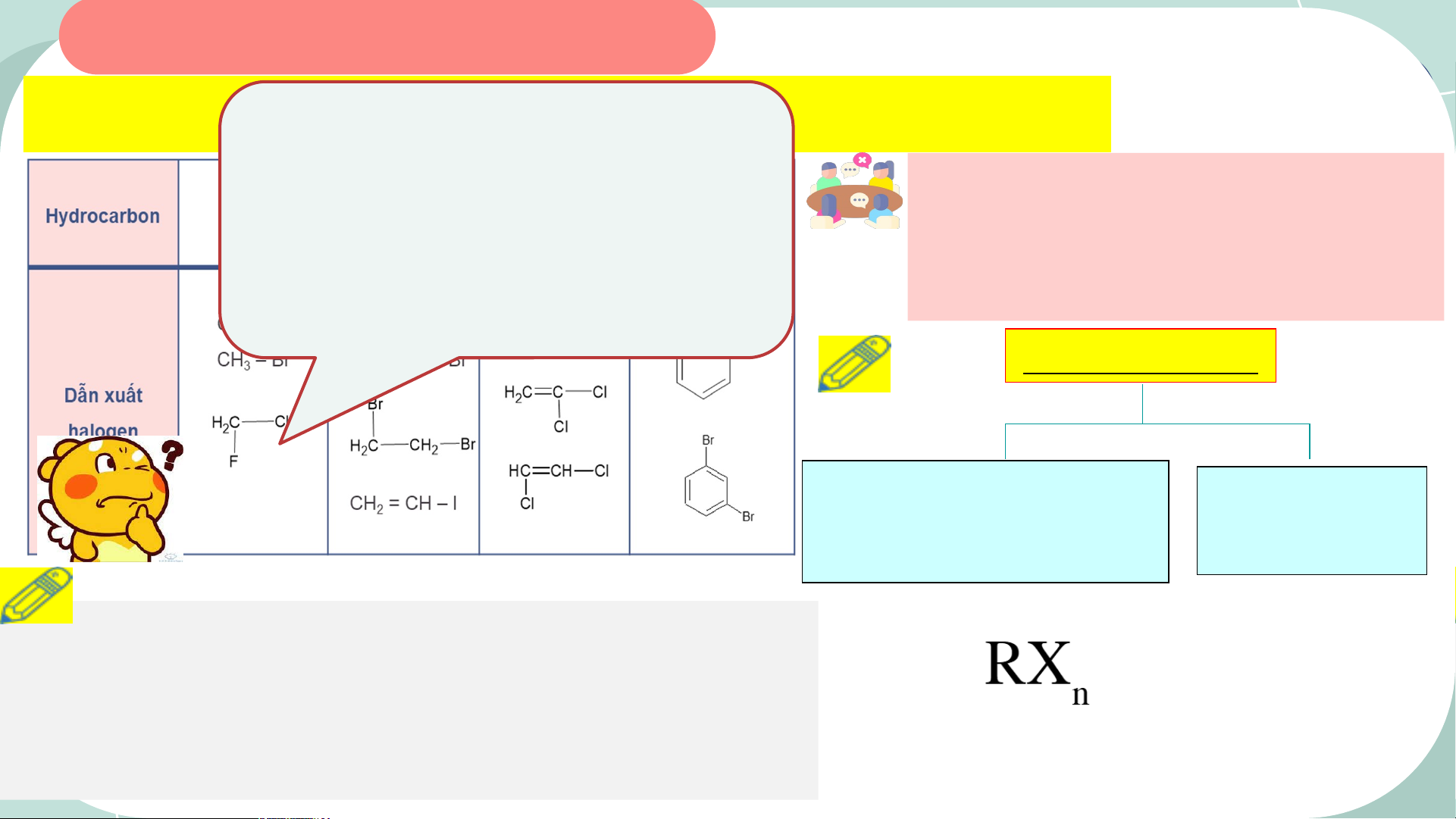
2. Cho các chất sau: CH Br,
Bảng 15.1. Hydrocarbon và một số d3ẫn xuất halogen tương ứng
Cl O F C=CF , CH Cl , HCl, 2 7, 2 2 2 2
1. Em hãy cho biết thành phần các
COCl (phosgene). Chất nào là 2
nguyên tố có trong dẫn xuất
dẫn xuất halogen của halogen của hydrocarbon. hydrocarbon? DX halogen CH Br F C=CF , CH Cl , Gốchidrocacbon 3 , 2 2 2 2 Halogen (C, H) COCl (phosgene). (F ,Cl, Br, I) 2 (No , không no, thơm) R: goá chydrocarbon
Khi thay thế nguyên tử H trong phân tử hydrocarbon CTTQ: X: F, Cl, Br, I
bằng một hay nhiều nguyên tử halogen, ta được dẫn n: soánguyeântöûhalogen
xuất halogen của hydrocarbon. 02 ĐỒNG PHÂN VÀ DANH PHÁP
Tìm hiểu về cách gọi tên các dẫn xuất halogen
- Tên gốc chức
Tên gốc hydrocarbon + halide
(dùng để gọi dx halogen đơn giản)
- Tên thay thế (halogen là nhóm thế)
Số chỉ vị trí nhóm thế - Tên nhóm thế halogen – Tên hydrocarbon
3. Em hãy đọc tên các dẫn xuất halogen sau: Cl Dẫn xuất halogen CH – Cl CH – CH – Cl CH = CH – Cl 3 3 2 2 Tên gốc chức methyl chloride ethyl chloride vinyl chloride phenyl chloride Tên thay thế chloromethane chloroethane chloroethene chlorobenzene
Tìm hiểu về công thức cấu tạo và cách gọi tên các dẫn xuất halogen
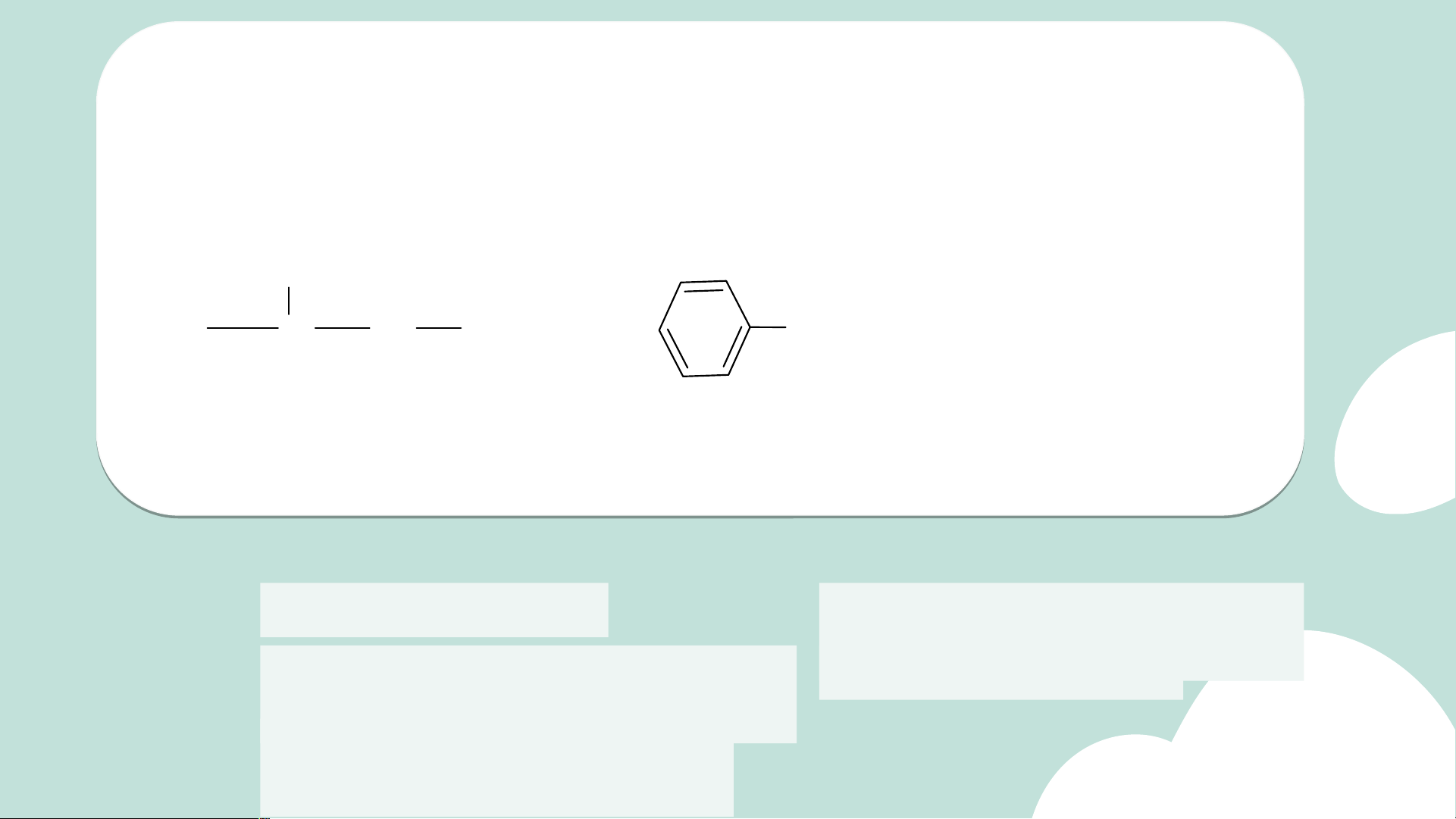
4. Em hãy gọi tên các dẫn xuất halogen sau: 5 4 3 2 1 1 2 3 4 5 C H CH H C H C 2 CH CH3 3 CH2 CH2 CH CH2 Cl 3 CH Cl CH 3 3
1-chloro-2-methyl-pentane
2-chloro-4-methyl-pentane 3 2 4 1
Cách đánh số thứ tự mạch carbon DX halogen: Br CH2 CH2 CH
CH2 - Mạch carbon (mạch chính) được ưu tiên đánh số từ
4-bromo-but-2-ene
phía gần nhóm thế hơn (từ nguyên tử halogen hoặc từ nhóm alkyl).
- Nếu có liên kết bội thì ưu tiên đánh số từ phía gần liên kết bội.
Trường hợp tổng số của số chỉ vị trí của các nhóm thế bằng nhau thì đánh số thứ tự các nguyên tử
carbon ở mạch chính ưu tiên từ phía gần nguyên tử halogen
Tìm hiểu về công thức cấu tạo và cách gọi tên các dẫn xuất halogen
5. Em hãy gọi tên thay thế của các dẫn xuất halogen sau: Br 3 2 1 H C 2 Cl Br CH2CH CH2 F Br
3 - b r o m o p r o p - 1 - e n e
c h l o r o f l u o r o m e t h a n e 1 , 3 - d i b r o m o b e n z e n e -
Dẫn xuất có 2, 3 hoặc 4,… nguyên tử halogen giống nhau -
dùng tiếp đầu ngữ di, tri, tri hoặc tetra, … trước tên halogeno;
- Dẫn xuất có từ 2 nguyên tố halogen, ưu tiên gọi tên halogeno theo thứ tự a, b, c.
6. Em hãy gọi tên các dẫn xuất halogen sau: H C H C 2 Cl 2 CH CH2 Br a l l y l b r o m i d e Cl
m e t h y l e n e c h l o r i d e H C 2 Cl H C 2 CH F vinyl fluoride b e n z y l c h l o r i d e
Một số ít dẫn xuất halogen được gọi theo tên thường CHCl CH Br CCl F-CF Cl 3 3 2 2 chloroform bromoform Freon-113
7. Viết công thức cấu tạo và gọi tên thay thế của các đồng phân dẫn
xuất halogen có công thức phân tử C H Cl, C H Cl. 3 7 4 9 H C C H Cl H C 3 CH CH3 3 7 3 CH2 CH2 Cl 1-chloropropane 2-chloropropane Cl C H Cl 4 9 4 3 2 1 4 3 2 1 H C H C 3 CH2 C H CH 3 CH2 CH2 CH 3 2 Cl Cl 1 - c h l o r o b u t a n e 2 - c h l o r o b u t a n e CH CH 3 3 1 3 2 1 2 3 H C 3 C CH3 H C 3 CH CH2 Cl Cl
1 - c h l o r o - 2 - m e t h y l p r o p a n e
2 - c h l o r o - 2 - m e t h y l p r o p a n e
Tìm hiểu về công thức cấu tạo và cách gọi tên các dẫn xuất halogen
8. Em hãy cho biết dẫn xuất halogen có các loại đồng phân cấu tạo nào. Đồng phân mạch carbon Đồng phân cấu tạo
Đồng phân vị trí liên kết đôi, liên kết ba của dẫn xuất halogen
Đồng phân vị trí nguyên tử halogen 03 TÍNH CHẤT VẬT LÍ
Tìm hiểu tính chất vật lí dẫn xuất halogen
Bảng 15.2 Nhiệt độ sôi của một số dẫn xuất halogen
Nhiệt độ sôi, 0C ( 1bar)
9. Dựa vào Bảng 15.2, cho Công thức X = F X = Cl X = Br X = I
biết xu hướng biến đổi nhiệt CH X -78 -24 4 42
độ sôi của các dẫn xuất 3 CH CH X -38 12 38 72
halogen theo chiều tăng độ 3 2 CH [CH ] X 3 47 71 102
dài mạch carbon (cùng loại 3 2 2 CH [CH ] X 33 78 102 131 3 2 3
halogen) và theo chiều tăng
Theo chiều tăng độ dài mạch carbon (cùng loại halogen) CH [CH ] X 65 108 129 157 3 2 4
nguyên tử khối của halogen
=> KLPT => nhiệt độ sôi tăng.
Theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I từ F, Cl, Br, I (cùng gốc
(cùng gốc alkyl) => KLPT=> nhiệt độ sôi tăng. alkyl).
Nhiệt độ sôi tăng dần theo chiều tăng của khối lượng phân tử NỘI DUNG BÀI HỌC Dẫn xuất halogen:
- Ở điều kiện thường, một số có phân tử khối nhỏ (CH F, C H Cl, …) ở thể khí, 3 2 5
các chất có phân tử khối lớn hơn ở thể lỏng hoặc rắn.
- Nhiệt độ sôi tăng dần theo chiều tăng khối lượng phân tử.
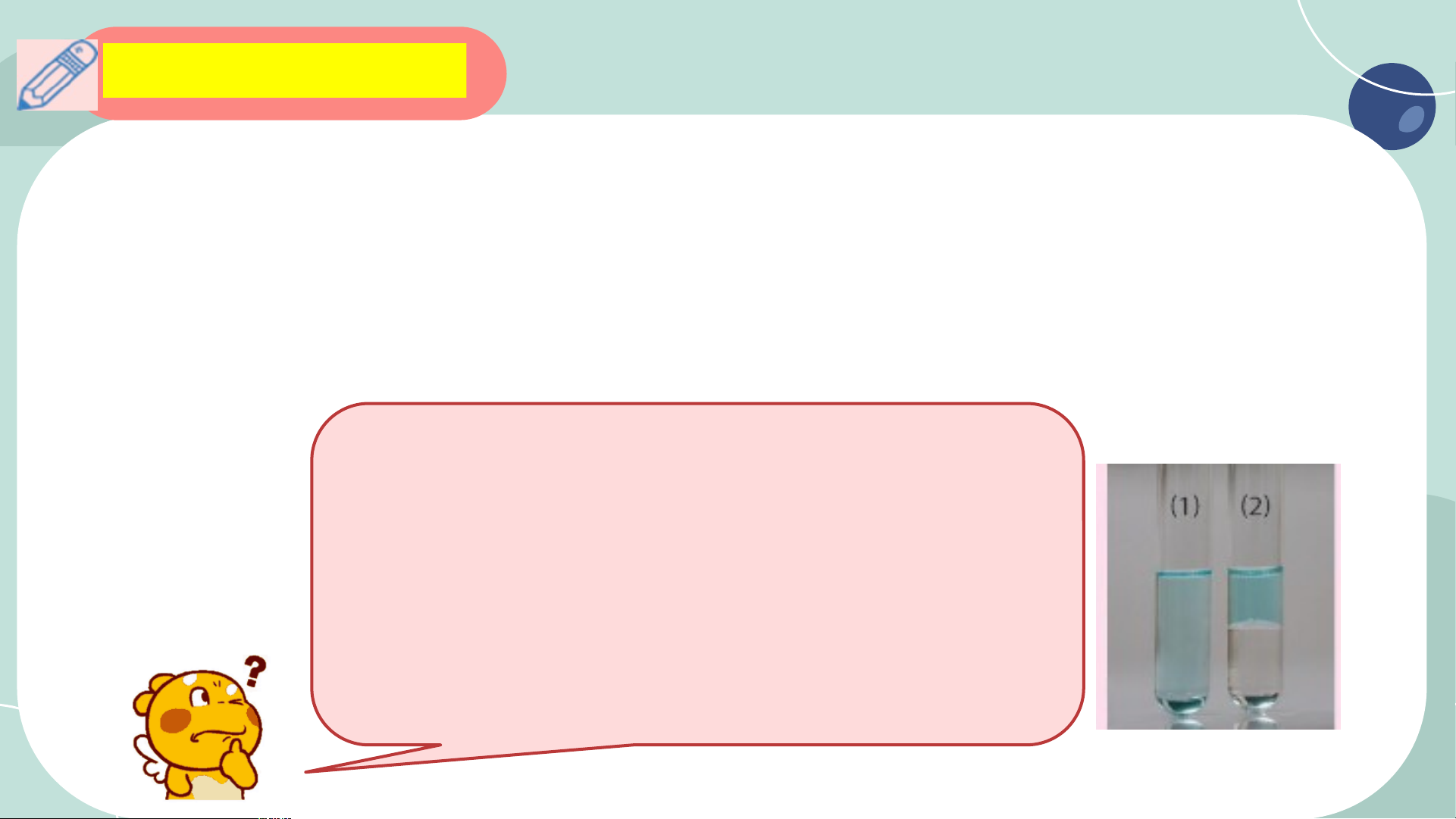
- Không tan trong nướ 10. c C , như ho cácng c t hấ an t t eth rong anol ( d C ung m H OH) ôi
và hữu cơ như alcohol, 2 5 ether, benzene.
dichloromethane (CH Cl ) vào 2 ống nghiệm 2 2
- Một số có hoạt tính si ch n ứa h học c dung dịc ao
h CuSO loãng, lắc hỗn hợp và 4
để yên như hình bên. Cho biết ống nghiệm nào chứa dichloromethane.
Một số dẫn xuất halogen có hoạt tính sinh học cao. Cl Cl Cl O Cl Cl F Cl C C H F C C H Br O Cl Cl F Cl Cl
Halothane – Chất gây mê
Dioxin – Chất cực độc
DDT – Chất có độc tính cao 04 TÍNH CHẤT HÓA HỌC
04. Tính chất hoá học Dựa vào đặc điểm
Ñoä aâm điện cuûa halogen lôùn cấu tạo hãy dự hôn carbon, đoán các tính chất + - hoá học của dẫn C C X xuất halogen
Liên kết carbon với halogen là liên kết phân cực.
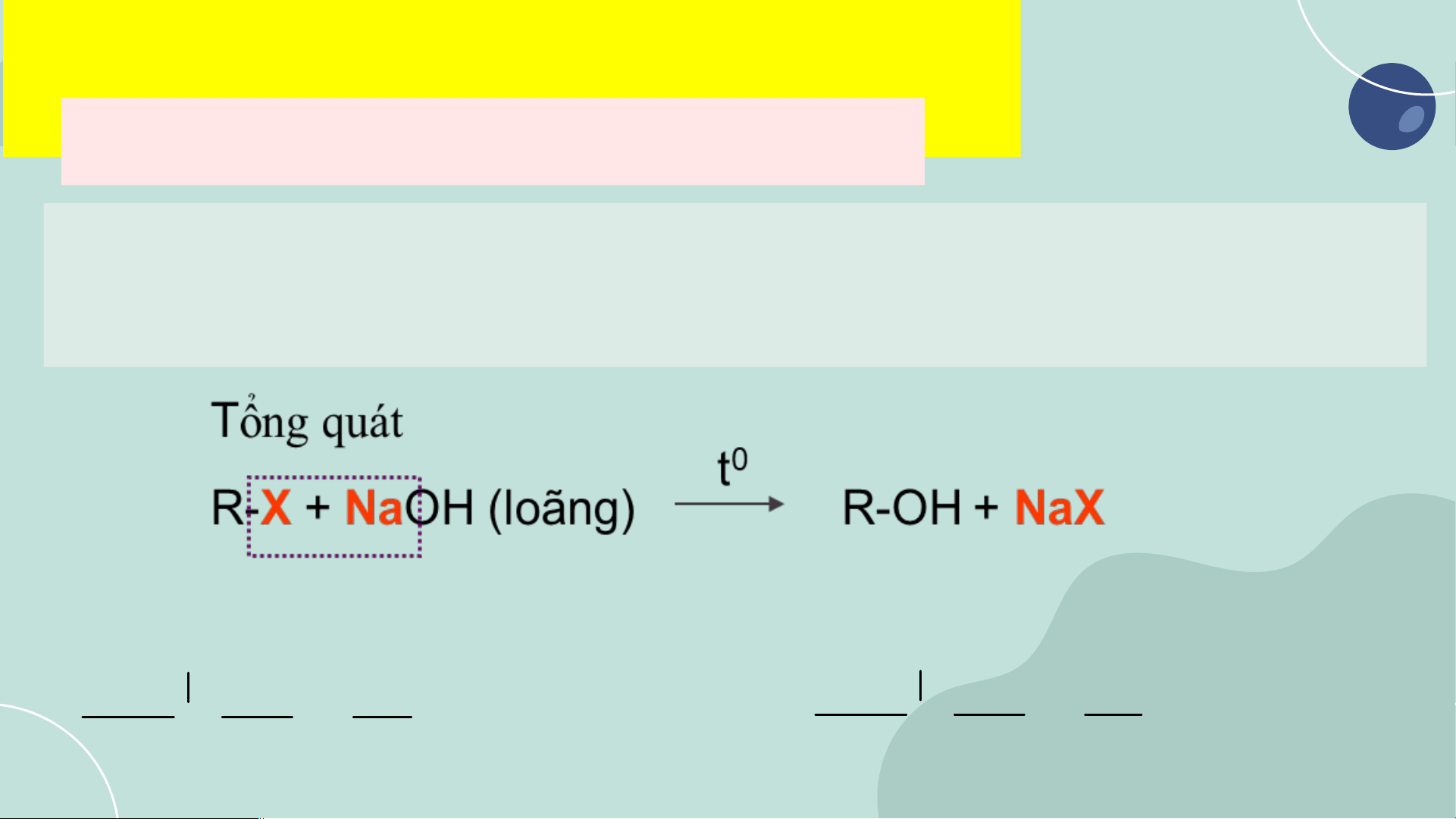
Do đặc điểm này mà DX halogen có thể tham gia phản ứng thế nguyên tử
halogen bằng nhóm –OH, phản ứng tách hydrogen halide 1. Ph n ả n ứ g th ế nguyên t h ử alogen b ng ằ nhóm –OH (Ph n ả ứng thu
ỷ phân trong môi trư ng ờ ki m ề )
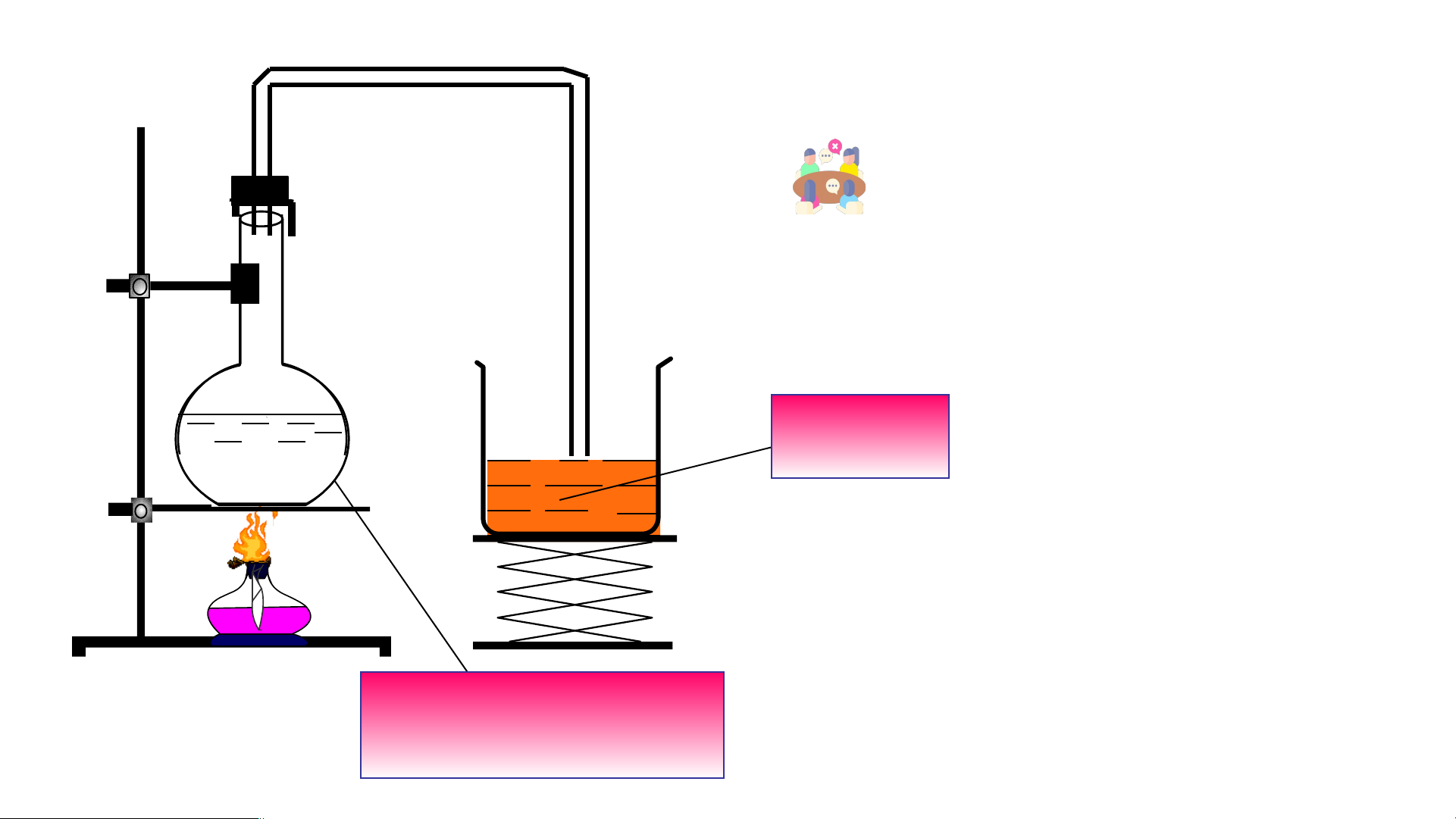
Tìm hiểu thí nghiệm thủy phân chloroethane
11. Tại sao cần phải rửa ion Cl -
Quan sát video và trả lời câu hỏi sau:
12. Hãy cho biết mục đích của việc acid hóa
dung dịch sau thủy phân bằng dung dịch HNO . 3
Có thể thay dung dịch HNO bằng H SO hoặc 3 2 4
dung dịch HCl được không?
13. Giải thích kết quả ở cuối thí nghiệm. 1. Ph n ả n ứ g th ế nguyên t h ử alogen b ng ằ nhóm –OH (Ph n ả ứng thu
ỷ phân trong môi trư ng ờ ki m ề )
Tìm hiểu thí nghiệm thủy phân chloroethane
Quan sát video và trả lời câu hỏi sau:
11. Tại sao cần phải rửa ion Br -
12. Hãy cho biết mục đích của việc acid hóa
dung dịch sau thủy phân bằng dung dịch HNO . 3
Có thể thay dung dịch HNO bằng H SO hoặc 3 2 4
dung dịch HCl được không?
13. Giải thích kết quả thí nghiệm ở Bước 4. .
Tìm hiểu thí nghiệm thủy phân chloroethane
11. Tại sao cần phải rửa ion - Br
Vì một phần C H Br thuỷ phân cho ra HBr, nên cần làm sạch HBr nếu còn HBr sẽ xảy ra phản 2 5
ứng trung hoà ảnh hưởng đến hiệu suất phản ứng thuỷ phân
12. Hãy cho biết mục đích của việc acid hóa dung dịch sau thủy phân bằng dung dịch
HNO . Có thể thay dung dịch HNO bằng H SO hoặc dung dịch HCl được không? 3 3 2 4
Acid hóa dung dịch sau thủy phân để trung hòa lượng NaOH dư
Dùng HNO để tạo muối NaNO vì cho AgNO vào chỉ tạo kết tủa AgBr vàng nhạt, nếu H SO 3 3 3 2 4
và HCl khi thêm AgNO vào thì tạo thêm kết tủa Ag SO , AgCl hiện tượng không rõ ràng. 3 2 4
13. Giải thích kết quả thí nghiệm ở Bước 4.
Phản ứng thủy phân C H Cl tạo ra NaCl. NaCl phản ứng với dung dịch AgNO tạo kết tủa trắng 2 5 3 0 t
CH CH -Cl + NaOH CH CH -OH + NaBr 3 2 3 2 chloroethane ethanol
AgNO + NaCl AgCl +NaNO 3 3 1. Ph n ả n ứ g th ế nguyên t h ử alogen b ng ằ nhóm –OH (Ph n ả ứng thu
ỷ phân trong môi trư ng ờ ki m ề )
Tìm hiểu thí nghiệm thủy phân chloroethane
Dẫn xuất halogen mà nguyên tử halogen liên kết với carbon no có phản
ứng thế nhóm –OH trong dung dịch kiềm, đun nóng. VD: CH CH 3 3 0 t H C Br + NaOH H C + NaBr 3 CH CH2 3 CH CH2 OH
Em hãy quan sát thí nghiệm,
nêu hiện tượng, viết PTPU dung dịch nươc brom KOH; C H OH; 2 5 CH CH Cl 3 2
2. Phản ứng tách hydrogen halide Trong phản ứng tách Phản ứng tách HX (tách HX) hydrogen halide nguyên của 2-bromobutane
Tìm hiểu phản ứng tách hydrogen halide tử halogen được tách thu được sản phẩm cùng với nguyên tử H 0 CH –CH + +KOH, ethanol;t CH =CH nào? của carbon nào? 2 2 -HCl 2 2 KOH ethane H Cl CH -CH=CH-CH 3 3 0 + KOH, ethanol, t H C but-2-ene 3 CH C H CH2 - HBr Br H H CH -CH CH=CH 3 2 2 2- bromobutane but-1-ene
- Quy tắc Zaitsev: khi tách HX ra khỏi dẫn xuất halogenua thì sản phẩm chính
được tạo thành theo hướng “X tách ra cùng với H của carbon bậc cao hơn” (tạo
thành anken có nhiều nhóm thế hơn). LUYỆN TẬP
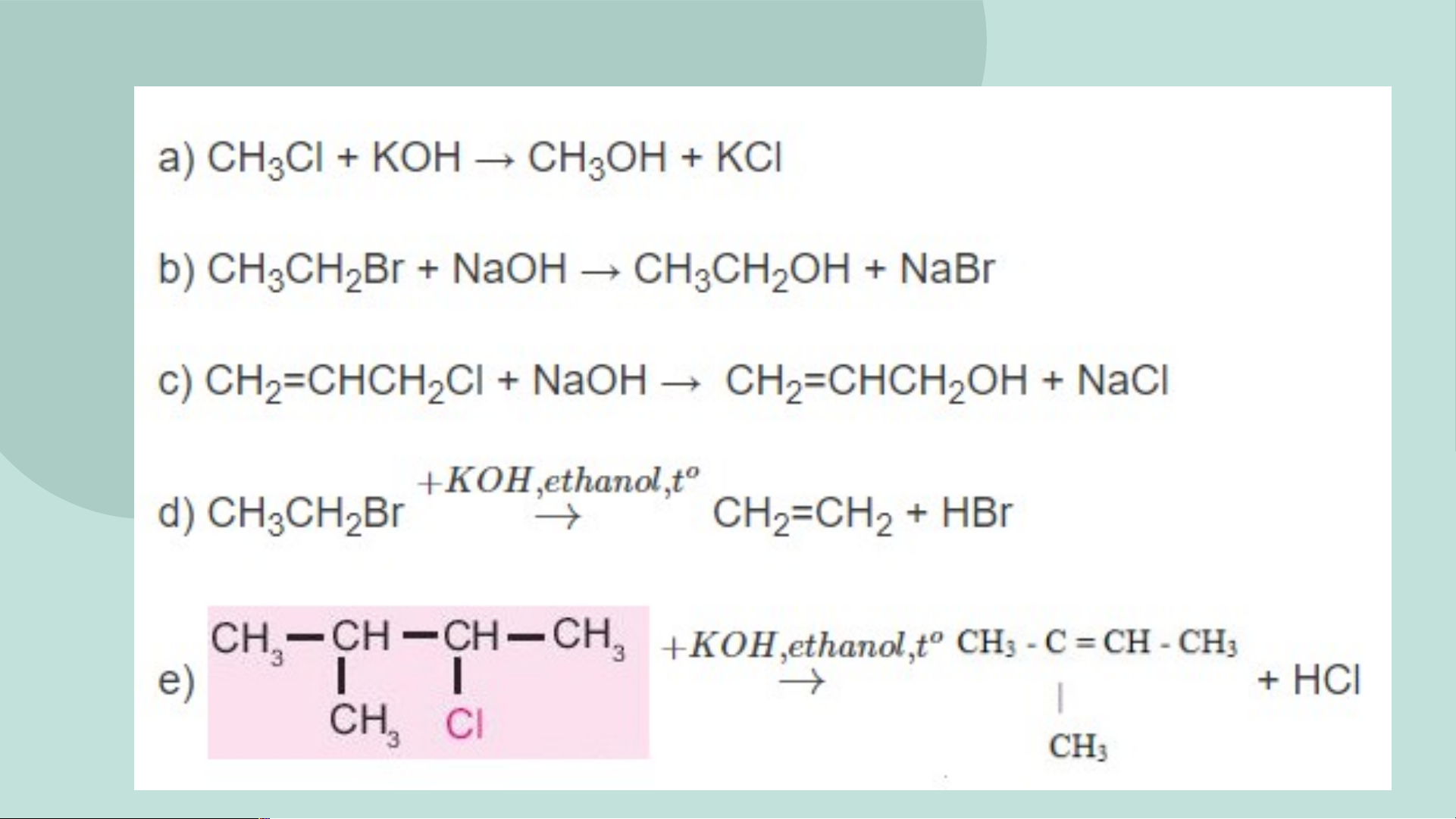
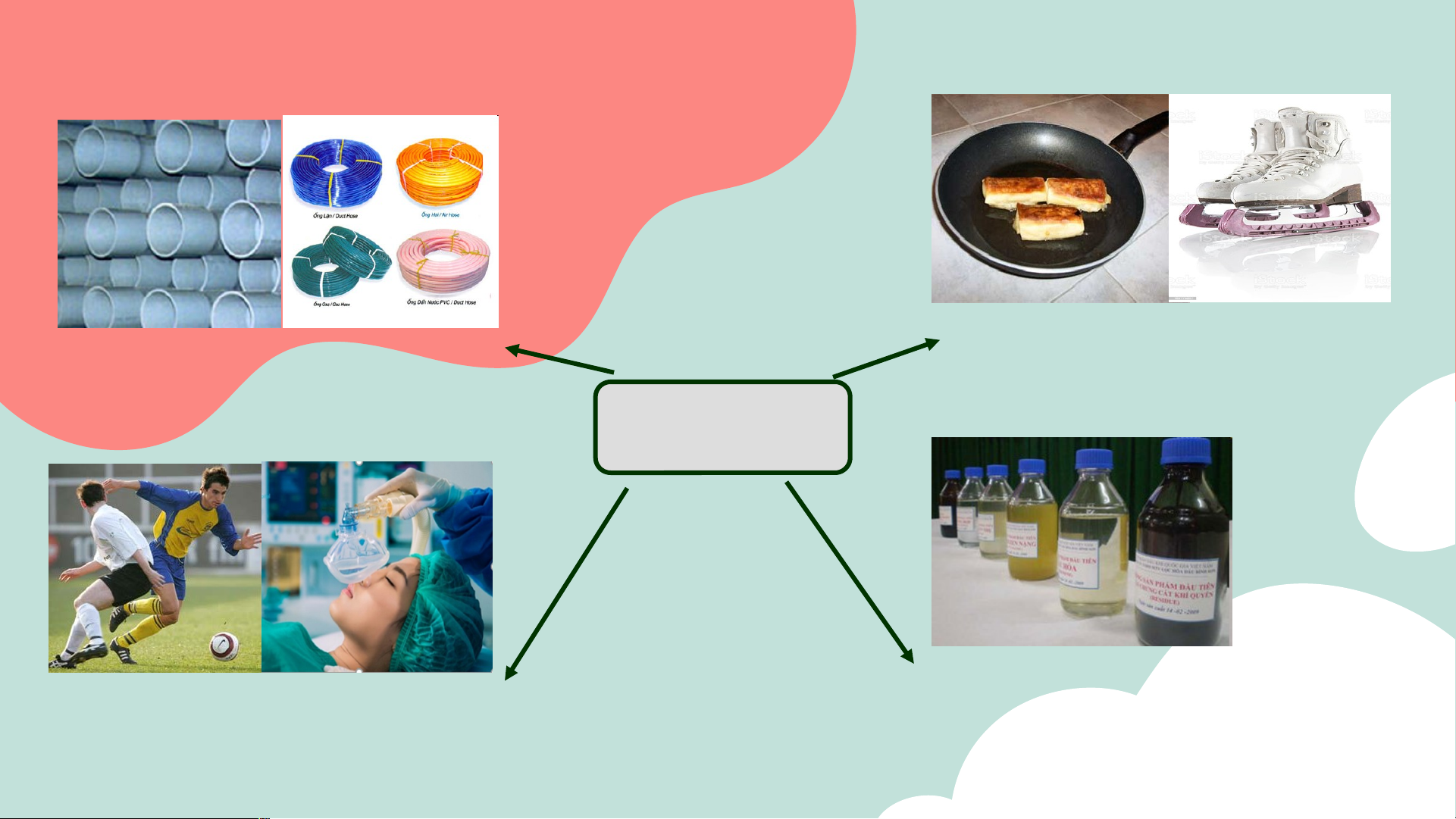
16. Hoàn thành các phương trình hóa học . a) CH Cl + KOH 3 b) CH CH Br + NaOH 3 2 c) CH = CHCH Cl + NaOH 2 2 0 KOH,ethanol, t d) CH CH Br 3 2 e ) H C 0 KOH,ethanol,t 3 CH CH CH3 CH Cl 3 05 ỨNG DỤNG 05- ÖÙNG DUÏNG Nhöïa PVC -(CH - Teflon: -(CF - 2 2 CH ) - CF ) - 2 n 2 n DX Halogen
Thuoác gaây teâ: C H Cl Làm dung môi 2 5 CH Cl , CHCl , CCl 2 2 3 4
Thuốc gây mê: CF -CHClBr. 3
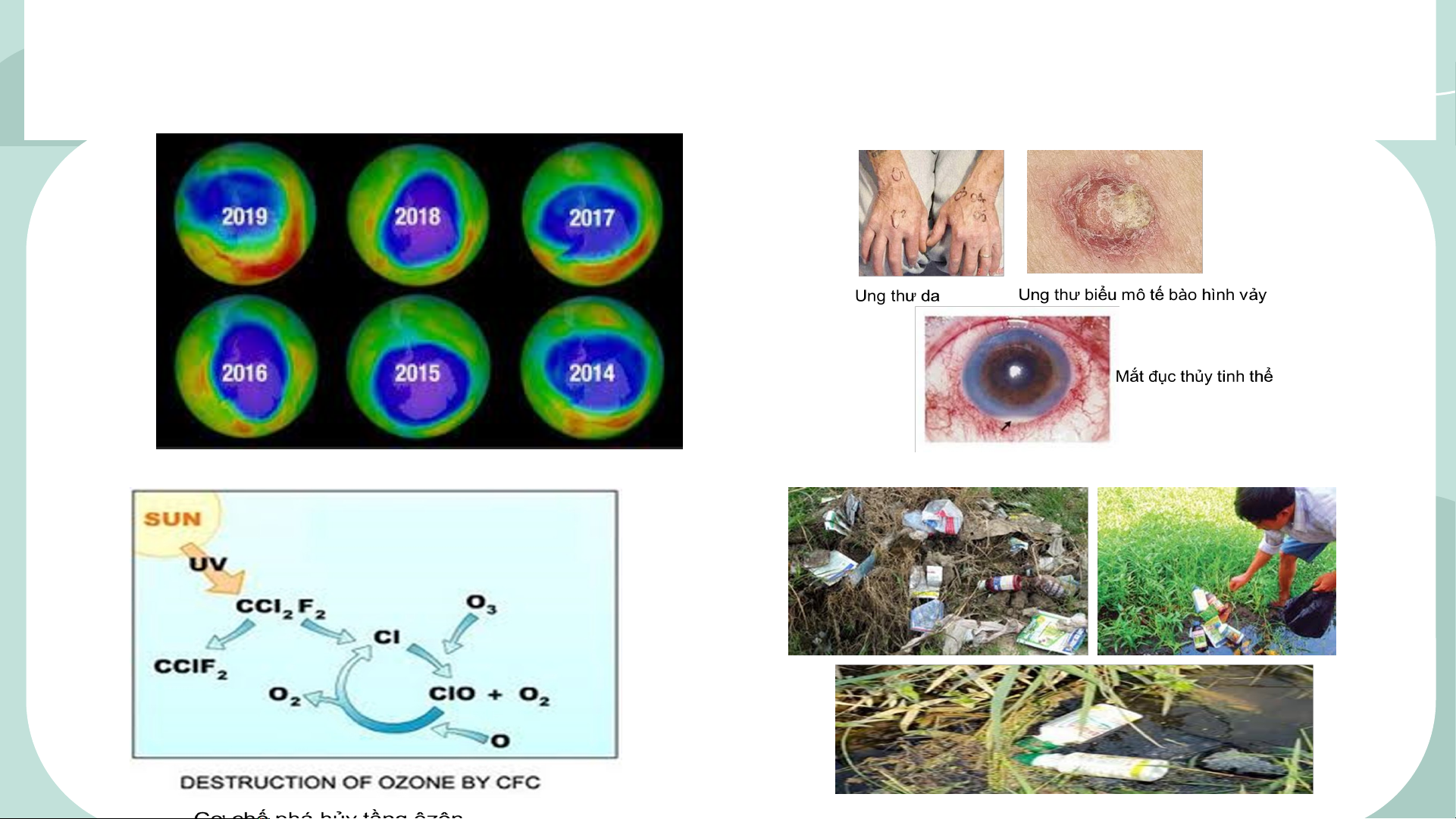
Mặc dù có nhiều ứng dụng trong thực tế nhưng các dẫn xuất của halogen lại gây ra một
vấn về môi trường đó là “lỗ thủng tầng ozone”, “ô nhiễm môi trường”.
Lỗ thủng tầng ôzôn qua thời gian
Tìm hiểu ứng dụng và cách sử dụng dẫn xuất halogen
Hiện nay, vì yếu tố lợi nhuận mà vấn đề lạm dụng thuốc bảo vệ thực vật, thuốc kích thích
tăng trưởng gây tác hại nghiêm trọng đến sức khỏe người tiêu dùng. Hãy đưa ra hướng giải
quyết về tình trạng trên. Lời giải:
Tuyên truyền nâng cao ý thức của
người dân trong việc sản xuất nông nghiệp sạch
Tăng cường công tác thanh, kiểm tra, xử lý nếu vi phạm.
Hãy chung tay bảo vệ môi trường của chúng ta. CỦNG CỐ
Câu 1: Cho các dẫn xuất halogen sau: (1)C H F (2) C H Br (3) C H I (4) C H Cl 2 5 2 5 2 5 2 5
Thứ thự giảm dần nhiệt độ sôi là:
A (3) > (2) > (4) > (1)
B (1) > (4) > (2) > (3)
C (1) > (2) > (3) > (4)
D (3) > (2) > (1) > (4)
Câu 2: Danh pháp IUPAC của dẫn xuất halogen có công
thức cấu tạo ClCH CH(CH )CHClCH là 2 3 3 1,3-dichloro-2-methylbutane 2,4-dichloro-3-methylbutane 1,3-dichloropentane 2,4-dichloro-2-methylbutane
Câu 3: Sự tách hydrogen halide của dẫn xuất
halogen X có CTPT C H Cl cho 3 olefin đồng phân, 4 9
X là chất nào trong những chất sau đây? A n- butyl chloride. B sec-butyl chloride. C iso-butyl chloride. D tert-butyl chloride.
Câu 4: Theo quy tắc Zaitsev, sản phẩm chính của phản
ứng tách HCl ra khỏi phân tử 2-chlorobutane là A. But-2-ene B. But-1-ene C. But-1,3-diene D. But-1-yne
Câu 5: Khi đun sôi hỗn hợp gồm C H Br và KOH trong 2 5
C H OH thấy thoát ra một chất khí không màu. Dẫn khí này đi 2 5
qua ống nghiệm đựng nước bromine. Hiện tượng xảy ra là: A. Xuất hiện B. Nước bromine kết tủa trắng có màu đậm hơn C. Nước bromine D. Không có hiện bị mất màu tượng gì xảy ra.
1. Gọi tên các dẫn xuất halogen CH3CH2CH2 – Cl CH2 = CH – I Cl – CH2CH2CH2 – Cl (1) (2) (3) CH3 H C 3 CH CH2 Cl Br (4) (5) Lời giải (1) chloropropane (4) 1,2 - (2) iodoethene (Vinyl dichloropropane (5) bromobenzene iodide) (3) 1,3 - dichloropropane
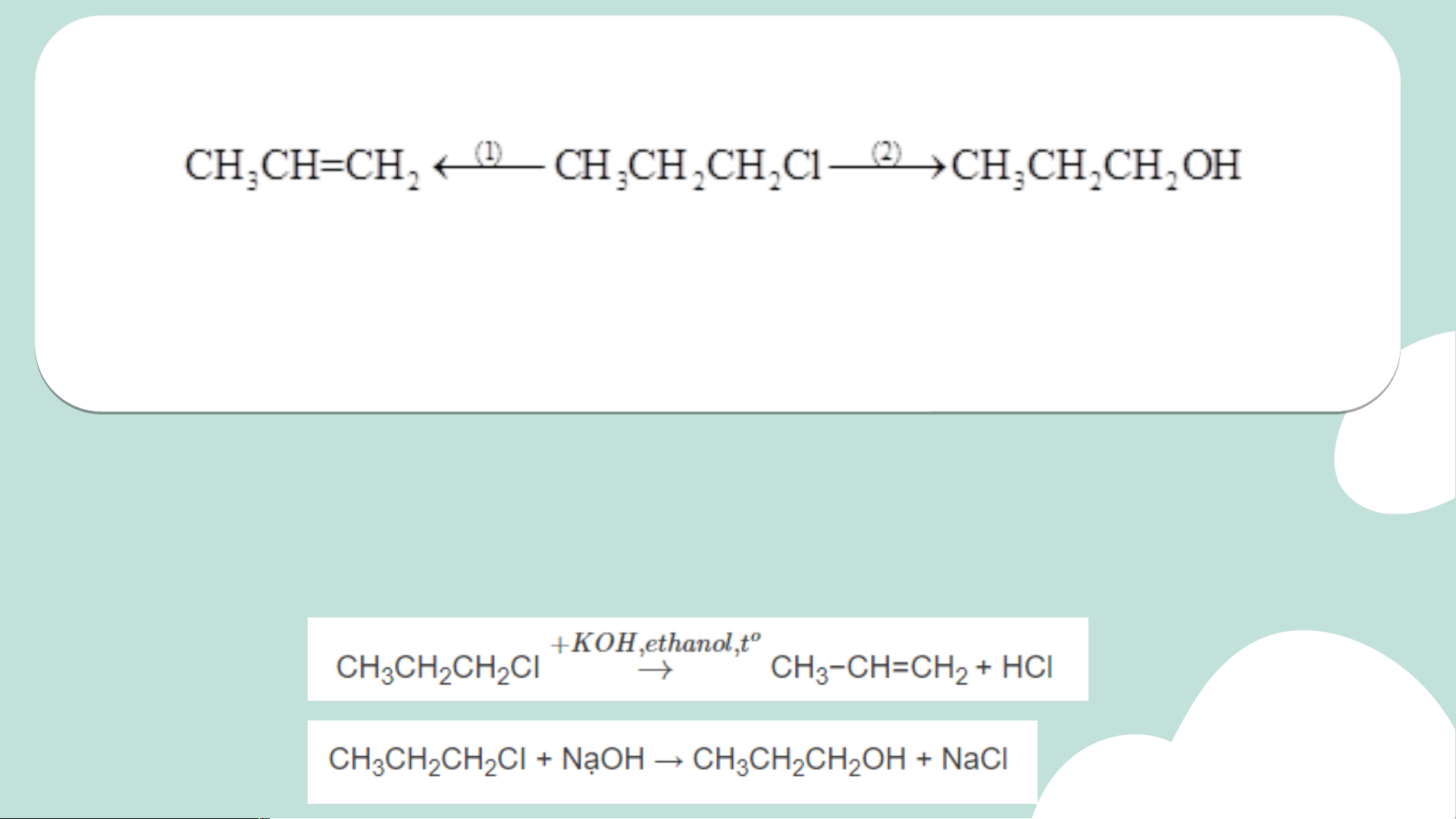
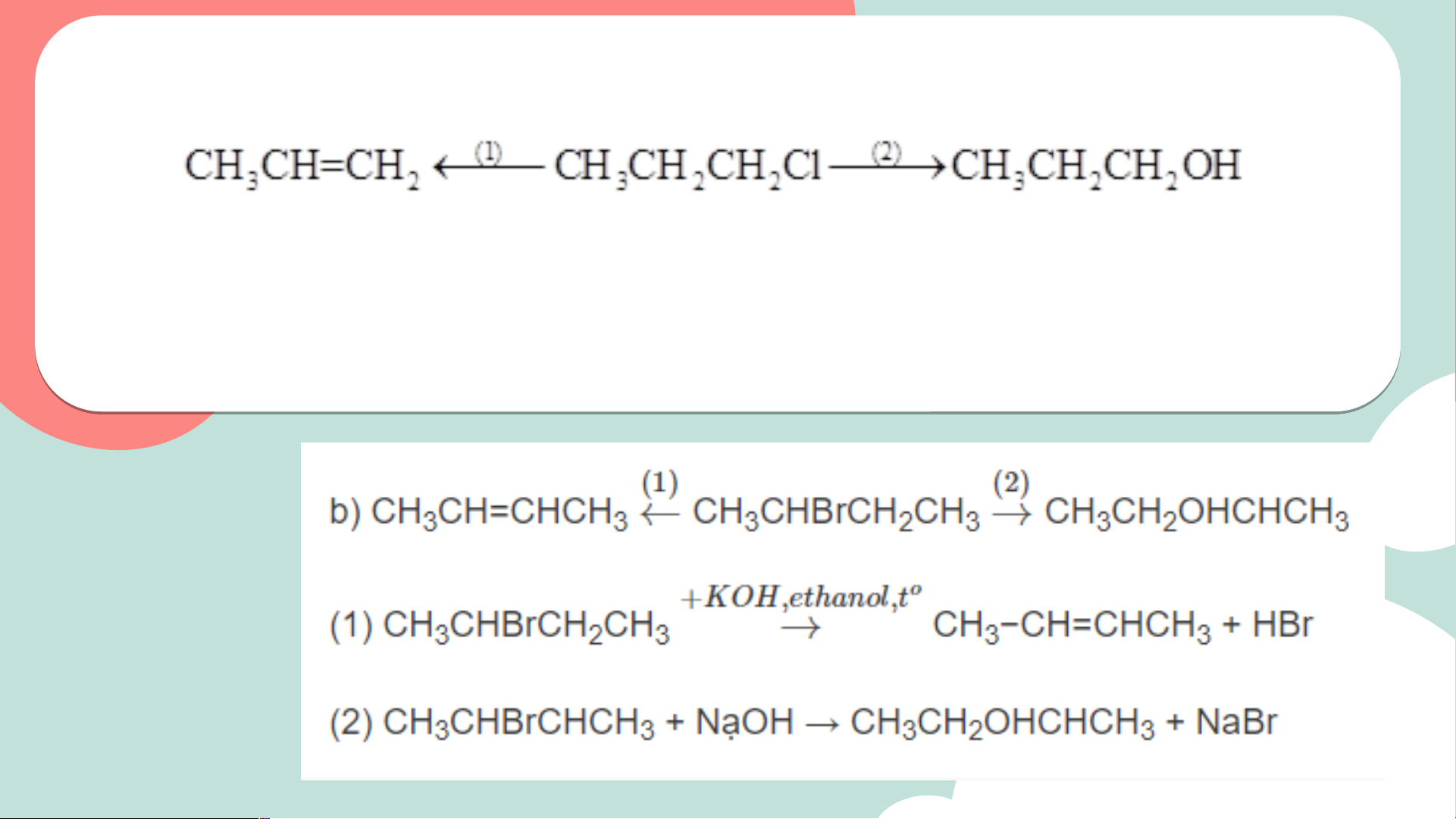
2. Cho sơ đồ biến đổi của 1-chloropropane như sau:
a) Gọi tên loại phản ứng (1), (2) và hoàn thành các phương trình hóa học.
b) Thực hiện 2 phản ứng theo sơ đồ trên khi thay hợp chất CH3CH2CH2Cl
bằng 2-bromobutane. Xác định sản phẩm hữu cơ chính (nếu có) trong các phản ứng. Lời giải
a) (1) Phản ứng tách hydrogen halide
(2) Phản ứng thế nguyên tử halogen bằng nhóm OH
2. Cho sơ đồ biến đổi của 1-chloropropane như sau:
a) Gọi tên loại phản ứng (1), (2) và hoàn thành các phương trình hóa học.
b) Thực hiện 2 phản ứng theo sơ đồ trên khi thay hợp chất CH3CH2CH2Cl
bằng 2-bromobutane. Xác định sản phẩm hữu cơ chính (nếu có) trong các phản ứng. Lời giải
3. CFC là hợp chất khó cháy, không độc và trơ về mặt hóa học. Trước đây CFC chủ yếu
được sử dụng trong công nghiệp nhiệt lạnh. CFC không gây hại ở điều kiện thường, nhưng
trên khí quyển của Trái Đất, chúng tồn tại trong khoảng 100 năm và khuếch tán lên tầng
bình lưu. Dưới tác dụng của tia UV từ Mặt Trời, liên kết C-Cl của CFC bị phá vỡ, tạo ra gốc
Cl tự do. Theo ước tính , mỗi gốc Cl tự do phá hủy 1 triệu phân tử ozone. Việc không sử
dụng CFC đã giúp lỗ hổng tầng ozone được thu hẹp. Ngày nay người ta đã sử dụng hợp
chất nào để thay thế CFC trong công nghiệp làm lạnh để tránh phá hủy tầng ozone? Lời giải
Các chất làm lạnh phổ biến khác được sử dụng trong các ứng dụng khác
nhau là ammonia, sulfur dioxide và các hydrocarbon không halogen hóa như các propane,...
Document Outline
- Slide 1
- Khởi Động
- Slide 3
- Slide 4
- Slide 5
- 01
- Slide 7
- 02
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- 03
- Slide 16
- Slide 17
- Slide 18
- 04
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- 05
- Slide 30
- Slide 31
- Slide 32
- CỦNG CỐ
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42




