














Preview text:
LƯU Ý KHI THAM GIA HỌC
1- Làm BTVN và chuẩn bị bài trước khi bắt đầu tiết học
2- Tích cực giơ tay phát biểu xây dựng bài
3- Phản hồi thông tin văn minh, sáng tạo
4- Thực hiện thí nghiệm an toàn, theo đúng quy định MỞ ĐẦU
Hãy nối những hình ảnh là ứng dụng của dãy đồng đẳng Hydrocacbon nào? Xăng, dầu, nến, sáp… Thuốc nổ TNT Đèn xì oxy - axetilen Kích thích hoa quả chín Alkane Arene Alkyne Alkene BÀI 18 ÔN T P Ậ CHƯ NG Ơ 4 Hóa học 11 – KNTT MỤC TIÊU
• Phân loại được các Hydrocacbon dựa vào đặc điểm cấu tạo 01
• Trình bày được tính chất hóa học đặc trưng của alkane, 02 alkene, alkyne, arene.
• Mô tả phương pháp điều chế và liệt kê ứng dụng của các 03
alkane, alkene, alkyne, arene trong đời sống. NỘI DUNG BÀI HỌC 1.
Hệ thống hóa kiến thức về các Hydrocarbon 2.
Luyện tập dạng bài tập lý thuyết về Hydrocarbon 3.
Luyện tập dạng bài vận dụng liên hệ thực tiễn 01 HỆ THỐNG HÓA KIẾN THỨC VỀ HYDROCARBON
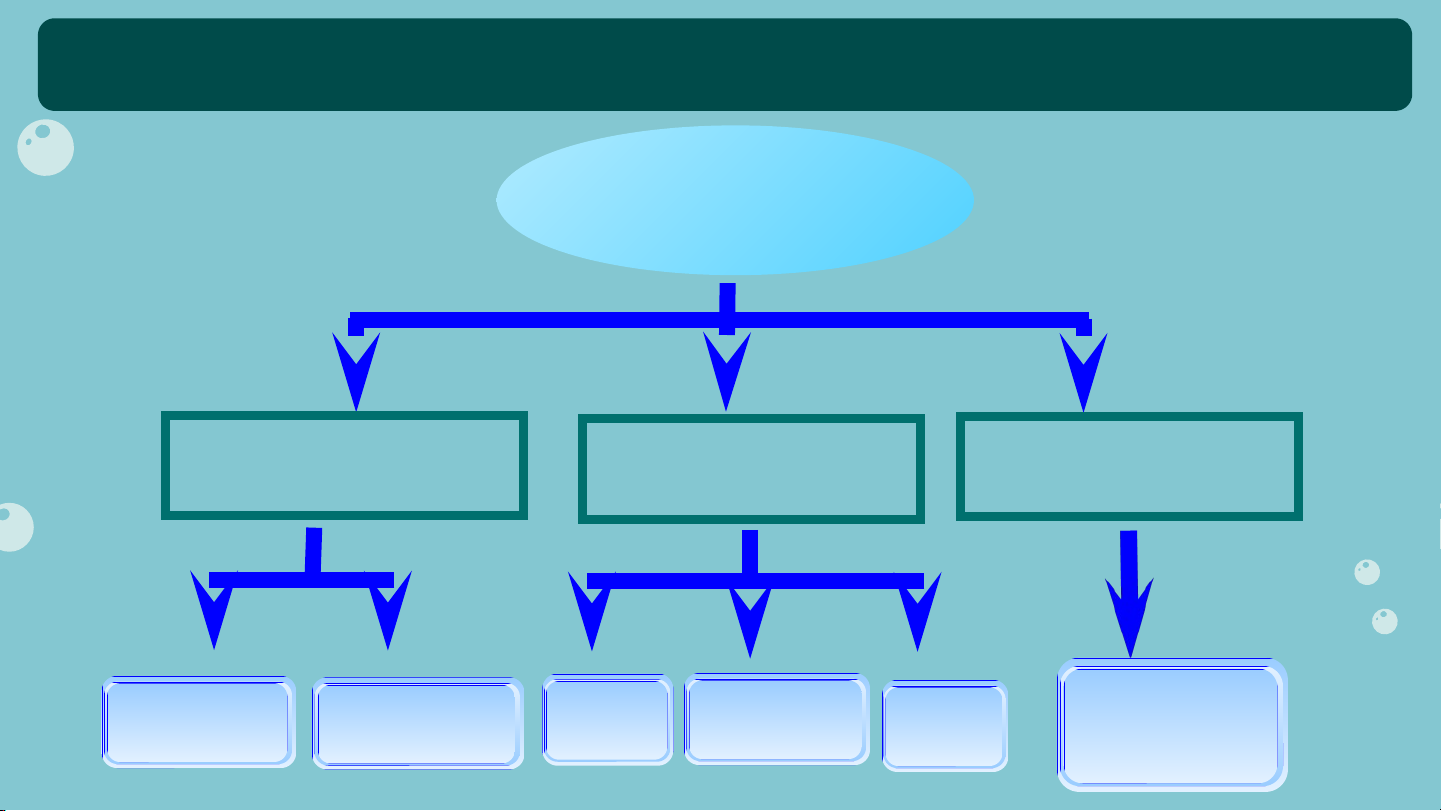
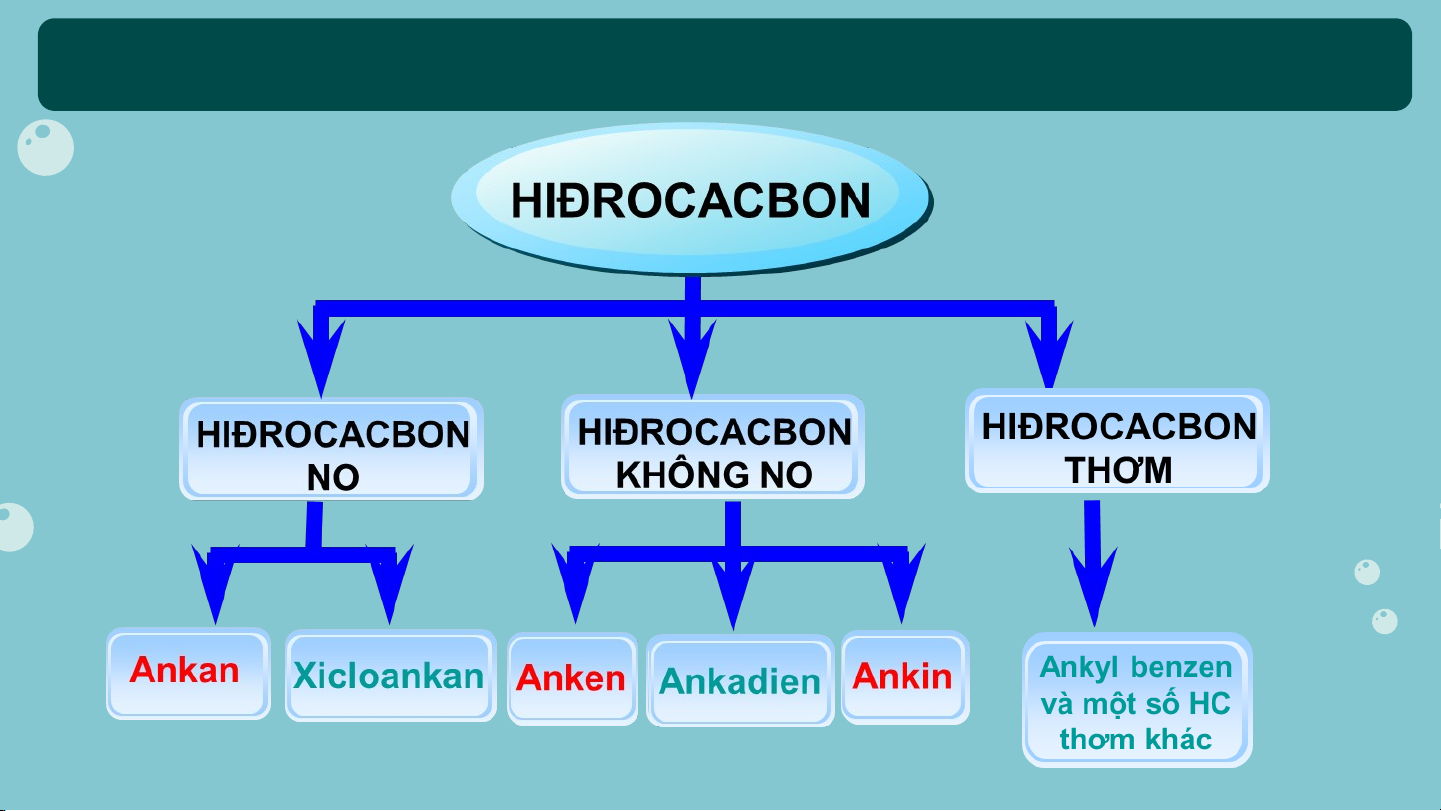
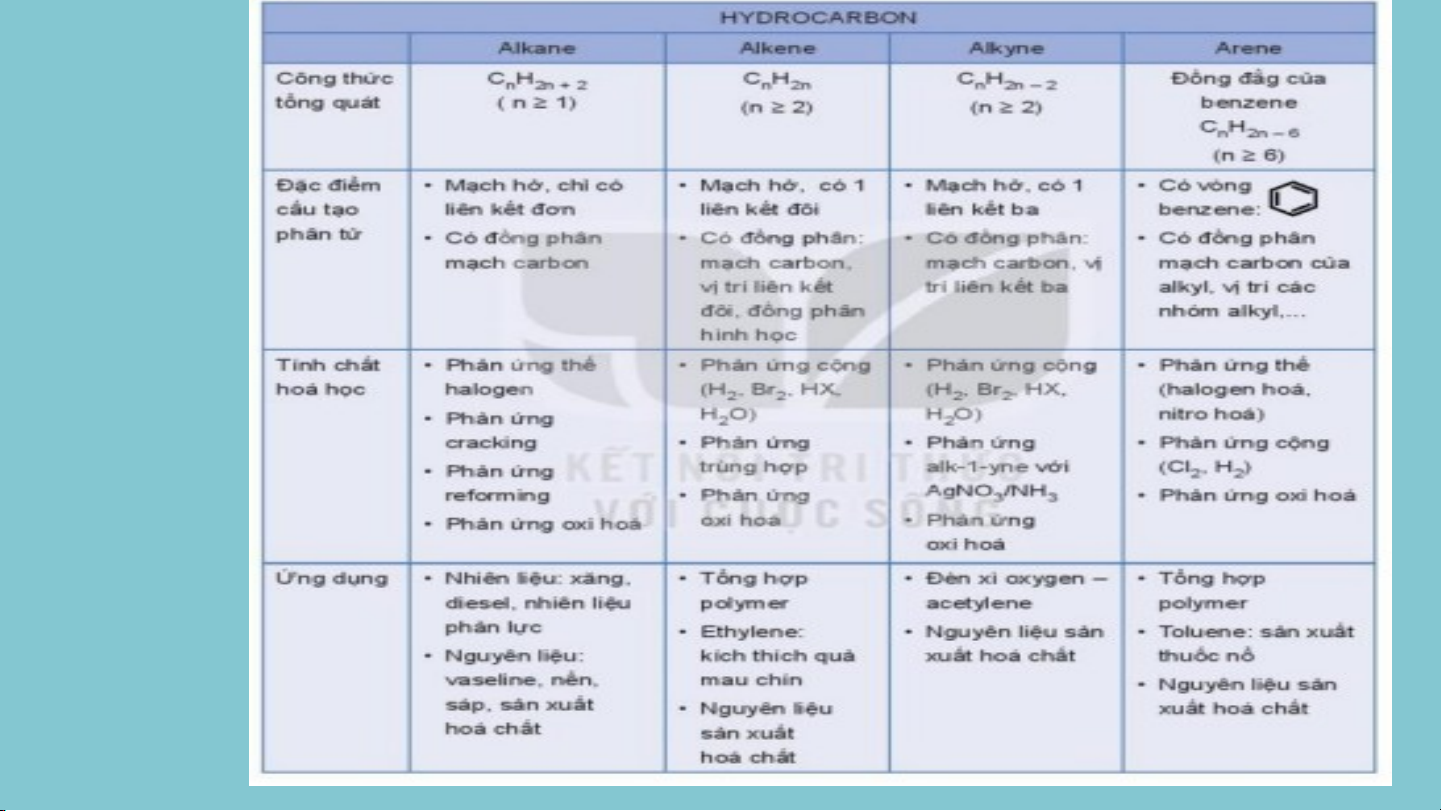
HỆ THỐNG HOÁ VỀ HYDROCARBON HIĐROCACBON HIĐROCACBON HIĐROCACBON HIĐROCACBON NO KHÔNG NO THƠM Ankyl benzen Ankan Xicloankan Anken Ankadien Ankin và một số HC thơm khác NHIỆM VỤ Thời gian: 10 phút
• So sánh sự khác biệt của alkane, Tiêu chí thành công Điểm
alkene, alkyne và arene về: CTTQ, Nhiệm vụ
đặc điểm cấu tạo, tính chất hóa học Hoàn thành CTTQ, nêu ví dụ 2 điểm cơ bản đặc trưng.
chất tiêu biểu đại diện
Nêu được đặc điểm cấu tạo 2 điểm
Trình bày được tính chất hóa 4 điểm
• Xây dựng mối liên hệ giữa các học của alkane, alkene, Nhiệm vụ
Hydrocarbon no, không no, thơm alkyne, arene. mở rộng
Thực hiện được nhiệm vụ mở 1 điểm
HS lựa chọn tài liệu nghiên cứu: rộng + Tìm hiểu SGK + Tra cứu trên internet Đúng giờ 1 điểm
HS được lựa chọn làm cá nhân hoặc nhóm đôi
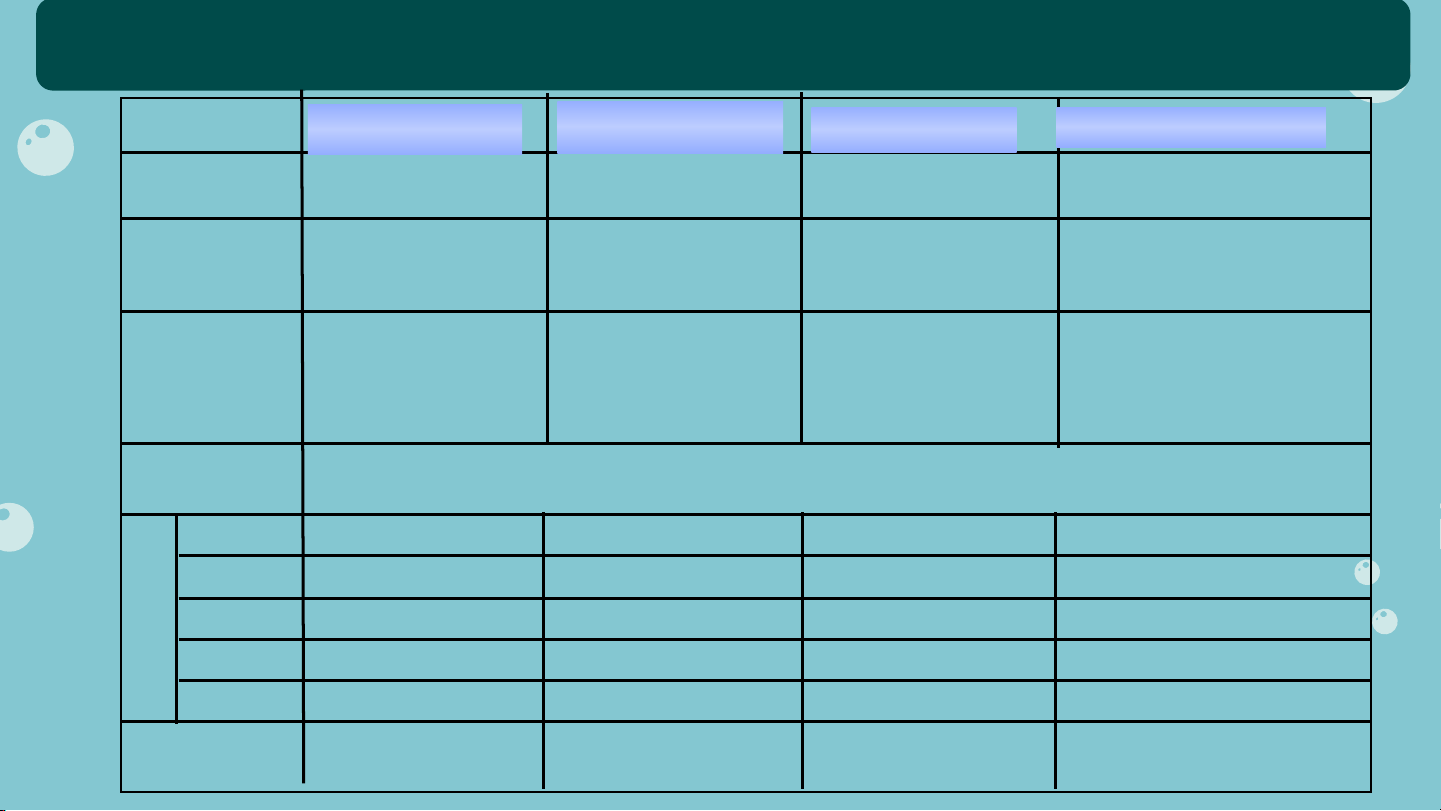
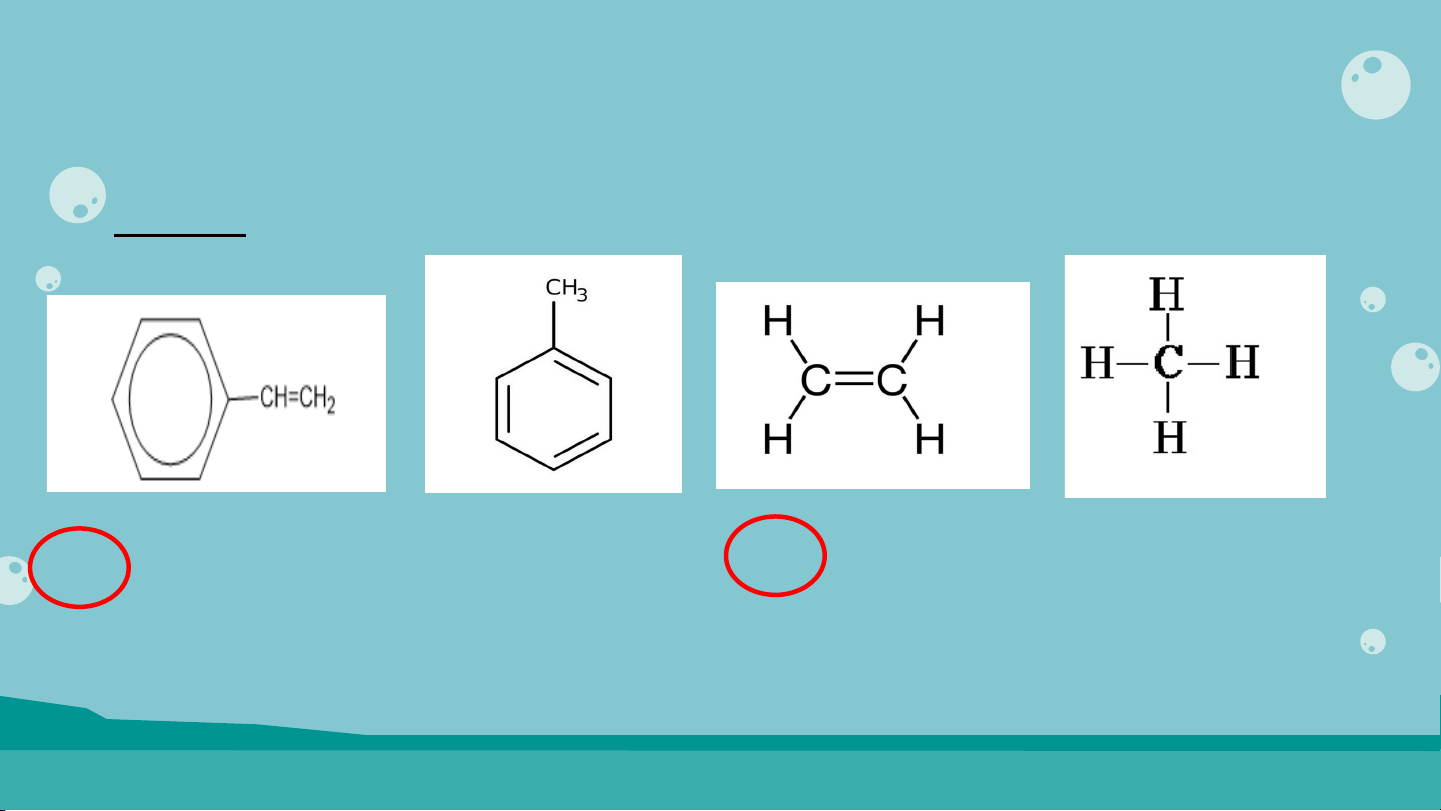
HỆ THỐNG HOÁ VỀ HIĐROCACBON Alkane Alkene Alkyne Ankylbenzene 1. CTTQ C H (n 1) C H (n 2) C H (n H (n 6) n 2n+2 n 2n 2) C n 2n-2 n 2n-6 2. Cấu tạo Chỉ có liên 1 liên kết đôi 1 liên kết ba Chứa vòng kết đơn C=C C ≡C thơm 3.Đồng phân Đồng phân mạch C Đồng phân mạch C ĐP mạch C Đồng phân mạch C Đồng phân vị trí C=C Đồng phân vị trí C ≡C của nhánh ankyl Đồng phân hình học Đồng phân vị trí -o,m,p 4. TCVL
Ở điều kiện thường, các hợp chất từ C -C đều là chất khí không màu ; C là chất lỏng/rắn 1 4 5 Không tan trong nước. 5. Thế + + Tính Tách + chất Cộng + + + hoá h c ọ t/hợp + cháy + + + + CO < H O CO = H O CO >H O CO > H O 2 2 2 2 2 2 2 2
Hoàn thành chuỗi phản ứng sau: C H 3 8 2 4 1 a) C H 3 C H 3 4 3 6 b) C H C H C H 6 12 7 8 6 14 (Xiclo hexan) (toluene)
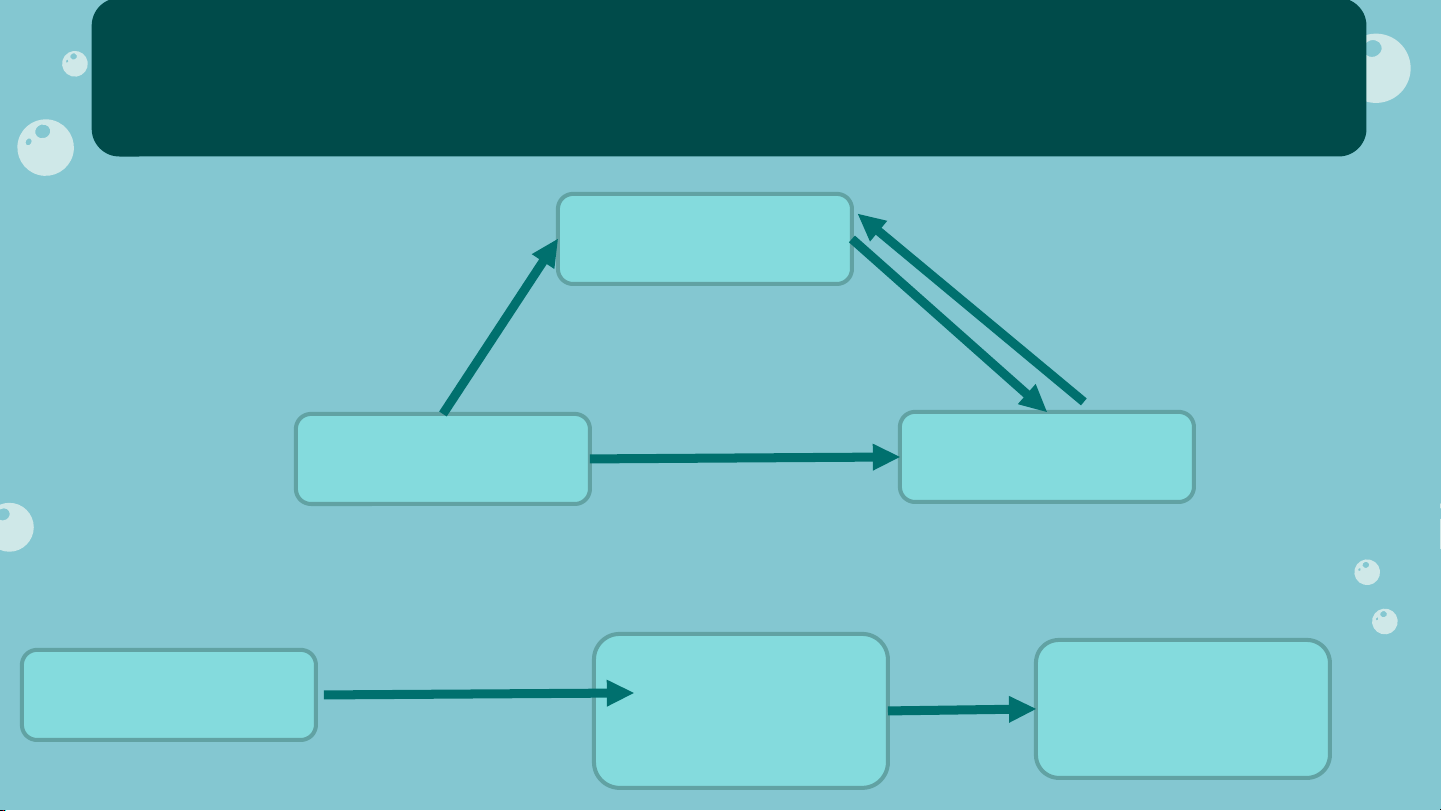
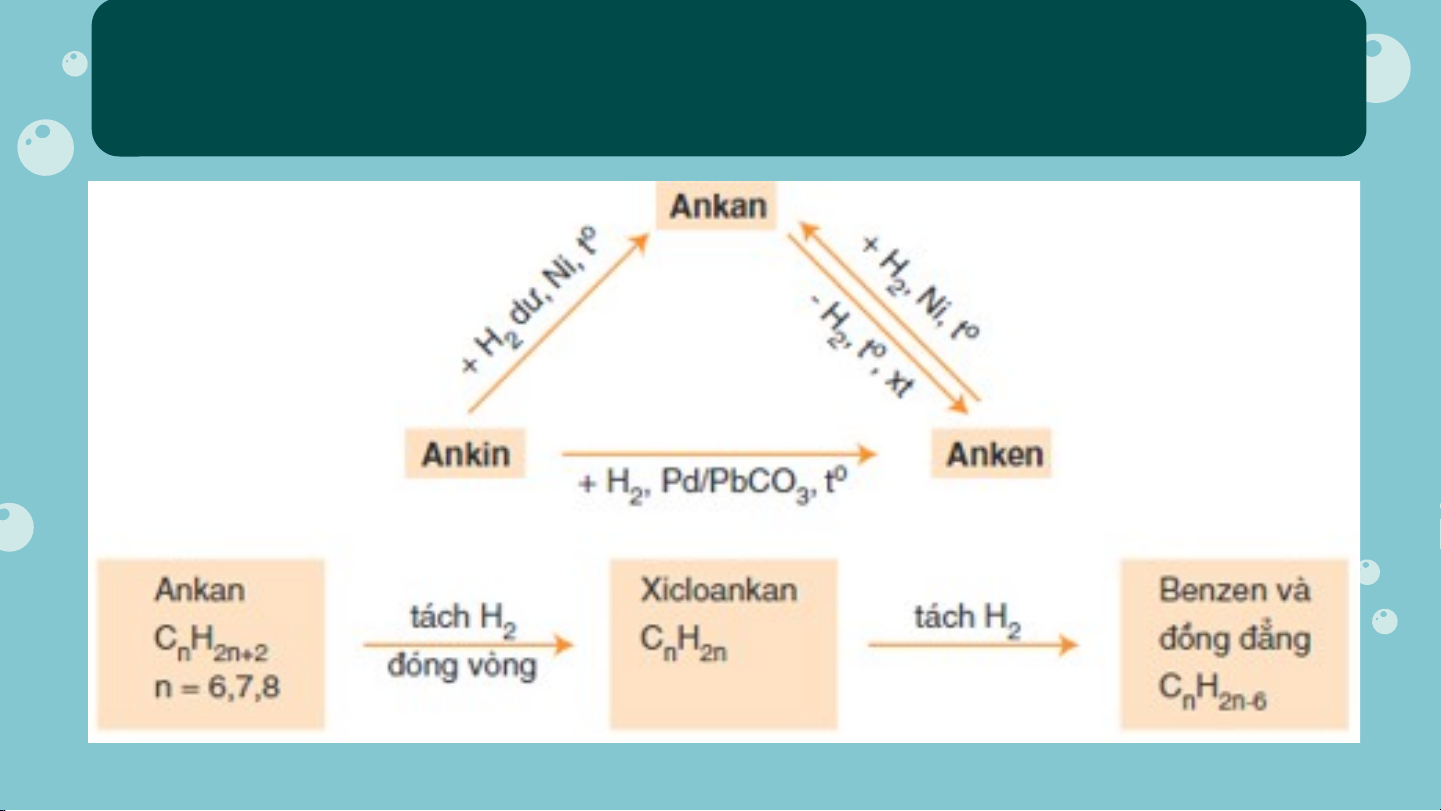
Sơ đồ mối quan hệ giữa các Hydrocarbon
Điều chế các Hydrocarbon 02 C NG C Ủ Ố C NG Ủ CỐ
Câu 1: Phát biểu nào sau đây không đúng?
A. Trong phân tử hydrocarbon, số nguyên tử hydrogen luôn là số chẵn.
B. Trong phân tử alkene, liên kết đôi gồm một liên kết σ và một liên kết π.
C. Hydrocarbon no là hydrocarbon mà trong phân tử chỉ có liên kết đơn..
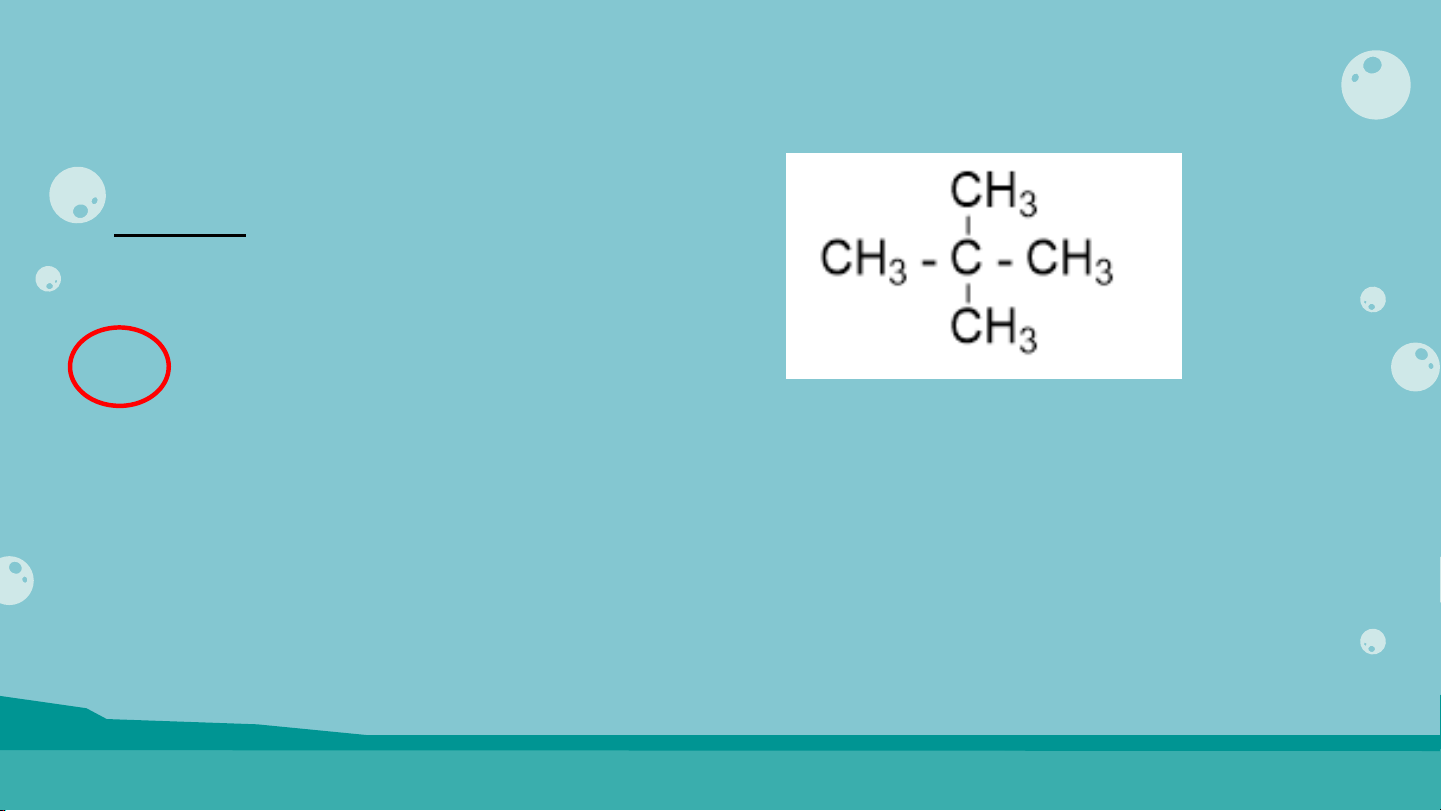
D. Công thức chung của hydrocarbon no, mạch hở có dạng C H . n 2n C NG Ủ CỐ Câu 2: Cho công th c ứ c u ấ t o ạ sau: Tên thay th ế c a ủ h p ợ ch t ấ là A. 2,2-dimethylpropane B. 2-methylbutane. C. 2 – metyl propan D. pentane CỦNG CỐ
Câu 3: Hai hydrocarbon A và B có cùng CTPT là C H 5 12
(A) + chlorine chỉ tạo ra 1 dẫn xuất monochlorine duy nhất
(B) + chlorine tạo ra 4 dẫn xuất monochlorine.
Tên gọi của A và B lần lượt là
A. 2,2-dimethylpropane và 2-methylbutane.
B. 2,2-dimethylpropane và pentane.
C. 2-methylbutane và 2,2-dimethylpropane.
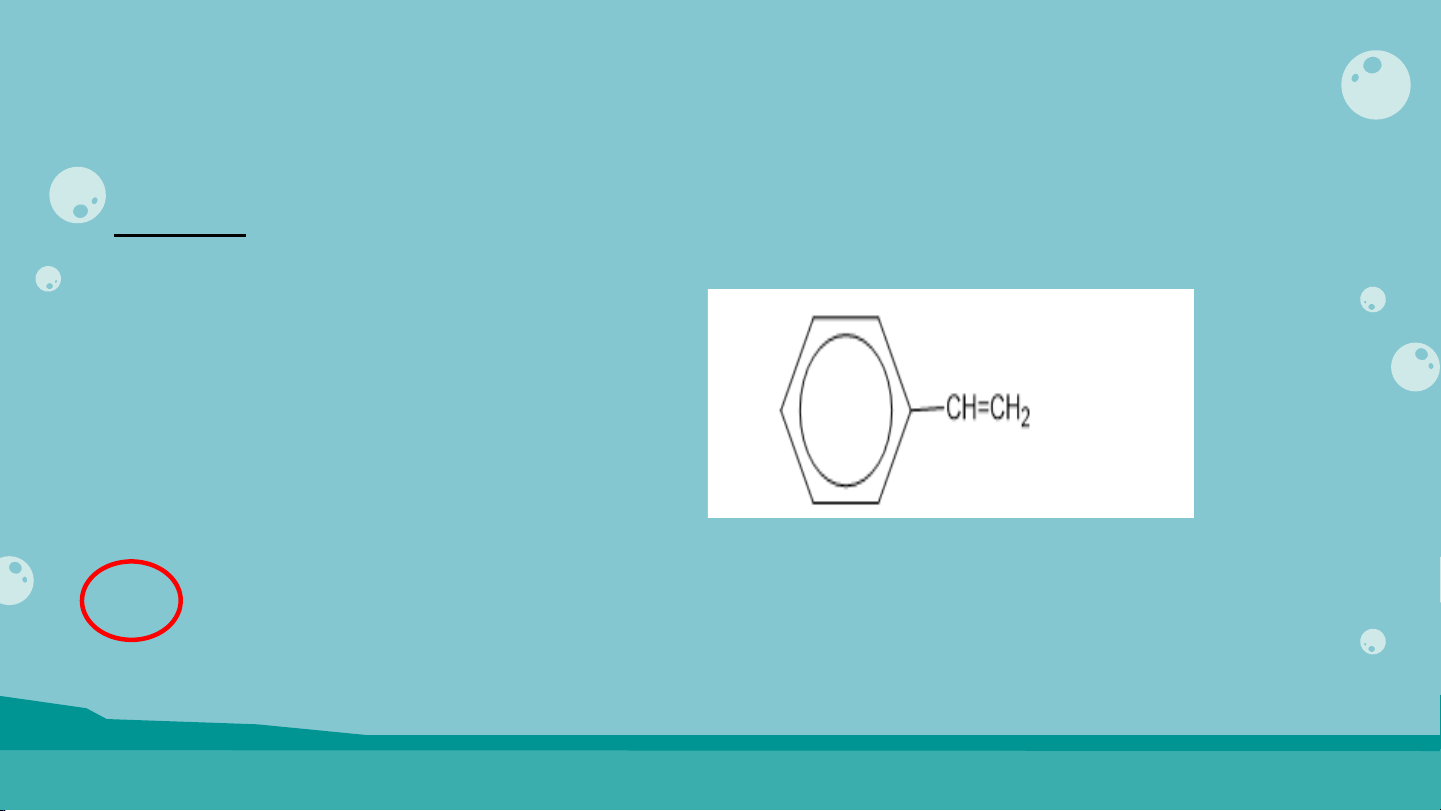
D. 2-methylbutane và pentane. C NG Ủ CỐ Câu 4: Cho công th c ứ c u ấ t o ạ sau: Tên c a ủ h p ợ ch t ấ này là A. Styrene. B. Vinyl benzene C. Toluen D. Cả A và B đều đúng. C NG Ủ CỐ Câu 5: Hãy ch n ọ nh n ữ g ch t ấ làm m t ấ màu dung d c ị h Bromine: (1) Styrene (2) Toluene (3) Ethene (4) Methane C NG Ủ CỐ
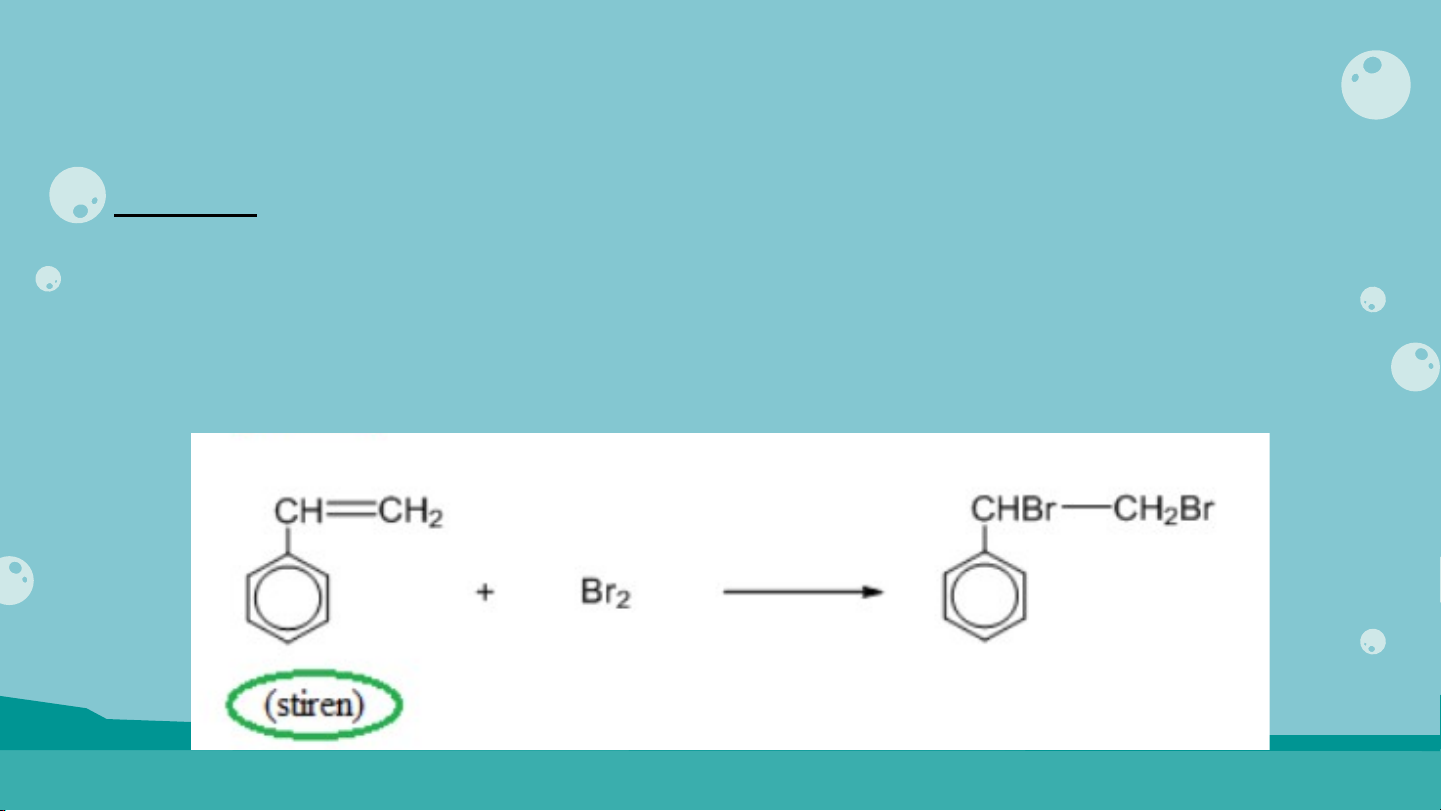
Câu 5: Styrene phản ứng với dung dịch bromine
tạo thành sản phẩm có công thức phân tử C H Br . 8 8 2
Hãy viết phương trình của phản ứng này. Lời giải: CỦNG CỐ
Câu 7: Reforming octane (C H ) thu được các arene có 8 18
công thức phân tử C H . Hãy viết công thức cấu tạo của 8 10 các arene này.
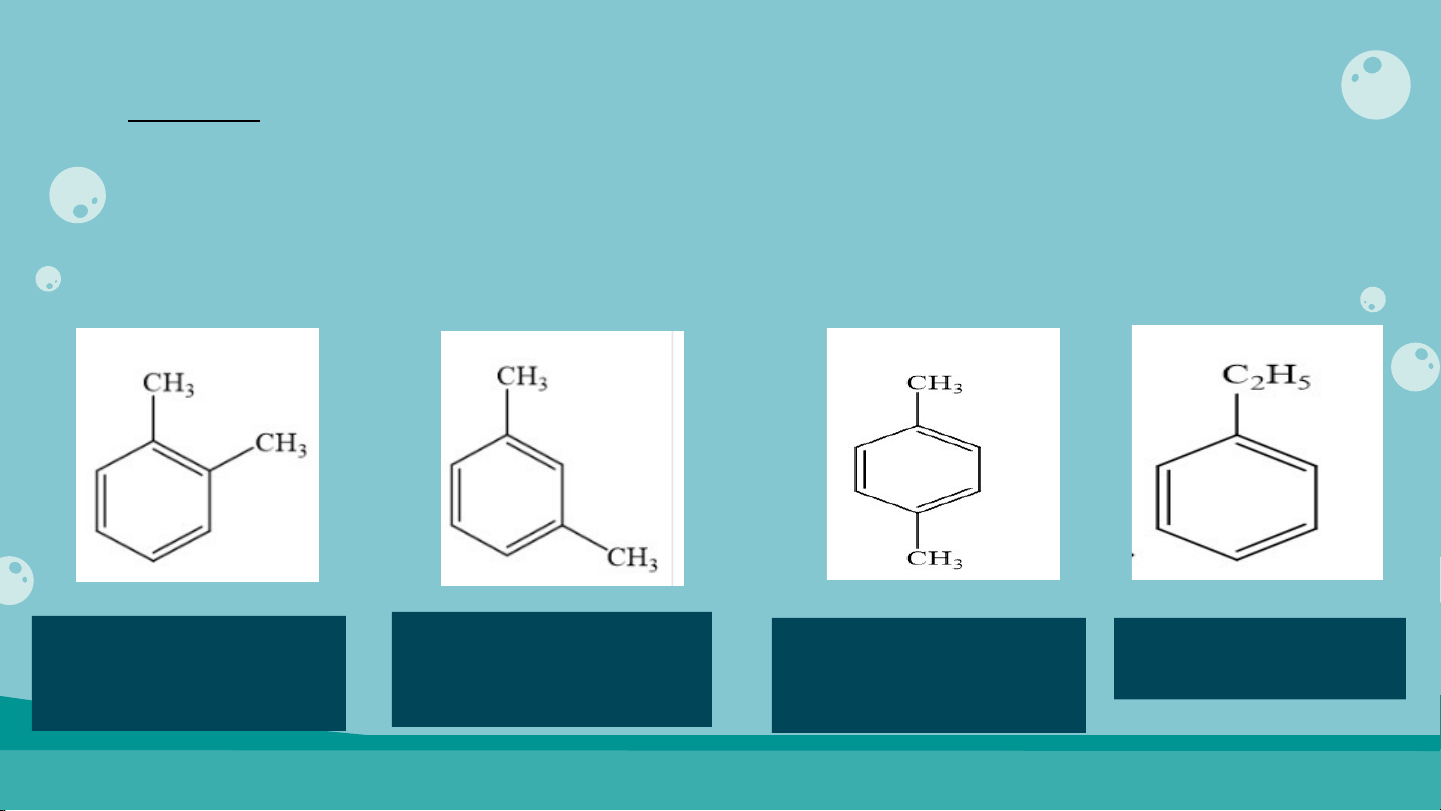
Lời giải: Phân tử C H có 4 đồng phân 8 10 o – xylene m – xylene p – xylene Ethyl benzene 1,2-dimethylbenzene 1,3-dimethylbenzene 1,4-dimethylbenzene . o – dimethylbenzene. m – dimethylbenzene. p– dimethylbenzene. MỞ RỘNG Ga G s, a s, n h n i hên ê n l iệu ệ u p h p ổ h ổ b i bến ế n h i hện ệ n n a n y a có y có t h t à h n à h n h p h p ầ h n ầ n ch c í h n í h n h là à p ro p p ro a p n a e n e và và b u b t u a t n a e n . e .N h N i hệt ệ tl ượ ư n ợ g n g g i gải ả p h p ó h n ó g n g kh i kh đ ố đ t ố t chá ch y á h y o h à o n à n t o t à o n à n 1 1 k g kg mộ t mộ tl oạ o i ạ g a g s a l s à à kh o kh ả o n ả g n g 5 0 5 0 4 0 4 0 0 0 kJ . kJ. a) a Bi Bết ế tđ ể đ ể l àm àm n ó n n ó g n g 1 1 kg kg n ư n ớ ư c ớ l c ên ê n 1 1 đ ộ đ ộ t h t ì h ìcầ n cầ n cu n cu g n g cấp cấ p n h n i hệt ệ tl ượ ư n ợ g n g l à à 4 4 2 0 2 0 0 0 J. J. Đ ể Đ ể đ u đ n u n sô i sô 3 0 3 0 kg kg n ư n ớ ư c ớ từ t ừ n h n i hệt ệ tđ ộ đ ộ 2 0 2 °C 0 °C cầ n cầ n cu n cu g n g cấ p cấ p b a b o a o n h n i hêu ê u kJ n kJ h n i hệt ệ ? t A. A .2 5 2 2 5 0 2 0 kJ kJ B . B .5 0 5 4 0 0 4 0 kJ kJ C . C .1 0 1 0 0 8 0 0 8 kJ 0 kJ D . D . 60 6 4 0 8 4 8 kJ Lời giải: Tóm tắt a) c = 4200 J
Nhiệt lượng cần cung cấp để đun sôi 30 kg m = 30 kg
nước từ nhiệt độ là: Q = 50 400 kJ o
Q = m. c.▲t = 30.4200.(100 - 20) = 10 080 kJ 1 H = 80%. MỞ RỘNG Ga G s, a s, n h n i hên ê n l iệu ệ u p h p ổ h ổ b i bến ế n h i hện ệ n n a n y a có y có t h t à h n à h n h p h p ầ h n ầ n ch c í h n í h n h là à p ro p p ro a p n a e n e và và b u b t u a t n a e n . e .N h N i hệt ệ tl ượ ư n ợ g n g g i gải ả p h p ó h n ó g n g kh i kh đ ố đ t ố t chá ch y á h y o h à o n à n t o t à o n à n 1 1 k g kg mộ t mộ tl oạ o i ạ g a g s a l s à à kh o kh ả o n ả g n g 5 0 5 0 4 0 4 0 0 0 kJ . kJ. b) b Cầ ) n Cầ n đố đ t ch ố á t ch y á h y o h à o n à n to à to n à b n a b o a o n h n i hê i u ê k u g kg ga g s a đ s ể đ cu ể n cu g n cấ g p cấ p đủ đ ủ nh n i hệ i t l ệ ư t l ợn ư g ợn tr g ê tr n ê , n b , iế b t h iế i t hệu iệ su u ấ su t h ấ ấ t h p ấ th p ụ th n ụ h n iệ h t iệ đ t ạ đ t ạ 80 t 8 % 0 ? % A. A .0 , 0 2 , 0 2 0 kg kg B . B .0 , 0 2 , 5 2 5 kg kg C . C .0 , 0 1 , 6 1 6 kg kg D . D .0 , 0 4 , 0 4 0 kg kg Lời giải: Tóm tắt
b) Nhiệt lượng toàn phần đun sôi nước là: c = 4200 J
Q = Q /H = 10 080/80% = 12600 kJ m = 30 kg 2 1 Q = 50 400 kJ
Cần đốt cháy hoàn toàn số kg gas để cung cấp o H = 80%. nhiệt lượng trên là:
m' = Q /Q = 12 600/50 400 = 0,25 kg 2 o 03 T N Ổ G K T Ế
TỔNG KẾT VỀ HIĐROCACBON Ankyl benzen TỔNG KẾT DẶN DÒ Nhi m ệ v ụ bắt bu c ộ Nhi m ệ v ụ khuy n ế khích + Hoàn thành phi u ế ghi bài cá nhân - Phiếu bài tập t n ổ g h p ợ v ề + Hoàn thành BT SGK/ hydrocarbon
Document Outline
- LƯU Ý KHI THAM GIA HỌC
- MỞ ĐẦU
- Slide 3
- Slide 4
- Slide 5
- 01
- Slide 7
- NHIỆM VỤ
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- 02
- CỦNG CỐ
- CỦNG CỐ
- CỦNG CỐ
- CỦNG CỐ
- CỦNG CỐ
- CỦNG CỐ
- CỦNG CỐ
- MỞ RỘNG
- Slide 22
- MỞ RỘNG
- Slide 24
- 03
- Slide 26
- Slide 27
- Nhiệm vụ khuyến khích




