











Preview text:
Tlamn: BÀI 8:
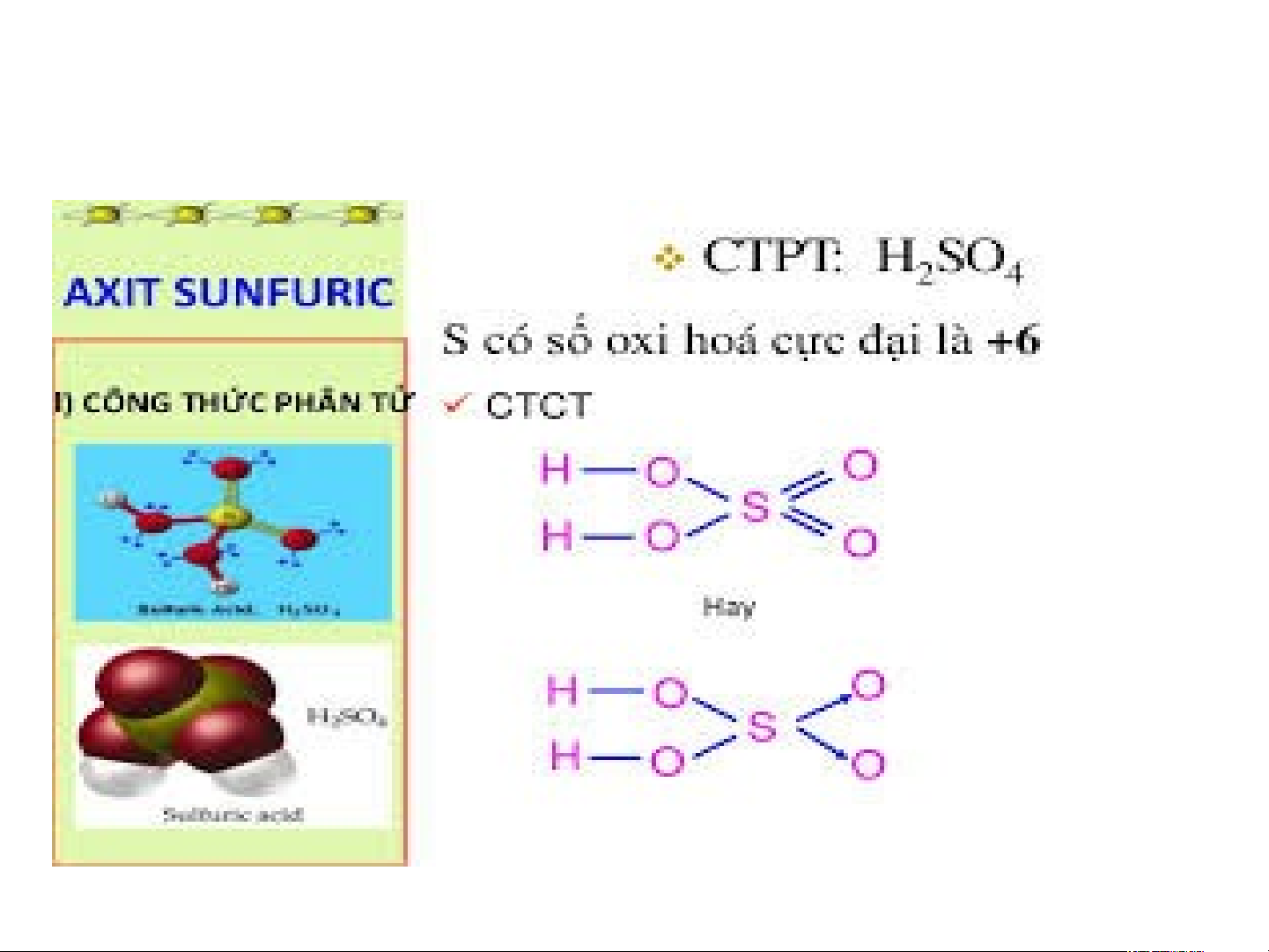
SULFURIC ACID VÀ MUỐI SUNFATE DƯỢC PHẨM CHẤT GIẶT RỬA H SO 2 4 SƠN MÀU THUỐC TRỪ SÂU CHẤT DẺO PHÂN BÓN TƠ SỢI HÓA HỌC hadan1110@gmail.com 2 I.SULFURIC ACID 1. Cấu tạo phân tử: 2. T 2. ÍNH ÍN C H H C Ấ H T Ấ T V Ậ V T Ậ L T Í
Là chất lỏng, sánh như dầu.
H SO đặc tan vô hạn trong 2 4
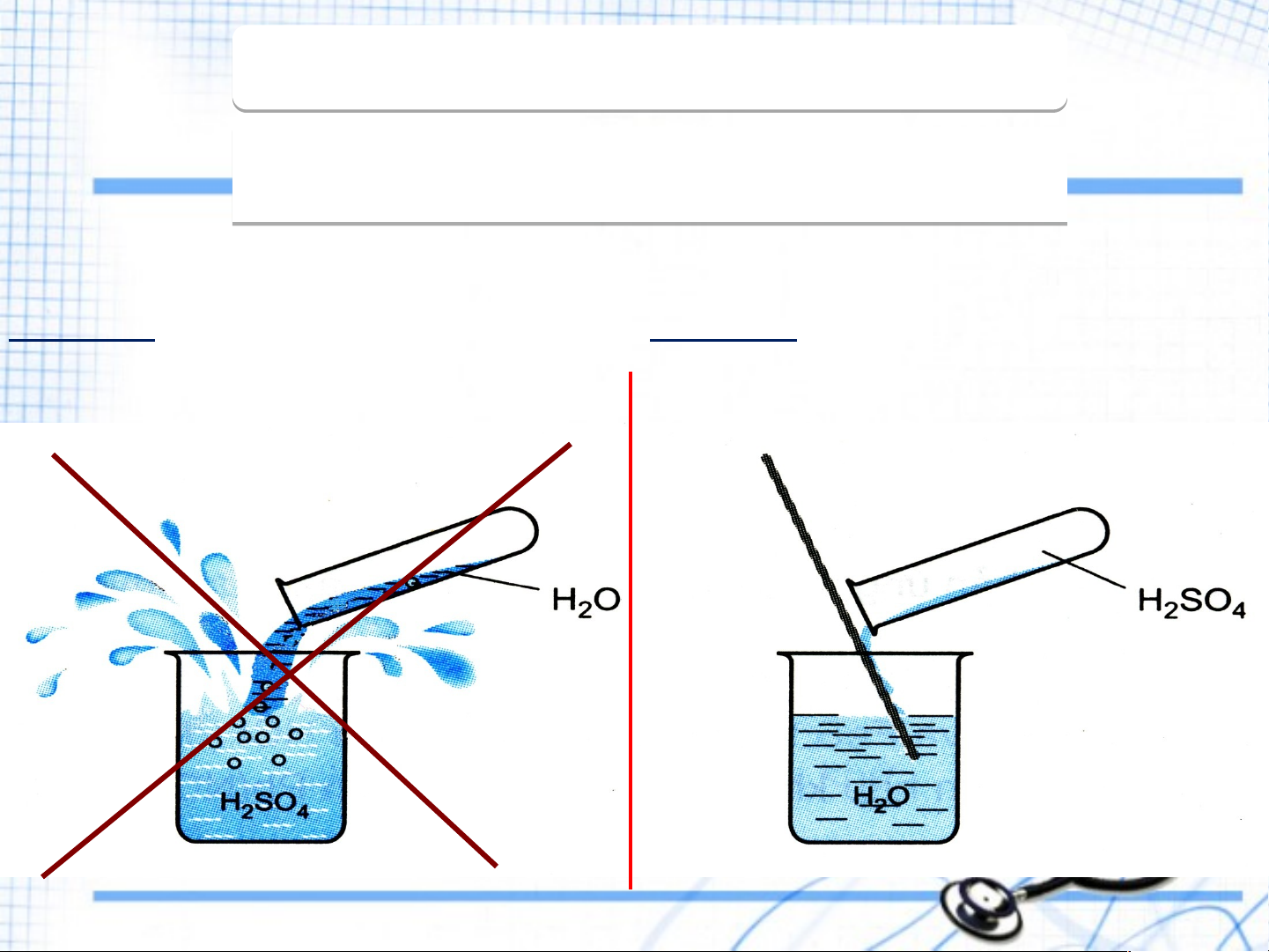
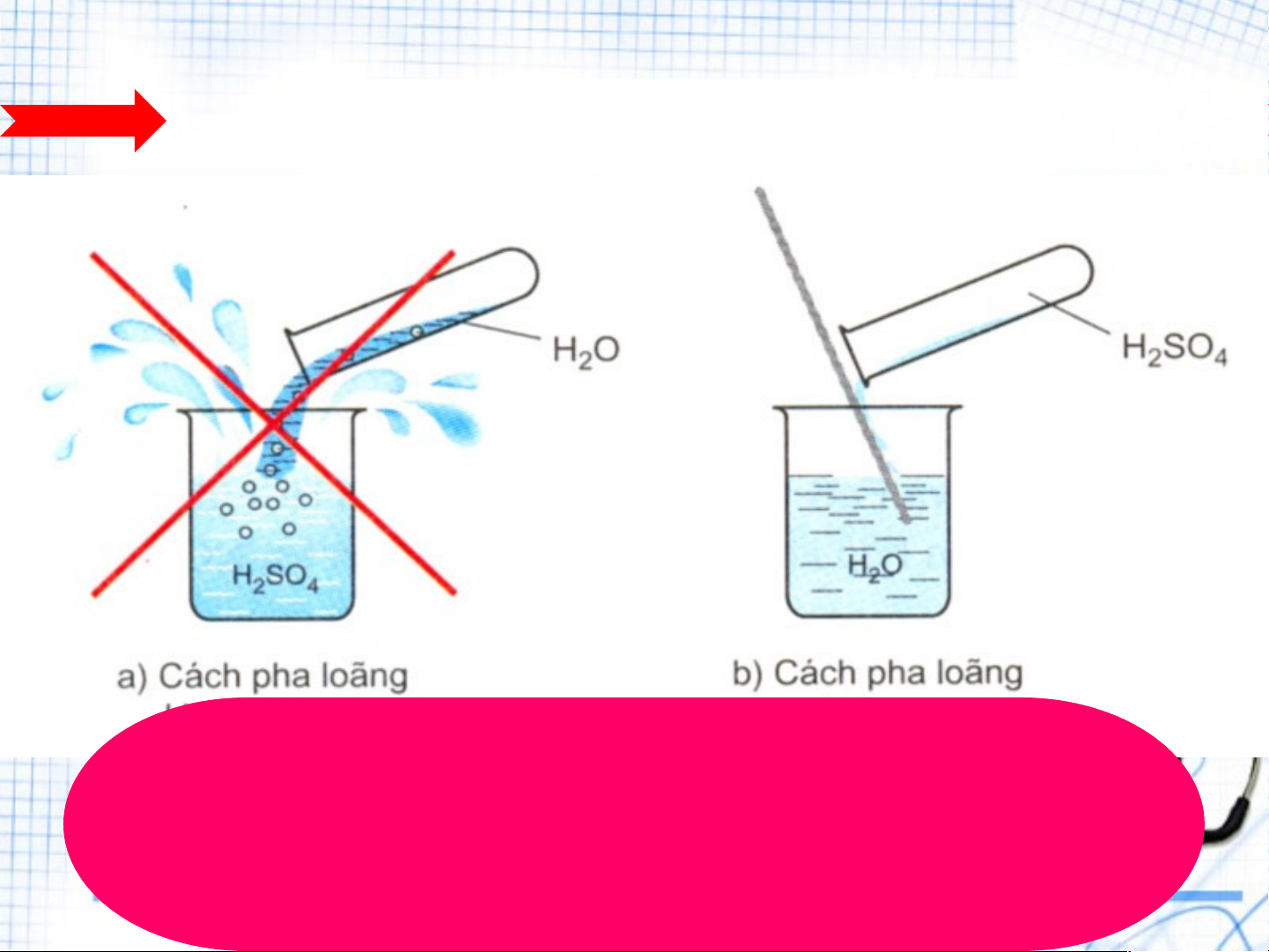
nước và toả nhiều nhiệt. 3. Quy tắc an n toàn: HÃY C Y HỌN 1 T R T ONG 2 CÁCH PHA L A O L ÃNG SAU
Cách 1: Rót H O vào H SO Cách 2: Rót từ từ H SO đặc 2 2 4 2 4 đặc. vào H O 2
Cách pha loãng axit sulfuric acid đặc
Rót từ từ axit H SO đặc vào nước và 2 4
khuấy nhẹ bằng đũa thuỷ tinh,
tuyệt đối không làm ngược lại.
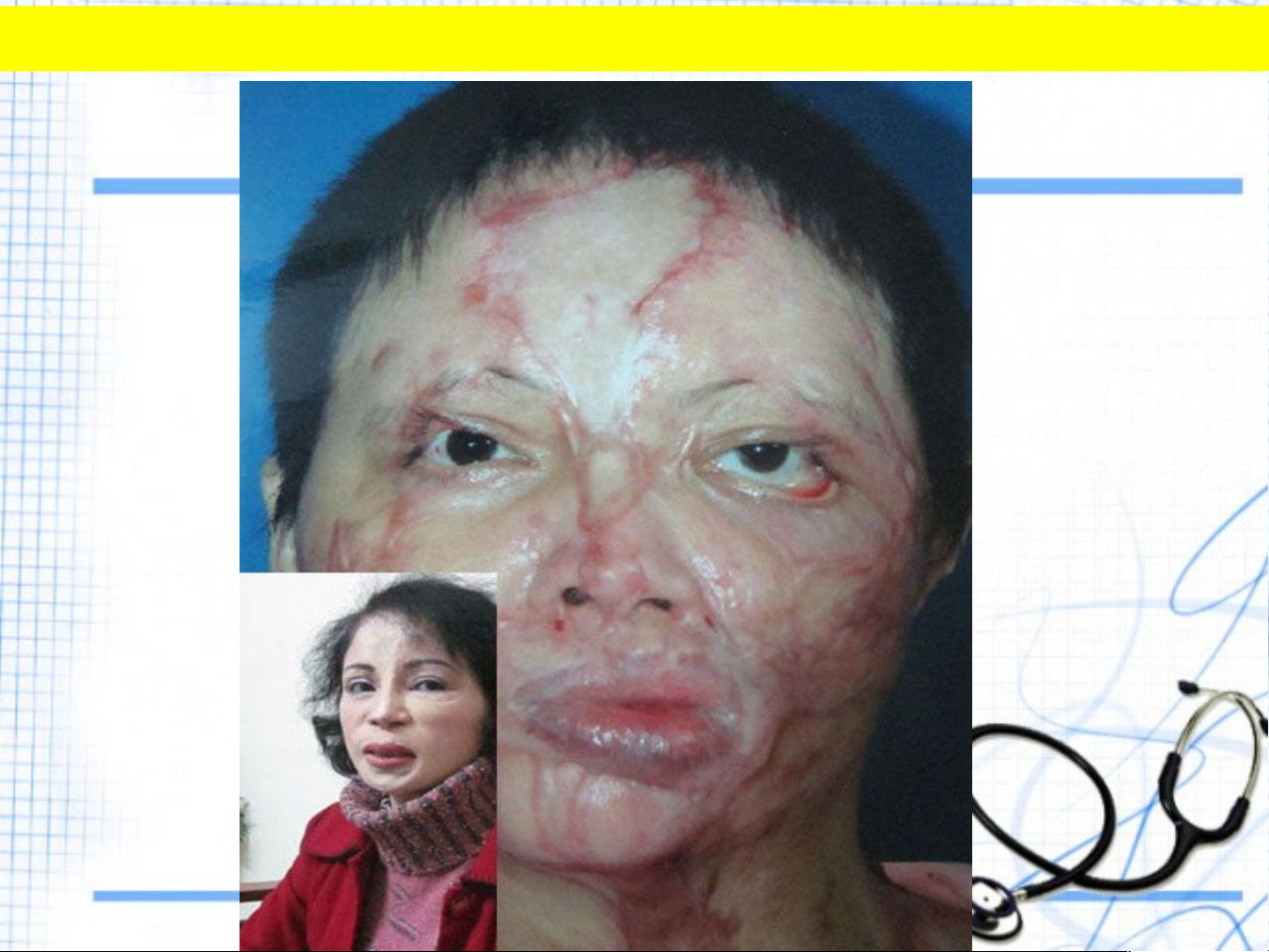
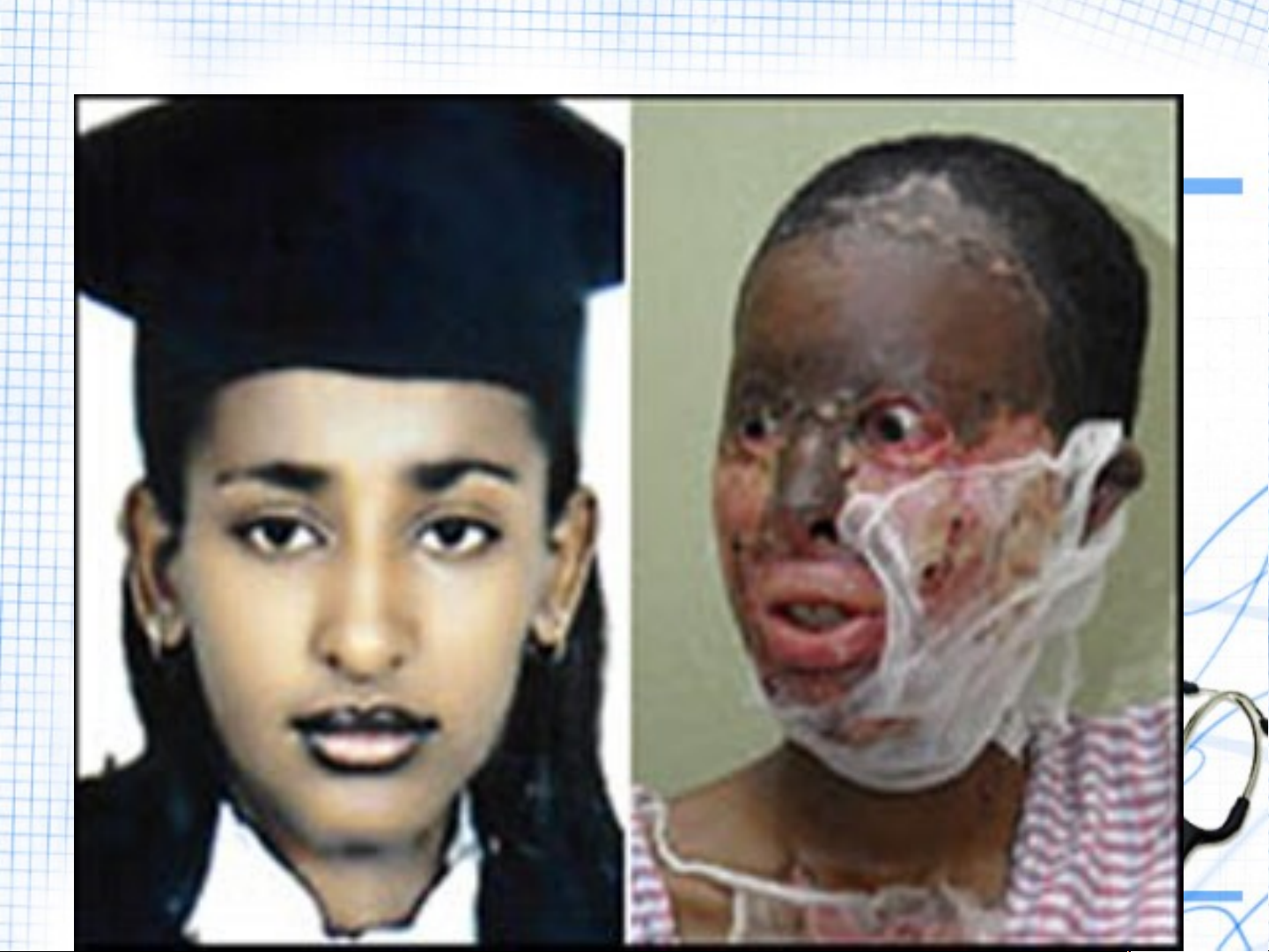
NGƯỜI BỊ BỎNG DO SULFURIC ACID
4. Tính chất hóa học:
a. Dung dịch sulfuric acid loãng:
- Làm quì tím hóa đỏ. sulfuric
- Tác dụng với bazơ, oxit bazơ. acid
CuO + H SO → CuSO + H O loãng có 2 4 4 2 đầy đủ 2NaOH + H SO → Na SO + 2H O 2 4 2 4 2 tính chất
- Tác dụng với muối của axit yếu chung hoặc dễ bay hơi. của một
Na CO + H SO → Na SO + CO + H O axit 2 3 2 4 2 4 2 2 1 9
- Tác dụng với kim loại hoạt động (kim loại
đứng trước H trong dãy điện hóa): H SO + Fe FeSO + H 2 4loãng 4 2 H SO + Cu 2 4loãng 1 10
b. Dung dịch sulfuric acid đặc
*Tính oxi hóa mạnh: H SO
oxi hóa được hầu hết các kim 2 4 đặc
loại (trừ Au, Pt), nhiều phi kim (C, S, P…) và nhiều hợp chất (KBr, FeO…)
Tác dụng với kim loại 0 +6 t 0 +2 +4 Cu + 2H SO → 2 4đ ↑ CuSO + SO + 2H O 4 2 2 Màu xanh lam H SO đặc 2 4 M →
M (SO ) + SO ↑, S, H S↑ + H O 2 4 n 2 2 2 (Trừ Pt, Au) n là hóa trị cao nhất
Axit sunfuric đặc, nguội làm thụ động một số Lưu ý!!!
kim loại như: Cr, Fe, Al… 1 11
Tác dụng với phi kim và hợp chất: to -1 +6 0 +4 2KBr + 2H SO đ → 2 4 Br + SO + K SO + 2H O 2 2 2 4 2 • Tính háo nước
H SO đặc có thể lấy nước từ các hợp chất gluxit, các muối 2 4 hiđrat… 13
H SO tiếp xúc với da thịt sẽ 2 4
gây bỏng nặng, vì vậy khi sử
dụng phải hết sức cẩn thận. DƯỢC PHẨM CHẤT GIẶT RỬA 5. ỨNG DỤNG CỦA H SO 2 4 SƠN MÀU THUỐC TRỪ SÂU CHẤT DẺO PHÂN BÓN TƠ SỢI HÓA HỌC hadan1110@gmail.com 15 6. SẢN XUẤT :
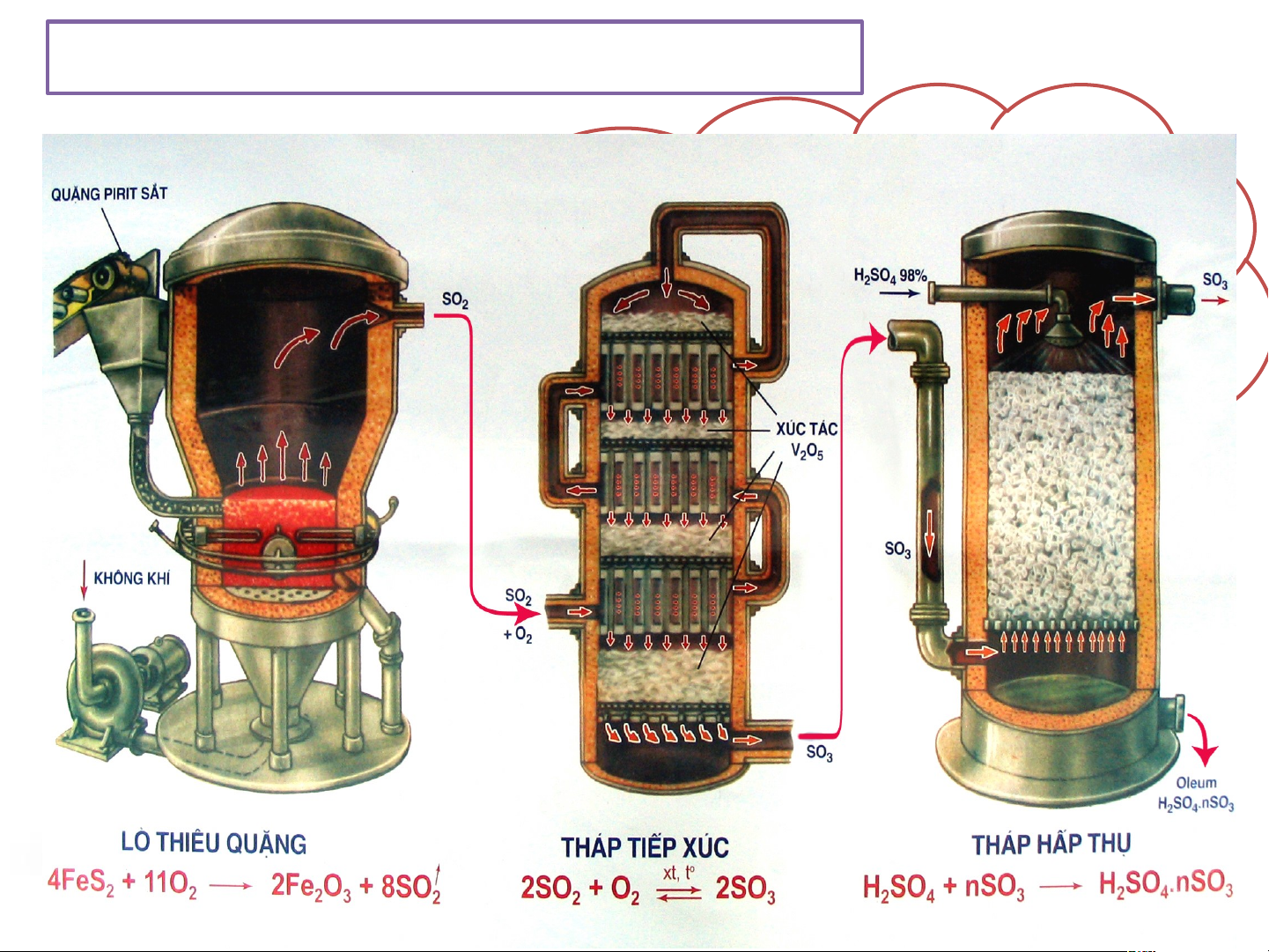
Phương pháp sản xuất trong công nghiệp?
Quá trình sản xuất được tiến hành theo
bao nhiêu công đoạn chính? II. MUỐI SULFATE 1. Ứng dụng:
Sản xuất thạch cao CuSO .5H 4 2 O (phèn xanh) CuSO .5H 4 2 Thuốc trừ nấm Boocđô O (phèn xanh)
4CuSO +3Ca(OH) → CuSO .3Cu(OH) +3CaSO 4 2 4 2 4 2. Nhận biết:
- Thuốc thử: dùng dung dịch muối bari hoặc dung dịch Ba(OH)2
- Hiện tượng: tạo kết tủa trắng BaSO bền 4
(không tan trong axit, bazơ) H SO + BaCl → 2 4 2 BaSO ↓+ 2HCl 4
Na SO + Ba(OH) → BaSO ↓+ 2NaOH 2 4 2 4 Trắng
Document Outline
- Slide 1
- Slide 2
- I.SULFURIC ACID 1. Cấu tạo phân tử:
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21




