





Preview text:
HÓA HỌC 11 BÀI 7: SULFUR – SULFUR DIOXIDE
GV: HỒ PHẠM THANH PHƯỚC BÀI 7: SULFUR – SULFUR DIOXIDE
Bài 7: SULFUR – SULFUR DIOXIDE
Dưới những đám khói độc đặc quánh từ núi Ijen, gần 200 công nhân phải làm
việc liên tiếp 12 tiếng trong tình trạng không có bất cứ đồ bảo hộ nào để đổi
lấy 4,6 USD (khoảng 100 ngàn đồng) tiền công.
Công việc hàng ngày của họ bắt đầu từ việc leo qua những tảng đá sắc nhọn
trên ngọn núi Ijen cao 2.600m và tìm kiếm những mảnh quặng lưu huỳnh
nóng đỏ từ trong miệng núi lửa để bán lại cho các nhà máy sản xuất đường địa phương.
Bài 7: SULFUR – SULFUR DIOXIDE I. SULFUR.
1. Trạng thái tự nhiên
- Sulfur (lưu huỳnh) là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất, tồn
tại ở 4 dạng đồng vị bền là 32S, 33S , 34S và 36S .
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất. Đơn
chất sulfur được phân bố ở vùng lân cận núi lửa và suối nước nóng,…
Hợp chất sulfur gồm các khoáng vật sulfide, sulfate, protein,… như
pyrite (FeS ), chalcopyrite (CuFeS ), chu sa, thần sa (HgS), thạch cao 2 2 (CaSO .2H O),… 4 2
- Trong cơ thể người, sulfur chiếm khoảng 0,2% khối lượng cơ thể, có
trong thành phần nhiều protein và enzyme.
Bài 7: SULFUR – SULFUR DIOXIDE I. SULFUR.
2. Cấu tạo nguyên tử, phân tử
- Cấu hình electron nguyên tử S: 1s2 2s2 2p6 3s2 3p4 16
- Sự phân bố electron vào các orbital ↑↓ ↑↓ ↑ ↑
- S ở ô thứ …., chu kỳ …., nhóm…. 3s 3p
- S có thể tạo hợp chất với các số oxi hoá: ……
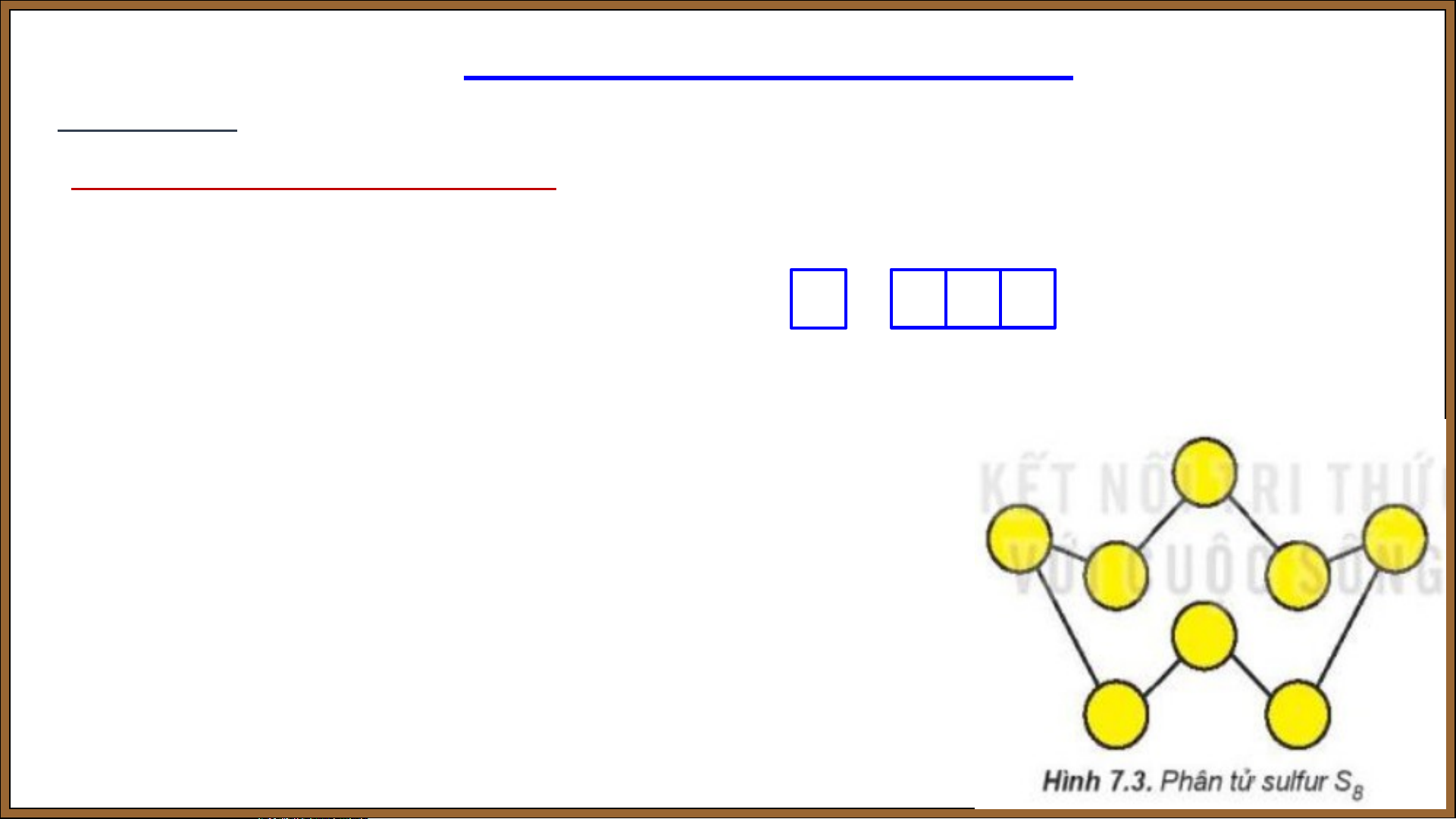
- Phân tử sulfur được tạo thành từ……
Bài 7: SULFUR – SULFUR DIOXIDE I. SULFUR.
3. Tính chất vật lý
- Đơn chất Sulfur (lưu huỳnh) có 2 dạng thù hình
Bài 7: SULFUR – SULFUR DIOXIDE I. SULFUR. Tính oxi hoá
4. Tính chất hoá học
Các số oxi hoá của Sulfur (lưu huỳnh): – 2 0 +4 +6 - Tính khử: Tính khử S + O SO 2 2 S + 3 F SF 2 6 - Tính oxi hoá: S + Fe FeS S + H H S 2 2
Ở nhiệt độ thường, sulfur tác dụng với Hydrargyrum(thuỷ ngân) S + Hg
HgS => Khử độc thuỷ ngân khi nhiệt kế vỡ
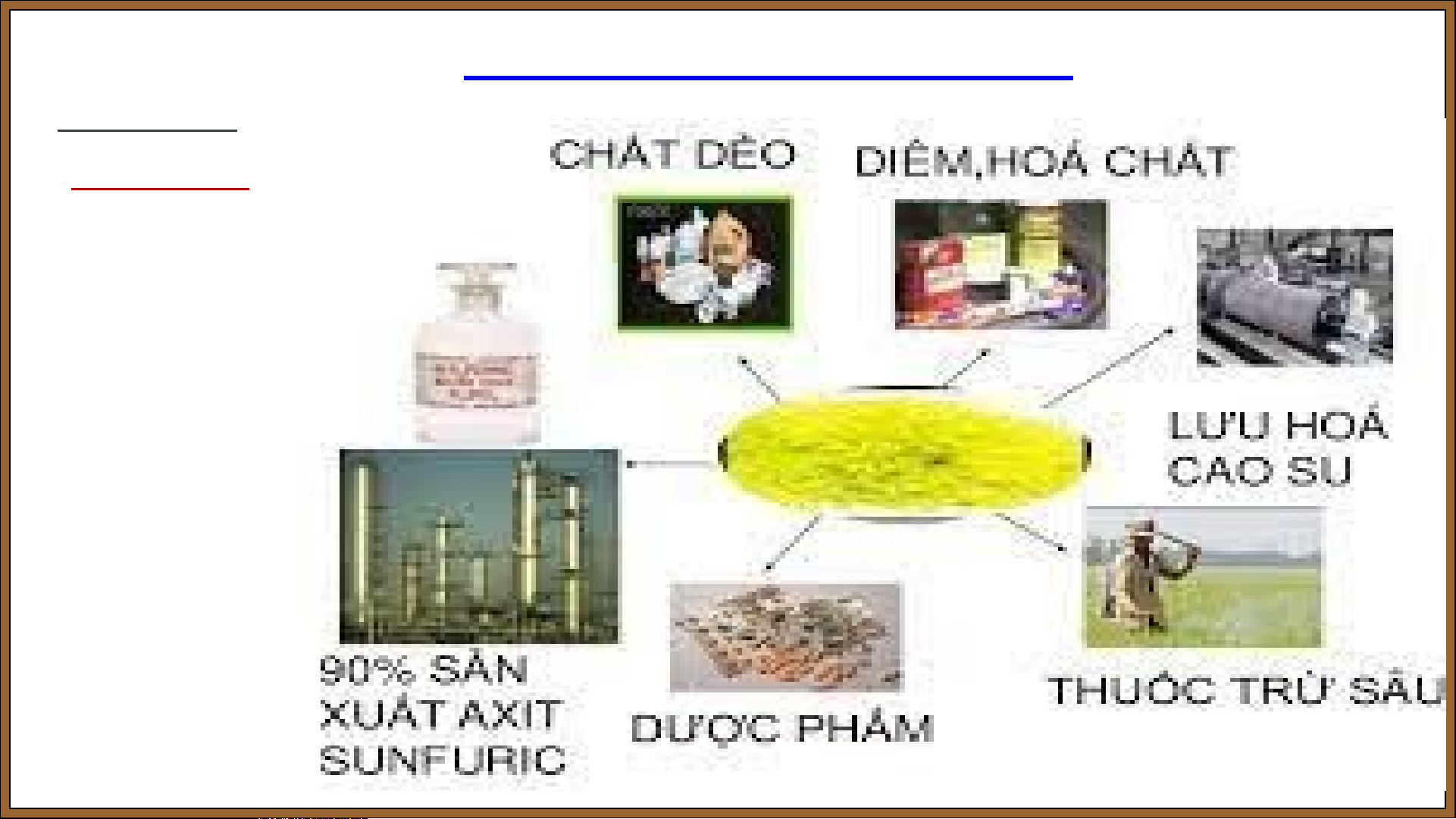
Bài 7: SULFUR – SULFUR DIOXIDE I. SULFUR. 5. Ứng dụng
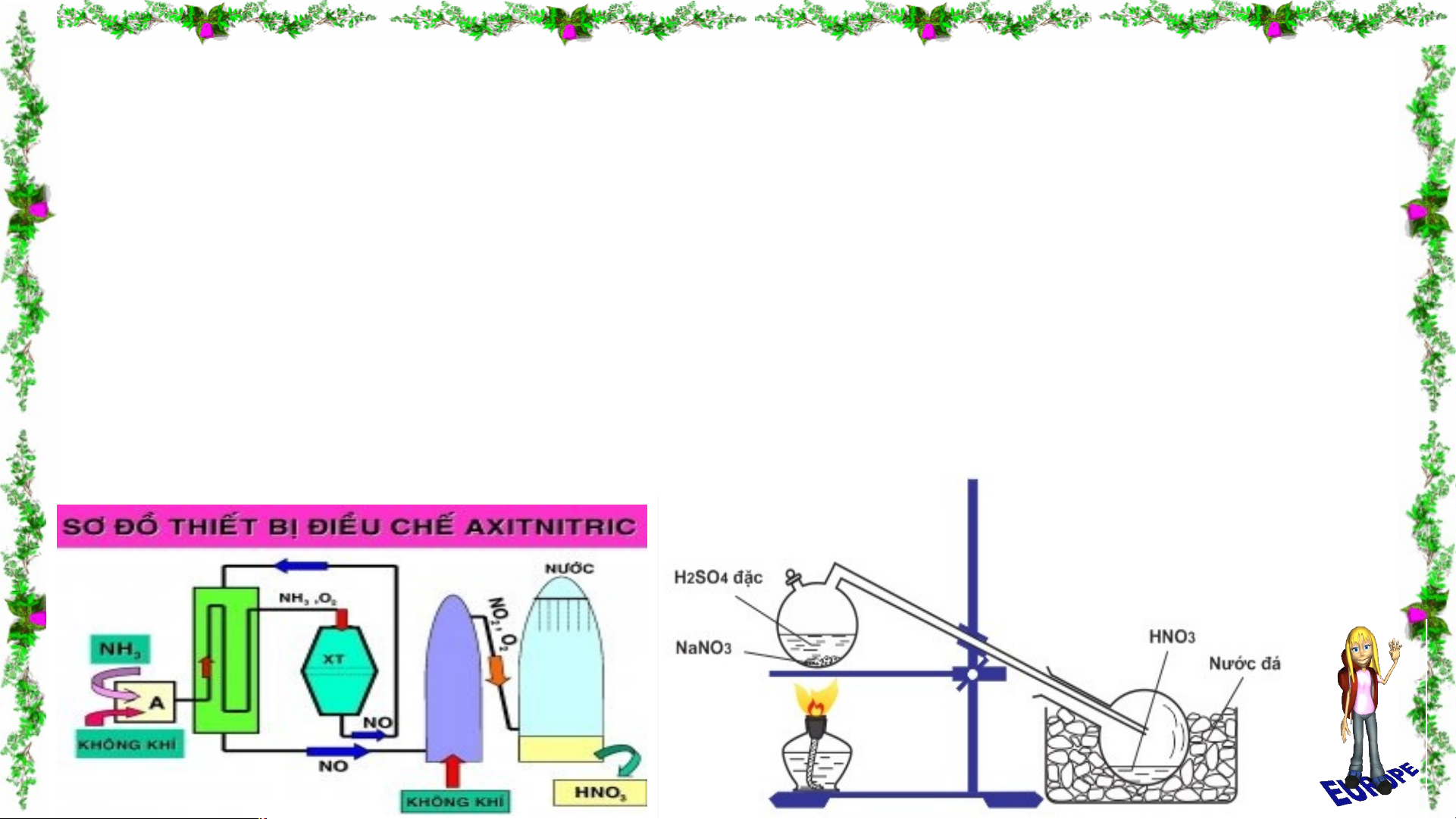
Bài 7: SULFUR – SULFUR DIOXIDE II. SULFUR DIOXIDE
1. Tính chất vật lý
- SO hay còn gọi là khí sunfurơ là chất khí, không màu, 2
nặng hơn không khí, thường có mùi hắc, là khí độc (gây
ho, viêm đường hô hấp,…) và Tí ta nh o n xi t hro oáng nước.
2. Tính chất hoá học Tính khử
Các số oxi hoá của Sulfur : – 2 0 +4 +6 SO2
a. Tính chất của oxide acid (acidic oxide) SO + H O H SO 2 2 2 3 SO + 2 NaOH Na SO + H O 2 2 3 2 SO + CaO CaSO 2 3
Bài 7: SULFUR – SULFUR DIOXIDE II. SULFUR DIOXIDE Sự oxi hoá
2. Tính chất hoá học Sự khử
Các số oxi hoá của Sulfur : – 2 0 +4 +6 SO2
a. Tính chất của oxide acid (acidic oxide)
b. Tính oxi hoá SO + 2H S 3 S + 2 H O 2 2 2 c. Tính khử SO + Br + 2H O H SO + 2 HBr 2 2 2 2 4 SO + NO SO + NO 2 2 3
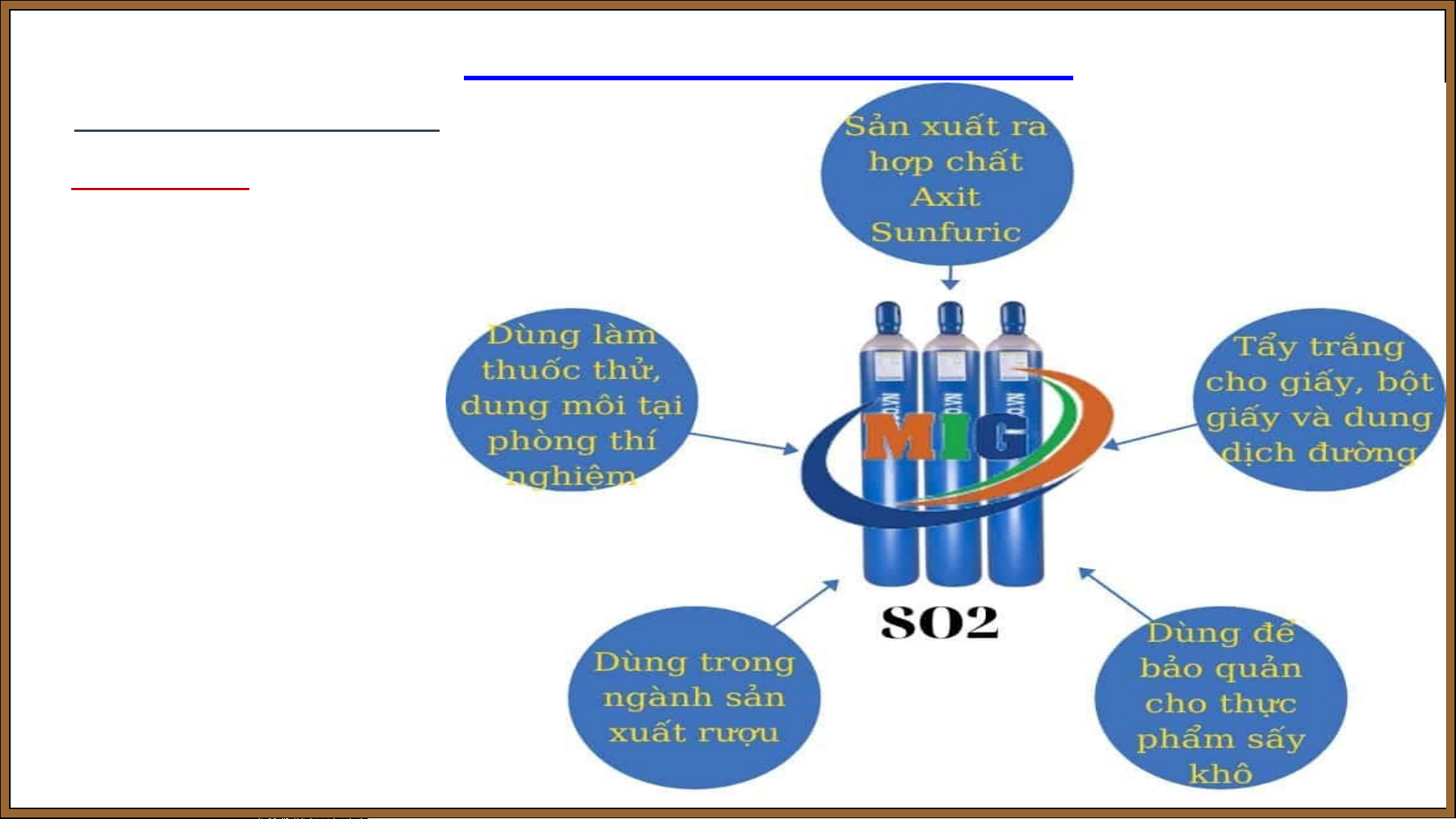
Bài 7: SULFUR – SULFUR DIOXIDE II. SULFUR DIOXIDE 3. Ứng dụng
Bài 7: SULFUR – SULFUR DIOXIDE II. SULFUR DIOXIDE
4. Sulfur dioxide và ô nhiễm môi trường
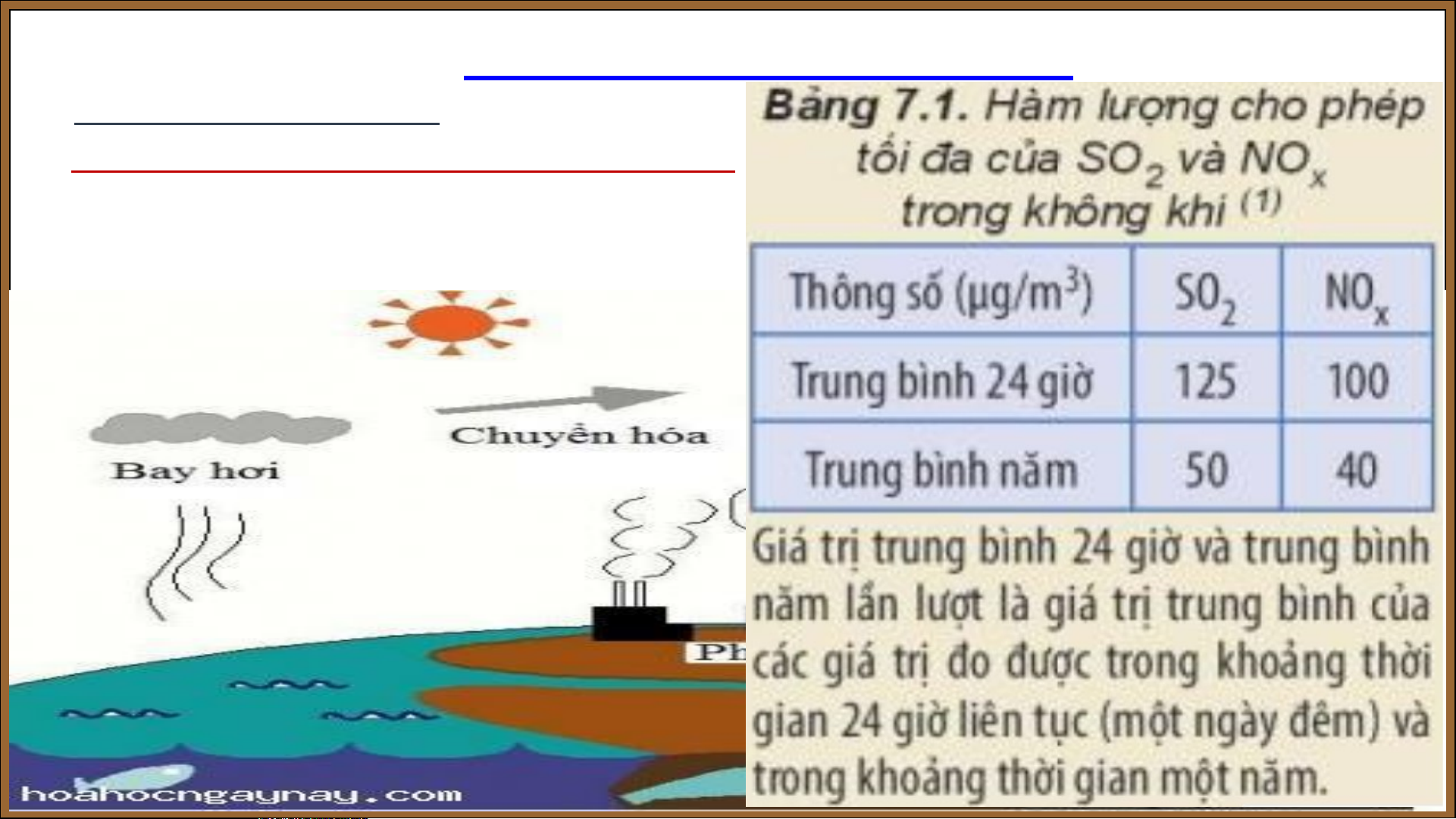
a. Nguồn phát sinh sulfur dioxide
Bài 7: SULFUR – SULFUR DIOXIDE II. SULFUR DIOXIDE
4. Sulfur dioxide và ô nhiễm môi trường
a. Nguồn phát sinh sulfur dioxide b. Tác hại
c. Biện pháp cắt giảm thải SO vào không khí 2
CHÂN THÀNH CẢM ƠN CÁC BẠN VÀ CÁC
EM ĐÃ THEO DÕI BÀI HỌC. MONG NHẬN
ĐƯỢC SỰ GÓP Ý CỦA MỌI NGƯỜI. Dưa Ổi TV
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14




