




















Preview text:
Đất có độ pH khoảng bao nhiêu thì rễ cây dễ
bị tổn thương khó hấp thụ chất dinh dưỡng?
CaO là một loại oxide có tên thường gọi là vôi
sống, tên hóa học là Cancium Oxide. Vậy trong
Công thức hóa học của Cancium Oxide được tạo
thành từ bao nhiêu nguyên tố hóa học?
Đất trồng trọt canh tác lâu năm hoặc đất trũng thường sẽ
xảy ra tình trạng đất bị chua nghĩa là đất có nồng độ PH
thấp <5. Làm cho rễ cây mọc ra sẽ bị hư hại, cây kém phát
triển cây không lấy được chất. Bón vôi sống để cân bằng
độ pH làm giảm độ chua của đất giúp cây phát triển tốt hơn.
Vậy CaO là 1 loại oxide, Oxide là gì chúng ta cùng tìm
hiểu bài học hôm nay? I. Khái niệm
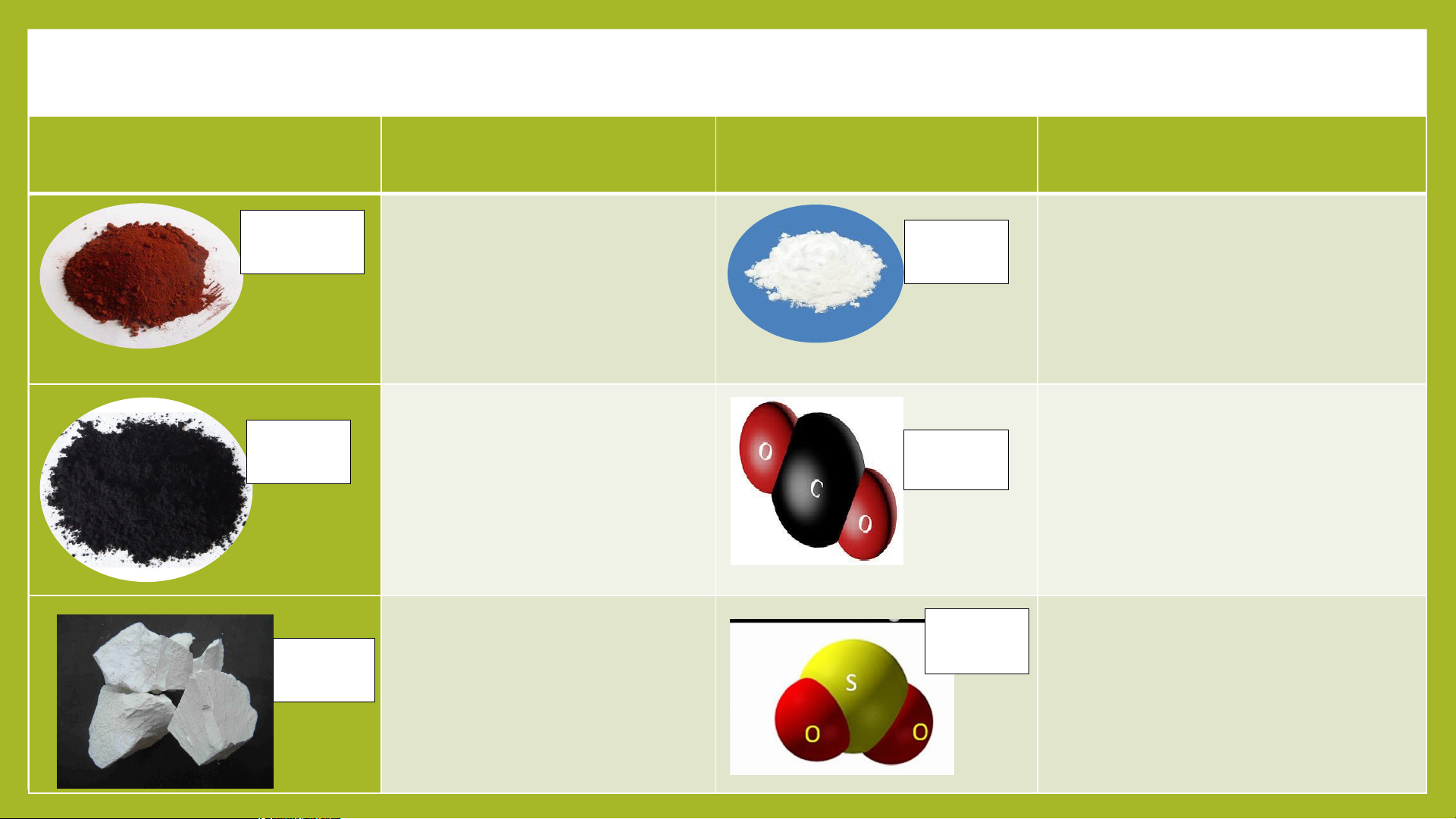
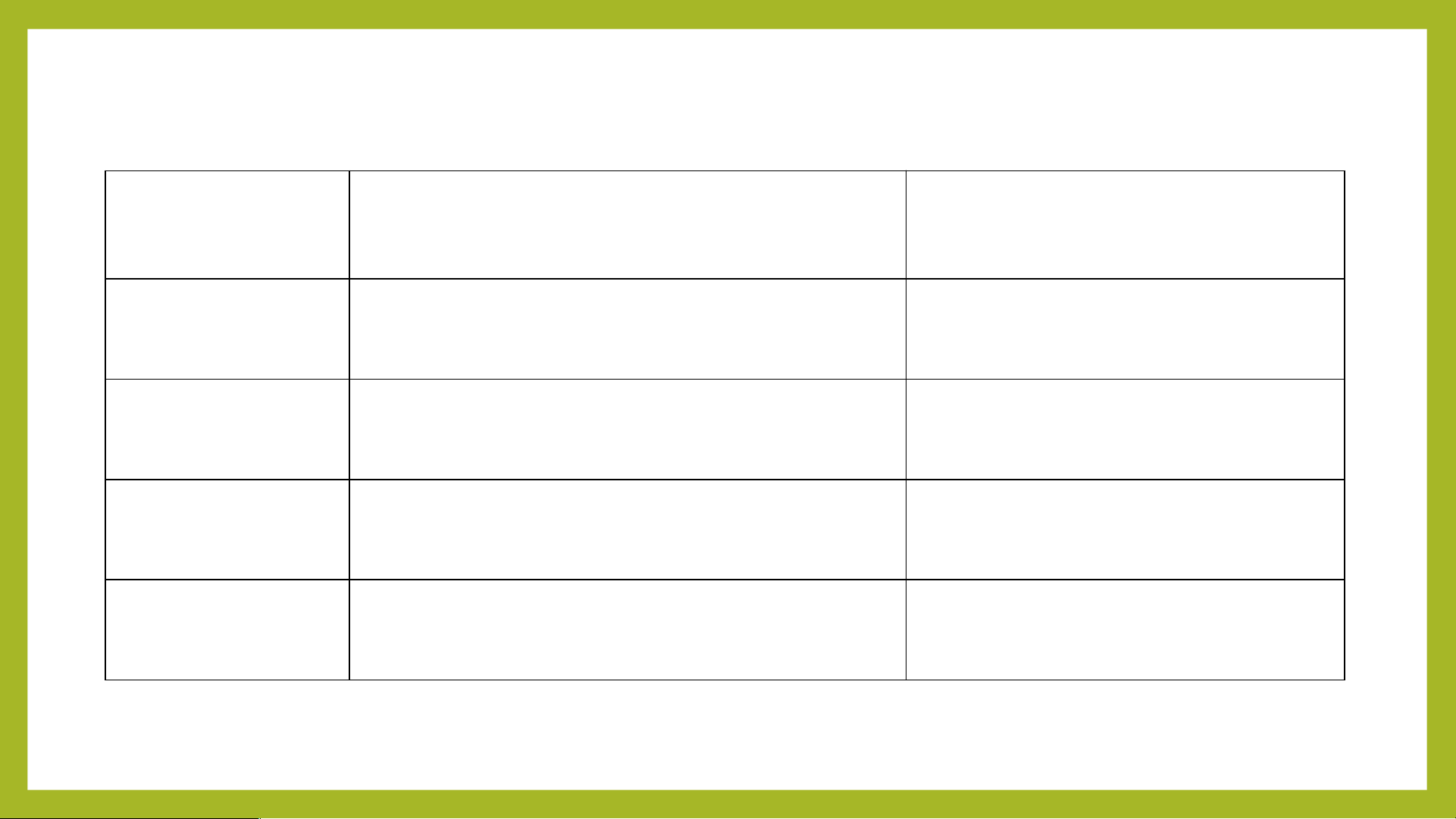
MỘT SỐ OXIDE THƯỜNG GẶP Cột 1 Cột 2 (tên gọi) Cột 3 Cột 4(tên gọi) diphosphorus Fe O 2 3 Iron( III) Oxide P O 2 5 pentoxide Carbon dioxide CuO Copper (II) Oxide CO2 Cancium Oxide SO CaO 2 Sulfur dioxide I. Khái niệm
1. Các oxide trên được tạo ra từ bao nhiêu nguyên tố hóa học? THẢ
2. Các oxide cột 1 và cột 3 có đặc điểm gì O
giống nhau và khác nhau trong thành phần hóa LUẬ học? N
3. Đề xuất khái niệm của Oxide là gì?
4. Dựa vào thành phần hóa học có thể chia
oxide ra thành những loại nào? I. Khái niệm
1. Các oxide trên được tạo ra từ bao nhiêu nguyên tố hóa học?
Trong thành phần hóa học của các Oxide đều được tạo ra từ 2 nguyên tố hóa học
2. Các oxide cột 1 và cột 3 có đặc điểm gì giống nhau và khác nhau trong thành phần hóa học?
Giống nhau: Đều chứa nguyên tố O trong phân tử
Khác nhau: Cột 1 Có nguyên tố kim loại liên kết với Oxygen
Cột 3 Có nguyên tố phi kim liên kết với Oxygen THẢ O
3. Đề xuất khái niệm của Oxide là gì? LUẬ
Oxide là hợp chất của 2 nguyên tố trong đó có một nguyên tố là Oxygen. N
4. Dựa vào thành phần hóa học có thể chia oxide ra thành những loại nào? 2 loại I. Khái niệm
Kim loại + Khí Oxygen Oxide kim loại Oxide base VD: BaO, CuO VD: BaO, CuO Dựa Ba + O BaO 2 Dựa vào Cu + O CuO 2 vào thành tính Oxide acid phần chất VD: CO , SO hóa 2 2 S+ O SO 2 2 hóa học C + O CO 2 2 học Oxide trung tính. VD: CO , SO VD: CO 2 2
Phi kim + Khí Oxygen Oxide Phi kim Oxide lưỡng tính. VD: ZnO I. Khái niệm
- Oxide là hợp chất tạo bởi 2 nguyên tố hóa học trong đó có 1 nguyên tố là oxygen.
- Dựa vào thành phần hóa học của oxide người ta chia oxide ra
làm 2 loại : oxide kim loại và oxide phi kim
- Dựa vào tính chất hóa học của các oxide người ta chia oxide ra
làm 4 loại: Oxide base, oxide acid, oxide trung tính, oxide lưỡng tính. ĐỌC TÊN OXIDE
----------------------------------------
* Nguyên tố chỉ có 1 hóa trị:
Tên oxide = tên nguyên tố + oxide ZnO : Zinc oxide Al O : 2 3 Aluminium oxide
* Kim loại có nhiều hóa trị:
Tên oxide = tên nguyên tố (kèm hóa trị) + oxide Fe O : 2 3 Iron (III) oxide CuO: Copper (II) oxide ĐỌC TÊN OXIDE
----------------------------------------
* Phi kim có nhiều hóa trị:
Tên oxide= (tiền tố của Phi Kim) tên Phi Kim + (tiền tố của oxygen) oxide
Tiền tố (chỉ số nguyên tử )
1 – mono; 2 – di ; 3 – tri ; 4 – tetra ; 5 – penta
Tiền tố mono chỉ gọi cho nguyên tố O - Gọi tên của: + SO : Sulfur dioxide 2 + SO : Sulfur trioxide 3 + P O : 2 5 Diphosphorus pentaoxide Oxide Tên gọi Phân loại FeO Iron(II) oxide Oxide base N O 2 3 Dinitrogen trioxide Oxid acid Na O 2 Sodium oxide Oxide base NO Nitrogen monoOxide Oxid trung tính I. Khái niệm
- Cách gọi tên oxide của nguyên tố có 1 hóa trị:
Tên oxide = Tên kim loại + Oxide
- Cách gọi tên oxide của kim loại nhiều hóa trị:
Tên oxide = Tên kim loại +(hóa trị kim loại) + Oxide
- Cách gọi tên của Oxide phi kim:
Tên oxide = Tiền tố ngtử Phi kim +Tên phi kim + tiền tố ngtử Oxygen + Oxide
Chú ý : Khi gọi tên của các oxide phi kim khi gọi cần kèm theo tiền tố chỉ số nguyên tử:
1- Mono ; 2- Di ; 3- Tri; 4- tetra ; 5- Penta
Tiền tố mono chỉ gọi cho nguyên tố O II. Tính chất hóa học 1. Oxide acid
Hoạt động nhóm tiến hành thí
nghiệm. Nêu hiện tượng xảy ra và viết PTHH Từ PHHH trên em hãy
cho biết sản phẩm của phản ứng khi cho Oxide Acid tác
Sản phẩm thuộc loại muối và nước
dụng với dung dịch Base tạo Oxide Acid + Base Muối + Nước
ra sản phẩm là những chất nào? Hãy viết PTHH bằng
Dung dịch nước Ca(OH) bị đục. chữ? 2 PTHH: CO + Ca(OH) CaCO + H O 2 2 3 2 SO + 2 NaOH Na SO + H O Viết PTHH khi cho SO , SO 2 2 3 2 2 3 SO + 2NaOH Na SO + H O
tác dụng với dung dịch base 3 2 4 2 NaOH II. Tính chất hóa học 2. Oxide baso
Hoạt động nhóm tiến hành thí
nghiệm. Nêu hiện tượng xảy ra và viết PTHH Từ PHHH trên em hãy
cho biết sản phẩm của phản ứng khi cho Oxide Baso tác
Sản phẩm thuộc loại muối và nước
dụng với dung dịch acid tạo Oxide Base + Acid Muối + Nước
ra sản phẩm là những chất
Bột CuO màu đen tan dần dung dịch từ không màu
nào? Hãy viết PTHH bằng chuyển sang màu xanh lam chữ? PTHH: CuO + H SO CuSO + H O 2 4 4 2 Fe O + 6HCl 2FeCl + 3H O Viết PTHH khi cho Fe O , 2 3 3 2 2 3 Na O + 2HCl 2NaCl + H O
Na O tác dụng với dung dịch 2 2 2 Acid HCl II. Tính chất hóa học 1. Oxide acid
Oxide acid (CO SO , SO …) tác dụng với dung dịch base tạo thành muối và nước. 2, 2 3 CO + Ca(OH) → CaCO + H O 2 2 3 2 SO + Ca(OH) → CaSO + H O. 2 2 3 2 2. Oxide base
Các oxide base (như CuO, Na O, CaO, Fe O ..) phản ứng với dung dịch acid tạo thành 2 2 3 muối và nước. CuO + H SO → CuSO + H O. 2 4 4 2 Fe O + 6HCl → 2FeCl + 3H O. 2 3 3 2
Nghiên cứu SGK cho biết Oxide trung tính và oxide
lưỡng tính có tính chất hóa học gì?
Oxide lưỡng tính tác dụng được với acid và dung dịch
base tạo thành muối và nước như ZnO, Al O , Cr O 2 3 2 3
Oxide trung tính không tác dụng được với Acid và Base như CO, NO II. Tính chất hóa học 3. Oxide lưỡng tính
Oxide lưỡng tính tác dụng được với acid và dung dịch base tạo thành muối
và nước như ZnO, Al O , Cr O 2 3 2 3 4. Oxide trung tính
Oxide trung tính không tác dụng được với Acid và Base như CO, NO BÀI TẬP Oxide NaOH(Sodium Hydroxide) H SO (Sulfuric acid) 2 4 Al O 2 3 x x NO CaO x P O x 2 5 Trò chơi: Ghép hình Phân CTHH Tên gọi loại N O 2 CO Di Nitrogen mono Oxide Zinc oxide Oxide Acid BaO P O 2 5 Sulfur di oxide Potassium oxide Oxide Base ZnO K O 2
Chromium (II)oxide Barium oxide Oxide trung tính NO SO 2 2
Nitrogen dioxide Carbon mono oxide Oxide lưỡng tính Cr O Al O 2 3 2 3 Alumium Oxide di Phosphorus Pentoxide Trò chơi: Ghép hình N O 2 Di Nitrogen mono Oxide Oxide Acid BaO Barium oxide Oxide Base ZnO Zinc oxide Oxide lưỡng tính NO2 Nitrogen dioxide Oxide Acid Cr O 2 3 Chromium (III)oxide Oxide lưỡng tính CO Carbon mono oxide Oxide trung tính P O 2 5 di Phosphorus Pentoxide Oxide Acid K O 2 Potassium oxide Oxide Base SO2 Sulfur di oxide Oxide Acid Al O 2 3 Alumium Oxide Oxide lưỡng tính PHI PH ẾU Ế H U Ọ H C Ọ C T Ậ T P Ậ P 1
Câu 1: Viết CTHH của Base và Acid tương ứng của các Oxide sau Oxide Base Oxide Acid Acid Al O SO 2 3 2 K O P O 2 2 5 CaO SO 3
Câu 2: Hoàn thành các phản ứng sau 1. Na + O 2 2. P + P O 2 5 3. BaO + BaCl + …… 2
4. SO + Ca(OH) --------- + H O 3 2 2
5. FeO + H SO --------- + H O 2 4 2 PHI PH ẾU Ế H U Ọ H C Ọ C T Ậ T P Ậ P 1
Câu 1: Viết CTHH của Base và Acid tương ứng của các Oxide sau Oxide Base Oxide Acid Acid Al O SO 2 3 2 Al(OH) SO 3 3 K O P O 2 KOH 2 5 H PO 3 4 CaO Ca(OH) SO H SO 2 3 2 4
Câu 2: Hoàn thành các phản ứng sau 1. 4Na + O 2Na O 2 2 2. 4P + 5O 2P O 2 2 5 3. BaO + BaCl + H O 2 2 4. SO + Ca(OH) CaSO + 2H O 3 2 4 2 5. FeO + H SO FeSO + H O 2 4 4 2 Nh N i h ệm ệ m vụ g iao về n o về h n à h
Phân tích về nhân gây ra hiện tượng hiệu ứng nhà kính và đề xuất một số giải pháp
hiệu quả để giảm thiểu hiệu ứng nhà kính. - Nội dung:
+ Nêu được hiệu ứng nhà kính là gì: NHÓ
+ Nguyên nhân gây ra hiệu ứng nhà kính thể hiện rõ PTHH M
+ Đề xuất được ít nhất 2 giải pháp
- Hình Thức: Sạch, đẹp, có thể viết tay, word, Power point, Video có thể hiện thông tin cá nhân. Các tiêu chí Yêu cầu Điểm tối đa Nội dung 5 điểm
Bảo đảm chính xác, khoa
-Nêu được khái quát về hiện tượng hiệu 1
học thể hiện được đầy đủ ứng nhà kính các yêu cầu sau
- Nêu được nguyên nhân gây ra hiệu ứng 2 nhà kính
Đề xuất được giải pháp giảm thiểu hiệu 2 nhứng nhà kính Hình thức trình bày 4 điểm
Rõ ràng, sạch sẽ, khoa hoc,
-Có sử dụng nhiều hình ảnh tư liệu 4 có nhiều hình ảnh
-Sử dụng it hình ảnh tư liệu
Không có hình ảnh, tư liệu 3 2 Sáng tạo 1 điểm
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27




