












Preview text:
CHÀO MỪNG CÁC EM HỌC SINH LỚP 8
Giáo viên: Võ Thanh Khiết
Trường THCS SƠN ĐÔNG
Tổ khoa học tự nhiên
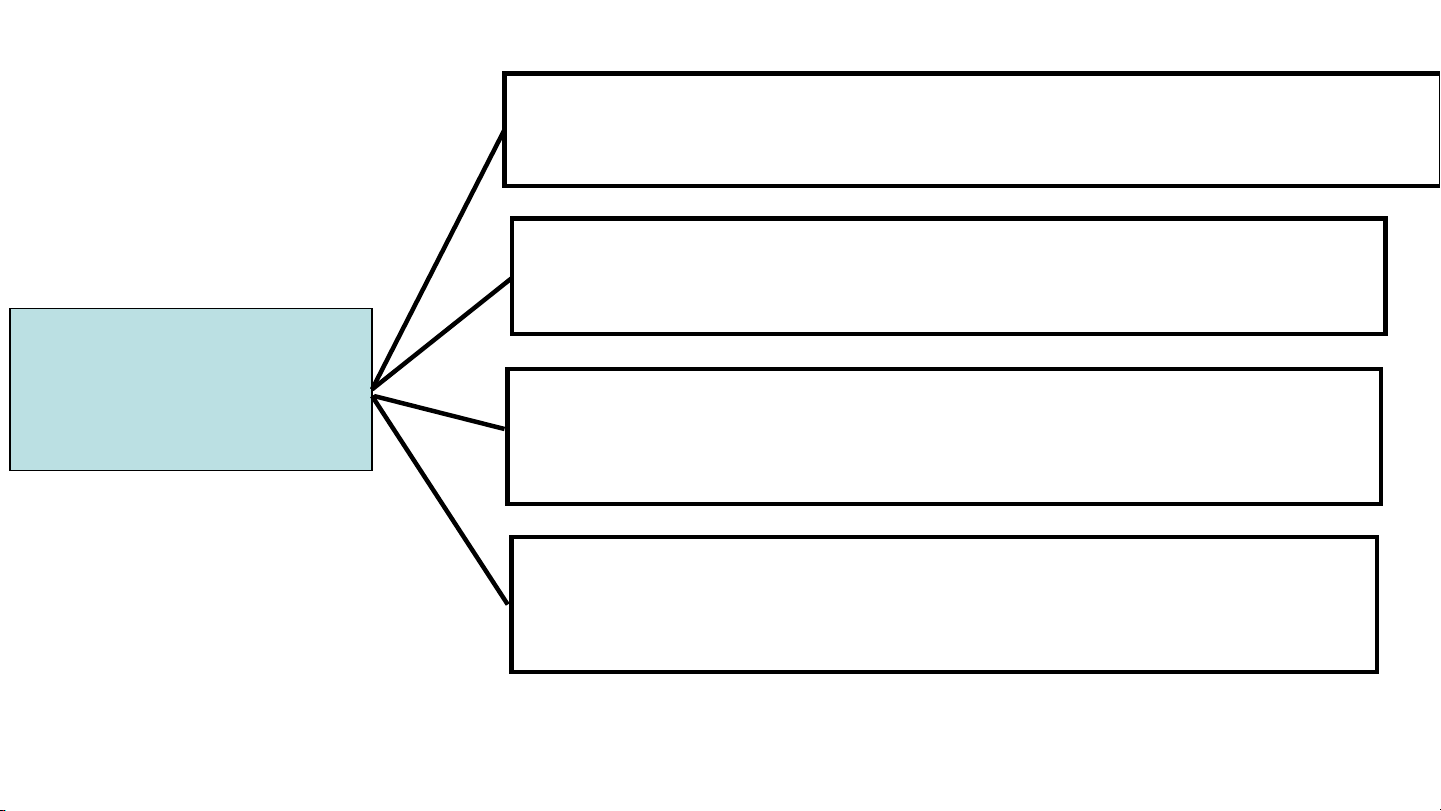
Tác dụng với kim loại Tác dụng với Acid
TÍNH CHẤT CỦA MUỐI Tác dụng với Base
Tác dụng với Muối
BÀI 12 MUỐI (Tiết 4)
IV. Tính chất hóa học của muối
3. Muối tác dụng với Base
PHIẾU THỰC HÀNH SỐ 1 Tên thí Cách tiến Hiện
Nhận xét, viết phương trình, nghiệm hành tượng kết luận.
Lấy khoảng 2 Tạo ra chất - Dung dịch CuSO phản ứng với dung 4
Thí nghiệm 3: ml dung dịch không tan dịch NaOH tạo ra chất không tan CuSO cho Dung dịch 4
màu xanh. Cu(OH) và dung dịch Na SO 2 2 4 CuSO phản vào ống - CuSO + 2NaOH →Cu(OH) SO 4 4 2 + Na2 4 nghiệm, sau ứng dd NaOH
- Kết luận: Muối có thể tác dụng với đó nhỏ từ từ
dung dịch base tạo thành muối mới và dung dịch base mới. NaOH vào ống nghiệm.
BÀI 12 MUỐI (Tiết 4)
IV.Tính chất hóa học của muối
3. Muối tác dụng với Base
a. Phương trình phản ứng CuSO + 2NaOH →Cu(OH) SO 4 2 + Na2 4 Copper(II) sulfate Sodium sulfate
b. Kết luận: Muối có thể tác dụng với
dung dịch base tạo thành muối mới và base mới.
BÀI 12 MUỐI (Tiết 4) Phiếu học tập 1
Viết phương trình hóa học xảy ra trong các trường hợp sau:
A. Dung dịch CuCl tác dụng với dung dịch KOH. 2
B. Dung dịch Na SO tác dụng với dung dịch Ca(OH) 2 4 2
C. Dung dịch NH Cl tác dụng với dung dịch NaOH. 4
D. Dung dịch Ba(NO ) tác dụng với dung dịch NaOH. 3 2 Bài làm A. CuCl + 2KOH → Cu(OH) 2 2 + 2KCl B. Na SO + Ca(OH) → CaSO + 2NaOH 2 4 2 4 (ít tan)
C. NH Cl + NaOH → NaCl + NH ↑ + H O 4 3 2
D. Ba(NO ) + NaOH → Không xảy ra 3 2
BÀI 12 MUỐI (Tiết 4)
IV.Tính chất hóa học của muối
3. Muối tác dụng với Base
a. Phương trình phản ứng CuSO + 2NaOH →Cu(OH) SO 4 2 + Na2 4 Copper(II) sulfate Sodium sulfate
b. Kết luận: Muối có thể tác dụng với
dung dịch base tạo thành muối mới và base mới.
c. Điều kiện phản ứng xảy ra
- Hai chất tham gia phản ứng phải tan.
- Sản phẩm phải có ít nhất một chất là
chất khí, chất ít tan, chất không tan.
4. Muối tác dụng với muối
PHIẾU THỰC HÀNH SỐ 2 Tên thí Cách tiến Hiện
Nhận xét, viết phương trình, nghiệm hành tượng kết luận. Lấy khoảng 2
- Dung dịch Na CO phản ứng với dung 2 3
Thí nghiệm 4: ml dung dịch Tạo ra chất dịch BaCl tạo ra chất không tan BaCO 2 3 Dung dịch Na CO cho 2 3 không tan và dung dịch NaCl Na CO phản vào
ống màu trắng. - Na CO + BaCl →BaCO 2 3 2 3 2 3 +2NaCl ứng dd BaCl nghiệm, sau
- Kết luận: Hai dd muối có thể tác dụng 2 đó nhỏ từ từ
với nhau tạo thành 2 muối mới mới. dung dịch BaCl vào 2 ống nghiệm.
BÀI 12 MUỐI (Tiết 4)
IV.Tính chất hóa học của muối
4. Muối tác dụng với Muối
a. Phương trình phản ứng Na CO + BaCl →BaCO 2 3 2 3 +2NaCl Barium carbonate
b. Kết luận: Hai dd muối có thể tác
dụng với nhau tạo thành 2 muối mới.
BÀI 12 MUỐI (Tiết 4) Phiếu học tập 2
Viết phương trình hóa học xảy ra trong các trường hợp sau:
A. Dung dịch AgNO tác dụng với dung dịch NaCl 3
B. Dung dịch CaCl tác dụng với dung dịch Na SO 2 2 4
C. Dung dịch BaCl tác dụng với dung dịch NaNO 2 3 Bài Làm A. AgNO + NaCl → AgCl 3 + NaNO3
B. CaCl + Na SO → CaSO + 2NaCl 2 2 4 4 (ít tan) C. BaCl + NaNO → Không xảy ra 2 3
BÀI 12 MUỐI (Tiết 4)
IV.Tính chất hóa học của muối
4. Muối tác dụng với Muối
a. Phương trình phản ứng Na CO + BaCl →BaCO 2 3 2 3 +2NaCl Barium carbonate
b. Kết luận: Hai dd muối có thể tác
dụng với nhau tạo thành 2 muối mới.
c. Điều kiện phản ứng xảy ra
- Hai chất tham gia phản ứng phải tan.
- Sản phẩm phải có ít nhất một chất là chất ít tan, không tan.
1. Tác dụng với kim loại → Muối mới + Kim loại mới
2.Tác dụng với acid → Muối mới + acid mới Tính chất hóa học của muối
3. Tác dụng với base → Muối mới + base mới
4. Tác dụng với muối → 2 muối mới LUYỆN TẬP Phiếu học tập 3
Muối CuSO có thể phản ứng với dãy chất nào sau đây: 4 A. NaOH, H SO , Fe 2 4 B H SO , AgNO , Ca(OH) 2 4 3 2 C. NaOH, BaCl , HCl 2 D D. NaOH, BaCl , Fe 2
BÀI 12 MUỐI (Tiết 4) Phiếu học tập 4
Hòa tan dung dịch có chứa 21,2 gam Sodium carbonate (Na CO ) vào 2 3
dung dịch Calcium chloride (CaCl ). Phản ứng xảy ra hoàn toàn. 2
a. Viết phương trình hóa học của phản ứng xảy ra.
b. Tính khối lượng chất không tan được tạo thành. Na= 23 ; C=12 ; O=16 ; Ca= 40 Bài Làm n = = = 0,2 (mol) Na CO 2 3 a. Phương trình hóa học:
Na CO + CaCl → CaCO 2 3 2 3 + 2NaCl 0,2 0,2 (mol)
b . Khối lượng chất không tan: m = n x M = 0,2 x 100 = 20 (gam) CaCO 3
Các em về nhà tiếp tục xem trước phần 5:
Mối quan hệ giữa acid, base, oxide và muối.
Document Outline
- PowerPoint Presentation
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Các em về nhà tiếp tục xem trước phần 5: Mối quan hệ giữa acid, base, oxide và muối.




