





























Preview text:
BỘ SÁCH CÁNH DIỀU GIÁO VIÊN: BÀI 12: MUỐI BÀI 12: M UỐI I. KHÁI NIỆM MUỐI. Phản ứng Công thức Acid Công thức muối
Kim loại + acid Muối + hydrogen HCl ZnCl2 Zn + 2HCl ZnCl + H 2 2
Acid + Base Muối + Nước H SO Na SO 2 4 2 4 H SO + 2NaOH Na SO + H O 2 4 2 4 2
Acid + Oxide base Muối + Nước HCl CuCl2 2HCl + CuO CuCl + H O 2 2
Nhận xét về sự giống và khác nhau giữa thành phần phân tử của acid và muối? - Giống: ion gốc acid. - Khác:
+ Acid: ion hydrogen liên kết với ion gốc acid
+ Muối: ion kim loại liên kết với ion gốc acid
Thử đề xuất khái niệm về Muối? BÀI 12: M UỐI I. KHÁI NIỆM MUỐI.
- Muối là những hợp chất được tạo ra khi thay thế ion H+ trong
acid bằng ion kim loại hoặc ion ammonium (NH + ). 4
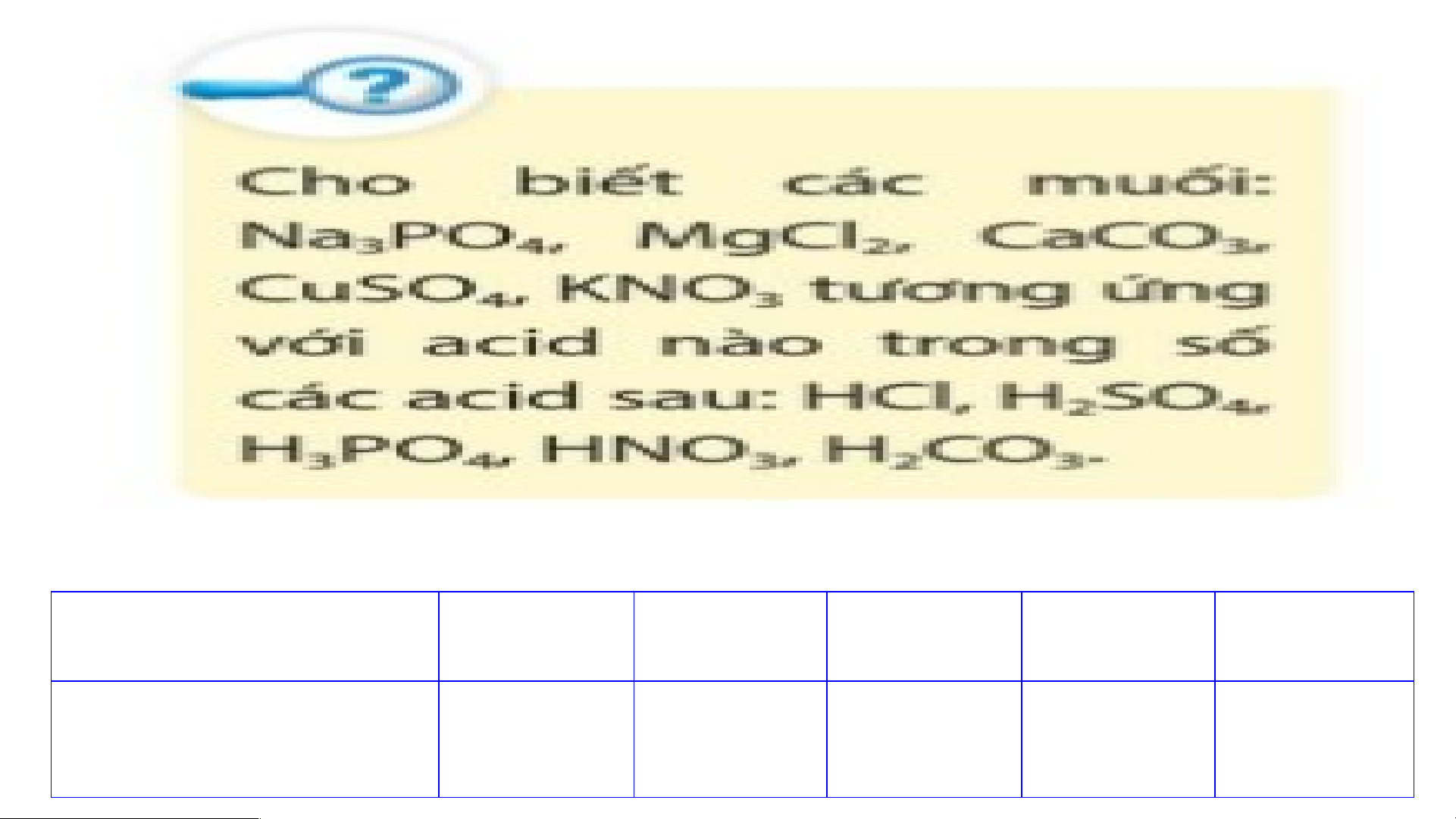
- VD: CuSO , NaCl; (NH ) SO … 4 4 2 4 Muối Na PO MgCl CaCO CuSO KNO 3 4 2 3 4 3 Acid tương ứng H PO HCl H CO H SO HNO 3 4 2 3 2 4 3 BÀI 12: M UỐI I. KHÁI NIỆM MUỐI.
- Muối là những hợp chất được tạo ra khi thay thế ion H+ trong
acid bằng ion kim loại hoặc ion ammonium (NH + ). 4
- VD: CuSO , NaCl; (NH ) SO … 4 4 2 4
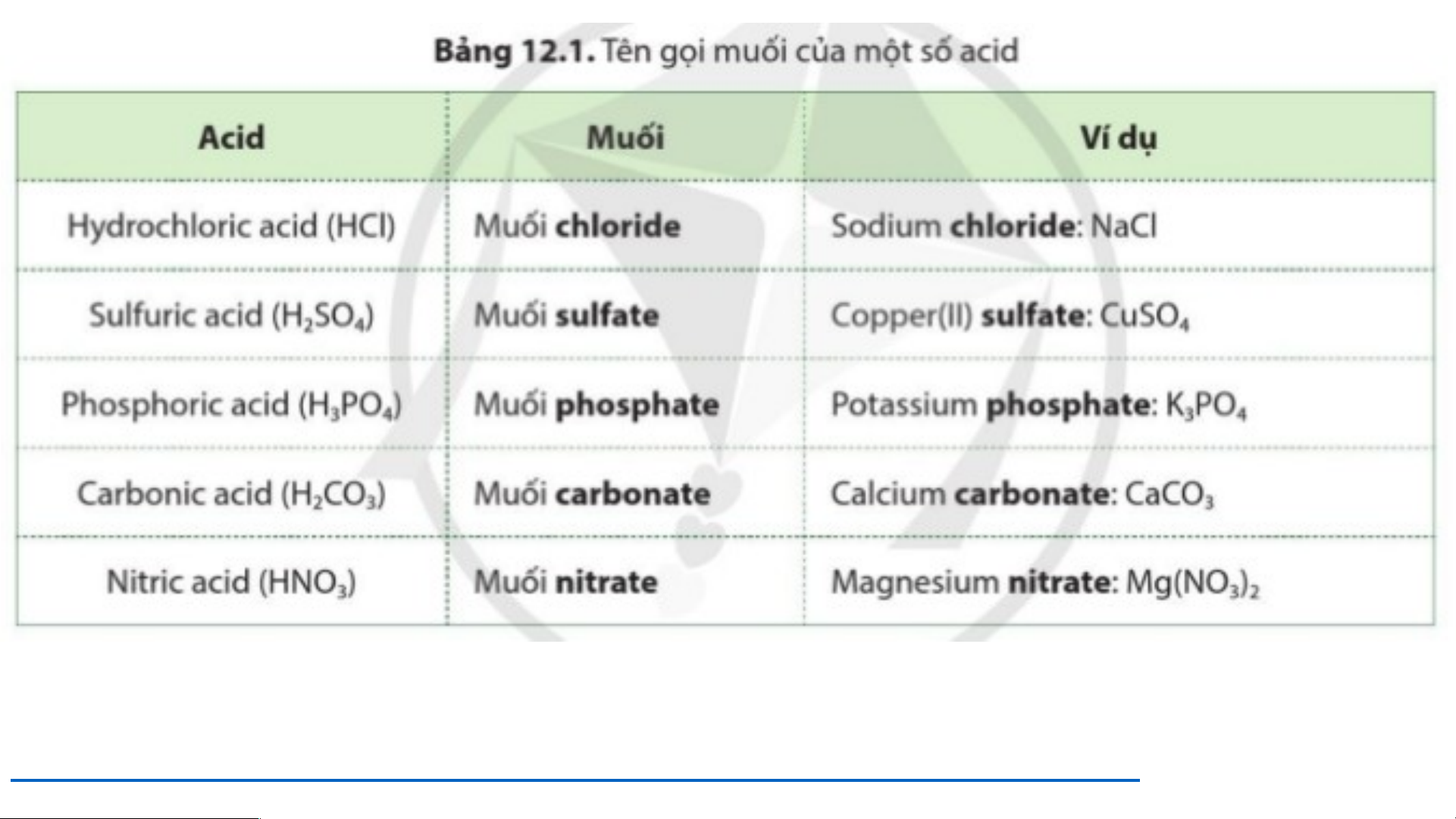
II. TÊN GỌI CỦA MUỐI. * Link đọc tên muối:
https://youtu.be/zJAOn5b4I6k?si=a6peYO1nnBAOxNcm KCl: Potassium chloride ZnSO : Zinc sulfate 4 MgCO : Magnesium carbonate 3 Ca (PO ) : Calsium phosphate 3 4 2 Cu(NO ) : Copper (II) nitrate 3 2 Al (SO ) : Aluminium sulfate 2 4 3 BÀI 12: MUỐI I. KHÁI NIỆM MUỐI
- Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim
loại hoặc ion ammonium (NH + ). 4
- VD: CuSO , NaCl; (NH ) SO … 4 4 2 4
II. TÊN GỌI CỦA MUỐI
Tên muối = tên ion kim loại [kèm hoá trị]/ ion ammonium (NH +) + tên gốc acid 4 VD : KCl: Potassium chloride 1
VD : Al (SO ) : Aluminium sulfate 2 2 4 3 III. TÍNH TAN CỦA MUỐI
- Có muối tan tốt trong nước: NaCl; CuSO ; KNO … 4 3
- Có muối ít tan trong nước: CaSO ; PbCl … 4 2
- Có muối không tan trong nước: BaSO ; AgCl, CaCO … 4 3 Các muối tan trong nước là: K SO , 2 4 Na CO , AgNO , KCl, 2 3 3 CaCl , MgSO . 2 4 BÀI 12: MUỐI I. KHÁI NIỆM MUỐI
II. TÊN GỌI CỦA MUỐI
Tên muối = tên ion kim loại [kèm hoá trị]/ ion ammonium (NH +) + tên gốc acid 4 VD : KCl: Potassium chloride 1
VD : Al (SO ) : Aluminium sulfate 2 2 4 3 III. TÍNH TAN CỦA MUỐI
- Có muối tan tốt trong nước: NaCl; CuSO ; KNO … 4 3
- Có muối ít tan trong nước: CaSO ; PbCl … 4 2
- Có muối không tan trong nước: BaSO ; AgCl, CaCO … 4 3
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại - Hiện tượng: Mẩu dây đồng tan dần, có lớp kim loại trắng bạc bám
- Bề mặt sợi dây đồng có ngoài dây đồng, dung
lớp kim loại trắng bạc, dịch sau phản ứng có dung dịch trong ống màu xanh. nghiệm đậm màu dần. Do dung dịch AgNO đã 3 phản ứng với kim loại Cu theo phương trình hoá học sau: 2AgNO + Cu → 3 Cu(NO ) + 2Ag↓. 3 2 Dung dịch Cu(NO ) có 3 2 màu xanh. BÀI 12: MUỐI I. KHÁI NIỆM MUỐI II. TÊN GỌI CỦA MUỐI III. TÍNH TAN CỦA MUỐI
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại
- PTHH: 2AgNO + Cu Cu(NO ) + 2Ag 3 3 2
- Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
dd muối + kim loại muối mới + kim loại mới. 3.
- Phương trình hoá học xảy ra: Zn + CuSO → ZnSO + Cu. 4 4
- Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu. 4. a) Fe + CuSO → FeSO + Cu. 4 4
b) Zn + 2AgNO → Zn(NO ) + 2Ag. 3 3 2 BÀI 12: MUỐI I. KHÁI NIỆM MUỐI II. TÊN GỌI CỦA MUỐI III. TÍNH TAN CỦA MUỐI
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại
- PTHH: 2AgNO + Cu Cu(NO ) + 2Ag 3 3 2
- Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
dd muối + kim loại muối mới + kim loại mới.
2. Tác dụng với acid
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch BaCl phản ứng với dung dịch H SO tạo thành kết tủa trắng 2 2 4
là BaSO . Phương trình hoá học: 4
BaCl + H SO → BaSO ↓ + 2HCl. 2 2 4 4 BÀI 12: MUỐI
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại
- PTHH: 2AgNO + Cu Cu(NO ) + 2Ag 3 3 2
- Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
dd muối + kim loại muối mới + kim loại mới. 2. Tác dụng với acid
- Phương trình hoá học: BaCl + H SO → BaSO ↓ + 2HCl. 2 2 4 4
- Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
Muối + dd acid muối mới + acid mới.
a) - Hiện tượng: có khí thoát ra.
- Giải thích: H SO loãng tác dụng với Na CO sinh ra 2 4 2 3
khí CO theo phương trình hoá học: 2
H SO + Na CO → Na SO + CO ↑ + H O. 2 4 2 3 2 4 2 2
b) - Hiện tượng: xuất hiện kết tủa trắng.
- Giải thích: HCl tác dụng với AgNO sinh ra kết tủa 3
trắng là AgCl theo phương trình hoá học: HCl + AgNO → AgCl↓ + HNO . 3 3 BÀI 12: MUỐI
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại
- PTHH: 2AgNO + Cu Cu(NO ) + 2Ag 3 3 2
- Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
dd muối + kim loại muối mới + kim loại mới. 2. Tác dụng với acid
- Phương trình hoá học: BaCl + H SO → BaSO ↓ + 2HCl. 2 2 4 4
- Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
Muối + dd acid muối mới + acid mới.
3. Tác dụng với base
- Hiện tượng: Xuất hiện kết tủa xanh, dung dịch nhạt màu dần.
- Giải thích: CuSO tác dụng với NaOH sinh ra kết tủa Cu(OH) có màu xanh. 4 2
Phương trình hoá học: CuSO + 2NaOH → Cu(OH) ↓ + Na SO . 4 2 2 4 BÀI 12: MUỐI
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại
dd muối + kim loại muối mới + kim loại mới.
2. Tác dụng với acid
Muối + dd acid muối mới + acid mới. 3. Tác dụng với base
- Phương trình hoá học: CuSO + 2NaOH → Cu(OH) ↓ + Na SO . 4 2 2 4
- Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
Muối + dd base muối mới + base mới.
a) FeCl + 3NaOH → Fe(OH) ↓ + 3NaCl 3 3
b) CuCl + 2KOH → Cu(OH) ↓ + 2KCl. 2 2 a) MgO + H SO → MgSO + H O 2 4 4 2
b) 2KOH + CuCl → Cu(OH) ↓ + 2KCl. 2 2 BÀI 12: MUỐI
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại
dd muối + kim loại muối mới + kim loại mới.
2. Tác dụng với acid
Muối + dd acid muối mới + acid mới. 3. Tác dụng với base
- Phương trình hoá học: CuSO + 2NaOH → Cu(OH) ↓ + Na SO . 4 2 2 4
- Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
Muối + dd base muối mới + base mới.
4. Tác dụng với muối
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch Na CO tác dụng với dung dịch CaCl sinh ra kết tủa trắng 2 3 2
là CaCO theo phương trình hoá học: 3
Na CO + CaCl → CaCO ↓ + 2NaCl. 2 3 2 3 BÀI 12: MUỐI
IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
1. Tác dụng với kim loại
dd muối + kim loại muối mới + kim loại mới.
2. Tác dụng với acid
Muối + dd acid muối mới + acid mới.
3. Tác dụng với base
Muối + dd base muối mới + base mới. 4. Tác dụng với muối
- Phương trình hoá học: Na CO + CaCl → CaCO ↓ + 2NaCl 2 3 2 3
- Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
dd muối + dd muối muối mới + muối mới.
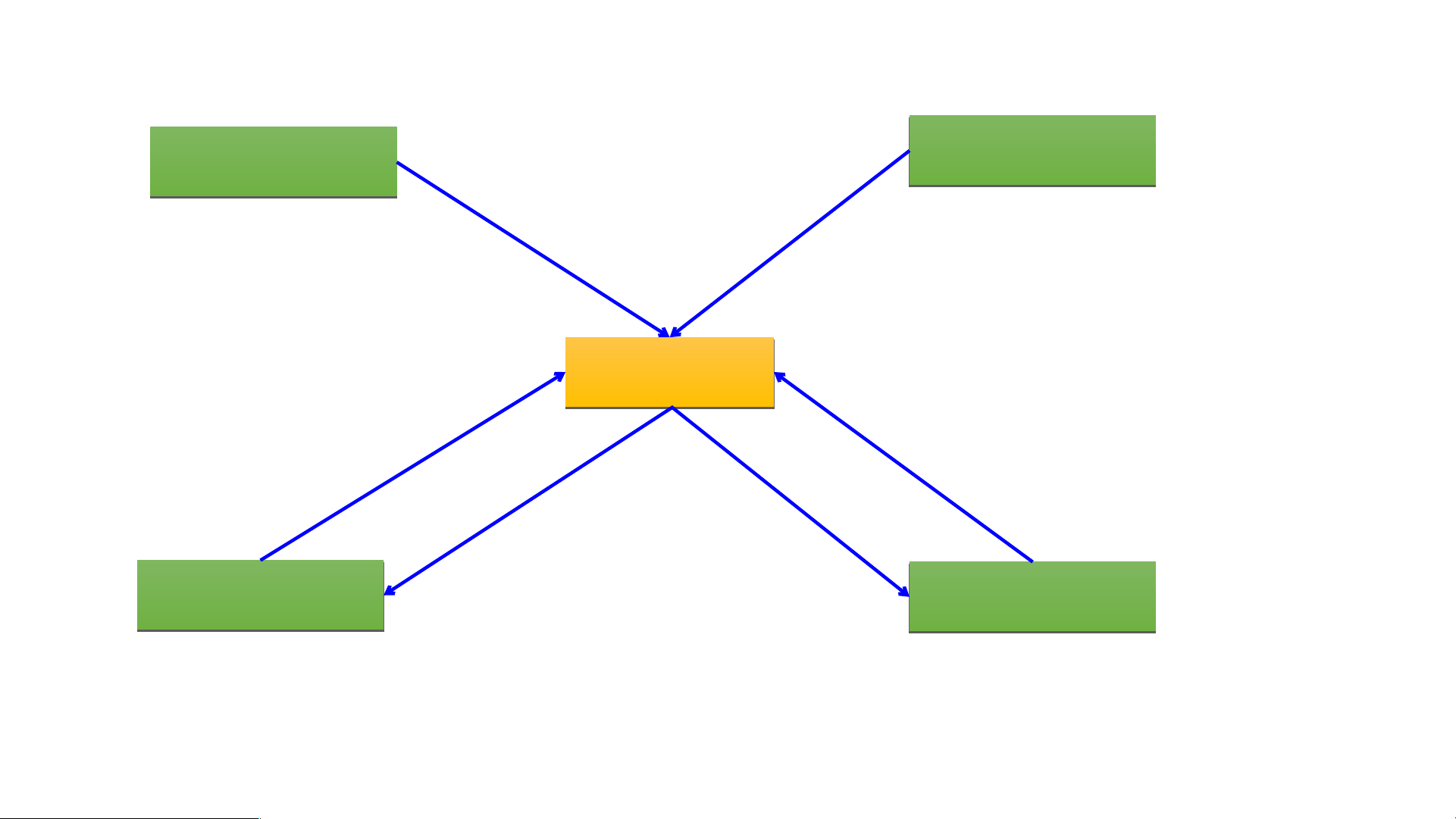
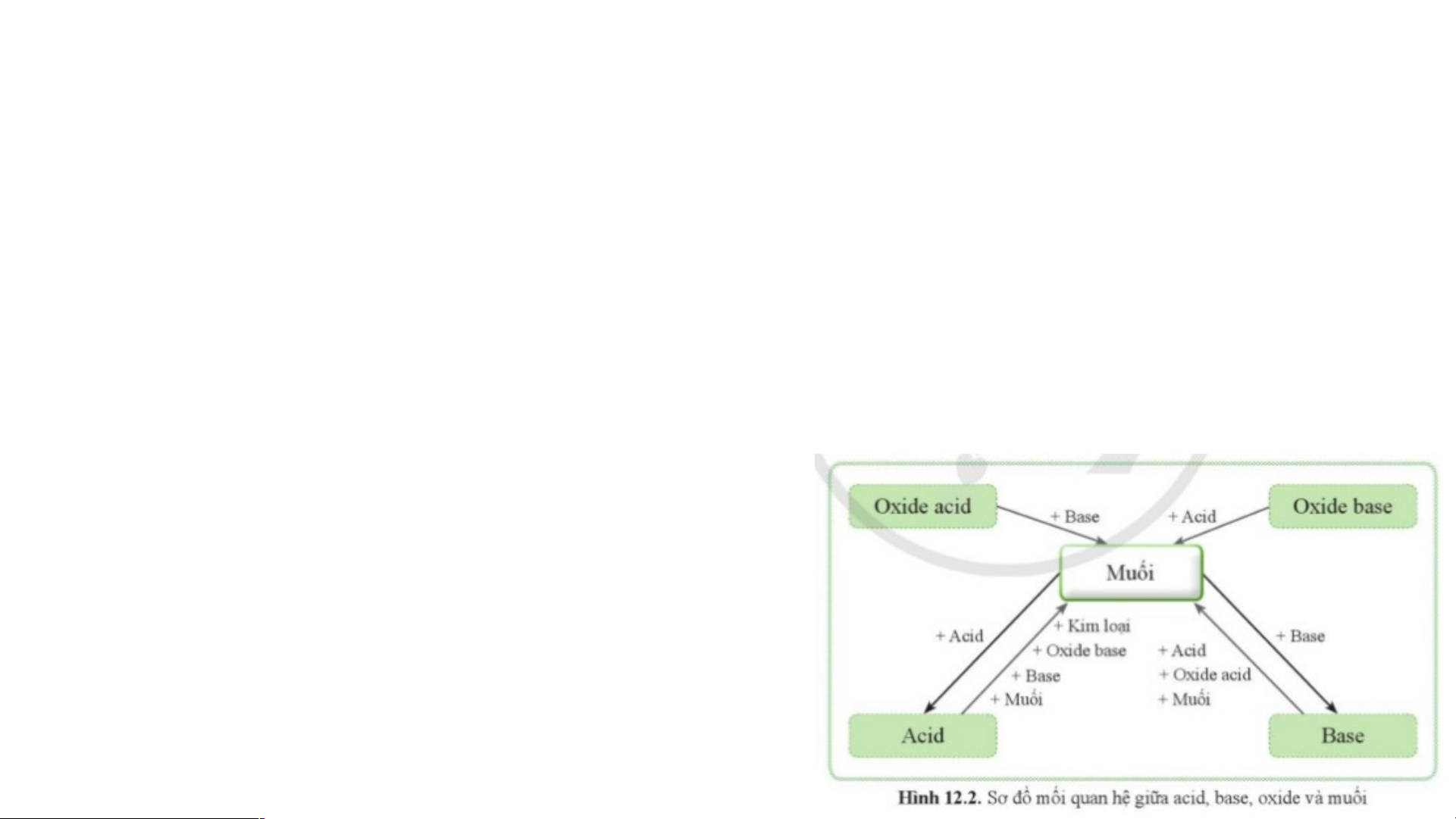
V. MỐI QUAN HỆ GIỮA ACID, BASE, OXIDE VÀ MUỐI BÀI 12: MUỐI
V. MỐI QUAN HỆ GIỮA ACID, BASE, OXIDE VÀ MUỐI Oxide acid Oxide base + Base + Acid + kim loại Mu M ối + Acid + Oxide base + Oxide acid + Base + Muối + Acid + Muối + Base Acid Base
a) NaCl + AgNO → AgCl↓ + NaNO . 3 3
b) Na SO + BaCl → BaSO ↓ + 2NaCl. 2 4 2 4
c) K CO + Ca(NO ) → CaCO ↓ + 2KNO . 2 3 3 2 3 3 (1) CuO + H SO → CuSO + H O. 2 4 4 2
(2) CuSO + BaCl → BaSO ↓ + CuCl . 4 2 4 2
(3) CuCl + 2NaOH → Cu(OH) ↓ + 2NaCl. 2 2 BÀI 12: MUỐI
VI. MỘT SỐ PHƯƠNG PHÁP ĐIỀU CHẾ MUỐI
- dd acid + base muối + H O. 2
VD: H SO + 2NaOH → Na SO + 2H O. 2 4 2 4 2
- dd acid + Oxide base muối + H O.
Dựa vào sơ đồ hình 12.2 Hãy nêu 2
các phương pháp điều chế muối?
VD: 2HCl + CuO → CuCl + H O. 2 2
- dd acid + Muối muối mới + acid mới.
VD: BaCl + H SO → BaSO ↓ + 2HCl. 2 2 4 4
- dd base + Oxide acid muối + H O. 2
VD: Ca(OH) + CO → CaCO ↓ + H O. 2 2 3 2
- dd muối + dd muối 2 muối mới
VD: Na CO + CaCl → CaCO ↓ + 2NaCl 2 3 2 3 10.
(1) 2NaOH + SO → Na SO + H O. 3 2 4 2
(2) 2NaOH + H SO → Na SO + 2H O. 2 4 2 4 2
(3) 2NaOH + CuSO → Na SO + Cu(OH) ↓. 4 2 4 2 11. (1) CuO + 2HCl → CuCl + H O. 2 2
(2) Cu(OH) + 2HCl → CuCl + 2H O. 2 2 2
(3) CuSO + BaCl → CuCl + BaSO ↓. 4 2 2 4 Đổi 51 kg = 51 000 gam. n =51 000 :102=500 (mol) Al2O3 Phương trình hoá học:
Al O + 3H SO → Al (SO ) + 3H O 2 3 2 4 2 4 3 2
Theo phương trình hoá học có: n =n =500 (mol) Al2(SO4)3 Al2O3
Khối lượng Al (SO ) tạo thành là: 2 4 3
m = 500 × 342 = 171 000 gam = 171 kg.
Bài 1: Chọn các chất thích hợp để điền vào vị trí dấu ? và hoàn thành các
phương trình hoá học sau: a) CO + ? ⇢ K CO + H O 2 2 3 2 b) Na CO + ? ⇢ BaCO + NaCl 2 3 3 c) Cu + ? ⇢ Cu(NO ) + Ag 3 2 d) KOH + ? M ⇢ g(OH) + K SO 2 2 4
Bài 2: Hoàn thành các phương trình hoá học theo sơ đồ chuyển hoá sau:
NaOH → Na CO → Na SO → NaCl 2 3 2 4
Bài 3: Cho các chất sau: Mg, MgCl , MgO, Mg(OH) , MgSO . 2 2 4
a) Lập sơ đồ chuyển hoá giữa các chất trên.
b) Hoàn thành các phương trình hoá học theo sơ đồ chuyển hoá đã lập được.
Bài 4: Cho một chiếc đinh sắt vào 20 ml dung dịch CuSO 0,1 M. Sau 4
khi phản ứng kết thúc, thấy có kim
loại màu đỏ được tạo thành.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Giả sử CuSO trong dung dịch phản ứng hết, tính khối lượng kim loại 4 màu đỏ được tạo ra.
Bài 5: Cho 50 ml dung dịch Na CO 0,1 M tác dụng vừa đủ với dung dịch HCl 0,1 2 3
M, thu được dung dịch NaCl và khí CO thoát ra 2 .
a) Tính thể tích dung dịch HCl đã dùng.
b) Tính thể tích khí CO (ở đkc) được tạo thành (coi hiệu suất phản ứng là 100%). 2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39