



























Preview text:
GIẢI CỨU ĐẠI DƯƠNG Bắt đầu!
Câu 1: Chất được tạo thành sau phản ứng hóa học là? A.Chất phản B.Chất Sản phẩm C. Chất lỏng D. Chất khí ứng HẾT GIỜ Bắt đầu!
Câu 2: Chất mới được tạo ra từ phản ứng hóa học so
với chất cũ sẽ như thế nào? A.Cả hai đều B.Cả hai đều C.Giống hệt D.Có tính chất sai đúng chất ban đầu mới , khác biệt chất ban đầu HẾT GIỜ
Câu 3 : Cho sơ đồ phản ứng hóa học sau: Bắt đầu!
2 Hydrogen + Oxygen → nước
Trong quá trình phản ứng, số nguyên tử H và
số nguyên tử O có thay đổi không? A.Thay đổi theo C. Thay đổi B.Không Thay D.H tăng còn O chiều tăng dần theo chiều đổi giảm HẾT giảm dần GIỜ Bắt đầu! Câu 4 : Trong phản ứng:
Magnesium + sulfuric acid → magnesium sulfate
+ khí hyđrogen. Magnesium sulfate là A. chất phản B. C. sản phẩm chất xúc tác. D. chất xúc tác. ứng. HẾT GIỜ Bắt đầu!
Câu 5 : Cho mẩu magie phản ứng với dung
dịch hydrochloric acid thấy tạo thành muối
magnesium chloride và khí hydrogen. Khẳng
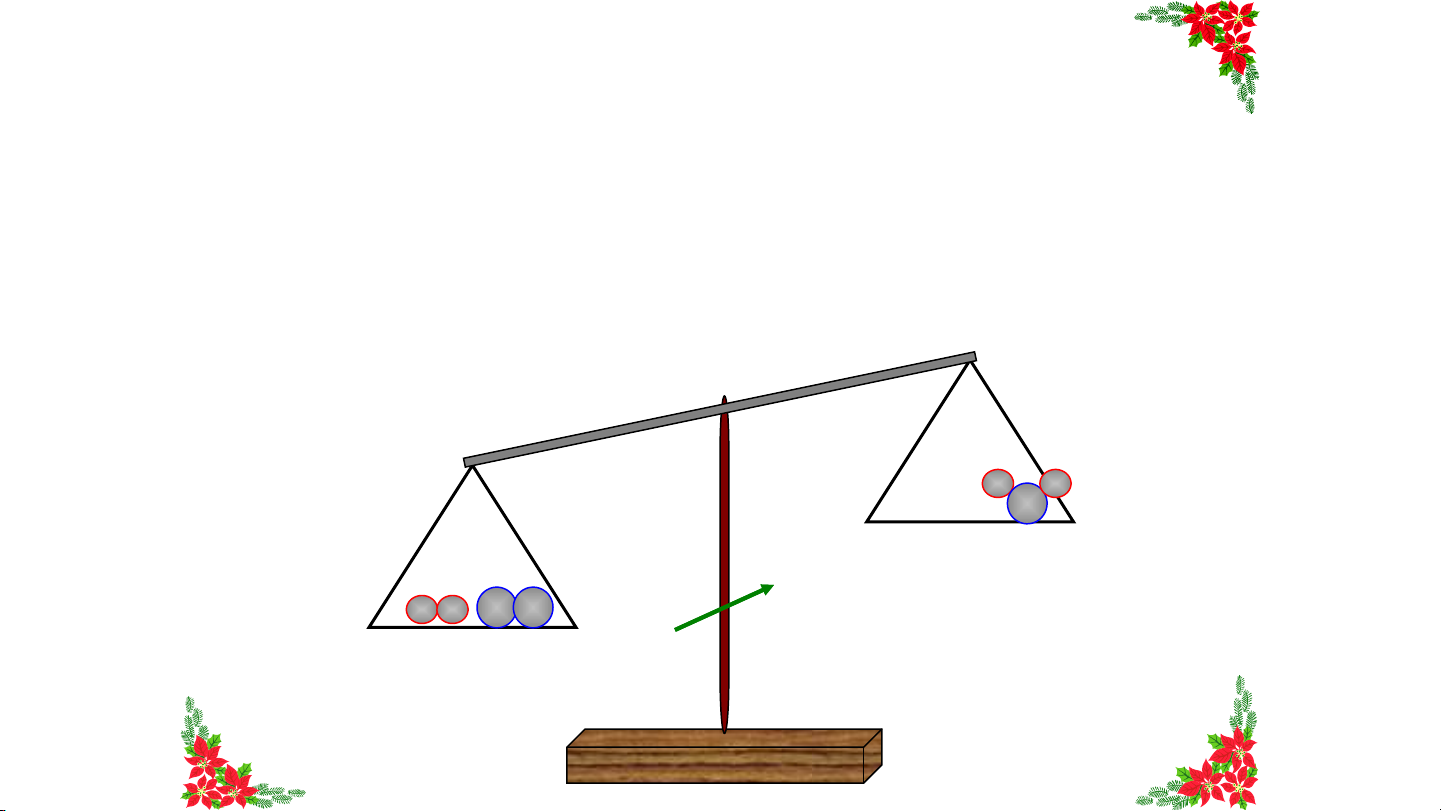
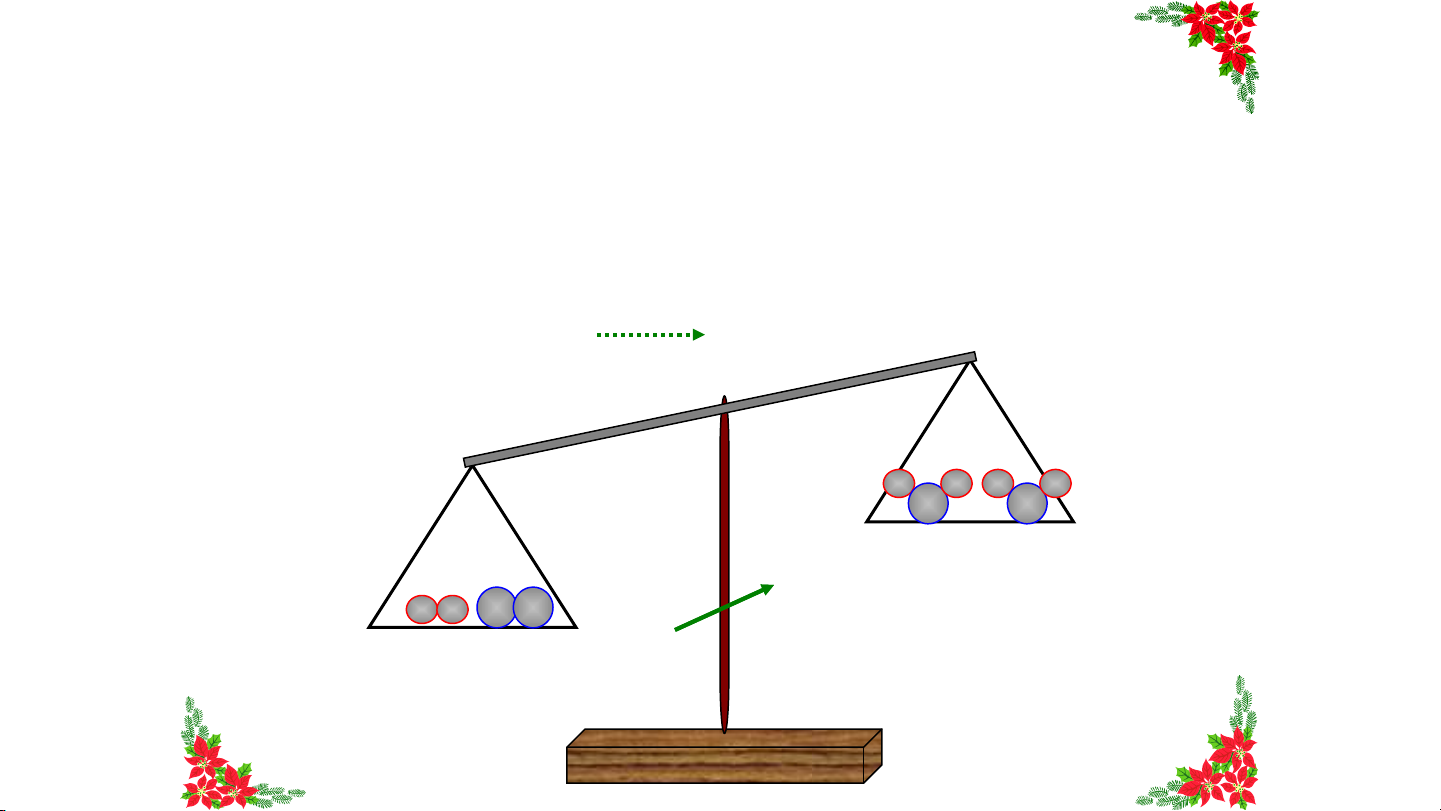
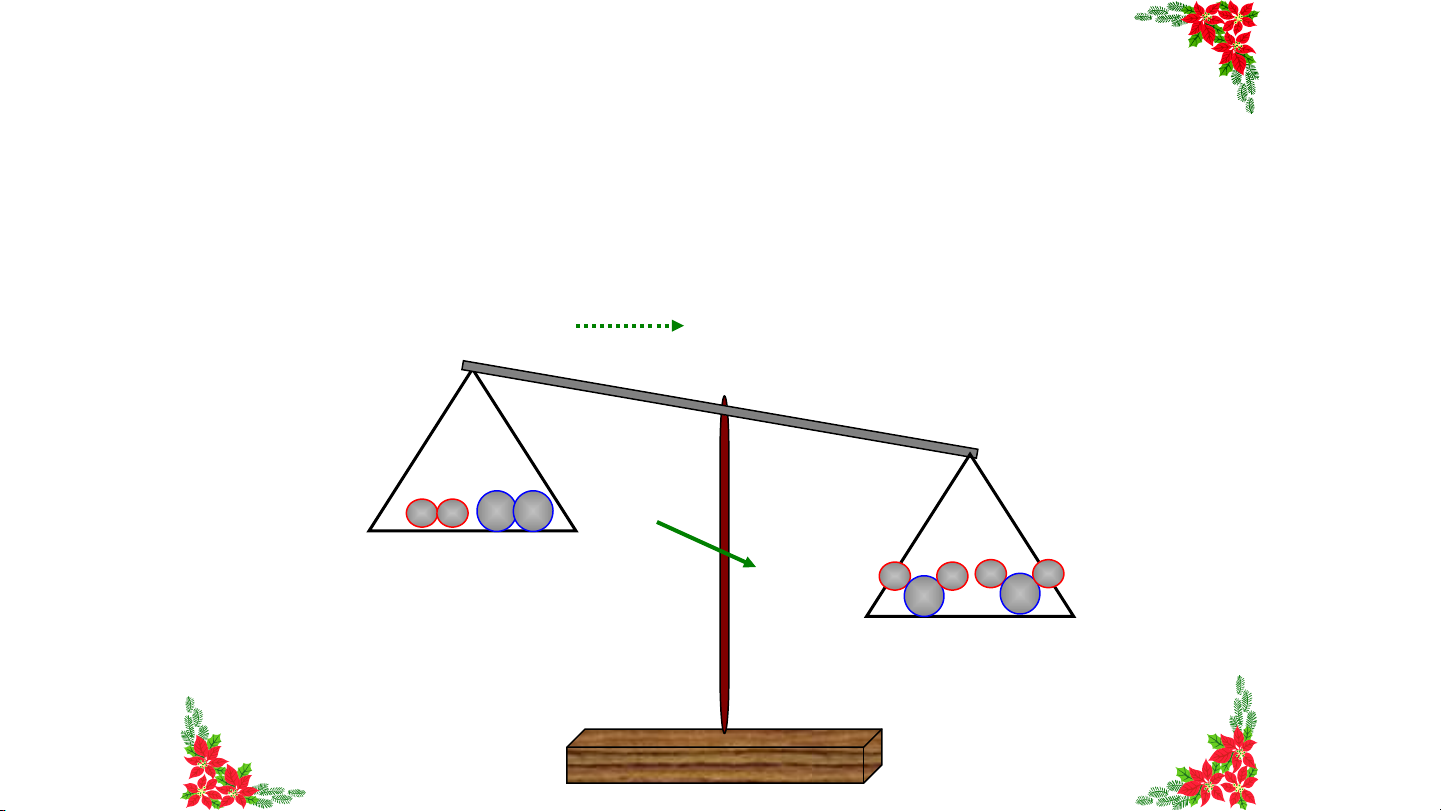
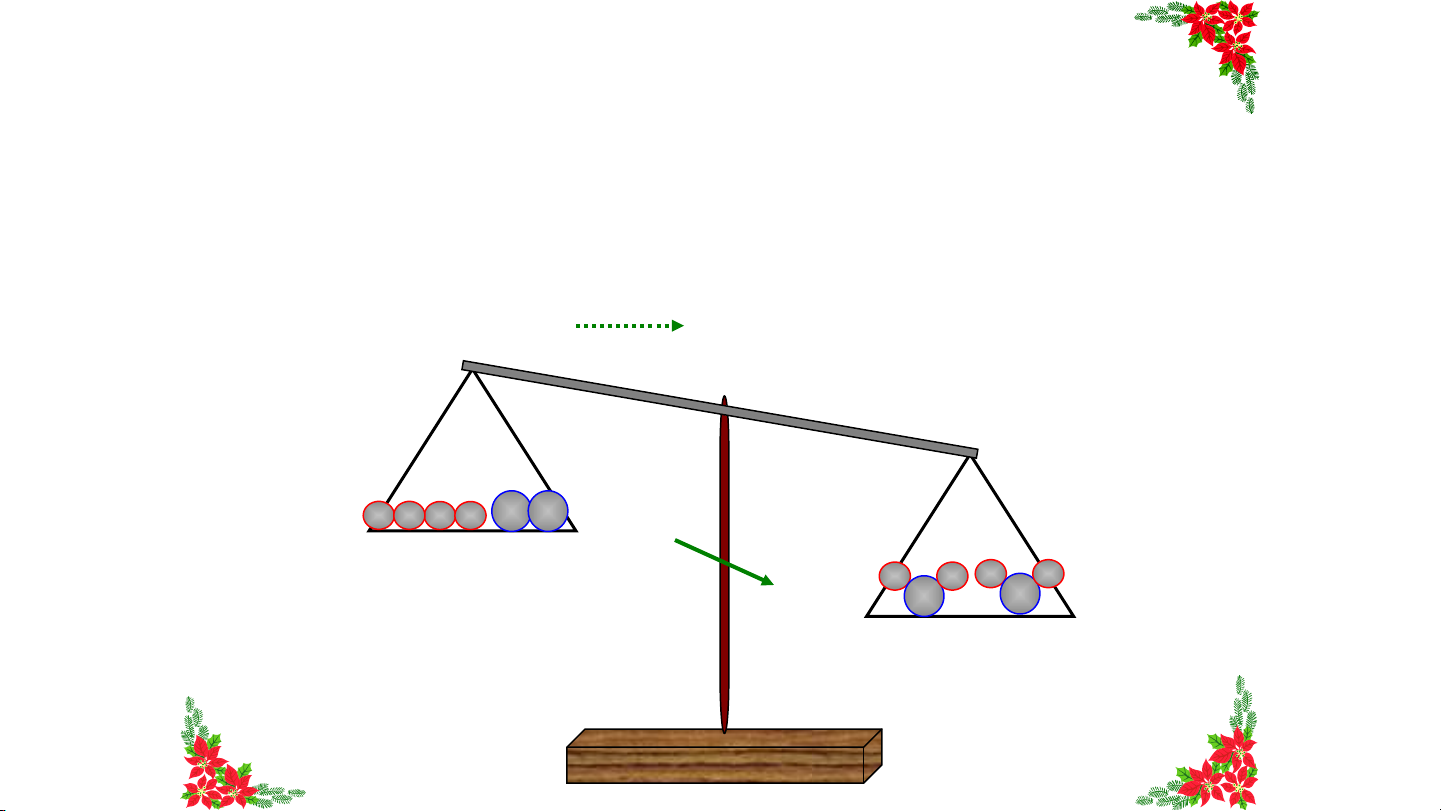
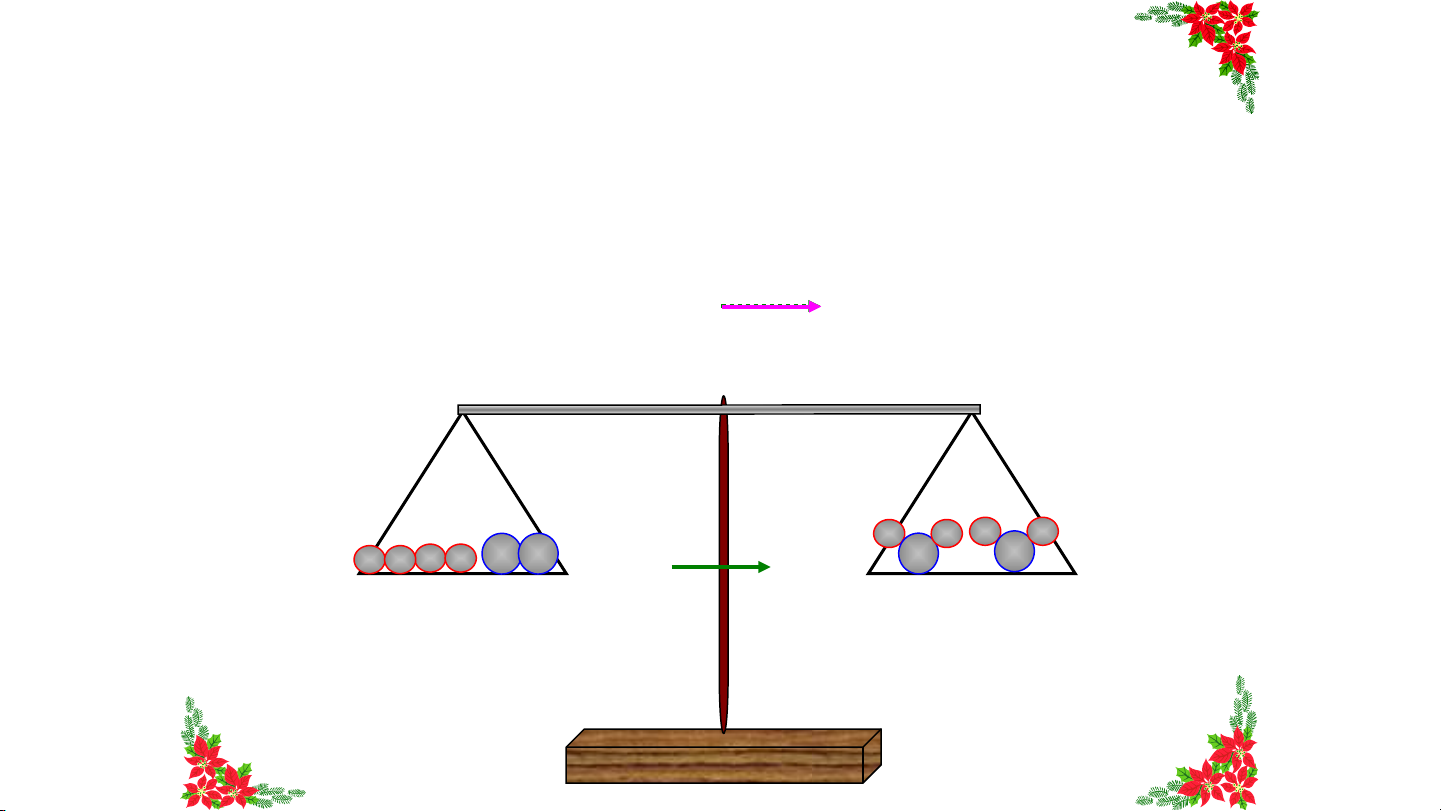
định nào dưới đây đúng? Tổng khối Khối lượng Tổng khối lượng của Khối lượng của lượng chất phản magnesium magnesium và magnesium ứng bằng khối hydrochloric acid bằng khối chloride bằng A. HẾ lượng khí B T .
C. bằng tổng khối lượng D. lượng khí tổng khối hydrogen sinh raGIỜ muối magnesium hydrogen chloride và khí lượng chất hydrogen phản ứng
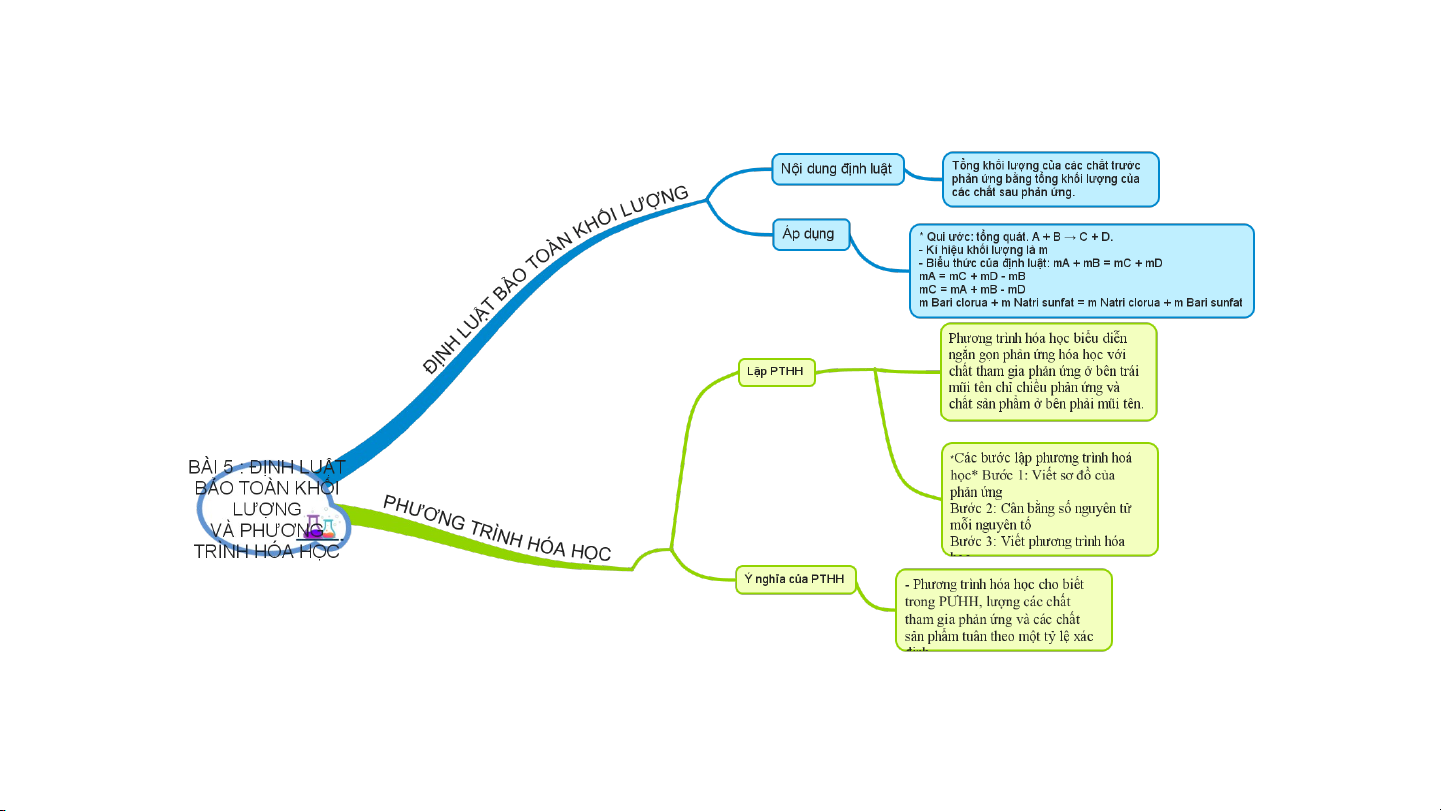
I: ĐỊNH LUẬT BẢO TOÀN KHÔI LƯỢNG 7 Đọc tài Làm thí liệu (Phân tích) nghiệm (Trải nghiệm) Áp dụng (Áp dụng)
Phụ lục 1: GÓC PHÂN TÍCH Thời gian tối đa 5 phút
Mục tiêu: Thông qua việc tìm hiểu TN SGK, học sinh xác định được các loại hóa chất, phân
loại hóa chất, dụng cụ để tiến hành TN so sánh được khối lượng các chất trước và sau phản ứng.
Nhiệm vụ: Đọc SGK phần “I Định luật bảo toàn khối lượngI” , nghiên cứu phần bàn tay và điền vào phiếu học tập số 1 PHIẾU SỐ 1 HOÁ CHẤT DỤNG CỤ
PHỤ LỤC 2: GÓC TRẢI NGHIỆM
Thời gian tối đa 10 phút
Mục tiêu : Học sinh thông qua hoạt động thực hành
TN để so sánh được tổng khối lượng của các chất
trước phản ứng với tổng khối lượng các chất sau phản ứng:
Nhiệm vụ: Thực hiên TN SGK, ghi kết quả vào phiếu số 2 PHIẾU SỐ 2 THÍ NGHIỆM HIỆN TƯỢNG NHẬN XÉT KẾT LUẬN (VIẾT PTHH ) PHIẾU SỐ 3 ? Phần 1: ? Phần 2 . KẾT LUẬN
1. Giáo viên hướng dẫn học sinh báo cáo kết quả .
2 Đại diện nhóm trình bày kết quả từ bảng của góc (theo thứ tự
góc trải nghiệm, góc phân tích, góc áp dụng).
3. Các nhóm khác theo dõi kết quả của mình và nhận xét.
4. Yêu cầu bổ sung và nêu câu hỏi (nếu có).
5. Giáo viên chốt lại và hướng dẫn học sinh học cách học bài.
II: PHƯƠNG TRÌNH HOÁ HỌC
1. Lập phương trình hoá học a. Phương trình hoá học
Biết khi hydrogen cộng với - Phương trình chữ:
khí oxygen tạo thành nước.
Khí hydrogen + Khí oxygen Nước
Hãy cho biết phương trình *Sơ đồ phản ứng:
chữ của phản ứng trên. H + O H O 2 2 2 Em hãy thay tên các chất trên thành công thức hoá học. 15
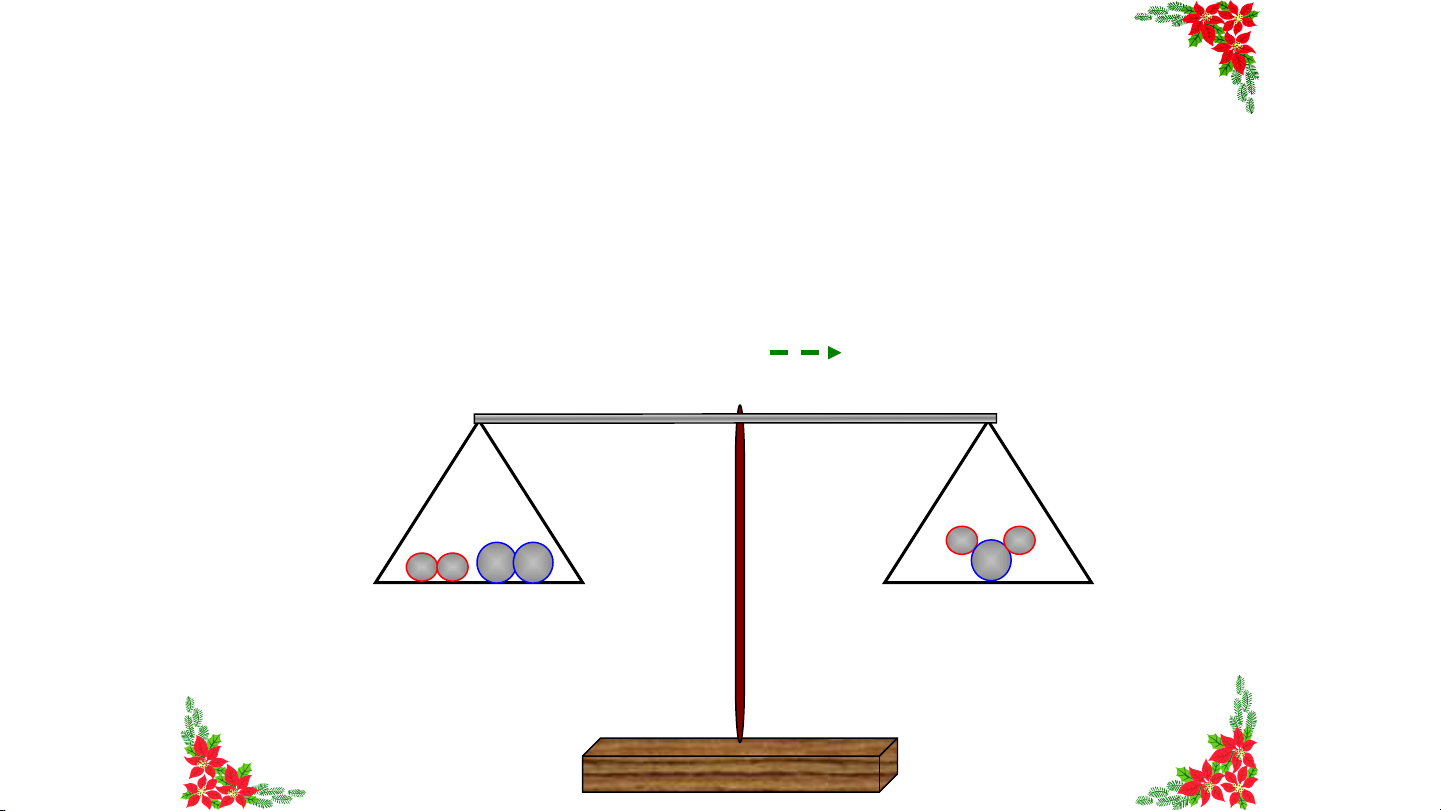
Dựa vào số nguyên tử có ở 2 đĩa cân, em
hãy cho biết cân sẽ lệch về bên nào? H + O O 2 2 H2 H H O O H H O H + O H O 2 2 2 16 ? D Vì o s sao ố n b gu ên yê tr n ái n tử Oặn b g ê nh tơn r b ái ê n n hi p ề h u ải h ? ơn bên phải. H H O H O 2 H H O O H + O 2 2 17 ? Ph T ? Dả h iê ựal àm m b v ê ào t h ns ế p n h ố n ào ải guyđ mê ể n stố ột p n h gu ân yê ử ở 2 đĩ n tử n tử a c 0 ước ân, ở H c h ânai O 2 vế s b ẽ lằn ệc g n h h về au p . hía nào? H + O 2 H O 2 2 2 H H H H O O 2H O 2 H H O O H + O 2 2 18 C Bêânn plệ h ch ải về n p ặn h g íha p ơn hbảêi. n V trì s ái ao d ? o số nguyên tử H nhiều hơn. H + O 2H O 2 2 2 H H O O H H H H O O H + O 2 2 2 H O 2 19 B ?E ên m c trái ó nh cần ận xé c t ó gì 4 về n s gu ố nyên guy ê tử n H. tử của
Làm thế nào để cân bằng 2 vế ? Thêm mỗi 2 n ngu gu yê yê n n t tố ở ử H 2 đ tức ĩa c 1 p ân. hân tử H 2 2 H + O 2H O 2 2 2 O O H H H H 2 H + O 2 2 H H H H O O 2 H O 2 20 * CÂN BẰNG SỐ O
NGUYÊN TỬ CỦA MỖI NGUYÊN TỐ 2H + 2H O 2 2 2 H H H H O O H H H H O O 2 H + O 2 H O 2 2 2 21
II . PHƯƠNG TRÌNH HOÁ HỌC
1. Lập phương trình hoá học a. Phương trình hoá học - Phương trình chữ:
Khí hydrogen + Khí oxygen Nước Em hãy lập phương trình hoá Sơ đồ phản ứng: học của phản H + O H O 2 2 2 ứng hydrogen tác
Cân bằng số nguyên tử của mỗi dụng với nguyên tố: oxygen? 2H + O 2H O 2 2 2
Viết phương trình hóa học: 2H + O 2H O 2 2 2
Phương trình hóa học biểu diễn
ngắn gọn phản ứng hóa học.
Ví dụ: 2 H + O 2 H O 2 2 2 22 Thông tin cho em -
Nói phương trình hoá học biểu diễn phản ứng hoá học,
cần thấy đó là mốt phản ứng có thực, có xảy ra -
Không phải cứ viết được thành phương trình vì số
nguyên tử của mỗi nguyên tố ở bên đều bằng nhau, thì
biểu diễn được 1 phản ứng hoá học.
Ví dụ: Phương trình sau: 3S + 2H O 2H S + SO 2 2 2
Không biểu diễn 1 phản ứng nào cả. Hay nói cách
khác không có phản ứng nào xảy ra theo phương trình này.
-Phương trình hoá học cũng có tính chất quốc tế như
kí hiệu hoá học. Nghĩa là mọi người dù ở đâu chỉ cần
nhìn vào phương trình hoá học đều hiểu cùng một 23 thông tin như nhau. *Sơ đồ phản ứng: H
Để lập phương trình 2 + O2 H O 2 *C©n b»ng sè nguyªn tö hoá học cần mấy cña mçi nguyªn tè: bước? Là những 2H2 + O2 2H O 2 bước nào? *ViÕt phư ¬ng tr×nh hãa häc: 2H2 + O2 2H O 2
Phương trình hóa học biểu diễn
ngắn gọn, phản ứng hóa học.
Ví dụ: 2 H + O 2 H O 2 2 2 24 Biết nhôm
b. Các bước lập phương trình hoá ( aluminium) tác học dụng với khí oxygen - Ví dụ: tạo ra aluminum
*Bước 1: Viết sơ đồ của phản ứng: Al O Al O oxide + 2 2 3
*Bước 2: Cân bằng số nguyên tử của Hãy lập phương mỗi nguyên tố
trình hoá học của 4 Al + 3 O 2 Al O 2 2 3 phản ứng?
*Bước 3: Viết phương trình hóa học: 4 Al + 3 O 2 Al O 2 2 3 25
b. Các bước lập phương trình hoá học
Tuy nhiên một số
*Bước 1: Viết sơ đồ của phản ứng.
trường hợp sơ đồ phản
*Bước 2:: Cân bằng số nguyên tử
ứng cũng là phương của mỗi nguyên tố
trình hoá học
*Bước 3: Viết phương trình hóa học.
Ví dụ: C + O2 CO2 26 Lưu ý: Ví dụ:
+ Viết đúng công thức hoá học của
các chất tham gia và chất tạo thành. Ca + O CaO
+ Không được thay đổi chỉ số trong 2 2
những công thức hóa học đã viết
Không phải là phương đúng.
trình hoá học.
+ Viết hệ số cao bằng kí hiệu.
+ Đối với nhóm nguyên tử thì coi
Không viết 3O2 thành 6O như
một đơn vị để cân bằng.
Viết 4Al không viết 4Al 27 ĐÁP ÁN:
a) Fe + O − − → Fe O 2 3 4
Số nguyên tử Fe và O ở hai vế không bằng nhau, nhưng O có số nguyên tử
nhiều hơn nên ta bắt đầu từ nguyên tố này trước. Do O có 2 nguyên tử O 2
còn Fe O có 4 nguyên tử O nên ta đặt hệ số 2 trước O ; để cân bằng tiếp số 3 4 2
nguyên tử Fe ta đặt hệ số 3 vào trước Fe ở vế trái. Phương trình hoá học của
phản ứng hoàn thiện như sau: 28 3Fe + 2O → Fe O . 2 3 4
b) Al + HCl − − → AlCl + H 3 2
Trước phản ứng có 1 nguyên tử H và 1 nguyên tử Cl trong
phân tử HCl; sau phản ứng có 3 nguyên tử Cl trong AlCl ; 2 3
nguyên tử H trong phân tử H , do đó ta lấy bội chung nhỏ 2
nhất của 3 và 2 là 6, đặt trước HCl, được:
Al + 6HCl − − → AlCl + H 3 2
Để cân bằng số nguyên tử H ta đặt hệ số 3 trước H ; để cân 2
bằng số nguyên tử Cl ta đặt hệ số 2 trước AlCl , được: 3
Al + 6HCl − − → 2AlCl + 3H 3 2
Cuối cùng để cân bằng số nguyên tử Al ta thêm hệ số 2 trước
Al ở vế trái. Phương trình hoá học của phản ứng được hoàn thiện như sau: 29
2Al + 6HCl → 2AlCl + 3H 3 2
c) Al (SO ) + NaOH − − → Al(OH) + Na SO 2 4 3 3 2 4
Trước tiên ta cân bằng nhóm (SO ) bằng cách đặt hệ số 3 vào 4 trước Na SO : 2 4
Al (SO ) + NaOH − − → Al(OH) + 3Na SO 2 4 3 3 2 4
Để cân bằng tiếp số nguyên tử Na ta thêm hệ số 6 vào trước NaOH.
Al (SO ) + 6NaOH − − → Al(OH) + 3Na SO 2 4 3 3 2 4
Cuối cùng thêm hệ số 2 trước Al(OH) để đảm bảo cân bằng 3
số nguyên tử Al và nhóm (OH), khi đó phương trình hoá học được thiết lập:
Al (SO ) + 6NaOH → 2Al(OH) + 3Na SO 2 4 3 3 2 4 30
d) CaCO + HCl − − → CaCl + CO + H O 3 2 2 2
Ta thấy trước phản ứng có 1 nguyên tử H; 1
nguyên tử Cl trong phân tử HCl; Sau phản ứng
có 2 nguyên tử Cl trong CaCl ; 2 nguyên tử H 2
trong H O. Để cân bằng số nguyên tử H và Cl ta 2
thêm hệ số 2 trước HCl.
CaCO + 2HCl → CaCl + CO + H O 3 2 2 2
Kiểm tra lại thấy các nguyên tử đã được cân 31
bằng, phương trình hoá học được hoàn thiện.
2. Ý NGHĨA CỦA PHƯƠNG TRÌNH HÓA HỌC 4Al + 3O t0 2Al O 2 2 3
• Trong PTHH có mấy nguyên tử P tác d C ụ ó n 4 g n v gớ u i y m ê ấ n y t p ử h A â l n tử O , 2 tác t ạ d o ụ r n a g m v ấ ới y 3 p h p â h n â nt ử t P ử OO, 2 ? 2 5
tạo ra 2 phân tử Al O 2 3
Tỉ lệ này chính là
ý nghĩa gì trong PTHH ?
2. Ý NGHĨA CỦA PHƯƠNG TRÌNH HÓA HỌC
* PTHH cho biết:- Phương trình hóa học cho biết trong PƯHH,
lượng các chất tham gia phản ứng và các chất sản Ví dụ:
phẩm tuân theo một tỷ lệ xác định 4Al + 3O t0 2Al O 2 2 3 Số Số ng ng uyên uyên tử tử Al Al : số p : số hân phân tử tử O O : : số ph số p ân tử hân tử Al Al O O = = ? 2 2 3 4 : 3 : 2 2 2 3
Hiểu là: Cứ 4 nguyên tử P tác dụng với 5 phân tử O tạo ra 2 2 phân tử Al O 2 3
- Tỉ lệ các chất trong pthh, từng cặp chất: Vd: Trong PTHH sau: 4Al + 3O t0 2Al O 2 2 3 Tỉ lệ: 4 3 2
Số nguyên tử Al : số phân tử O : 2 4 : 3 =
Số nguyên tử Al : số phân tử Al O : 4 : ? 2 2: 1 2 3 =
Số Phân tử O : số phân tử Al O : 3 : 2 2 2 3 =
Trong PTHH trên, thử nghĩ xem còn có tỉ lệ cặp chất nào nữa ? Bài Tập Trả lời
1.- Sơ đồ của phản ứng hoá học khác với phương trình hoá
học ở điểm: sơ đồ hoá học chưa cho biết tỉ lệ về số nguyên
tử hoặc số phân tử giữa các chất trong phản ứng.
- Ý nghĩa của phương trình hoá học: Phương trình hoá học
cho biết trong phản ứng hoá học, lượng các chất tham gia
phản ứng và các chất sản phẩm tuân theo một tỉ lệ xác định. 2. Ta có bảng sau: Nguyên tử/ nhóm Na (CO ) Ba (OH) 3 nguyên tử Trước phản ứng 2 1 1 2 (số lượng) Sau phản ứng (số 1 1 1 1 lượng)
Như vậy để cân bằng số nguyên tử Na và nhóm (OH), chỉ cần thêm hệ số 2 trước
NaOH. Khi đó phương trình hoá học cũng đã được thiết lập:
Na CO + Ba(OH) → BaCO + 2NaOH 2 3 2 3
Ta có tỉ lệ: Số phân tử Na CO : Số phân tử Ba(OH) : Số phân tử BaCO : Số phân 2 3 2 3 tử NaOH = 1 : 1 : 1 : 2. 3.
Phương trình hoá học: 4Fe + 3O → 2Fe O 2 2 3 •Ta có tỉ lệ:
•Số mol Fe : Số mol O : Số mol Fe O = 4 : 3 : 2. 2 2 3
•Từ tỉ lệ mol ta xác định được tỉ lệ khối lượng các chất:
•Khối lượng Fe : Khối lượng O : Khối lượng Fe O 2 2 3
•= (56 . 4) : (32 . 3) : (160 . 2) = 7 : 3 : 10.
•Vậy cứ 7 gam Fe phản ứng hết với 3 gam O tạo ra 10 gam 2 Fe O . 2 3
•Do đó từ 5,6 gam Fe có thể tạo ra tối đa: gam gỉ sắt. Luyện tập – Vận dụng
• Bài tập : Điền từ hay cụm từ thích hợp vào chỗ trống:
• “Phản ứng hoá học được biểu diễn bằng ....(1).... trong
đó có ghi công thức hoá học của các ....(2).... và Sản
phẩm. Trước mỗi công thức hoá học có thể có ....(3)...
(trừ khi bằng 1 thì không ghi) để cho số nguyên tử của
mỗi nguyên tố đều bằng nhau.
• Từ phương trình hoá học rút ra được tỉ lệ số .... (4)....,
số phân tử của các chất trong phản ứng ....(5).... này
đúng bằngTỉ lệ của hệ số trước công thức hoá học của
các ....(6).... tương đương. • Hướng dẫn giải 1. Phương trình hoá học 2. Chất tham gia 3. Hệ số 4. Nguyên tử 5. Tỉ lệ 6. Chất
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 8
- Phụ lục 1: GÓC PHÂN TÍCH
- Slide 10
- PHỤ LỤC 2: GÓC TRẢI NGHIỆM
- PHIẾU SỐ 2
- PHIẾU SỐ 3
- Slide 14
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Bài Tập
- Trả lời
- Slide 37
- Slide 38
- Slide 39
- Luyện tập – Vận dụng
- Hướng dẫn giải
- Slide 42
- Slide 43




