















Preview text:
KHỞI
Các loại quả trong hình dưới ĐỘNG
đây có đặc điểm gì giống nhau? Quả cà na Quả me Quả khế
Vì sao các loại quả trên lại có đặc điểm giống nhau đó? Chương II
MỘT SỐ HỢP CHẤT THÔNG DỤNG Bài 8: ACID NỘI DUNG BÀI HỌC I-Khái niệm II-Tính III-Một số acid chất hóa acid thông học dụng Bài 8: ACID I-Khái niệm acid
Tên một số acid, công thức hóa học và dạng tồn tại của acid trong dung dịch Dạng tồn tại của acid Công trong dung dịch Tên acid thức Cation Anion (ion hóa học (ion dương) âm) Gốc acid Hydrochloric HCl H+ Cl- acid Nitric acid HNO - 3 H+ NO3 Qua Nhận sát xé t b
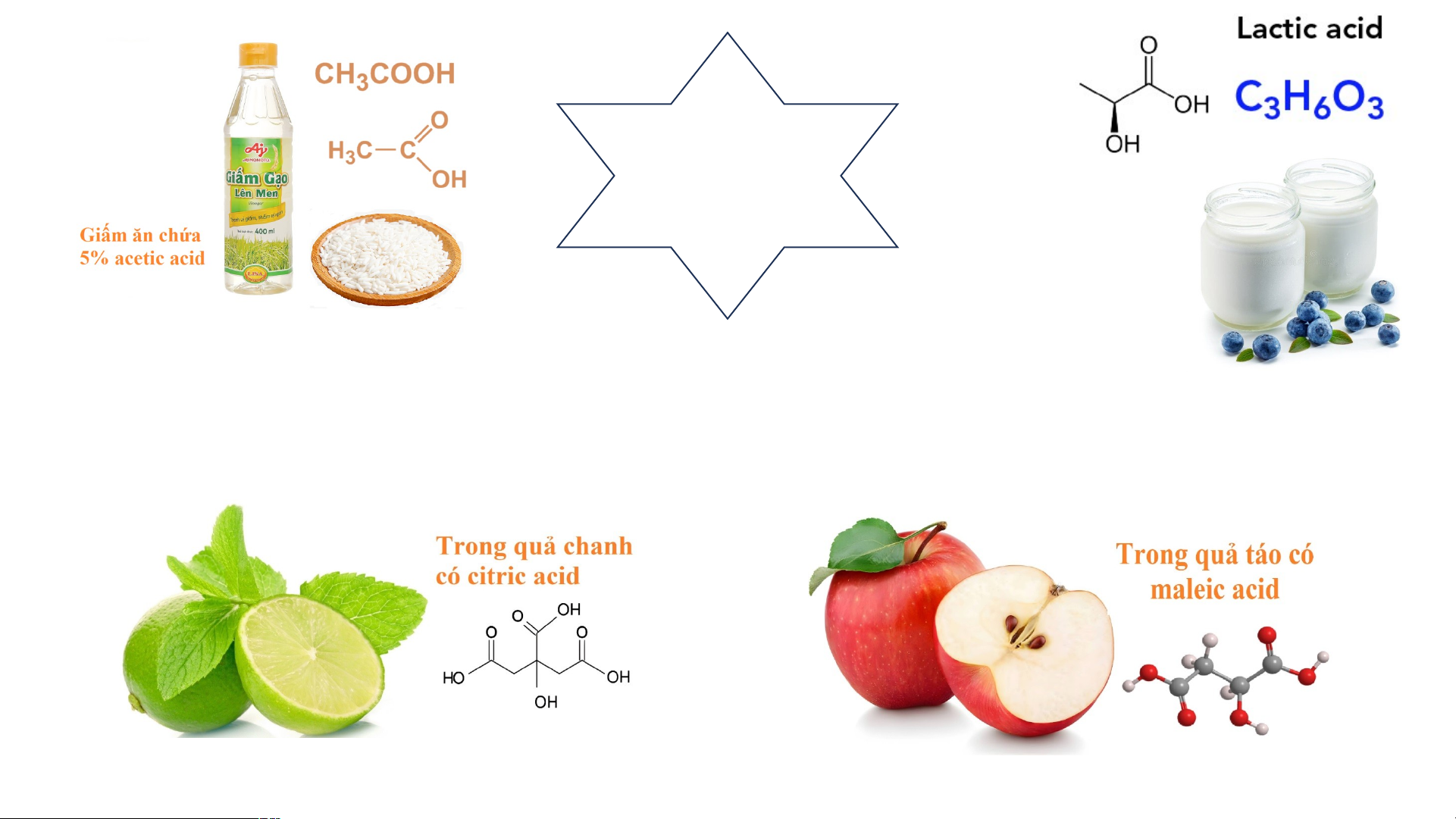
: ảng và cho biết: Sulfuric acid H SO 2- 2 4 H+ SO4 1. 1 C . Côn ông t thức h c hóa óa h học c củ của cá các c a aci cid có đ đều ặ c đi có n ể g m u g yê ì n g t iố ử ng 2. n 2 h D h ya . D d ạ u r n ? g og t e ồn ồ n. n t ạ tại củ của acid tr t on r g d dung d dịch ch có đ đều ặc c đ ó i iểm on H g + ì chung? ACID Trong sữa chua có lactic acid
Từ acid xuất phát từ tiếng
Latin là acidus – nghĩa là vị chua Bài 8: ACID I-Khái niệm acid
- Công thức phân tử Acid là những của acid hợp chất trong H A n Dạng tổng quát: phân tử có Trong đó: nguyên tử + A là gốc acid. hydrogen liên + n là chỉ số của kết với gốc acid. nguyên tử H. Khi tan trong nước, acid tạo ra ion H+
Acid tạo ra ion H+ theo sơ đồ sau:
H A nH+ + An− n Ví dụ HCl H Cl
Hydrochloric acid ion hydrogen ion chloride 2 H SO 2H SO 2 4 4
Sulfuric acid ion hydrogen ion sulfate Bài 8: ACID
- Phân loại và tên gọi của acid Phân loại Tên gọi Ví dụ
Hydro + tên phi kim + ic + H S: hydrosulfuric acid Acid không có oxygen 2 acid HCl: hydrochloric acid Acid chứa Tên phi kim + ic + acid H SO : sulfuric acid 2 4 Acid có nhiều oxygen H CO : carbonic acid 2 3 oxygen Acid chứa ít H SO : sulfurous acid Tên phi kim + ous + acid 2 3 oxygen HNO : nitrous acid 2
Ví dụ: Phân tử nào trong các phân tử sau đây là acid và có thể tạo ra
ion H+ khi tan trong nước: NaCl, HNO , HClO ? Viết sơ đồ tạo thành 3 4 ion H+. Hướng dẫn giải
Các phân tử là acid và có thể tạo ra ion H+ khi tan trong nước: HNO , HClO 3 4 Sơ đồ tạo thành ion H+: HNO H NO 3 3 HClO H ClO 4 4 Bài 8: ACID
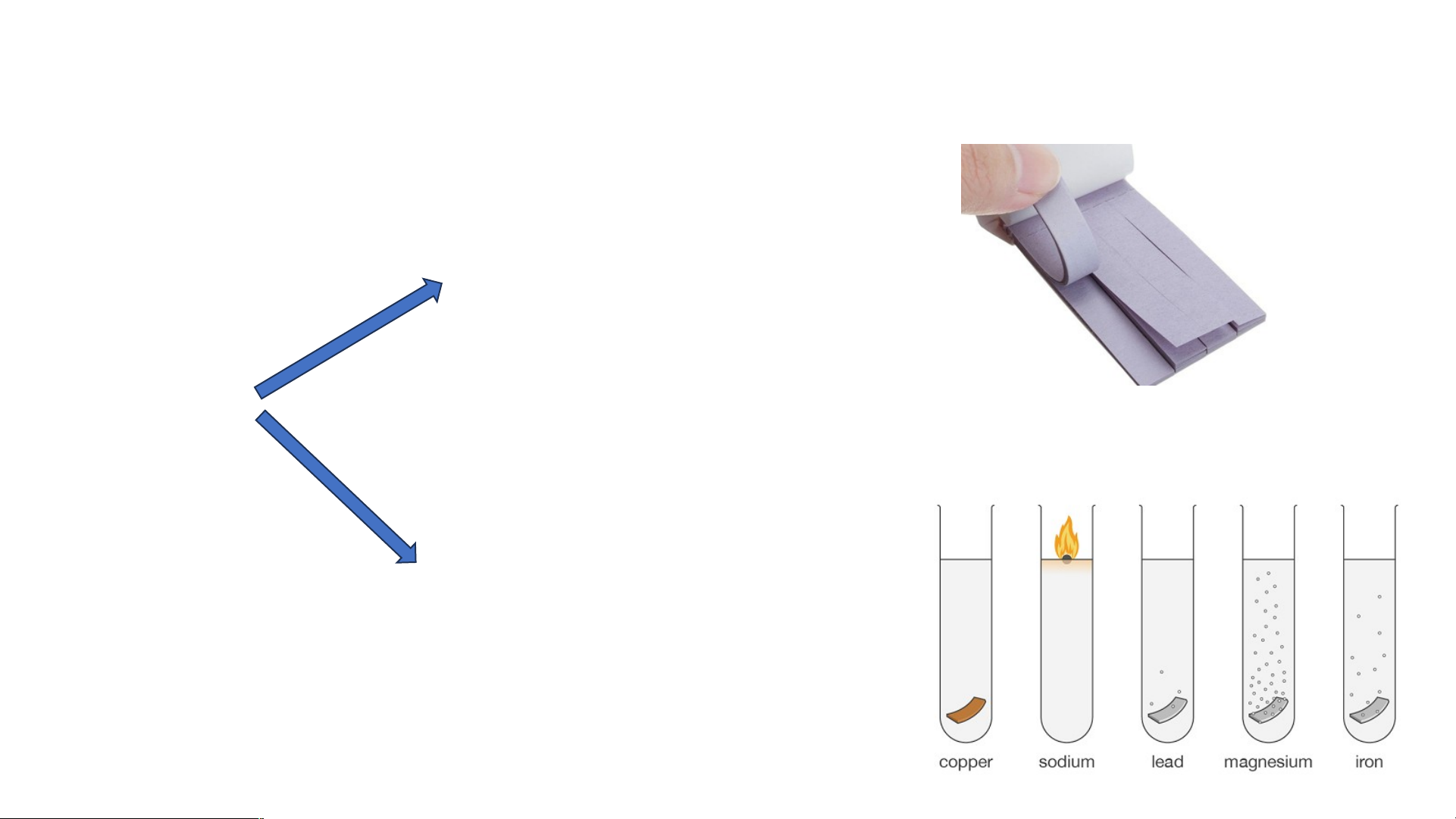
II-Tính chất hóa học Làm đổi màu chất chỉ thị Aci d Tác dụng với kim loại
1. Acid làm đổi màu chất chỉ thị Quan sát thí nghiệm và cho biết: Dung dịch acid làm quỳ tím chuyển màu như thế nào?
Kết luận: Dung dịch acid làm đổi màu giấy quỳ từ tím sang đỏ (hồng)
2. Acid tác dụng với kim loại Quan sát thí nghiệm: Zinc + dd HCl
Mô tả hiện tượng xảy ra và viết phương trình hóa học.
Hiện tượng: Zn tan dần trong dung dịch HCl, có khí không màu thoát ra.
Phương trình hóa học: Zn + 2HCl ZnCl + H 2 2
2. Acid tác dụng với kim loại
Kết luận: Acid tác dụng với kim loại sinh ra muối và giải phóng khí.
Phương trình tổng quát: kim loại + dd acid muối + H2 (HCl, H SO loãng) 2 4
Lưu ý: - Không phải tất cả các kim loại đều tác dụng được với acid.
- HNO , H SO đặc tác dụng với kim loại nhưng không giải 3 2 4 phóng H . 2
- Al, Cr, Fe không tác dụng với acid HNO và H SO đặc nguội 3 2 4
Ví dụ: Cho dung dịch H SO loãng tác dụng với kim loại Mg 2 4
và Al. Viết phương trình hóa học của phản ứng xảy ra.
Phương trình hóa học xảy ra: Mg H SO MgSO H 2 4 4 2
2Al 3H SO Al (SO ) 3H 2 4 2 4 3 2 Bài 8: ACID
III-Một số acid thông dụng 01 02 03 Sulfuric acid Hydrochloric Acetic acid acid 1. Sulfuric acid
Chất lỏng, Sulfuric acid là một hóa ch T ấ an t q vô ua hạn n t rọng được sánh như dầu trong nước và
sử dụng nhiều trong các ngành công nghiệp ăn tỏa nhiều nhiệt Không màu Không bay hơi Nặng gấp hai lần nước
- Lưu ý: Tuyệt đối không M t ộ ự t ý số pha ứng dụloã ng n củg a dung sulfuric dịch sulfuric acid đặc. acid
Tính háo nước của H SO đặc 2 4 2. Hydrochloric acid Hydrochloric C aci hấ d t l đư ỏ ợ ng c s , ử dụng trong các n H g y à d nh ro cô chlng o n ri g c hi
acid có trong dạ dày đóng k ệ hô p ng
vai trò quan trọng trong quá trình tiêu màu
hóa như: thúc đẩy quá trình tiêu hóa thức
ăn; kích thích ruột nong và tụy sản xuất
ra các enzyme tiêu hóa để phân giải chất
béo, protein,…; tiêu diệt các vi khuẩn có
hại từ bên ngoài đi vào dạ dày;… Khi
nồng độ acid trong dạ dày lớn hơn hoặc nhỏ hMộ ơnt số q ứ uáng dụng mức của cần thyd hiếro t chl đềor u ic gây ảnh hưởn a g ci đ d
ến chức năng tiêu hóa của dạ dày
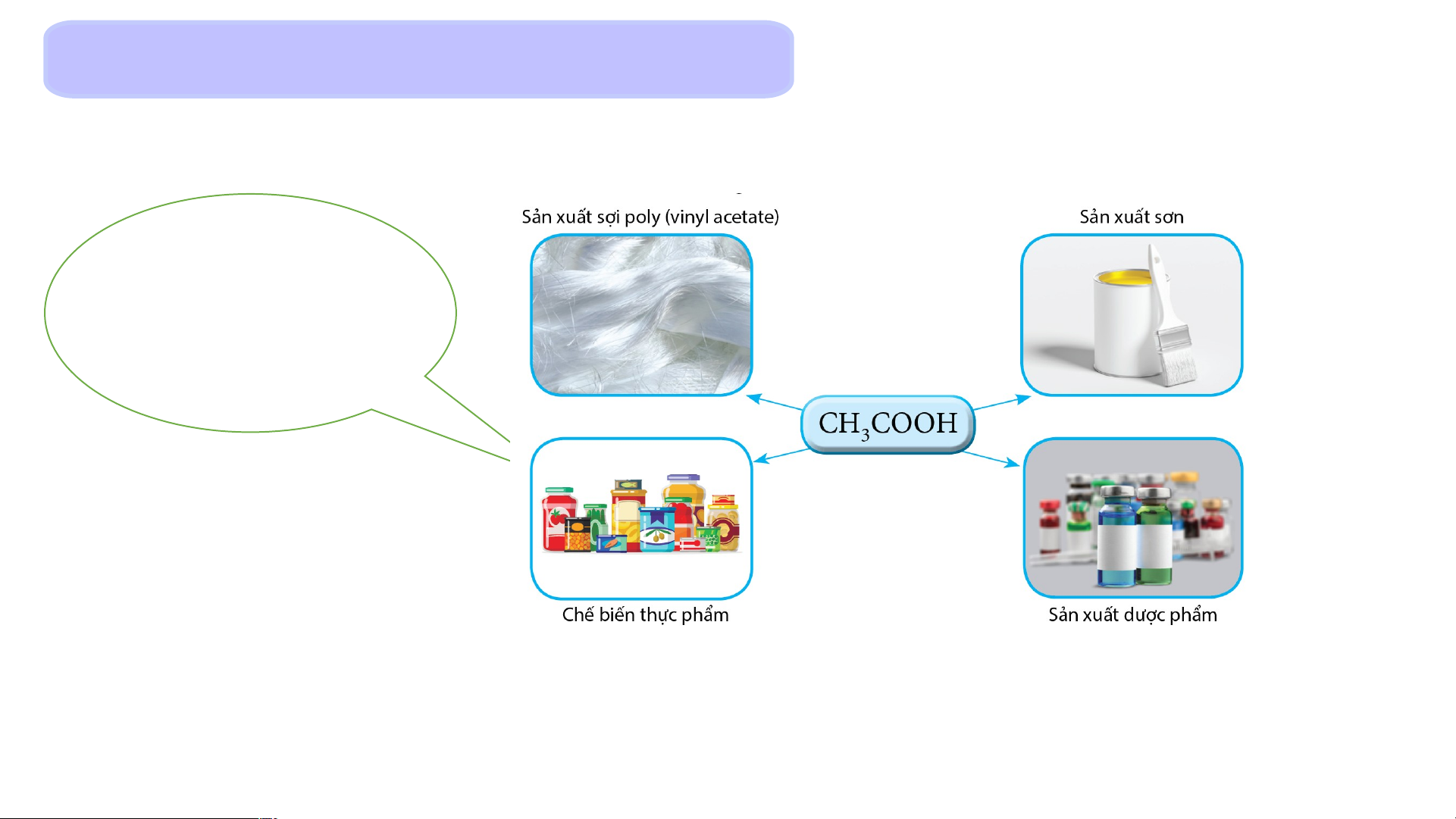
nói riêng và sức khỏe nói chung. 3. Acetic acid Giấm ăn chứa acetic acid với Chất lỏng nồng độ 2 – không 5% màu Có vị chua
Một số ứng dụng của acetic acid LUYỆN TẬP
Câu 1: Trong giấm ăn có chứa chất X với nồng độ 2 – 5%. Chất X là A hydrochloric acid. B acetic acid. C sulfuric acid. D nitric acid. Đáp án đúng: B
Câu 2: Công thức của phosphoric acid là A H SO . 2 4 B HCl. C H PO . 3 4 D H CO . 2 3 Đáp án đúng: C
Câu 3: Dung dịch chất nào sau đây không làm quỳ tím chuyển sang màu đỏ? A H SO . 2 4 B HCl. C H PO . 3 4 D KNO . 3 Đáp án đúng: D
Câu 4: Dãy gồm các kim loại phản ứng được với dung dịch HCl là: A Cu, Mg, Na. B Fe, Zn, Mg. C Al, Fe, Ag. D Fe, Cu, Ba. Đáp án đúng: B
Câu 5: Cho 2,4 gam Mg tác dụng với dung dịch
hydrochloric acid dư, thu được V lít khí H (đkc). Giá trị 2 của V là A 2,4790. B 4,9580. C 3,7185. D 6,1975. Đáp án đúng: A VẬN DỤNG
Trong một số loại thực phẩm (giấm ăn, đồ uống, trái cây
…) có chứa acid. Em hãy làm chất chỉ thị màu từ bắp cải
tím, hoa đậu biếc, hoa chiều tím… sau đó thử tính chất
acid của giấm ăn và một số loại trái cây có vị chua (như
cam, chanh…). Quay video quá trình thực hiện và nộp
sản phẩm qua mail hoặc zalo của GV.
* Hướng dẫn làm chất chỉ thị màu từ bắp cải tím: Chuẩn
bị bắp cải tím, xắt nhỏ và cho vào máy xay sinh tố, xay
nhuyễn, lọc lấy phần nước lọc. Dùng dung dịch nước lọc làm chất chỉ thị màu.
Document Outline
- Slide 1
- Slide 2
- NỘI DUNG BÀI HỌC
- I-Khái niệm acid
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- II-Tính chất hóa học
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- III-Một số acid thông dụng
- 1. Sulfuric acid
- Slide 17
- 2. Hydrochloric acid
- 3. Acetic acid
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25




