




















Preview text:
Thứ ba 2023 Bài 8: ACID Hình 1 Hình 2 Hình 3 Hình 4
Tại sao nước quả chanh, giấm ăn (như giấm gạo) … đều
có vị chua và được dùng để loại bỏ cặn trong dụng cụ đun nước?
Để giải thích được các câu hỏi đó, chúng ta cùng
tìm hiểu về loại hợp chất Acid, nội dung thứ nhất
là khái niệm về acid. 1. khái niệm acid H+ S Cl- 𝑵𝑶− H+ 𝟑 H+ H+ Hydroch loric acid - HCl Sulfuric acid – H SO Nitric acid – HNO 2 4 3
Các acid tan trong nước tạo ra các ion.
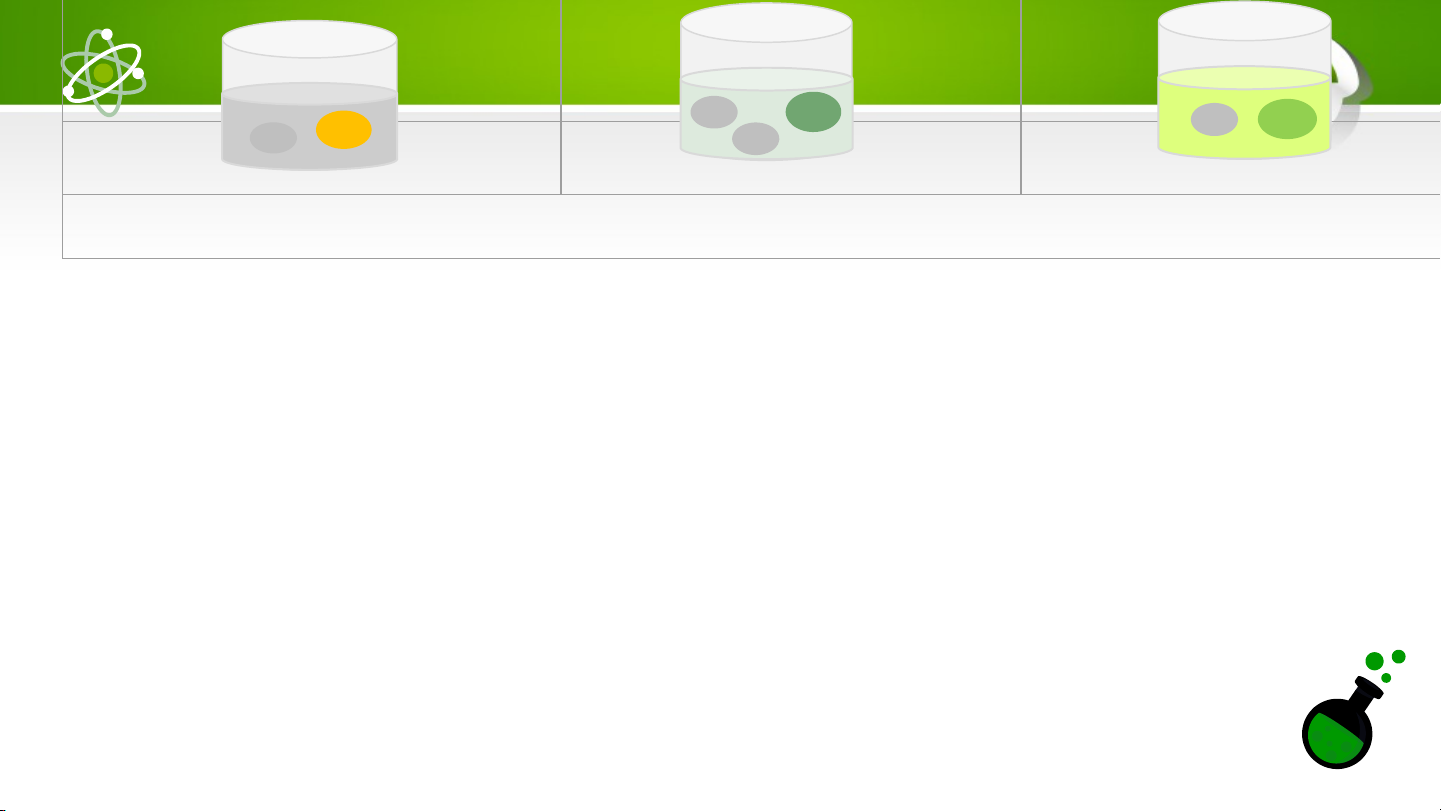
QS hình và b8.1, thảo luận nhóm các yêu cầu vào bảng nhóm:
1. Công thức hóa học của các acid có đặc điểm gì giống nhau?
2. Dạng tồn tại của các acid trong dung dịch có đặc điểm gì chung?
3. Đề xuất khái niệm acid. H+ S
𝑵𝑶−𝟑 H+ HydrochloHr+ic a
Cl- cid - HCl Sulfuric aHc+id – H SO Nitric acid – HNO 2 4 3
Các acid tan trong nước tạo ra các ion.
1. Công thức hóa học của các acid có đặc điểm giống nhau: trong phân
tử đều có nguyên tử H liên kết với gốc acid.
2. Dạng tồn tại của các acid trong dung dịch có đặc điểm chung: đều chứa cation H+ và anion.
3. Đề xuất khái niệm acid: Acid là những hợp chất mà phân tử đều có
nguyên tử H liên kết với gốc acid, khi các acid tan trong nước tạo ra ion H+.
- Kết luận: Acid là những hợp chất mà phân tử
đều có nguyên tử H liên kết với gốc acid, khi
các acid tan trong nước tạo ra ion H+.
- Công thức phân tử của acid: gồm 1 hay nhiều nguyên tử
Hydro liên kết với gốc acid. Dạng tổng quát: H A n
+ n là chỉ số nguyên tử H. + A là gốc acid.
− Acid tạo ra ion H+ theo sơ đồ: Acid
ion H+ + ion âm gốc acid Hydrochloric acid Acetic acid
Hình. Minh hoạ tạo ra ion H+ − Ví dụ: HCl H + + Cl-
Hydrochloric acid Ion hydrogen Ion chloride H SO H+ + SO 2- 2 4 4
Sulfuric acid Ion hydrogen Ion sulfate
Bảng. Tên gọi một số acid và gốc acid tương ứng Acid Tên acid Gốc acid Tên gốc Hóa trị gốc acid acid HCl hydrochloric acid –Cl chloride I H S hydrosulfuric acid =S sulfide II 2 H SO sulfurous acid =SO sulfite II 2 3 3 HNO nitric acid –NO nitrate I 3 3 H SO sulfuric acid =SO sulfate II 2 4 4 H PO phosphoric acid ≡PO phosphate III 3 4 4 CH COOH acetic acid CH COO– acetate I 3 3
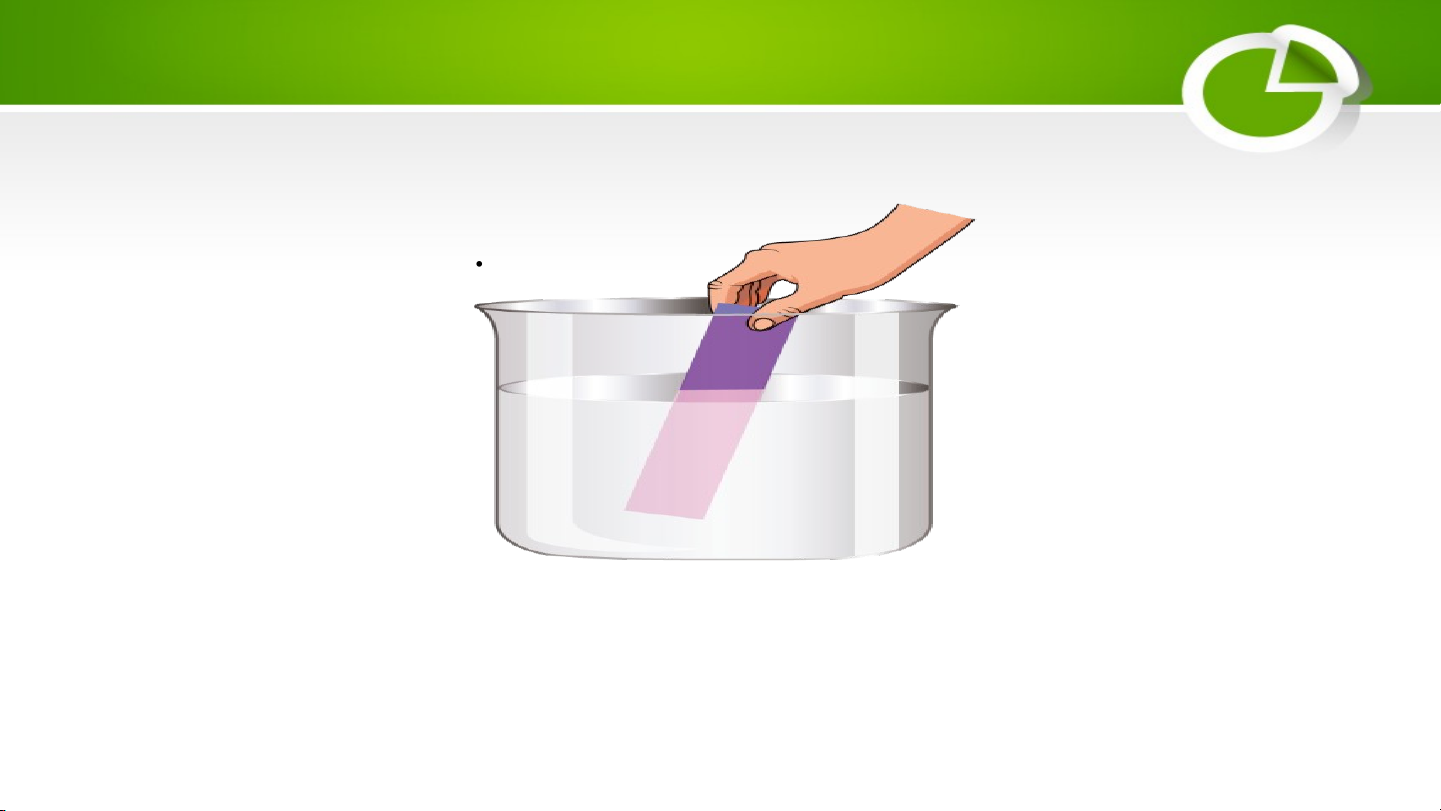
2. Tính chất hóa học của acid a. Đổi màu quỳ tím
Acid thường tan được trong nước, dung dịch acid làm đổi màu quỳ tím sang đỏ.
Hình. Acid làm quỳ tím hoá đỏ
b. Tác dụng với kim loại
− Nhiều kim loại (ngoại trừ Cu, Ag, Au, Pt,…), khi phản ứng với
dung dịch acid sẽ tạo thành muối và giải phóng khí hydrogen(*).
−Dãy hoạt động hóa học một số kim loại:
K, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au. − Sơ đồ chung: Kim loại + Acid Muối + Hydrogen ↑
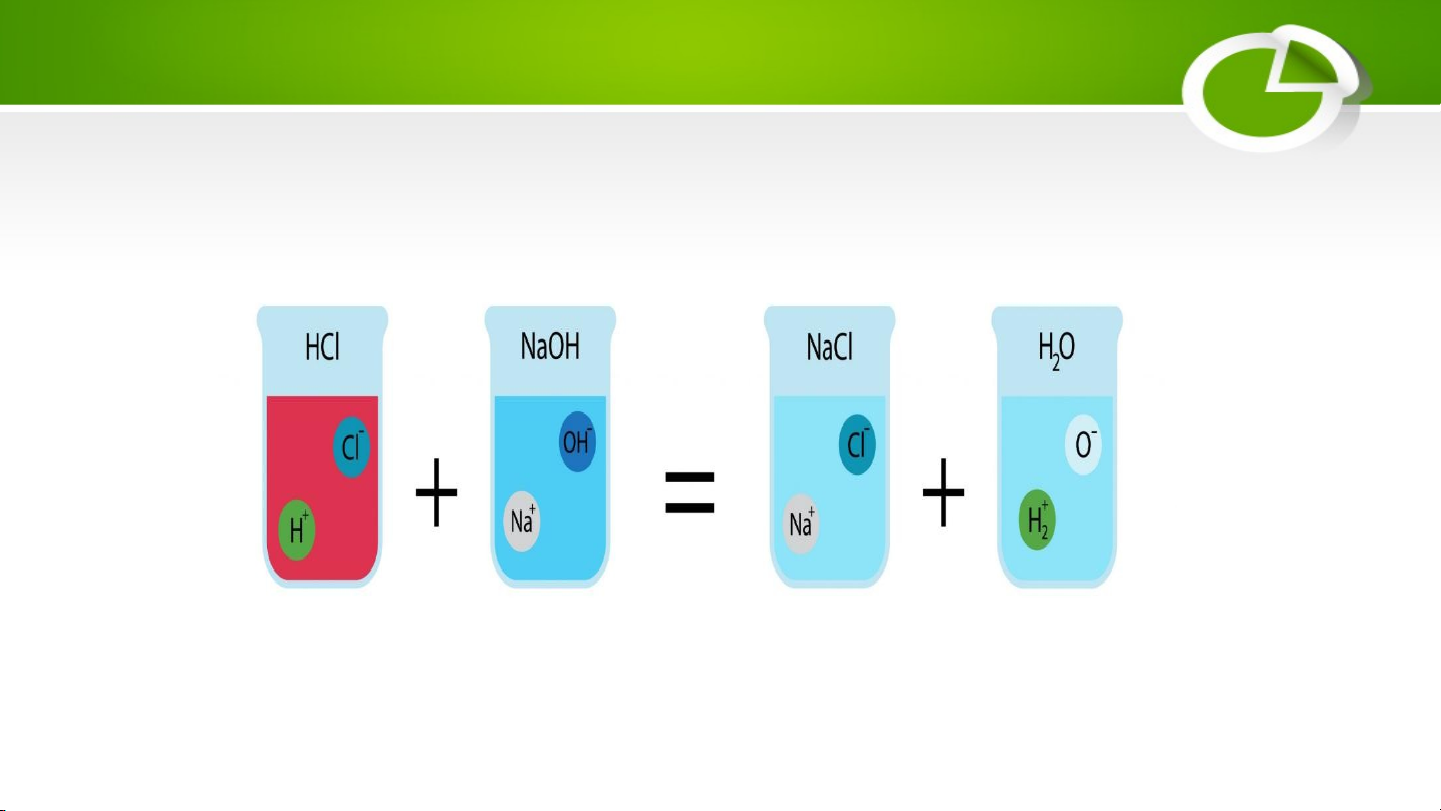
Hình. Minh hoạ phản ứng giữa iron và hydrochloric acid c. Tác dụng với base Acid + Base Muối + Nước
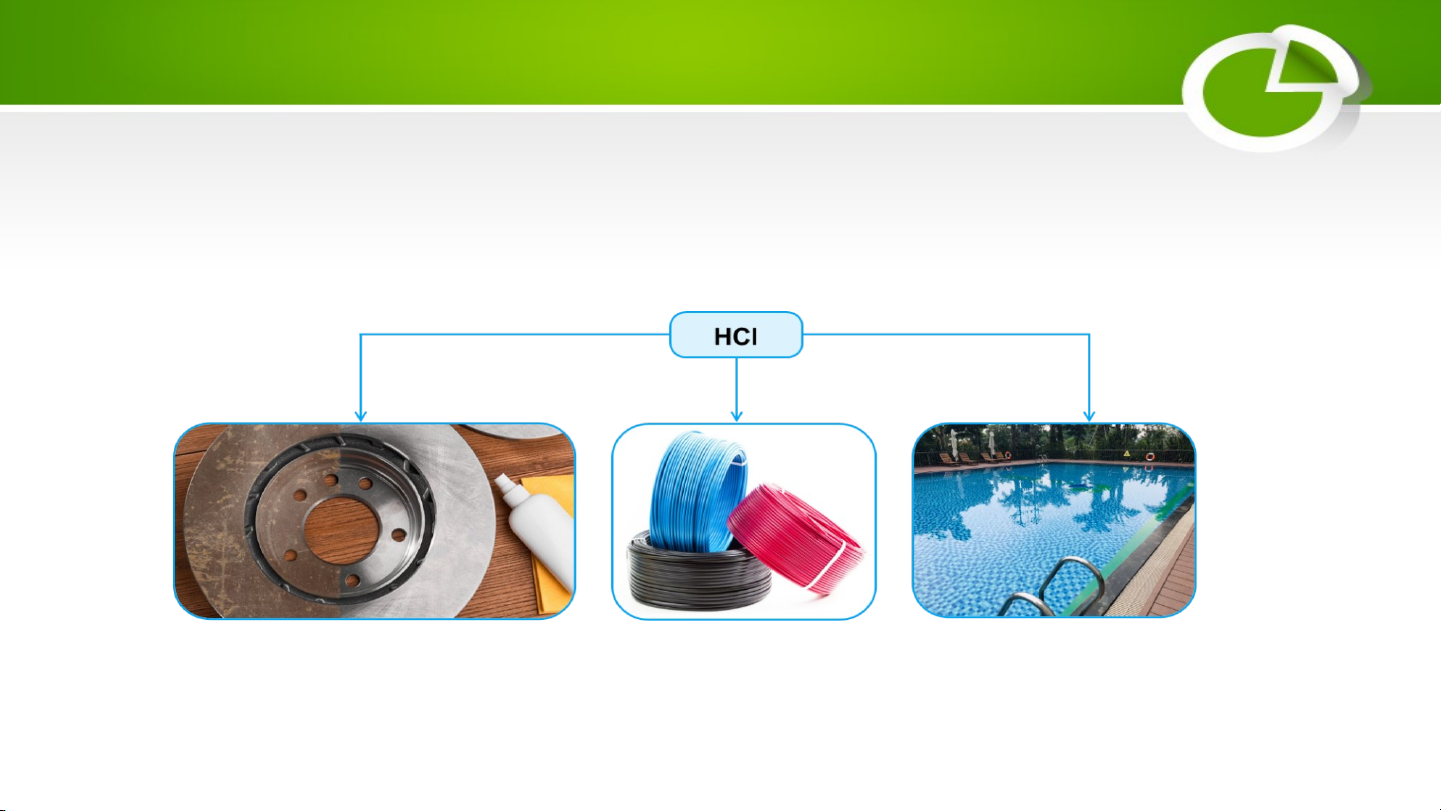
3. Một số acid thông dụng a. Hydrochloric acid (HCl)
− Là chất lỏng không màu.
− Có trong dạ dày của người và động vật giúp tiêu hoá thức ăn.
− Có nhiều ứng dụng nhiều trong các ngành công nghiệp như:
Tẩy gỉ thép Tổng hợp chất hữu cơ Xử lí pH nước bể bơi b. Acetic acid (CH3COOH)
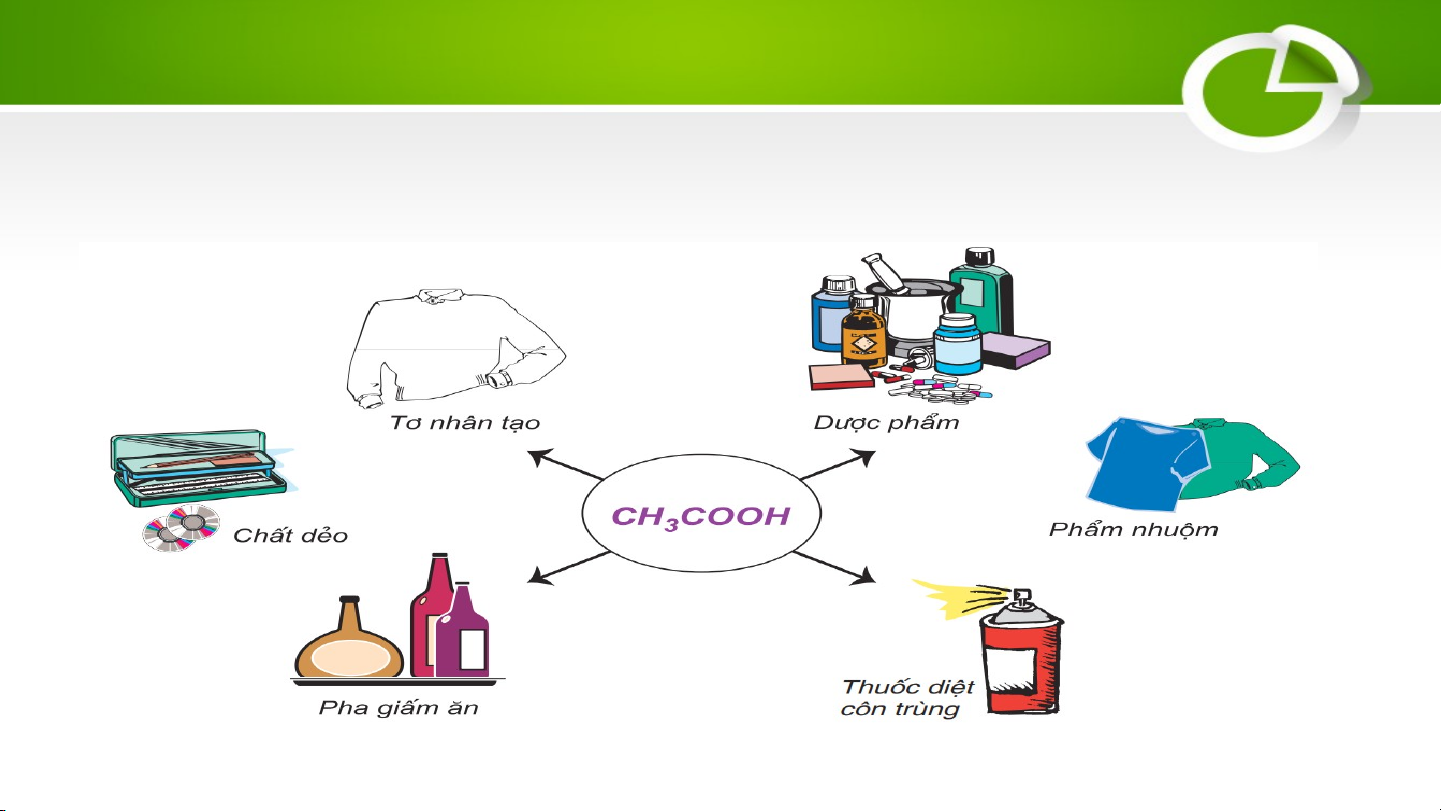
− Là chất lỏng không màu, có vị chua.
− Trong giấm ăn có chứa acetic acid với nồng độ 2 – 5%. c. Sulfuric acid (H SO ) 2 4
− Là chất lỏng không màu, không bay hơi, sánh như dầu ăn, nặng gần gấp hai lần nước.
− Sulfuric acid tan vô hạn trong nước và toả rất nhiều nhiệt.
Lưu ý: Tuyệt đối không tự ý pha loãng dung dịch sulfuric acid đặc.
Hình. Cách pha loãng acid đặc
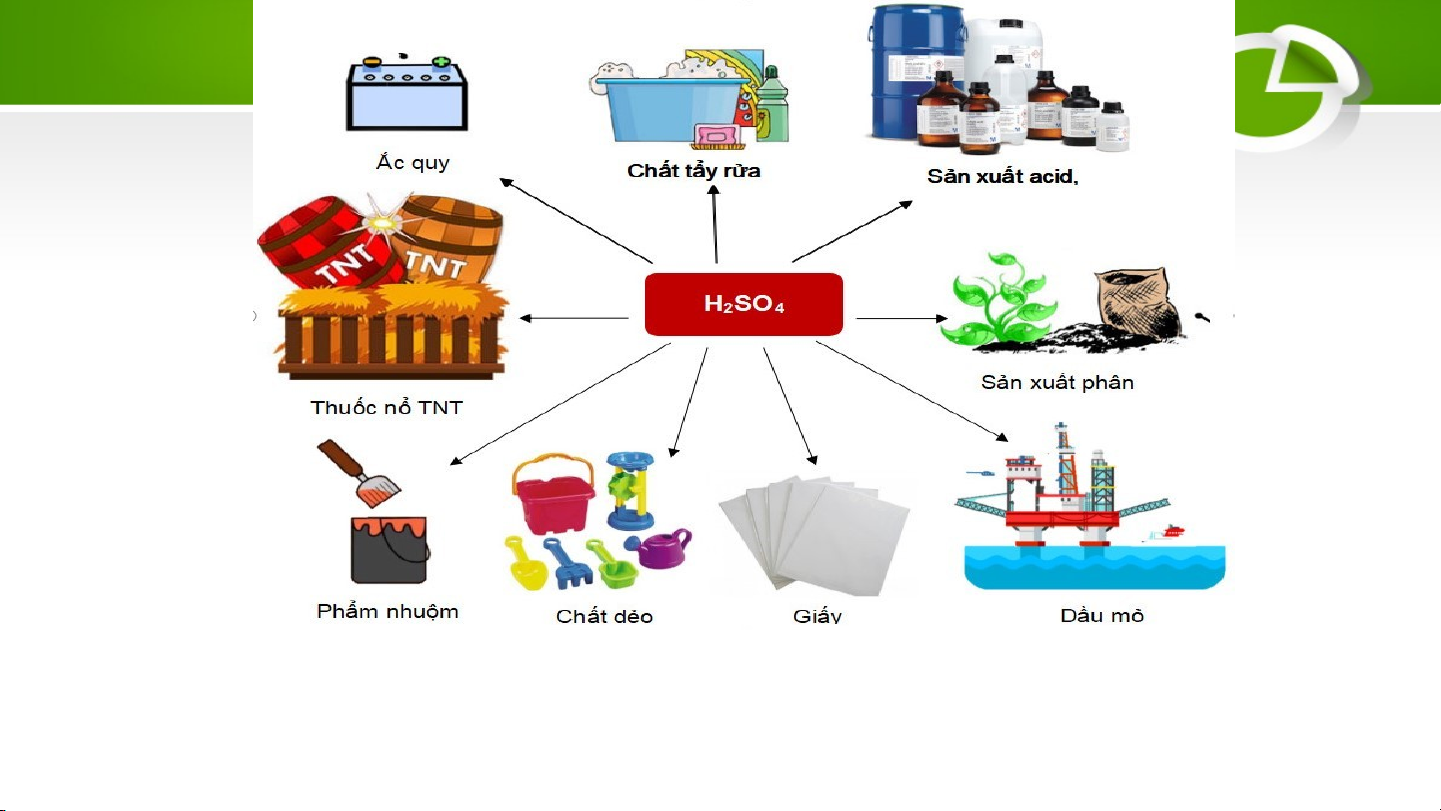
Hình. Một số ứng dụng của sulfuric acid 4. LUYỆN TẬP Câu 1:
Dãy chất gồm công thức hóa học của acid là: Ca(OH) , KOH, Ba(OH) , 2 2 A. B. CaCO , HCl. Cu(OH) . 3 2 H SO , HNO , CaCO , C. 2 4 3 3 D. HCl. ZnO, SO .2 Đáp án: C
Câu 2: Khi nhỏ dung dịch H SO vào giấy quỳ 2 4
tím thì giấy quỳ tím sẽ: A. Hóa đỏ B. Hóa xanh C. Hóa đen D. Không đổi màu Đáp án: A
Câu 3: Dãy gồm các kim loại phản ứng được với dung dịch HCl là: A. Cu, Mg, Na. B. Fe, Zn, Mg. C. Al, Fe, Ag. D. Fe, Cu, Ba Đáp án: B
Câu 4: 13 gam một kim loại hóa trị II phản ứng vừa
đủ với 200 ml dd H SO 1M. Kim loại đó là? 2 4 A. Zn B. Ca C. Fe D. Mg Đáp án: A
Câu 5: Acid nào là hóa chất tiêu thụ nhiều nhất trên thế giới? A. Hydrochloric acid B. Acetic acid C. Sulfuric acid D. Citric acid Đáp án: C
Câu 6: Hydrochloric acid, acetic acid, sulfuric acid
đều có tính chất chung nào sau đây?
A. Đều là chất khí không màu, đều làm quỳ tím hóa đỏ, tác
dụng với một số kim loại tạo muối và H .2
B. Đều là chất lỏng không màu, đều làm quỳ tím hóa đỏ, tác
dụng với một số kim loại tạo muối và H .2
C. Đều là chất lỏng không màu, đều làm quỳ tím hóa xanh, tác
dụng với một số kim loại tạo muối và H .2
D. Đều là chất khí không màu, đều làm quỳ tím hóa xanh, tác
dụng với một số kim loại tạo muối và H .2 Đáp án: B
Câu 7: Acid nào có trong dạ dày của người? A. Hydrochloric acid B. Acetic acid C. Sulfuric acid D. Maleic acid Đáp án: A
Câu 8: Trong giấm ăn có chứa acetic acid với nồng độ bao nhiêu? A. 1 - 2% B. 1 - 3% C. 2 - 4% D. 2 - 5% Đáp án: D BTVN
1. Học thuộc lý thuyết bài 8
2. Hoàn thành trắc nghiệm: 1 đến 50. THANKS!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- 1. khái niệm acid
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- 2. Tính chất hóa học của acid
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- 3. Một số acid thông dụng
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- 4. LUYỆN TẬP
- D.
- D.
- D.
- D.
- D.
- Slide 27
- D.
- D.
- Slide 30
- THANKS!




