








Preview text:
BỘ SÁCH CÁNH DIỀU
GIÁO VIÊN: TRƯƠNG THẾ THẢO
BÀI TẬP CHỦ ĐỀ 2
BÀI TẬP CHỦ ĐỀ 2 Acid: HCl, H SO 2 4 Base: Fe(OH) , KOH 2 Kiềm: KOH
BÀI TẬP CHỦ ĐỀ 2 - Muối: CuSO , MgCl , Na CO 4 2 2 3 - Oxide base: CaO - Oxide acid: SO2 -Tên gọi các muối: + CuSO : Copper sulfate. 4 + MgCl : Magnesium chloride. 2 + Na CO : Sodium Carbonate. 2 3
BÀI TẬP CHỦ ĐỀ 2 a) dung dịch NaOH. SO + 2NaOH → Na SO + H O 2 2 3 2 NaOH + HCl → NaCl + H O 2
CuSO + 2NaOH → Cu(OH) + Na SO 4 2 2 4 b) dung dịch H SO loãng. 2 4 CuO + H SO → CuSO + H O 2 4 4 2 Mg(OH) + H SO → MgSO + 2H O 2 2 4 4 2 Fe + H SO → FeSO + H O 2 4 4 2
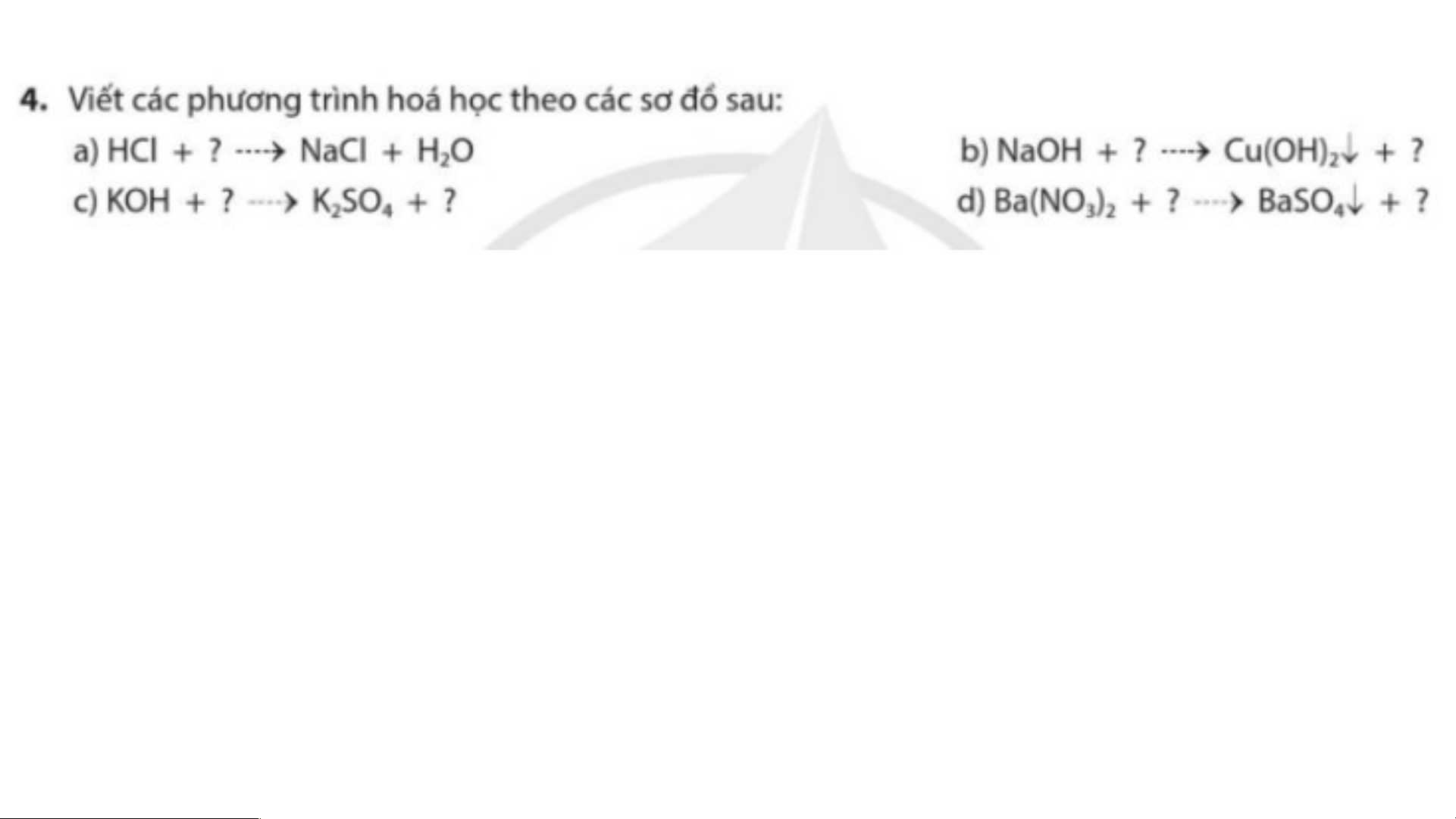
BÀI TẬP CHỦ ĐỀ 2 a) HCl + NaOH → NaCl + H O 2
b) 2NaOH + CuSO → Cu(OH) ↓ + Na SO 4 2 2 4
c) 2KOH + H SO → K SO + 2H O 2 4 2 4 2
d) Ba(NO ) + H SO → BaSO ↓+ 2HNO 3 2 2 4 4 3
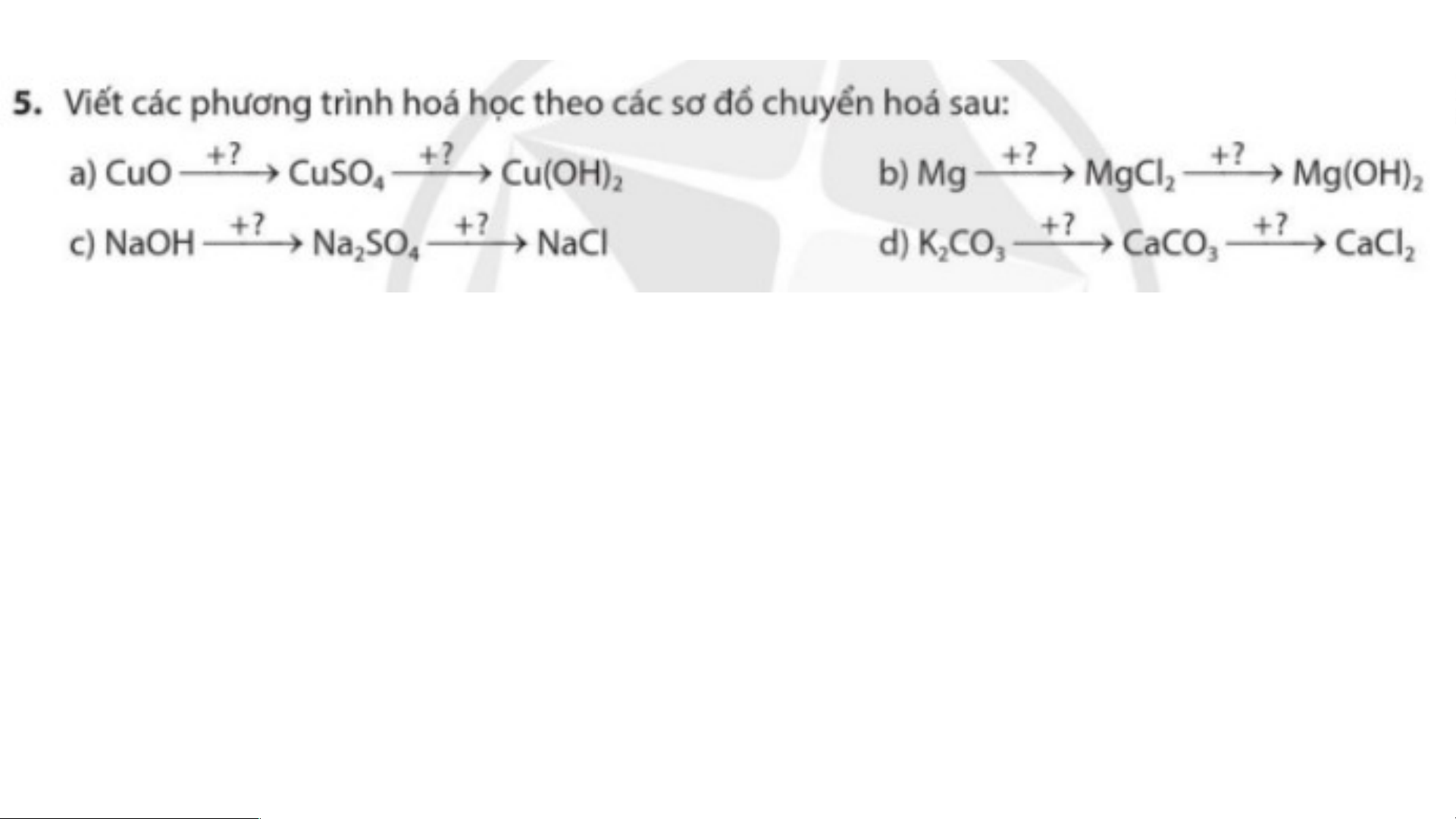
BÀI TẬP CHỦ ĐỀ 2 a) CuO+H SO → CuSO +H O 2 4 4 2 CuSO +2NaOH→Cu(OH) +Na SO 4 2 2 4 b) Mg + 2HCl → MgCl + H 2 2
MgCl + 2NaOH → Mg(OH) + 2NaCl. 2 2
c) 2NaOH + H SO → Na SO + 2H O 2 4 2 4 2
Na SO + Ba(OH) → 2NaCl + BaSO . 2 4 2 4 d) K CO + CaCl → CaCO + 2KCl 2 3 2 3
CaCO + 2HCl → CaCl + CO + H O 3 2 2 2
BÀI TẬP CHỦ ĐỀ 2
a) Phương trình hoá học của phản ứng xảy ra: Na SO + BaCl → BaSO ↓ + 2NaCl 2 4 2 4 b) n = 0,1 . 0,5 = 0,05 (mol) Na2SO4 Theo PTHH: n =n = 0,05 (mol) BaSO4 Na2SO4 Vậy m
= 0,05 × (137 + 32 + 16 × 4) = 11,65 (gam). BaSO4 c) Theo PTHH: n =n = 0,05 (mol) BaCl2 Na2SO4 Đổi 50 mL = 0,05 lít.
- Nồng độ mol của dung dịch BaCl là: 2 C =n: V=0,05 : 0,05=1M M(BaCl2)
BÀI TẬP CHỦ ĐỀ 2 MgO + 2HCl → MgCl + H O 2 2 Mg(OH) + 2HCl → MgCl + 2H O 2 2 2
MgSO + BaCl → MgCl + BaSO ↓. 4 2 2 4
BÀI TẬP CHỦ ĐỀ 2
Cho vào mỗi ống nghiệm một mẩu quỳ tím:
+ Quỳ tím chuyển sang màu xanh → dung dịch NaOH.
+ Quỳ tím chuyển sang màu đỏ → dung dịch HCl.
+ Quỳ tím không chuyển màu → dung dịch NaCl.
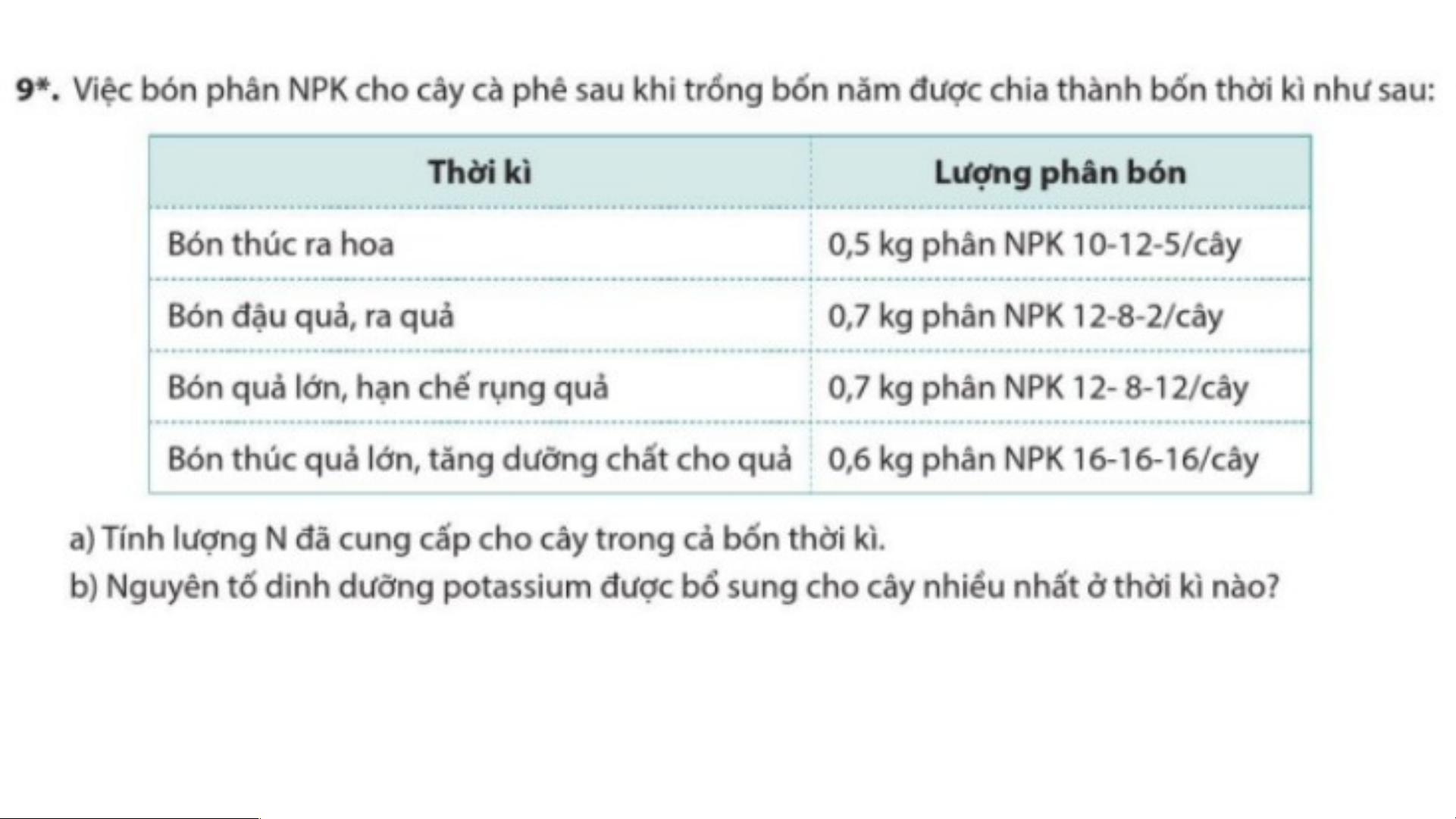
BÀI TẬP CHỦ ĐỀ 2 a) Lượng N cung cấp cho
cây trong thời kì bón thúc ra hoa là: 0,5.10% = 0,05 (kg)
Lượng N cung cấp cho cây
trong thời kì bón đậu quả, ra quả là: 0,7.12% = 0,084 (kg)
- Lượng N cung cấp cho cây trong thời kì bón quả lớn, hạn chế rụng quả là: 0,7.12% = 0,084 (kg)
- Lượng N cung cấp cho cây trong thời kì bón thúc quả lớn, tăng dưỡng chất cho
quả là: 0,6.16% = 0,096 (kg)
=> Lượng N đã cung cấp cho cây trong cả bốn thời kì là:
0,05 + 0,084 + 0,084 + 0,096 = 0,314 (kg).
BÀI TẬP CHỦ ĐỀ 2
b) Nguyên tố dinh dưỡng potassium được bổ sung cho cây nhiều nhất ở thời kì bón
thúc quả lớn, tăng dưỡng chất cho quả.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12




