































































































Preview text:
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC TÂY ĐÔ GIÁO TRÌNH HÓA SINH
(Dùng cho sinh viên Cao đẳng Dược) Chủ biên:
ThS. Huỳnh Ngọc Trung Dung DS. Nguyễn Thanh Huy Năm 2016
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC TÂY ĐÔ GIÁO TRÌNH HÓA SINH
(Dùng cho sinh viên Cao đẳng Dược) Chủ biên:
ThS. Huỳnh Ngọc Trung Dung DS. Nguyễn Thanh Huy Năm 2016 LỜI MỞ ĐẦU
Hóa sinh học là khoa học nghiên cứu thành phần hóa học, cấu trúc và tính chất
các hợp phần của tế bào, nghiên cứu quá trình trao đổi chất và năng lượng trong cơ thể
sinh vật, hay nói khác là khoa học nghiên cứu cơ sở hóa học của sự sống.
Với mục tiêu cung cấp cho sinh viên kiến thức ở mức độ cơ chế phân tử của các
quá trình sống: cấu tạo hóa học và tính chất của các sinh chất cùng các con đường
chuyển hóa các chất này trong cơ thể sống như: cơ chế xúc tác của enzym; sự hô hấp
mô bào; các nguồn cung cấp và dự trữ, các con đường chuyển hóa năng lượng; các giai
đoạn trung gian trong sự thoái hóa và tổng hợp các chất glucid, lipid, protein và acid
nucleic; sự bảo tồn và truyền đạt thông tin di truyền...
Với các kiến thức trên sinh viên dễ dàng tiếp thu và hiểu sâu hơn các môn học
cơ sở khác và các môn chuyên ngành có liên quan. Bên cạnh ý nghĩa thực tiễn đó, hóa
sinh cũng giúp tạo nên ở người học một thế giới quan khoa học duy vật biện chứng.
Vì lần đầu biên soạn, mặc dù đã rất cố gáng nhưng chắc chắn còn nhiều thiếu
sót, kinh mong quý thầy cô, bạn đồng nghiệp đóng góp, xây dựng ý kiến để giáo trình được hoàn thiện hơn. Xin trân trọng cám ơn! MỤC LỤC
MỤC LỤC ........................................................................................................................ i
Chương 1. ĐẠI CƯƠNG VỀ HÓA SINH HỌC ............................................................. 1
1. ĐỊNH NGHĨA ..................................................................................................... 1
2. ĐỐI TƯỢNG NGHIÊN CỨU ............................................................................. 1
3. LỊCH SỬ .............................................................................................................. 2
4. NHỮNG ĐẶC ĐIỂM CƠ BẢN CỦA CƠ THỂ SỐNG ...................................... 3
5. VAI TRÒ CỦA HOÁ SINH ................................................................................ 3
Chương 2. CÁC CHẤT XÚC TÁC SINH HỌC ............................................................. 5
1. ĐẠI CƯƠNG ....................................................................................................... 5
1.1. Phản ứng hóa sinh ....................................................................................... 5
1.2. Chất xúc tác sinh học ................................................................................... 6
2. VITAMIN ............................................................................................................ 7
2.1. Vitamin tan trong nước................................................................................ 7
2.2. Vitamin tan trong dầu .................................................................................. 9
3. HORMON ......................................................................................................... 10
3.1. Đại cương .................................................................................................. 10
3.2. Các hormon quan trọng ............................................................................. 10
4. ENZYM ............................................................................................................ 12
4.1. Đại cương .................................................................................................. 12
4.2. Cách gọi tên và phân loại enzym ............................................................... 12
4.3. Bản chất hóa học của enzym ..................................................................... 14
4.4. Sự phân bố enzym ..................................................................................... 15
4.5. Liên quan enzym và một số bệnh lý .......................................................... 15
4.6. Ứng dụng enzym trong y học .................................................................... 16
CÂU HỎI LƯỢNG GIÁ ............................................................................................... 17
Chương 3: CHUYỂN HÓA CHUNG CỦA CÁC CHẤT ............................................. 19
1. CHUYỂN HÓA CÁC CHẤT VÀ CHUYỂN HÓA TRUNG GIAN ................. 19
1.1. Khái niệm ............................................................................................... 19
1.2. Đặc điểm của quá trình trao đổi chất ......................................................... 19
1.3. Ý nghĩa ...................................................................................................... 20
2. CHUYỂN HÓA NĂNG LƯỢNG ..................................................................... 20
2.1. Phản ứng oxy hóa - khử............................................................................. 20 1
2.2. Phosphoryl hóa và khử phosphoryl hóa .................................................... 21
3. SỰ HÔ HẤP TẾ BÀO ....................................................................................... 22
4. CHU TRÌNH KREBS ....................................................................................... 25
CÂU HỎI LƯỢNG GIÁ ............................................................................................... 28
Chương 4. HÓA HỌC VÀ CHUYỂN HÓA GLUCID ................................................. 30
PHẦN 1. HÓA HỌC GLUCID ..................................................................................... 30
1. ĐẠI CƯƠNG ..................................................................................................... 30
1.1. Khái niệm .................................................................................................. 30
1.2. Vai trò ........................................................................................................ 30
1.3. Phân loại .................................................................................................... 30
2. MONOSACCARID ........................................................................................... 31
2.1. Cấu tạo và danh pháp ................................................................................ 31
2.2. Tính chất của monosaccarid ...................................................................... 31
3. OLIGOSACCARID .......................................................................................... 33
4. POLYSACCARID ............................................................................................ 33
PHẦN 2. CHUYỂN HÓA GLUCID ............................................................................. 35
1. TIÊU HÓA, HẤP THU VÀ NHU CẦU ............................................................ 35
2. CHUYỂN HÓA GLUCID Ở TẾ BÀO VÀ MÔ ................................................ 35
2.1. Con đường Hexose Diphosphat (HDP) ..................................................... 35
2.2. Con đường Pentose Monophosphat (Hexose monophotphat – HMP) ...... 37
2.3. Ý nghĩa - Liên quan giữa HDP và HMP ................................................... 38
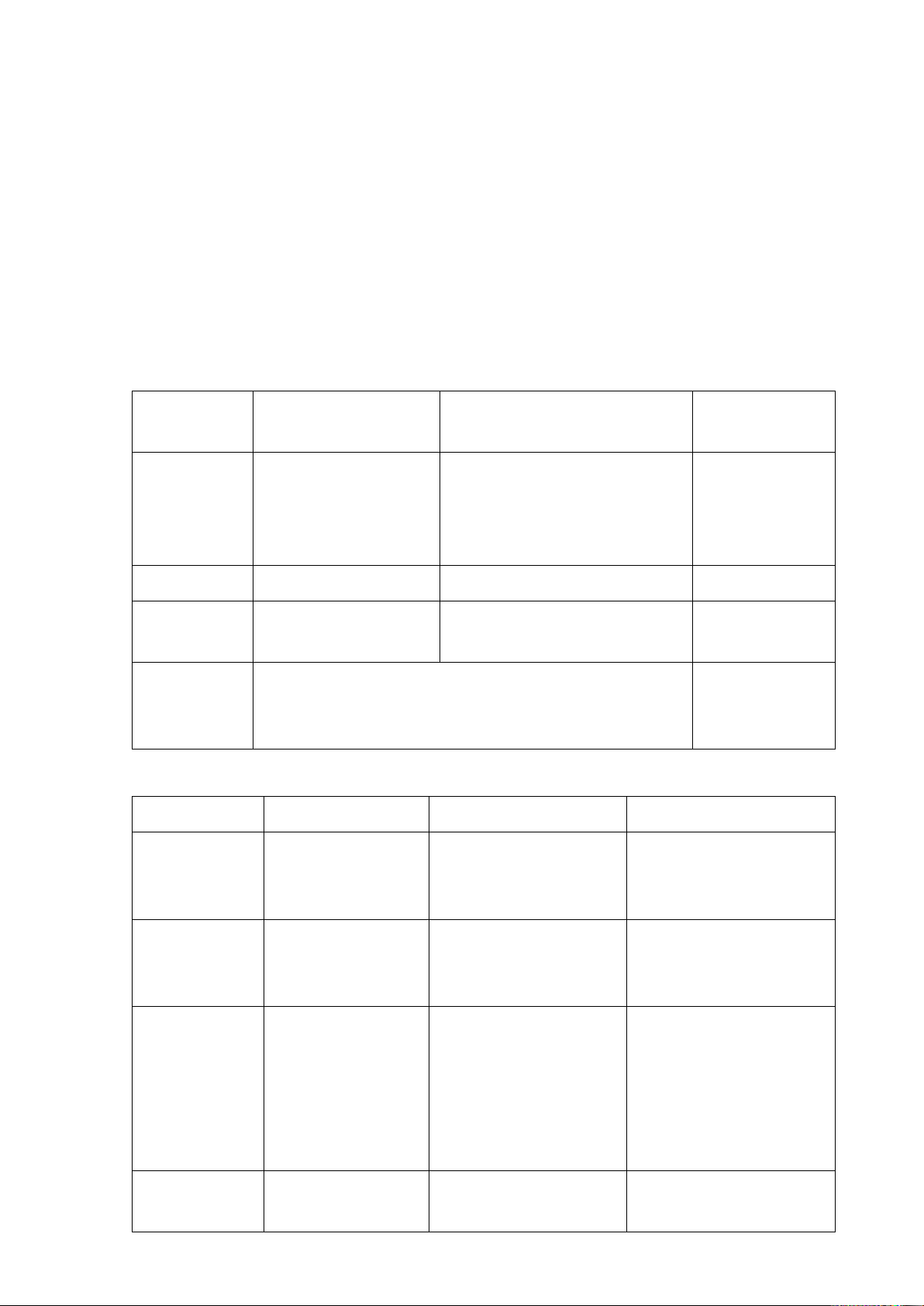
3. TẠO ACID URONIC ........................................................................................ 38
4. SỰ TỔNG HỢP GLUCOSE .............................................................................. 39
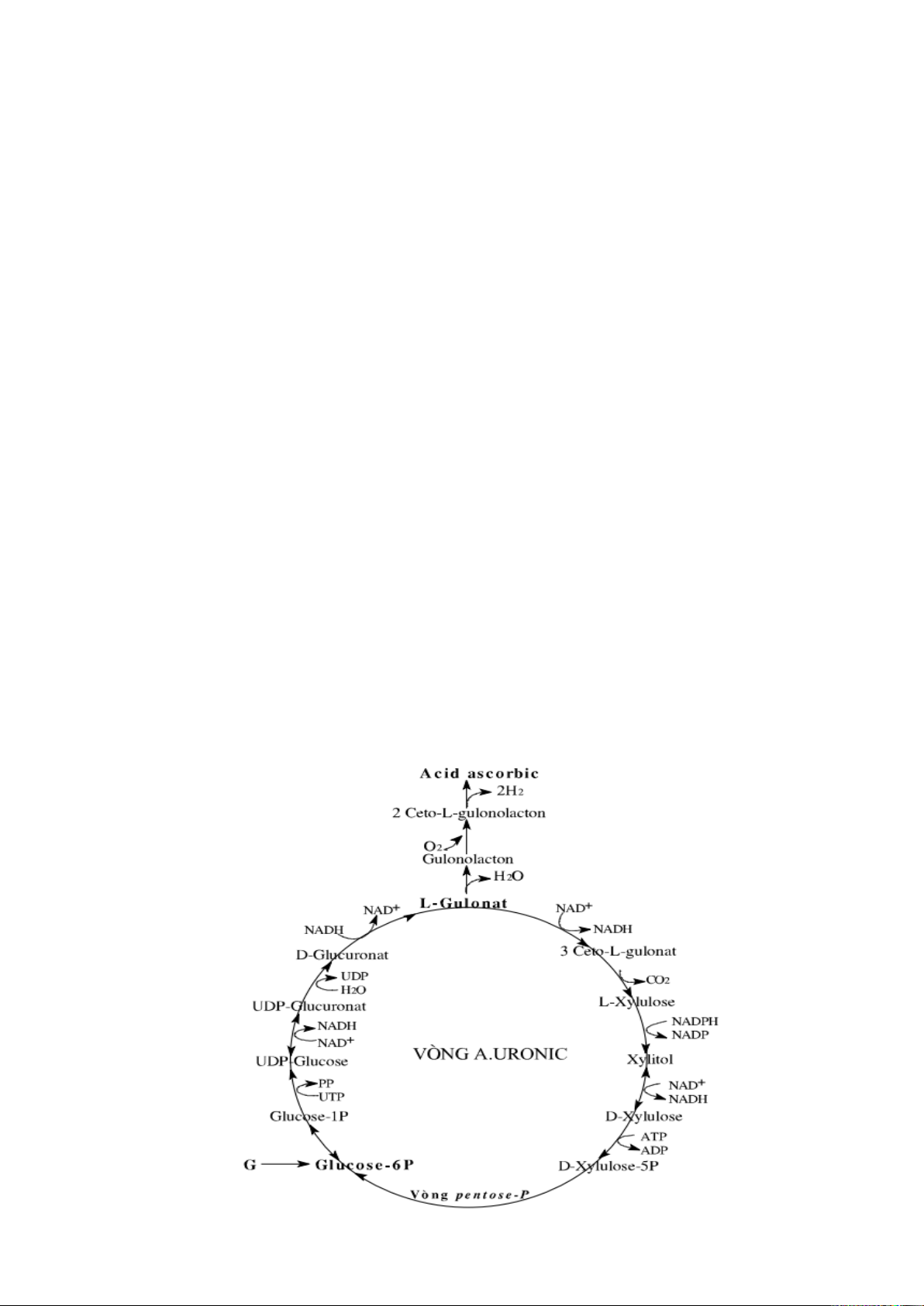
5. SINH TỔNG HỢP GLYCOGEN ...................................................................... 40
5.1. Quá trình tổng hợp glycogen từ glucose ................................................... 40
5.2. Tổng hợp glycogen từ các ose khác ....................................................... 41
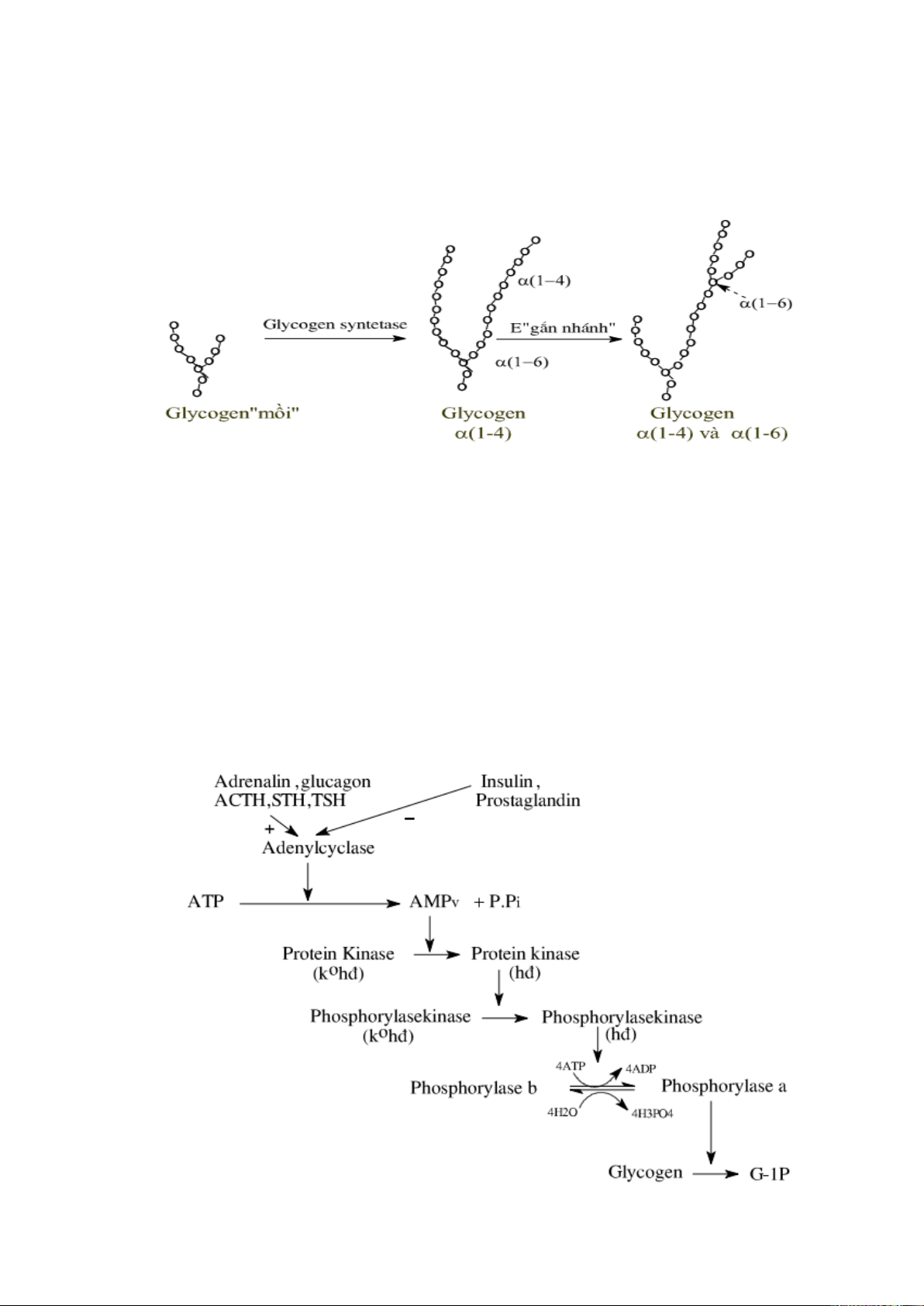
6. RỐI LOẠN CHUYỂN HÓA GLUCID ............................................................. 41
6.1. Hệ thống điều hòa đường huyết ................................................................ 41
6.2. Rối loạn chuyển hóa glucid ....................................................................... 42
CÂU HỎI LƯỢNG GIÁ ............................................................................................... 43
Chương 5. HÓA HỌC VÀ CHUYỂN HÓA LIPID ...................................................... 45
PHẦN 1. HÓA HỌC LIPID .......................................................................................... 45
1. ĐẠI CƯƠNG ..................................................................................................... 45
1.1. Phân loại .................................................................................................... 45
1.2. Vai trò của lipid ......................................................................................... 45
2. HÓA HỌC LIPID .............................................................................................. 46 ii
2.1. Acid béo .................................................................................................... 46
2.2. Lipid thuần ................................................................................................ 46
2.3. Lipid tạp .................................................................................................... 47
PHẦN 2. CHUYỂN HÓA LIPID .................................................................................. 48
1. TIÊU HÓA VÀ HẤP THU ................................................................................ 48
2. THOÁI HÓA LIPID .......................................................................................... 48
2.1. Thoái hóa glycegol .................................................................................... 48
2.2. Thoái hóa acid béo bão hòa ....................................................................... 49
2.3. Thoái hóa acid béo không bão hòa ............................................................ 52
3. TỔNG HỢP LIPID ............................................................................................ 52
3.1. Tổng hợp acid béo bão hòa ....................................................................... 52
3.2. Tổng hợp triglycerid .................................................................................. 52
4. CHUYỂN HÓA CHOLESTEROL ................................................................... 53
4.1. Tổng hợp cholesterol ............................................................................. 53
4.2. Sự thoái hóa cholesterol ......................................................................... 54
5. RỐI LOẠN CHUYỂN HÓA LIPID .................................................................. 54
5.1. Điều hòa chuyển hóa lipid ..................................................................... 54
5.2. Rối loạn chuyển hóa lipid: ..................................................................... 54
CÂU HỎI LƯỢNG GIÁ ............................................................................................... 55
Chương 6: HÓA HỌC VÀ CHUYỂN HÓA ACID NUCLEIC .................................... 57
PHẦN 1. HÓA HỌC ACID NUCLEIC ........................................................................ 57
1. ĐẠI CƯƠNG ..................................................................................................... 57
2. THÀNH PHẦN HÓA HỌC ACID NUCLEIC .................................................. 57
3. DNA (DEOXYRIBONUCLEIC ACID) .................................................................... 59
3.1. Cấu trúc DNA ............................................................................................ 59
3.2. Vai trò của DNA .................................................................................... 59
4. RNA (RIBONUCLEIC ACID) ................................................................................ 59
4.1. Cấu trúc RNA ........................................................................................ 59
4.2. Vai trò sinh học của RNA ...................................................................... 60
PHẦN 2. CHUYỂN HÓA NUCLEOTID ..................................................................... 60
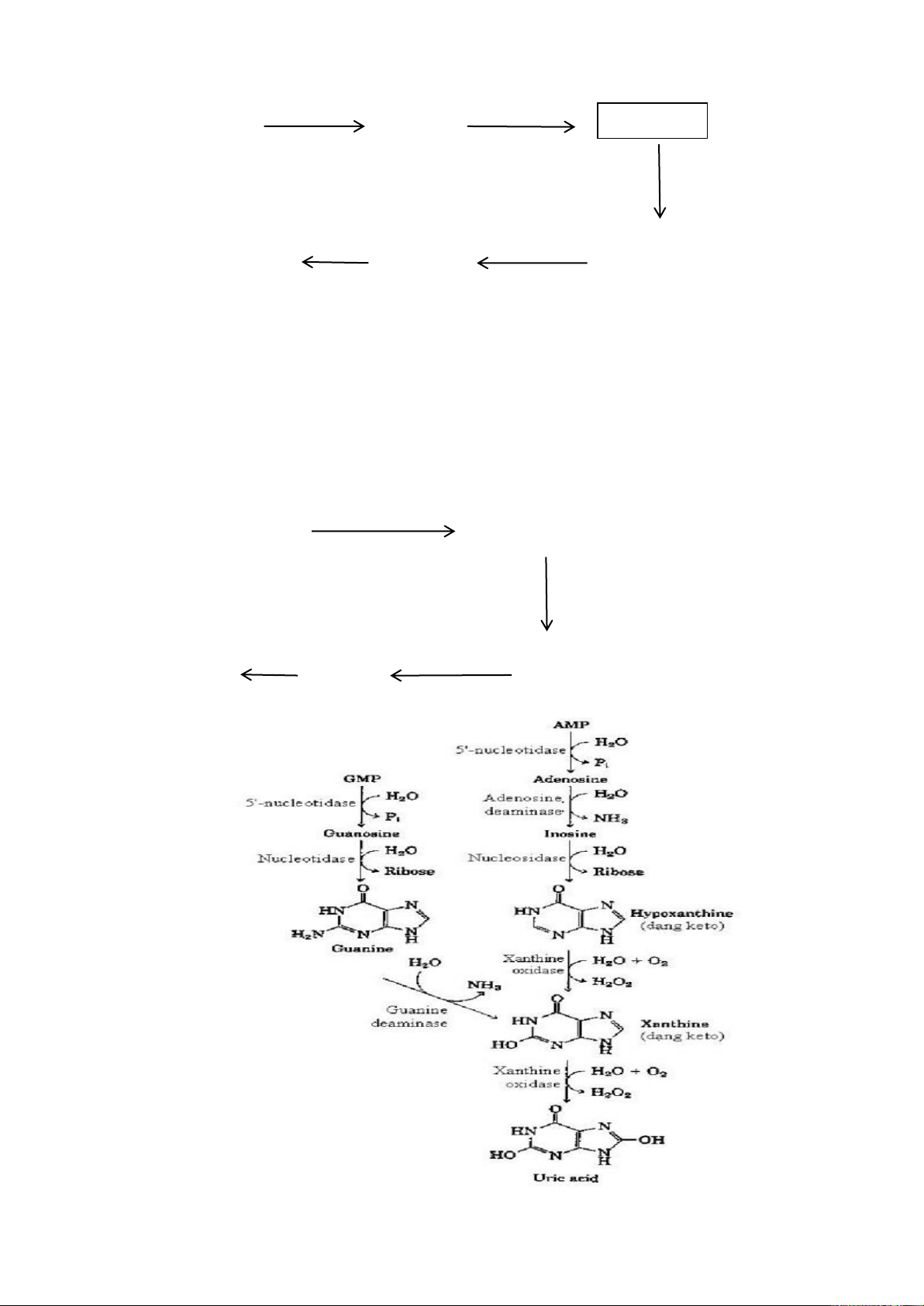
1. QUÁ TRÌNH THOÁI HÓA .............................................................................. 60
2. QUÁ TRÌNH TỔNG HỢP ................................................................................ 63
PHẦN 3. CHUYỂN HÓA ACID NUCLEIC ................................................................ 64
1. THOÁI HÓA ACID NUCLEIC ........................................................................ 64
1.1. Thoái hóa ADN ...................................................................................... 64
1.2. Thoái hóa ARN ...................................................................................... 64
2. TỔNG HỢP ACID NUCLEIC .......................................................................... 64 iii
2.1. Tổng hợp DNA ...................................................................................... 64
2.2. Tổng hợp RNA ...................................................................................... 66
CÂU HỎI LƯỢNG GIÁ ............................................................................................... 66
Chương 7: HÓA HỌC VÀ CHUYỂN HÓA PROTID ................................................. 69
PHẦN 1. HÓA HỌC PROTID ...................................................................................... 69
1. ĐẠI CƯƠNG .................................................................................................... 69
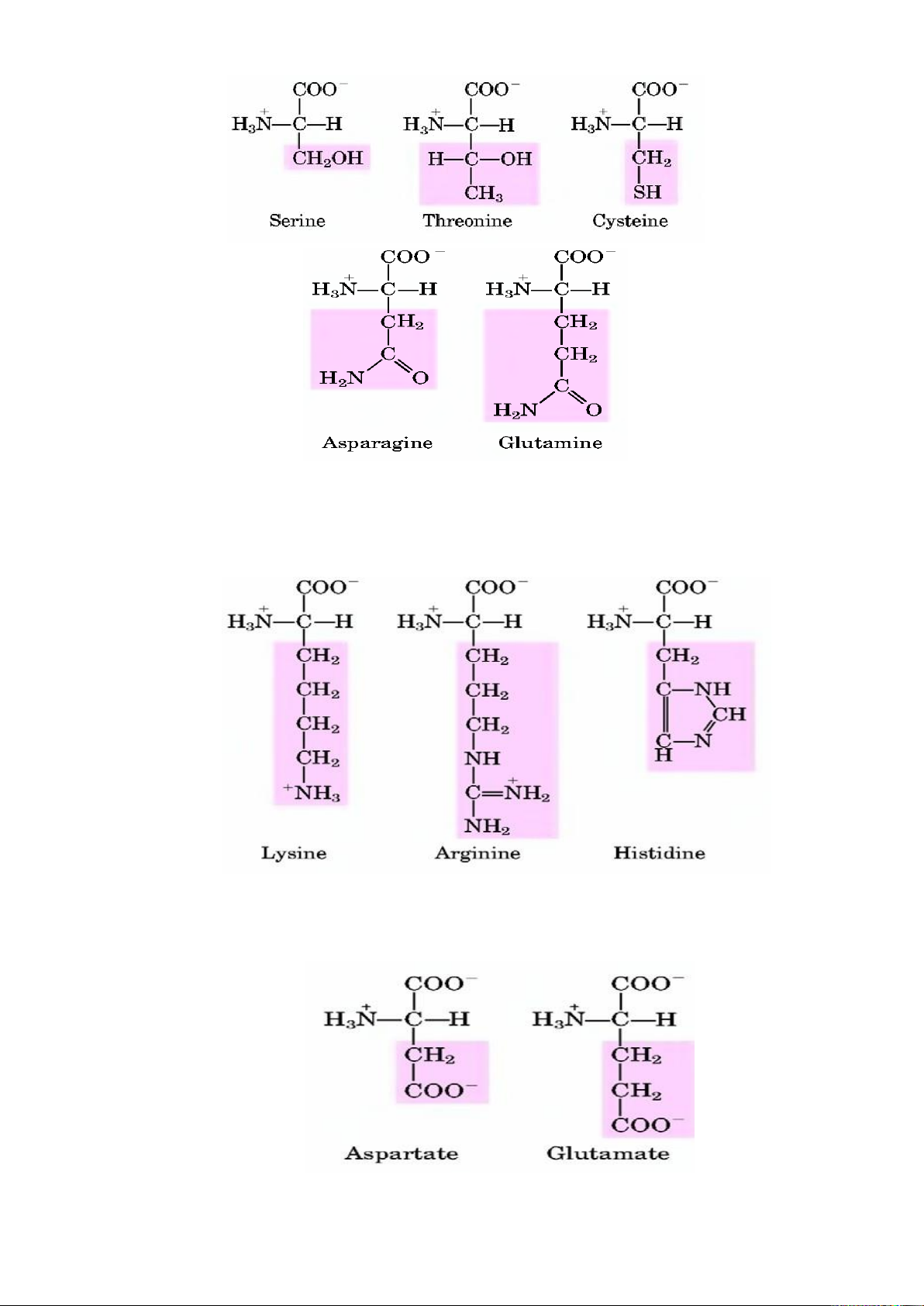
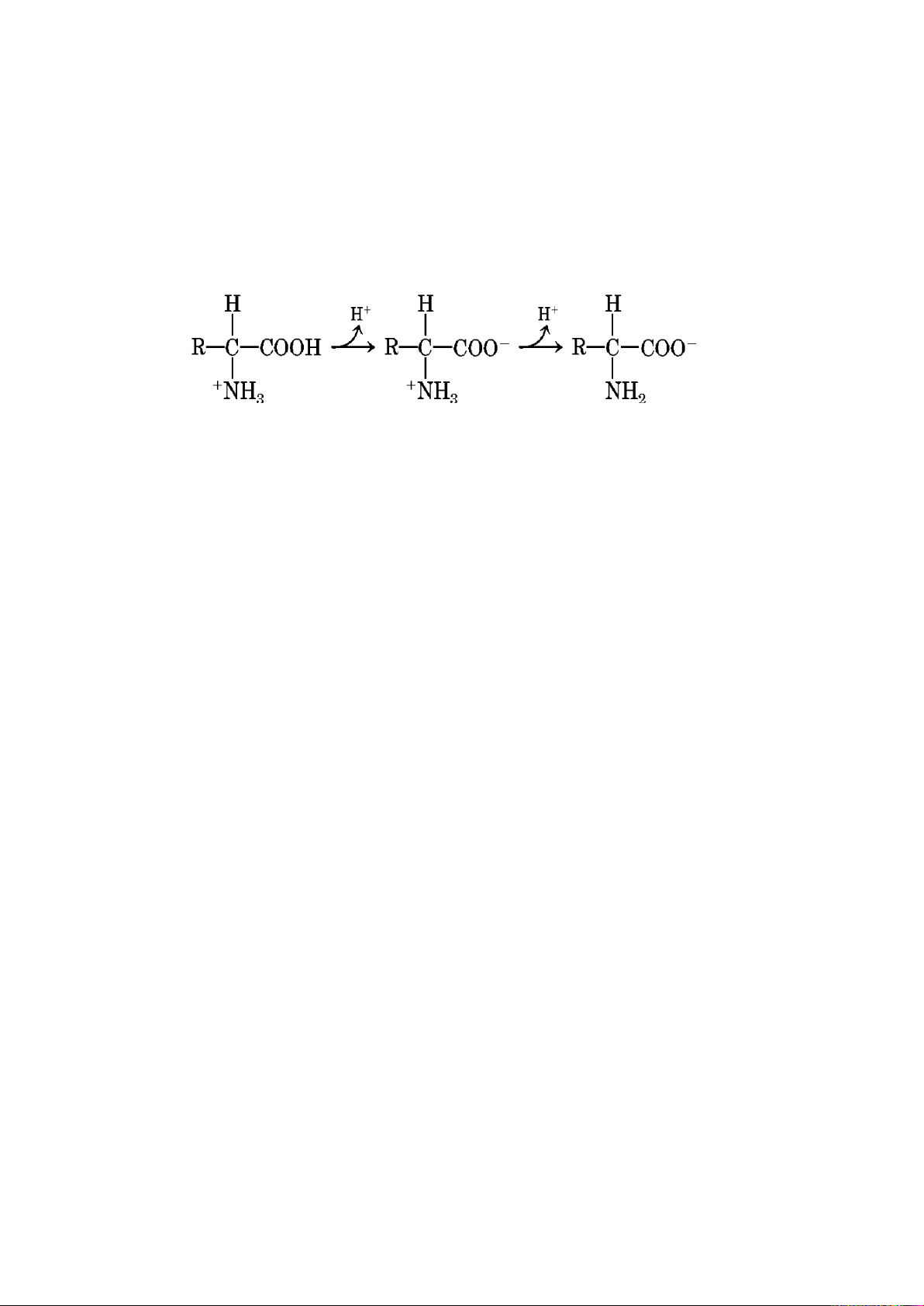
2. ACID AMIN ..................................................................................................... 69
2.1. Cấu tạo ................................................................................................... 69
2.2. Phân loại acid amin ................................................................................ 71
2.3. Tính chất của acid amin............................................................................. 73
3. PEPTID ............................................................................................................. 74
3.1. Định nghĩa ................................................................................................. 74
3.2. Cấu tạo ....................................................................................................... 74
3.3. Cách gọi tên ............................................................................................... 75
3.4. Tính chất hóa học ...................................................................................... 75
3.5. Các peptid thường gặp trong thiên nhiên .................................................. 76
4. PROTEIN .......................................................................................................... 78
4.1. Định nghĩa ................................................................................................. 78
4.2. Phân loại .................................................................................................... 78
4.3. Cấu trúc của protein .................................................................................. 78
4.4. Tính chất của protein ................................................................................. 78
4.5. Chức năng sinh học của Protein ................................................................ 80
4.6. Một số protein thường gặp ........................................................................ 82
PHẦN 2. CHUYỂN HÓA PROTID ............................................................................. 82
1. ĐẠI CƯƠNG .................................................................................................... 82
1.1. Sơ đồ tổng quát ...................................................................................... 82
1.2. Nguồn gốc .............................................................................................. 82
1.3. Tiêu hóa ................................................................................................. 83
2. SỰ THOÁI HÓA ACID AMIN ........................................................................ 84
3. TỔNG HỢP ACID AMIN ................................................................................. 87
4. TỔNG HỢP PROTID ....................................................................................... 88
CÂU HỎI LƯỢNG GIÁ ............................................................................................... 89
Chương 8. HÓA SINH HỆ THỐNG GAN MẬT ......................................................... 91
1. ĐẠI CƯƠNG .................................................................................................... 91
2. THÀNH PHẦN HÓA HỌC .............................................................................. 91
3. CHỨC NĂNG SINH HÓA CỦA GAN............................................................. 91 iv
4. NHỮNG XÉT NGHIỆM SINH HÓA HỆ THỐNG GAN MẬT ....................... 95
4.1. Hội chứng suy giảm chức năng gan....................................................... 95
4.2. Hội chứng tổn thương tế bào gan .......................................................... 96
4.3. Hội chứng tắc mật .................................................................................... 96
CÂU HỎI LƯỢNG GIÁ ............................................................................................... 97
Chương 9: HÓA SINH THẬN VÀ NƯỚC TIỂU ...................................................... 100
1. ĐẠI CƯƠNG .................................................................................................. 100
2. CHỨC NĂNG CỦA THẬN ............................................................................ 100
3. TÍNH CHẤT CHUNG CỦA NƯỚC TIỂU ..................................................... 104
4. THÀNH PHẦN HÓA HỌC CỦA NƯỚC TIỂU ............................................. 105
5. CÁC CHẤT BẤT THƯỜNG TRONG NƯỚC TIỂU ..................................... 105
6. THĂM DÒ CHỨC NĂNG THẬN .................................................................. 106
6.1. Protein niệu .............................................................................................. 106
6.2. Urê ........................................................................................................... 107
6.3. Creatinin .................................................................................................. 107
CÂU HỎI LƯỢNG GIÁ ............................................................................................. 107
TÀI LIỆU THAM KHẢO ................................................................................... 109
Tài liệu tiếng việt ............................................................................................ 109
Tài liệu tiếng nước ngoài ................................................................................ 109 v
Chương 1. ĐẠI CƯƠNG VỀ HÓA SINH HỌC Mục tiêu
1. Trình bày được định nghĩa về hóa sinh.
2. Trình bày được hóa sinh tĩnh, hóa sinh động.
3. Trình bày được vai trò hóa sinh trong y dược học. 1. ĐỊNH NGHĨA
Hóa sinh là môn học nghiên cứu về thành phần hóa học, cấu tạo, các tính chất vật
lý hóa học, chức năng sinh học của các chất trong cơ thể và quá trình chuyển hóa của
chúng trong cơ thể sống, là lĩnh vực nghiên cứu các hiện tượng sống bằng phương pháp hóa học.
2. ĐỐI TƯỢNG NGHIÊN CỨU
Môn học hóa sinh được hình thành trên cơ sở của sinh học và hoá học. Nó còn liên
quan mật thiết với tế bào học vì hầu hết các phản ứng hoá học đều xảy ra ở tế bào. Tế
bào là đơn vị hợp thành của cơ thể sống, có những đặc điểm chung; nhưng tế bào của
những cơ thể khác nhau, tế bào của từng loại mô trong một cơ thể có sự khác biệt về cấu
trúc và chức năng. Chính những sự chuyên biệt của các tế bào và những quá trình tiến
hoá tự nhiên đã dẫn đến sự khác biệt đa dạng và tạo nên những quá trình hoá sinh đặc
hiệu. Sự sống là hiện tượng trao đổi chất liên tục, hiện tượng này liên quan mật thiết với
các quá trình chuyển hoá vật chất. Những quá trình này được điều chỉnh nhịp nhàng ăn
khớp với nhau, bảo đảm cho nội môi của cơ thể luôn ở trạng thái động, nhưng cũng luôn ở thể ổn định.
Hoá sinh học gồm 2 phần: Hoá sinh tĩnh - Hoá sinh động.
Hóa sinh tĩnh: Nghiên cứu các chất cấu tạo có trong thành phần của cơ thể sinh
vật ở mức độ phân tử, nguyên tử dựa vào các phương pháp hóa, lý hiện đại. Hóa sinh
tĩnh gắn liền rất mật thiết với hoá hữu cơ. Đây chính là hóa sinh mô tả.
Hóa sinh động: Nghiên cứu các quá trình chuyển hoá, số phận của các chất khi
vào cơ thể, tính đặc hiệu của những phản ứng sinh học như phản ứng giữa enzym và cơ
chất, giữa hormon và các chất tiếp nhận, nghiên cứu về mặt hoá học của sự trao đổi chất
trong mối liên quan với toàn bộ cơ thể và môi trường xung quanh.
Hóa sinh tĩnh và động liên quan với nhau rất chặt chẽ - việc nghiên cứu các quá
trình hóa sinh học sẽ vô nghĩa nếu không có sự nghiên cứu các chất tham gia trong các quá trình này. 1 3. LỊCH SỬ
3.1. Trước thế kỷ XX
Gắn liền với những thành tựu của các lĩnh vực nghiên cứu hóa hữu cơ, sinh lý học,
y học, và một số ngành khoa học khác, các nghiên cứu hóa sinh đã bắt đầu từ thế kỷ
XVIII. Hàng loạt các hợp chất hữu cơ đã được tách ra từ thực vật và từ các tổ chức động
vật: acid citric, acid malic, acid tatric, acid oxalic, urea và các alkaloid.
Năm 1974, Lavoisier đã giải thích được cơ chế hoá học của sự hô hấp và sự cháy.
Tiếp theo các công trình chiết xuất, tinh chế và phân tích các chất hữu cơ là những công
trình nghiên cứu tổng hợp các chất hữu cơ.
Năm 1828, Friedrich Wöhler điều chế được carbamid (urea) bằng phương pháp
nhân tạo từ các chất vô cơ.
Cuối thế kỷ 19, đã tìm ra những số liệu về cấu trúc hóa học của axit amin, saccarit,
lipit, bản chất của liên kết peptit, bắt đầu nghiên cứu axit nucleic.
Năm 1897, Eduard Buchner thành công trong việc lên men vô bào
Năm 1886, Charles Alexander MacMunn đã tìm được cytocrom tham gia hệ thống
vận chuyển điện tử ở sinh vật. Năm 1897, Eduard Buchner lần đầu tiên chiết được enzym
thô từ tế bào nấm men có khả năng thủy phân đường.
3.2. Từ thế kỷ XX đến nay
Nhiều phát minh và ứng dụng về hóa sinh được công nhận, xác định bản chất của
enzym là protein và kết tinh thành công urease (1926), chiết xuất được ATP (Fiske và
Subbarow, 1929), mô tả vai trò của ATP trong quá trình dự trữ và chuyển vận chuyển
năng lượng (Lipmann, 1940), …
Năm 1937, Hans Krebs tìm ra chu trình acid citric (chu trình Krebs), Lohmann và
Shuster tìm ra vitamin B1 là coenzym của pyruvat decarboxylase.
Năm 1944 Avery, Maclesa và Mac Carty chỉ ra DNA là cơ sở của sự di truyền, mở
đầu cho môn hóa sinh di truyền.
Từ năm 1950, cơ bản đã xác định các tính chất chủ yếu cuả các chất và con đường
chuyển hoá các chất trong cơ thể, nghiên cứu cấu trúc phân tử protein, axit nucleic, liên
quan cấu trúc – chức năng, tổng hợp được insulin.
Năm 1961, tìm ra mô hình điều hòa gen tổng hợp protein, các quá trình tổng hợp
purin, acid amin, glicid, lipid cũng được làm rõ.
Từ 1970, bắt đầu nghiên cứu tổng hợp gen bằng phương pháp hóa học và tiếp tục
nghiên cứu các quá trình sinh tổng hợp acid nucleic, protein, sự liên quan giữa biến đổi
di truyền và các bệnh lý y học.
Năm 1980, nghiên cứu hóa sinh của hệ thống miễn dịch học được công bố (Snell,
Bena Cerraf và Dausset) và giải thưởng Nobel cho công trình nghiên cứu gắn các mẫu
DNA của Paul Berg. Năm 1981 – 1982, tổng hợp thành công gen α-interferon gồn 514
cặp base được thực hiên bởi Leicester. 2
Năm 1997, công trình nghiên cứu về prion của Staley Prusiner được trao giải Nobel
Y học, mở ra một khái niệm mới về “nhiễm khuẩn”, gây bệnh não thể xốp ở người và động vật.
Trong quá trình phát triển, nhiều ngành nhỏ của hoá sinh đã ra đời. Về hoá sinh
một số chức năng hệ thống quan trọng có hoá sinh miễn dịch, hoá sinh di truyền, đặc
biệt một ngành mới gần đây đã xuất hiện đó là công nghệ hoá sinh. Các lĩnh vực nhỏ
của hoá sinh đã đóng góp một cách tích cực vào thành tích chung của hoá sinh.
4. NHỮNG ĐẶC ĐIỂM CƠ BẢN CỦA CƠ THỂ SỐNG
4.1. Đặc điểm về thành phần hóa học trong cơ thể sống
Trong cơ thể sống, nước là thành phần quan trọng nhất, là nơi xảy ra các quá trình
hóa học đặc trưng cho sự sống. Ở người, nước chiếm 70% thể trọng (trong tế bào 50%, ngoài tế bào 20%).
Ngoài ra người ta đã phát hiện được hơn 60 nguyên tố có trong cơ thể sống, với
những lượng rất khác nhau. Trong đó, các nguyên tố C, H, O, N, S, P, Cl, Ca, Mg, K,
Na là những nguyên tố rất cần thiết cho sự sống, 11 nguyên tố này chiếm gần 100% khối
lượng toàn phần của động thực vật.
Trong tế bào và cơ thể sống, chủ yếu là các nguyên tố: C, H, O, N; một số nguyên
tố thường gặp dưới dạng ion như: Na+, Ka+, Ca++, Mg++, Cl-. Ngoài ra những nguyên tố
ở dạng vết được gọi là yếu tố vi lượng Fe, Cu, Co, Zn, Mn, Mo, … cũng có vai trò quan
trọng trong cơ thể sống.
4.2. Đặc điểm các phản ứng hóa học trong cơ thể sống
Đặc điểm chung của hầu hết các phản ứng hóa học trong cơ thể sống là đều có xúc
tác của enzym; xảy ra ở điều kiện nhiệt, áp suất bình thường; tốc độ nhanh và chính xác.
Nhiều phản ứng khác nhau cùng xảy ra trong một thời điểm, liên hệ với nhau theo
một trình tự xác định.
Cơ chế phản ứng tinh vi, phức tạp, được kiểm soát nghiêm ngặt.
Các sản phẩm của phản ứng, sản phẩm trao đổi, sản phẩm trung gian cũng đóng
vai trò trong cơ chế phản ứng, được gọi là cơ chế tự điều hòa.
5. VAI TRÒ CỦA HOÁ SINH
Những nghiên cứu sinh học ngày nay là nghiên cứu ở mức độ phân tử, hóa sinh là
khoa học nghiên cứu sự sống ở mức độ phân tử, nên có thể nói các chuyên ngành nào
của sinh học như động vật học, thực vật học, vi khuẩn học, sinh lý học, tế bào học, mô
phôi học ... đều cần phải trang bị kiến thức và kỹ thuật hoá sinh.
Trong miễn dịch học, xác định cấu trúc và chức năng của các kháng thể có bản
chất là protein nhờ vào các kỹ thuật hóa sinh.
Trong dược lý học, hóa sinh là cơ sở khoa học giúp con người hiểu sâu về cơ chế
tác dụng của thuốc ở mức độ dưới tế bào thông qua các tác dụng của thuốc (kích thích 3
hay kìm hãm một hay nhiều quá trình chuyển hóa) trên cơ thể sống. Từ đó có khả năng
hiểu chính xác hơn cơ chế tác dụng của thuốc.
Qua các nghiên cứu hóa sinh nội tiết, hóa sinh thần kinh, nhiều cơ chế tác dụng
của thuốc đã được biết và làm rõ, từ đó giúp cho việc nghiên cứu các loại thuốc mới có
tác dụng hiệu quả hơn trong điều trị. Bên cạnh đó, giúp con người hiểu rỡ hơn cơ chế
tác dụng của các thuốc chống virus, ung thư, kháng chuyển hóa, kháng hormon,....
Đối với y dược học, vấn đề chủ chốt nghiên cứu bệnh nguyên, bệnh lý, chẩn đoán
và điều trị bệnh cũng đều liên quan chặt chẽ đến hoá sinh, tức liên quan đến sự thay đổi
các phân tử bệnh lý xảy ra trong cơ thể và tìm những chất hoạt tính sinh học có tác dụng
phòng chống hoặc chữa khỏi bệnh. Hóa sinh đã đóng góp phần lớn trong việc bảo về và
không ngừng nâng cao sức khỏe con người trong việc phòng chống bệnh tật. Cung cấp
kiến thức giúp con người hiểu biết sâu xa nguyên nhân bệnh tật, giúp công tác chẩn
đoán, theo dõi bệnh tật chính xác, điều chỉnh liều lượng thuốc kịp thời nhờ sử dụng tốt
công cụ hóa sinh lâm sàng. 4
Chương 2. CÁC CHẤT XÚC TÁC SINH HỌC
(VITAMIN – ENZYM – HORMON) Mục tiêu
1. Trình bày được cấu tạo và vai trò sinh học của vitamin tan trong nước và dầu.
2. Trình bày được định nghĩa và chức năng của hormon.
3. Trình bày được bản chất hóa học và tác dụng của hormon.
4. Trình bày được danh pháp và phân loại theo quốc tế của enzym.
5. Trình bày được thành phần cấu tạo của enzym. 1. ĐẠI CƯƠNG
1.1. Phản ứng hóa sinh 1.1.1. Định nghĩa
Phản ứng hóa sinh là tất cả các phản ứng hóa học xảy ra trong cơ thể sống. Phần
lớn, các phản ứng hóa sinh là phản ứng thuận nghịch do các enzym xúc tác.
Tập hợp các phản ứng hóa sinh chính là quá trình chuyển hóa các chất, đáp ứng 2 yêu cầu:
Tạo ra các chất căn bản xây dựng cơ thể Tạo hình.
Tạo năng lượng Tạo thân nhiệt.
Tạo công đảm bảo hoạt động sống.
1.1.2. Động hóa học
Các phản ứng hóa học được chia làm 2 loại
Phản ứng 1 chiều không thuận nghịch A B
Phản ứng 2 chiều chuận nghịch A B Chất phản ứng k1 thuận Sản phẩm A + B C + D Sản phẩm k2 nghịch Chất phản ứng
Với: k1, k2 là hằng số (hệ số) tốc độ của phản ứng. Tốc độ phả ứng:
v1 = k1[A][B] và v2 = k2[C][D]
Ban đầu: [A] và [B] max v1 max [C] = [D] = 0 v2 = 0 5
Khi A phản ứng với B tạo C và D:
[A] và [B] giảm dần v1 giảm dần
[C] và [D] tăng dần v2 tăng dần
Đến một lúc nào đó v1 = v2 trạng thái cân bằng động
Ở trạng thái cân bằng động, phản ứng vẫn xảy ra theo hai chiều với tốc độ bằng nhau. Với: v1 = v2 k1 [C][D]
k1[A][B] = k2[C][D] = = Kcb k 2 [A][B]
Mỗi phản ứng thuận nghịch có hằng số cân bằng (Kcb) riêng.
Về mặt nhiệt động học: có 2 loại phản ứng
Phản ứng phát năng (về nhiệt độ, phản ứng tỏa nhiệt).
Phản ứng thu năng (về nhiệt độ, phản ứng thu nhiệt).
1.1.3. Năng lượng tự do
Năng lượng tự do là phần năng lượng có thể biến thành Công (năng lượng có thể sử dụng được).
Xét phản ứng từ A B
Với năng lượng tự do của A, B là GA và GB (G: Gibbs)
Biến thiên năng lượng tự do: G = GB – GA (Công sinh ra)
G > 0 GB > GA phản ứng thu năng.
Phản ứng thu năng là phản ứng không tự xảy ra theo chiều từ A B, chỉ xảy ra
khi được cung cấp đủ năng lượng (phản ứng tổng hợp trong hóa sinh)
G < 0 GB < GA phản ứng phát năng
Phản ứng phát năng là phản ứng có thể tự xảy ra theo chiều từ A B. Là các phản
ứng thoái hóa trong cơ thể.
Biến thiên năng lượng tự do chuẩn Go: phản ứng xảy ra trong điều kiện chuẩn khi
[A] = [B] = 1 mol/l, T = 25oC, pH = 0.Với phản ứng xảy ra trong cơ thể thì pH = 7.
1.2. Chất xúc tác sinh học
Phần lớn các phản ứng trong cơ thể đều có chất xúc tác. Chất xúc tác sinh học là
sản phẩm sinh học, có tác dụng làm tăng nhanh phản ứng và giữ nguyên sau phản ứng.
Có 3 loại chất xúc tác sinh học: vitamin, enzym, hormon. Trong đó, enzym có vai
trò quan trọng nhất, là trung tâm trực tiếp tham gia các phản ứng hóa sinh. 6 2. VITAMIN
Vitamin là một nhóm chất hữu cơ có tính chất lý, hoá học rất khác nhau, tác dụng
lên cơ thể sinh vật cũng rất khác nhau nhưng đều rất cần thiết cho sự sống của sinh vật,
nhất là đối với người và động vật. Khi thiếu một loại vitamin nào đó sẽ dẫn đến những
rối loạn về hoạt động sinh lý bình thường của cơ thể.
Vitamin được tổng hợp chủ yếu ở thực vật và vi sinh vật. Ở người và động vật
cũng có thể tổng hợp được một số ít vitamin, tuy nhiên không đáp ứng đủ nhu cầu cơ
thể nên phải tiếp nhận thêm ở ngoài vào bằng con đường thức ăn.
Có nhiều loại vitamin khác nhau, được gọi tên theo nhiều cách như gọi theo chữ
cái, gọi theo danh pháp hoá học, gọi theo chức năng. Ví dụ vitamin B1 còn có tên
hóa học là thiamin, đồng thời theo chức năng của nó còn có tên antinevrit.
Kiểu phân loại vitamin được sử dụng phổ biến nhất là dựa vào khả năng hòa tan
vào các dung môi, chia làm 2 nhóm: vitamin tan trong nước và vitamin tan trong mỡ.
Vitamin tan trong nước chủ yếu tham gia vào các quá trình liên quan tới giải
phóng năng lượng (quá trình oxi hoá khử, quá trình phân giải các hợp chất hữu cơ...)
Vitamin tan trong mỡ tham gia vào các phản ứng tạo nên các chất có chức năng
cấu trúc các mô, các cơ quan.
2.1. Vitamin tan trong nước
2.1.1. Vitamin B1 (Thiamin)
Vitamin B1 là loại vitamin rất phổ biến trong thiên nhiên, đặc biệt trong nấm men
cám gạo, mầm lúa mì ... Trong đó cám gạo có hàm lượng vitamin B1 cao nhất.
Trong cơ thể vitamin B1 có thể tồn tại ở trạng thái tự do (Thiamin pyrophosphat),
là dạng liên kết với phosphat có vai trò quan trọng trong quá trình trao đổi chất của
cơ thể. Thiamin pyrophosphat là coenzym xúc tác phân giải các acid cetonic như acid
pyruvic, acid oxaloacetic … Thiếu vitamin B1 sự chuyển hoá các acid cetonic bị ngừng
trệ, cơ thể tích luỹ các acid cetonic làm rối loạn trao đổi chất và gây nên các bệnh lý nguy hiểm.
Nhu cầu vitamin B1 của cơ thể là 1.5 mg/ ngày, tuy là loại vitamin lành nhưng
cũng có trường hợp gây phản ứng tuy ít gặp. Ngoài gây sốc phản vệ khi tiêm, dùng
vitamin B1 có thể bị các tác dụng phụ như tăng huyết áp cấp, ngứa, nổi mề đay, khó thở,
kích thích tại chỗ tiêm.
2.1.2. Vitamin B2 (Riboflavin)
Vitamin B2 là dẫn xuất của vòng isoalloxazin, thuộc nhóm flavin. Trong cơ thể B2
liên kết với phosphat tạo nên coenzym FMN và FAD ( enzym dehydrogenase hiếu khí).
Ở trạng thái khô vitamin B bền với nhiệt và 2 acid.
Vitamin B2 có nhiều trong nấm men, đậu, thịt, sữa, gan, trứng. Khi thiếu vitamin
B2 sự tổng hợp các enzym oxy hoá-khử bị ngừng trệ ảnh hưởng đến quá trình oxy
hoá- khử tạo năng lượng cho cơ thể. Đồng thời, thiếu vitamin B2 việc sản sinh tế bào 7
của biểu bì ruột bị ảnh hưởng gây nên sự xuất huyết tiêu hóa hay rối loạn hoạt động của
dạ dày, ruột. Ngoài ra, vitamin B2 giúp cơ thể kháng khuẩn tốt hơn. Nhu cầu vitamin B2 hàng ngày khoảng 2-3mg.
2.1.3. Vitamin B3 (Acid nicotinic, nicotinamid)
Vitamin B3 là acid nicotinic và amid của nó là nicotinamid, là thành phần của
coenzym NAD, NADP có trong các enzym thuộc nhóm dehydrogenase kỵ khí.
Vitamin PP có nhiều trong gan, thịt nạc, tim, đặc biệt là nấm men. Thiếu vitamin
B3 ảnh hưởng đến các quá trình oxi hoá - khử.
Vitamin B3 có tác dụng ngăn ngừa bệnh ngoài da, sưng màng nhầy ruột, dạ dày,
giúp cơ thể chống lại bệnh pellagra (bệnh da sần sùi, bệnh dẫn đến sưng màng nhầy dạ
dầy, ruột, sau đó sưng ngoài da). Nhu cầu hàng ngày khoảng 15-25 mg vitamin B3.
2.1.4. Vitamin B6 (Pyridoxin)
Vitamin B6 tồn tại trong cơ thể ở 3 dạng khác nhau: Piridoxol, Pyridoxal,
Pyridoxamin. Ba dạng này có thể chuyển hoá lẫn nhau.
Vitamin B6 là thành phần coenzym của nhiều enzym xúc tác cho quá trình chuyển
hoá acid amin, là thành phần cấu tạo của phosphorylase ... Vitamin B6 có nhiều trong
nấm men, trứng, gan, hạt ngũ cốc, rau, quả ...
Thiếu Vitamin B6 sẽ dẫn đến các bệnh ngoài da, bệnh thần kinh, rụng lông tóc
... Hàng ngày, người lớn cần 1,5-2,8 mg, với trẻ em cần 0,5-2 mg vitamin B6.
2.1.5. Vitamin B12 (Cyanocobalamin)
Vitamin B12 có cấu tạo phức tạp, trong thành phần có chứa nhóm C, CO, amin.
Thành phần chính là nhóm porphyrin.
Vitamin B12 giúp cho việc tạo huyết tố cầu và hồng cầu, tham gia vào các quá trình
tổng hợp nucleotid. Thiếu vitamin B12 gây bệnh thiếu máu ác tính.
Ngoài các loại vitamin trên, trong nhóm vitamin tan trong nước còn một số
vitamin khác như vitamin B5, Bc, H...
2.1.6. Vitamin C (Acid ascorbic)
Trong cơ thể vitamin C tồn tại ở 2 dạng: dạng khử (acid ascorbic) và dạng oxy hóa (dehydro ascorbic).
Vitamin C tham gia nhiều quá trình sinh lý quan trọng trong cơ thể:
- Quá trình hydroxyl hoá do hydroxylase xúc tác.
- Duy trì cân bằng giữa các dạng ion Fe+2/ Fe+3, Cu+1/Cu+2.
- Vận chuyển H2 trong chuỗi hô hấp phụ.
- Làm tăng tính đề kháng của cơ thể đối với những điều kiện không thuận lợi của
môi trường, các độc tố, làm giảm các triệu chứng bệnh lý do phóng xạ.
Ngoài ra vitamin C còn tham gia vào nhiều quá trình khác có vai trò quan trọng trong cơ thể. 8
Vitamin C có nhiều trong rau quả tươi, nhất là quả có múi như cam, chanh, bưởi
cam,... Nhu cầu hàng ngày cần 70-80 mg/người. Nếu thiếu vitamin C sẽ dẫn đến bệnh hoại
huyết, giảm sức đề kháng của cơ thể, chảy máu răng, lợi hay nội quan.
2.2. Vitamin tan trong dầu
2.2.1. Vitamin A (retinol)
Vitamin A có 2 dạng quan trọng là A1 và A2. vitamin A được hình thành từ β-
caroten là tiền vitamin A. Từ một phân tử β-caroten tạo 2 phân tử vitamin A.
Có vai trò quan trọng trong cơ chế tiếp nhận ánh sáng thành của mắt, tham gia
vào quá trình trao đổi protid, lipid, saccharid. Thiếu vitamin A bị bệnh quáng gà, khô
mắt, chậm lớn, sút cân, giảm khả năng đề kháng.
Có nhiều trong dầu cá, lòng đỏ trứng. Trong thực vật có nhiều tiền vitamin A (β-
caroten) nhất là cà rốt, cà chua, quả gấc, đu đủ. Nhu cầu với người lớn 1-2 mg, trẻ em
dưới 1 tuổi 0,5-1 mg/ngày. 2.2.2. Vitamin D
Các vitamin D là dẫn xuất của các sterol, được tạo ra từ tiền vitamin D (dưới da)
nhờ ánh sáng mặt trời (tia tử ngoại). Trong cơ thể tồn tại quan trọng nhất là D2 và D3.
Vitamin D có nhiều trong dầu cá, mỡ bò, lòng đỏ trứng. Tiền vitamin D có
sẵn trong mỡ động vật. Thiếu hoặc thừa vitamin D đều ảnh hưởng đến nồng độ
phospho và canxi trong máu. Thiếu vitamin D trẻ em dễ bị bệnh còi xương, ở người
lớn bị bệnh loãng xương.
2.2.3. Vitamin E (Tocopherol)
Vitamin E có nhiều dạng khác nhau là α, β, γ, δ... tocopherol. Các dạng này được
phân biệt bởi số lượng và vị trí của các nhóm methyl gắn vào vòng thơm của phân
tử. Trong các loại vitamin E, dạng α-tocopherol có hoạt tính cao nhất:
Vitamin E có nhiều ở các loại rau xanh, nhất là xà lách, ngũ cốc, dầu thực vật, gan
bò, lòng đỏ trứng, mầm hạt hoà thảo ...
Vitamin E là chất chống oxi hoá, có tác dụng bảo vệ các chất dễ bị oxi hoá trong
tế bào. vitamin E còn có vai trò quan trọng trong sinh sản. Nhu cầu vitamin E hàng
ngày khoảng 20 mg cho một người lớn. 2.2.4. Vitamin K
Vitamin K cần cho quá trình sinh tổng hợp các yếu tố làm đông máu
(prothrombin), thiếu vitamin K tốc độ đông máu giảm, máu khó đông. Có nhiều loại vitamin K.
Vitamin K có nhiều trong cỏ linh lăng, bắp cải, rau má, cà chua, đậu, ngũ cốc,
lòng đỏ trứng, thịt bò ... Ở người khỏe mạnh, vi khuẩn dường ruột có khả năng cung cấp
khá đủ vitamin K cho cơ thể, chỉ cần bổ sung thêm khoảng 0,2-0,3 mg/ngày. 9 3. HORMON 3.1. Đại cương
Hormon là những chất xúc tác sinh học do tế bào đặc biệt sản xuất, có tác dụng
điều hoà các hoạt động sống trong cơ thể. Với một lượng rất thấp, hormon hấp thu
thẳng vào máu, tới mô đích để kích thích, hoạt hóa những hoạt động sinh lý, sinh hóa
đặc hiệu trong cơ thể mà không tham gia trực tiếp vào các phản ứng.
Hormon có cả ở thực vật và động vật. Ở động vật hormon được sản xuất tại các
tuyến nội tiết và tác động đến các mô khác nơi nó được tạo ra. Hormon từ tuyến nội
tiết được tiết trực tiếp vào máu và được máu vận chuyển đến các mô chịu tác dụng.
Hormon tác động đến tốc độ sinh tổng hợp protein, enzym, ảnh hưởng đến tốc
độ xúc tác của enzym; thay đổi tính thấm của màng tế bào, qua đó điều hoà hoạt động
sống xảy ra trong tế bào.
3.2. Các hormon quan trọng
Hormon động vật có nhiều loại với cấu tạo và chức năng rất khác nhau. Dựa vào
cấu tạo hoá học có thể chia thành 3 nhóm:
- Hormon là dẫn xuất của acid amin.
- Hormon steroid là dẫn xuất của cholesterol.
- Hormon là peptid hay protein.
3.2.1. Hormon là dẫn xuất acid amin
- Adrenalin và noradrenalin (tuyến thượng thận) tác dụng kích thích sự phân
giải glycogen, làm giảm sự tổng hợp glycogen nên làm tăng glucose trong máu.
- Thyroxin (tuyến giáp) tác dụng tăng cường trao đổi chất, giúp cơ thể phát triển
bình thường. Thiếu thyroxin gây nên thiểu năng tuyến giáp ( bướu cổ đơn thuần, đần
độn). Thừa thyroxin gây ưu năng tuyến giáp (Basedow). 3.2.2. Hormon steroid
Đây là nhóm hormon có số lượng lớn, có vai trò quan trọng và đa dạng, được
chia thành 5 nhóm nhỏ với nhiều loại khác nhau: Bảng 2.1. Hormon steroid TT Nhóm
Đại diện Nơi tạo thành Vai trò - Thể vàng
Hormon dưỡng thai, giúp trứng 1 Progestagen Progesteron phát triển. - Vỏ thượng thận 10
- Kích thích tổng hợp và tích lũy glycogen ở gan. 2 Gluco-corticoid Cortisol
Vỏ thượng thận - Kích thích phân giải protein, lipid.
- Chông viêm, tích nước, muối. - Tăng hấp thụ Na+, Cl-. 3
Mineral corticoid Andosteron Vỏ thượng thận - Tăng tích nước.
Phát triển các đặc điểm của nam 4 Androgen Testosteron Tinh hoàn giới. Estrol
- Phát triển các đặc điểm giới nữ. 5 Estrogen Estron Buồng trứng
- Phát triển niêm mạc tử cung Estriol
3.2.3. Hormon là peptid hoặc protein
Đây là nhóm hormon có vai trò quan trọng trong quá trình điều hoà trao đổi chất
trong cơ thể, đặc biệt là điều hoà lượng đường trong máu.
Bảng 2.2. Một số hormon là peptid: TT Hormon Nơi tạo ra Vai trò 1 Tyrocalcitonin
Tuyến giáp Giảm hàm lượng Ca++ trong máu 2 Oxytoxin (HGF)
Tuyến yên Gây co dạ con, kích thích sinh 3 Vasopressin (ADH)
Tuyến yên Tăng áp, chống bài tiết 4 Melanotropin (MSH)
Tuyến yên Kích thích tăng sắc tố da 5 Somatotropin (STH)
Tuyến yên Kích thích tăng trưởng, tăng TĐC 6 Corticotropin (ACTH)
Tuyến yên Kích thích tuyến trên thận Thyroid-Stimulating 7
Tuyến yên Kích thích tuyến giáp Hormon (TSH) 8 Kích nang tố (FSH)
Tuyến yên Kích thích tạo estradiol
- Insulin: đ ư ợ c t iết từ tế bào β của t i ể u đảo Langerhans của tuyến tụy. Khi
lượng đường trong máu cao, Insulin kích thích các quá trình tổng hợp và kìm hãm các
quá trình phân giải glycogen ở gan, mô mỡ. Insulin còn kích thích sự phân giải glucose,
làm giảm lượng đường trong máu, chống lại bệnh đái tháo đường.
Insulin có khối lượng phân tử là 5800 Dalton, gồm 2 chuỗi polypeptid liên 11
kết với nhau bằng 2 liên kết disunfit. Chuỗi A có 21 acid amin, chuỗi B có 30 acid
amin. Tiền chất của insulin là proinsulin và preproinsulin.
- Glucagon: có tác dụng ngược với insulin. Khi lượng đường trong máu giảm
quá mức cho phép thì tuyến tuỵ sản sinh ra glucagon có tác dụng làm tăng lượng đường
trong máu nhờ kìm hãm quá trình tổng hợp glycogen.
Glucagon có khối lượng phân tử 3.500, gồm 29 gốc acid amin tạo thành
chuỗi polypeptid mạch thẳng. 4. ENZYM 4.1. Đại cương
Enzym có bản chất là protein, do mọi tế bào sản xuất ra, do đó nó mang tính chất
của protein. Enzym có khả năng xúc tác đặc hiệu cho các phản ứng hóa học, thúc đẩy
phản ứng xảy ra mà không có mặt trong sản phẩm cuối cùng.
Khả năng xúc tác của enzym rất lớn, có thể làm tăng nhanh phản ứng hàng triệu
lần với liều lượng rất thấp. CO2 + H2O H2CO3
Enzym xúc tác phản ứng là carbonic anhydratase, một phân tử enzym hydrat hóa
105 phân tử CO2 trong 1 giây tăng tốc độ phản ứng lên 10 triệu lần.
Enzym không làm thay đổi hệ số cân bằng mà chỉ làm cho phản ứng mau đạt đến trạng thái cân bằng.
Enzym có tính đặc hiệu (chuyên biệt) rất cao, nghĩa là xúc tác những phản ứng
nhất định với những cơ chất nhất định. Tinh bột α-Amylase Maltose, Gluc ose Maltase Glucose
4.2. Cách gọi tên và phân loại enzym
4.2.1. Cách gọi tên: 4 cách
a) Tên cơ chất + tiếp vĩ ngữ ase. Ví dụ: urease (urê), proteinase (protein),…
b) Tên tác dụng + tiếp vĩ ngữ ase. Ví dụ: oxidase (tác dụng oxy hóa),
aminotransferase (trao đổi amin enzym), decarboxylase (khử nhóm CO2),…
c) Tên cơ chất, tác dụng + tiếp vĩ ngữ ase. Ví dụ: lactat dehydrogenase (khử hydro trên cơ chất lactat), …
d) Tên thường gọi : cách gọi tên này không có tiếp vĩ ngữ ase. Ví dụ : pepsin, trypsin, chymotrypsin,… 4.2.2. Phân loại
Dựa vào tính đặc hiệu phản ứng của enzym, người ta chia enzym ra làm 6 lớp.
Mỗi lớp chia thành nhiều tổ (dưới lớp), mỗi tổ chia thành nhiều nhóm (siêu lớp).
a) Oxydoreductase: Xúc tác các phản ứng oxi hoá-khử. Gồm các dưới lớp:
- Dehydrogenase: Sử dụng các phân tử không phải oxy là chất nhận e-. Ví dụ: lactat 12 dehydrogenase…
- Oxidase: Sử dụng oxy là chất nhận e nhưng không tham gia vào thành phần cơ
chất. Ví dụ: cytochrom oxidase, xanthin oxidase…
- Reductase: Đưa H và e vào cơ chất. Ví dụ: -cetoacyl -ACP reductase
- Catalase : 2H2O2 O2 + 2H2O
- Peroxidase: H2O2 + AH2 A + 2H2O
- Oxygenase (hydroxylase): gắn một nguyên tử oxy vào cơ chất. Ví dụ: Cytp-450
xúc tác phản ứng: RH + NADPH + H+ + O2 ROH + NADP+ + H2O
b) Transferase: Xúc tác cho các phản ứng chuyển vị. Gồm các dưới lớp:
- Aminotransferase: vận chuyển -NH2 từ acid amin sang acid alpha cetonic. Ví dụ: AST, ALT
- Transcetolase và transaldolase: chuyển đơn vị 2C và 3C
- Các acyl-, metyl-, glucosyl-transferase, phosphorylase
- Các kinase: chuyển gốc phosphat từ ATP vào cơ chất. Ví dụ: Hexokinase
- Các thiolase: chuyển CoA –SH vào cơ chất. Ví dụ: acyl CoA - Acetyl transferase
- Các polymerase: DNA polymerase, RNA polymerase
c) Hydrolase: Xúc tác cho các phản ứng thủy phân. Gồm các dưới lớp:
- Các esterase: thủy phân liên kết este. Ví dụ: triacylglycerol lipase.
- Các glucosidase: thủy phân liên kết glycosid
- Các protease: thủy phân liên kết peptid
- Các phosphatase: thủy phân liên kết este phosphat
- Các phospholipase: thủy phân liên kết este phosphat trong phân tử phospholipid
- Các amidase: thủy phân liên kết N-osid. Ví dụ: nucleoside
- Các desaminase: thủy phân liên kết C-N, tách nhóm amin ra khỏi cơ chất. Ví dụ: adenosin deaminase
- Các nuclease: thủy phân liên kết este phosphat trong DNA hay RNA
d) Lyase: Xúc tác các phản ưng phân cắt không cần nước. Gồm các dưới lớp:
- Các decarboxylase: tách CO2 khỏi cơ chất. Ví dụ: glutamat decarboxylase
- Các aldolase: tách 1 phân tử aldehyd từ cơ chất.
- Các lyase: VD arginosuccinase.
- Các hydratase: gắn 1 phân tử nước vào cơ chất.VD: fumarase.
- Các dehydratase: tách 1 phân tử nước từ cơ chất. VD: -hydroxyacyl-ACP dehydratase.
- Các synthase: gắn 2 phân tử mà không cần có sự tham gia của ATP. Ví dụ: ATP
synthase, glycogen synthase, citrat synthase… 13
e) Isomerase: Xúc tác cho các phản ứng đồng phân hoá. Gồm các dưới lớp:
- Các racemase: chuyển dạng đồng phân D và L.
- Các epimerase: chuyển đồng phân epime. Ví dụ: ribose-5 phosphat epimerase.
- Các isomerase: chuyển đồng phân nhóm chức aldehyd và ceton.
- Các mutase: chuyển nhóm hóa học giữa các nguyên tử trong 1 phân tử.
f) Ligase (synthetase): Xúc tác cho các phản ứng tổng hợp có sử dụng liên kết giàu
năng lượng của ATP .v.v… Gồm các dưới lớp: - Synthetase.
- Carboxylase: Ví dụ: pyruvat carboxylase.
- Ligase: ví dụ DNA ligas.
4.3. Bản chất hóa học của enzym
Trừ một nhóm nhỏ ARN có tính xúc tác, tất cả enzym đều là protein. Tính chất
xúc tác phụ thuộc vào cấu tạo của protein. Enzym có trọng lượng phân tử khoảng
12.000 đến hơn 1000.000 Dalton. Enzym bị biến tính hay phân tách thành những tiểu
đơn vị thì hoạt tính xúc tác thường mất đi, tương tự protein, enzym bị phân cắt thành
những acid amin. Theo điều kiện hoạt động, người ta chia enzym thành 2 loại:
a) Enzym không cần cộng tố: là các enzym có bản chất protein thuần, gồm các
enzym thủy phân: pepsin, trypsin, cathepin...
b) Enzym cần cộng tố (cofactor): là các enzym protein tạp gồm 2 phần Protein
thuần + cộng tố (cofactor) = Holoenzym.
Protein thuần gọi là apoenzym.
Cộng tố: kim loại (Cu2+, Fe2+/Fe3+, Mn2+, Zn2+,...), chất hữu cơ (coenzym), kim
loại và chất hữu cơ. Coenzym là phân tử hữu cơ tương đối nhỏ, có thể thẩm tích được,
chịu được nhiệt. Trực tiếp tham gia vận chuyển điện tử, hydro, các nhóm hóa học,... Các
vitamin tan trong nước thường tham gia cấu tạo và hoạt động của coenzym.
Bảng 2.3. Một số coenzym và chức năng vận chuyển nhóm tương ứng Coenzym Vận chuyển Biocytin CO2 Coenzym A Nhóm Acyl 5’- Deoxyadenosylcobalamin
Nguyên tử H và nhóm alkyl (coenzym B12) Flavin adenin dinucleotid Điện tử Lipoat Điện tử và nhóm acyl
Nicotinamid adenin dinucleotid Ion Hydrid (:H-) Pyridoxal phosphat Nhóm Amin Tetrahydrofolat Nhóm 1 Carbon 14
4.4. Sự phân bố enzym 4.4.1. Trong tế bào
- Lysosom: AND-ase, ARN-ase, cathepsin, -glycuronidase, uricase …
- Ty thể: các enzym của chu trình Krebs, enzym oxy hóa acid béo, chuyển amin, khử amin…
- Nhân: aldolase, enolase, ATP-ase, photphoglyceraldehyd dehydrogenase, photphatase,…
4.4.2. Trong các tổ chức cơ quan
- Enzym phân hủy glucose: aldolase, photphohexo isomerase ... có trong xương,
gan, niêm mạc, ruột, thận, nhau thai.
- GOT có ở gan, tim, cơ vân; creatin kinase có trong cơ vân, cơ tim, não.
- Photphatase chỉ có ở tiền liệt tuyến.
Có sự liên quan mật thiết, xem xét mức độ đặc hiệu của enzym trong lâm sàng.
Qua thực tế xét nghiệm thấy rằng:
- GOT: ở gan > Tim >> Cơ
- GPT, SDH: ở gan >> Tim, cơ
- CPK: ở gan << Tim << cơ
- LDH: ở gan > Tim < cơ
4.4.3. Enzym ở huyết tương
a) Enzym chức năng huyết tương:
Loại này được tạo ra ở gan, có nồng độ ở máu tương đương hay cao hơn các tổ
chức, gồm các enzym và tiền enzym như lipoprotein, cholinesterase giả, ceruloptamin,
tiền enzym đông máu và tan cục máu.
b) Enzym không có chức năng huyết tương:
Hoạt độ của các enzym này ở huyết tương rất thấp, gồm các enzym từ các tuyến
tiết ra (amylase từ nước bọt, tuyến tụy; lipase, photphatase acid từ tuyến tiền liệt,…).
Các enzym nội bào bình thường không có ở huyết tương mà gắn chặt với các thành phần dưới tế bào.
4.4.4. Enzym ở nước tiểu
Thường có trọng lượng phân tử thấp, qua được thận, chủ yếu có nguồn gốc từ thận
được tách ra trong quá trình thay thế tế bào.
Enzym trong nước tiểu còn có thể có nguồn gốc từ hồng cầu, bạch cầu, các tế bào
biểu mô, chất bài tiết của các tuyến và vi khuẩn luôn đào thải ra đường tiểu.
4.5. Liên quan enzym và một số bệnh lý
4.5.1. Tăng tổng hợp enzym
- Photphatase acid tăng khi carcinoma tiền liệt tuyến.
- Cholinesterase tăng khi thận hư.
- CPK, aldolase tăng khi loạn dưỡng cơ tiến triển.
- GPT, OCT tăng trong viêm gan.
- Amylase, Lipase tăng trong viêm tụy.
- CPK, LDH tăng trong nhồi máu cơ tim.
- CPK tăng trong viêm đa cơ. 15
- Amylase, lipase tăng bài tiết tụy cản trở.
- Photphatase kiềm tăng khi tắc đường dẫn mật.
4.5.2. Giảm tổng hợp enzym
- Do khiếm khuyết về chuyển hóa. - Do bệnh lý về enzym.
- Tổn thương nặng cơ quan.
- Viêm xơ teo, ung thư dạ dày giảm uropepsinogen, pepsin.
- Thận hư tăng đào thải ceruloplasmin ra nước tiểu.
4.6. Ứng dụng enzym trong y học
Enzym có một vị trí quan trọng trong y học. Đặc biệt là các phương pháp định
lượng và định tính enzym trong hóa học lâm sàng và phòng thí nghiệm chẩn đoán. Do
đó, hiện nay trong y học đã xuất hiện lãnh vực mới gọi là chẩn đoán enzym, nhằm:
- Phân tích xác định nồng độ cơ chất như glucose, ure, cholesterol…với sự hổ trợ của enzym.
- Xác định hoạt tính xúc tác của enzym trong mẫu sinh vật.
- Xác định nồng độ cơ chất với sự hổ trợ của thuốc thử enzym đánh dấu.
Dùng enzym để định lượng các chất, phục vụ công việc xét nghiệm chẩn đoán
bệnh, ví dụ: kiểm tra glucose nước tiểu, urease để định lượng ure…
Dùng enzym làm thuốc ví dụ protease làm thuốc tắc nghẽn tim mạch, tiêu mủ vết
thương, làm thông đường hô hấp, chống viêm, làm thuốc tăng tiêu hóa protein, thành
phần của các loại thuốc dùng trong da liễu và mỹ phẩm…
Trong y học các protease cũng được dùng để sản xuất môi trường dinh dưỡng để
nuôi cấy vi sinh vật sản xuất ra kháng sinh, chất kháng độc… Ngoài ra người ta còn
dùng enzym protease để cô đặc và tinh chế các huyết thanh kháng độc để chữa bệnh.
Amylase được sử dụng phối hợp với coenzym A, cytocrom C, ATP, carboxylase
để chế thuốc điều trị tim mạch, bệnh thần kinh, phối hợp với enzym thủy phân để chữa
bệnh thiếu enzym tiêu hóa.
Bảng 2.4. Một số enzym sử dụng trong điều trị TÊN ENZYM NGUỒN GỐC ĐIỀU TRỊ Urate oxidase tái tổ hợp
Saccaromyces cereviciae Cao uric máu Lipase Rhiropus arrhizus trợ tiêu hoá - amylase tuỵ heo trợ tiêu hoá -amylase Aspergylus oryzae trợ tiêu hoá Urate oxidase tái tổ hợp Saccaromyces cereviciae Cao uric máu Lipase Rhiropus arrhizus trợ tiêu hoá 16 - amylase tuỵ heo trợ tiêu hoá -amylase Aspergylus oryzae trợ tiêu hoá Papain Carica papaya Làm sạch Nucleotid
của đĩa đệm cột sống bị lệch Pepsin dạ dày heo hỗ trợ chức năng dạ dày, loét DD Protease Bacillussubtilis Làm sạch vết thương Serrapeptase Serratia E 15 Kháng viêm Thrombin Huyết tương người Chảy máu ngoại biên, bệnh fibrin Plasmin Huyết tương người Làm sạch vết thương Lactase Nhiều nguồn Không dung nạp lactose Urokinase
Nước tiểu người hay tế bào Nhồi máu cơ tim cấp thận người CÂU HỎI LƯỢNG GIÁ
1. Vai trò chủ yếu của vitamin B6:
A. Tham gia vào cơ chế nhìn của mắt B. Chống bệnh pellagra
C. Tham gia vào quá trình đông máu
D. Là coenzym của những enzym xúc tác cho phản ứng trao đổi amin và
decarboxyl củamột số acid amin
2. Vitamin tham gia cấu tạo coenzym A là :
A.Vitamin E B. Vitamin B5 C. VitaminA D.VitaminB
3. Vitamin D cần thiết cho:
A. Quá trình chuyển hóa Ca2+và phosphor
B. Chuyển prothrombin thành thrombin 17 C. Qúa trình tạo máu D. Chống thiếu máu.
4. Trong lipid có thể chưá các vitamin sau : A. Vitamin C , Vítamin A B. Vitamin B1, B2 C. Vitamin PP, B6, B12 D. Vitamin A , D, E, K
5. Oxidoreductase là những enzym xúc tác cho các phản ứng: A. Oxy hóa khử B. Phân cắt C. Trao đổi nhóm D. Thủy phân
6. Lyase là những enzym xúc tác cho phản ứng: A. Tổng hợp B. Đồng phân C. Thủy phân D. Oxy hóa khử
7. Enzym Lipase thuộc loại: A. Lyase B. Isomerase C. Lygase D. Transferase
8. Trong viêm gan siêu vi cấp tính:
A. GOT tăng, GPT tăng, GOT tăng chủ yếu hơn GPT
B. GOT tăng, GPT tăng, GPT tăng chủ yếu hơn GOT C. GOT, GPT tăng như nhau D. Amylase máu tăng 9. Multienzym là: A. Tổng hợp nhiều enzym
B. Các dạng phân tử khác nhau của enzym
C. Nhiều enzym xúc tác cho nhiều phản ứng
D. Nhiều enzym khác nhau cùng xúc tác cho 1 quá trình chuyển hoá
10. Định nghĩa về đơn vị enzym (U/l) là:
A. Số lượng enzym xúc tác sự biến đổi 1 mol cơ chất trong 1 phút trong những điều kiện xác định
B. Số lượng cơ chất bị biến đổi bởi 1 mol enzym trong 1 phút trong những điều kiện xác định
C. Số lượng phức hợp enzym - cơ chất hình thành trong 1 đơn vị thời gian
D. Số lượng enzym xúc tác sự biến đổi 1 micromol cơ chất trong 1 phút trong
những điều kiện xác định 18
Chương 3: CHUYỂN HÓA CHUNG CỦA CÁC CHẤT Mục tiêu
1. Giải thích được bản chất của sự hô hấp tế bào.
2. Kể được các liên kết phosphat giàu năng lượng quan trọng trong cơ thể sống.
3. Trình bài được các giai đoạn của chu trình Krebs.
4. Tính được năng lượng giải phóng của sự hô hấp tế bào, chu trình Krebs.
5. Nêu được ý nghĩa của sự hô hấp tế bào, sự phosphoryl hóa và chu trình Krebs.
1. CHUYỂN HÓA CÁC CHẤT VÀ CHUYỂN HÓA TRUNG GIAN 1.1. Khái niệm
Để tồn tại và phát triển, cơ thể sống hấp thụ các chất khác nhau từ môi trường
ngoài, làm biến đổi các chất đó và một mặt tạo nên các yếu tố cấu tạo của bản thân cơ
thể sống, mặt khác thải vào môi trường ngoài các sản phẩm phân giải của chính cơ thể
cũng như các sản phẩm hình thành trong quá trình sống của cơ thể. Quá trình đó thực
hiện được là do các biến đổi hóa học liên tục xảy ra trong cơ thể. Người ta gọi toàn bộ
các biến đổi hóa học đó là sự trao đổi chất.
Sự trao đổi chất bao gồm nhiều khâu chuyển hóa trung gian, diễn ra phức tạp trong
từng mô, tế bào. Gồm 2 quá trình cơ bản: đồng hóa (tổng hợp) và dị hóa (phân giải) tạo
nên chu kỳ trao đổi chất liên tục.
Quá trình đồng hóa là sự hấp thụ các chất mới từ môi trường bên ngoài, biến đổi
chúng thành sinh chất của cơ thể; biến đổi các chất đơn giản thành chất phức tạp hơn,
sự tích lũy năng lượng cao hơn.
Ngược lại, dị hóa là sự biến đổi các chất phức tạp thành các chất đơn giản và giải
phóng năng lượng cần thiết cho hoạt động sống.
Trong quá trình dị hóa, xảy ra nhiều loại phản ứng hóa học như: oxy hóa-khử, thủy
phân, chuyển nhóm, tách nhóm, … Trong đó, oxy hóa-khử sinh học đóng vai trò quan
trọng nhất trong sự giải phóng năng lượng, một phần được tỏa ra dưới dạng nhiệt
(khoảng 50%), phần còn lại được tích trữ dưới dạng ATP (khoảng 50%).
Hai quá trình đồng hóa và dị hóa xảy ra liên tục liên quan với nhau và không tách
rời nhau. Quá trình đồng hóa là quá trình đòi hỏi năng lượng cho nên đồng thời phải xảy
ra quá trình dị hóa để cung cấp năng lượng cho quá trình đồng hóa.
1.2. Đặc điểm của quá trình trao đổi chất
Trao đổi chất và trao đổi năng lượng là bản chất của hoạt động sống ở mọi sinh
vật. Song song với sự trao đổi chất bao giờ cũng có kèm theo quá trình trao đổi năng lượng. 19
Quá trình chuyển hóa trong cơ thể sống mang tính thống nhất và riêng biệt. Nhìn
chung các con đường chuyển hóa lớn trong mọi cơ thể động vật, thực vật, đơn bào, đa
bào đều theo những giai đoạn tương tự nhau. Tuy nhiên, đi sâu vào từng mô, cơ quan,
cá thể từng loài thì lại có những nét riêng biệt.
Các phản ứng hóa học trong cơ thể xảy ra liên tục trong điều kiện pH trung tính,
nhiệt độ 37oC và enzym xúc tác.
Ở động vật, các quá trình chuyển hóa được điều khiển bởi hệ thống thần kinh.
1.3. Ý nghĩa của việc nghiên cứu quá trình trao đổi chất đối với Y - Dược học
Nắm được quy luật chuyển hóa của vật chất, điều khiển theo hướng có lợi cho con người.
Hiểu được nguyên nhân bệnh do rối loạn chuyển hóa, chẩn đoán bệnh sớm, chính xác.
Giải thích được các tác dụng dược lý của thuốc, giúp cho công tác nghiên cứu thuốc mới hoàn thiện.
2. CHUYỂN HÓA NĂNG LƯỢNG
2.1. Phản ứng oxy hóa - khử 2.1.1. Khái niệm
Trao đổi oxy hóa-khử là quá trình trao đổi điện tử giữa các chất tham gia phản ứng,
làm biến đổi số oxy hóa của chúng. Trong đó:
- Sự oxy hóa là sự tách một hay nhiều điện tử hoặc hydro.
- Sự khử là sự thu điện tử hoặc hydro.
Trong phản ứng oxy hóa-khử, sự oxy hóa và sự khử các chất diễn ra song song vì
điện tử được truyền từ chất bị oxy hóa sang chất bị khử
Phản ứng oxy hóa-khử thực chất gồm hai phản ứng ngược nhau nhưng luôn đi đôi
với nhau. Bao giờ cũng có chất oxy hóa và chất khử, tập hợp nhau thành cặp hay hệ thống oxy hóa-khử.
2.1.2. Thế năng oxy hóa-khử (E)
Tùy theo nhiệt độ các thành phần oxy hóa và khử mà một cặp oxy hóa-khử có xu
hướng nhận e- nhiều hay ít, xu hướng này tạo cho dung dịch một thế năng gọi là thế
năng oxy hóa-khử, được tính theo công thức Nernst: RT Cox E = Eo + ln nτ Ckh 20 Với: E: Thế năng oxy hóa-khử
Eo: Thế năng oxy hóa-khử chuẩn R: Hằng số lý tưởng
T: Nhiệt độ tuyệt đối
τ: Trị số Faraday (96,500 Coulomb hay 23,07 Kcal.vol-1.mol-1)
n: Số điện tử trao đổi
Cox: Nồng độ chất dạng oxy hóa trong dung dịch
Ckh: Nồng độ chất dạng khử trong dung dịch
Thế năng oxy hóa-khử biểu hiện sự cho và nhận e- của hệ thống: hệ thống có E
thấp, nồng độ chất khử lớn thì xu hương phóng e- cao nghĩa là hệ thống có E thấp dễ
cho e- và hệ thống có E cao dễ nhận e-. Hydro hay e- sẽ di chuyển từ hệ thống có thế
năng thấp đến hệ thống có thế năng cao.
2.2. Phosphoryl hóa và khử phosphoryl hóa 2.2.1. Định nghĩa
Sự phosphoryl hóa là sự gắn kết acid phosphoric (gốc phosphat) vào một phân tử
chất hữu cơ (R–H) dưới xúc tác của enzym phosphorylase. Phản ứng cần cung cấp năng
lượng để tích trữ trong những liên kết phosphat. Phosphorylase R – H + HO – PO3H2 R – PO3H2 + H2O (kinase)
Sự khử phosphoryl là sự cắt đứt liên kết phosphat nhờ enzym phosphatase, giải
phóng năng lượng (bằng năng lượng đã tạo thành liên kết phosphat). Phosphatase R – PO3H2 + H2O R – H + H3PO4
Phosphoryl hóa là một trong những phản ứng quan trọng bậc nhất trong chuyển
hóa các chất, đóng vai trò chủ yếu trong việc tích trữ và vận chuyển năng lượng.
2.2.2. Các loại liên kết phosphat
Căn cứ vào năng lượng tự do được giải phóng từ quá trình thủy phân cắt đứt các liên
kết phosphat, các liên kết phosphat được chia làm hai loại: liên kết phosphat nghèo năng
lượng và liên kết phosphat giàu năng lượng.
a) Liên kết phosphat nghèo năng lượng, ký hiệu: P
Khi thủy phân cắt đứt liên kết này chỉ có từ 1000 - 5000 calo được giải phóng.
Trong các liên kết phosphat chỉ có este phosphat là nghèo năng lượng.
b) Liên kết phosphat giàu năng lượng, ký hiệu: P
Khi thủy phân cắt đứt liên kết này, năng lượng giải phóng lớn hơn 7000 calo.
Một số liên kết phosphat giàu năng lượng:
- Liên kết pyrophosphat (Anhydrid phosphat): Adenin-Ribose-P~P~P (ATP) 21
- Liên kết acylphosphat: R-COO~P (tạo thành do gốc acid của chất hữu cơ kết hợp với gốc acid phosphoric).
- Liên kết enol phosphat: liên kết này được tạo thành do gốc acid phosphoric kết
hợp với nhóm chức của của chất hữu cơ.
- Liên kết Amit phosphat: do gốc acid phosphoric kết hợp với nhóm amin của chất hữu cơ: R-NH~P
Chất liên kết phosphat quan trọng nhất của cơ thể là ATP. ATP có một liên kết
este phosphat nghèo năng lượng và hai liên kết pyrophosphat giàu năng lượng.
Ngoài các liên kết phosphat giàu năng lượng còn các liên kết giàu năng lượng khác
như liên kết thioste, trong acetyl coenzym A (CH3-CO ~S CoA).
3. SỰ HÔ HẤP TẾ BÀO
Hô hấp tế bào là quá trình đốt cháy các chất hữu cơ trong cơ thể (quá trình oxy
hóa-khử tế bào hay quá trình oxy hóa sinh học) cho sản cuối cùng là CO2 và H2O. Trong
đó, sự kết hợp hydro và oxy tạo thành nước được gọi là sự hô hấp tế bào.
3.1. Bản chất của sự hô hấp tế bào
Ngoài cơ thể, oxy không khí trực tiếp tác dụng với carbon và hydro của các chất
hữu cớ để tạo thành CO2 và H2O. Phản ứng xảy ra rất nhanh và mạnh, năng lượng được
giải phóng ngay, tỏa nhiệt mạnh và có thể có ngọn lửa.
C6 H 12O6 + 6 O2 6 CO2 + 6 H2O + 688 kcal
Trong cơ thể, oxy không trực tiếp tác dụng với carbon và hydro của các chất hữu
cơ. Các phản ứng xảy ra qua từng bước, năng lượng được giải phóng dần và được tích
trữ lại, nhiệt độ không tăng cao và không có ngọn lửa.
CO2 được tạo thành do sự khử nhóm carboxyl của các phân tử hữu cơ dưới tác
dụng của enzym decarboxylase, phản ứng này không giải phóng nhiều năng lượng. R-COOH R-H + CO2
H2O được tạo qua một dây chuyền phản ứng gồm các quá trình tách dần hydro ra
khỏi cơ chất và vận chuyển qua một chuỗi dài các chất trung gian, cuối cùng tới oxy.
Trong quá trình này, hydro và oxy phân tử đều được hoạt hóa thành dạng ion H+ và O2-
dễ dàng kết hợp với nhau tạo thành H2O và giải phóng nhiều năng lượng.
Tóm lại, bản chất của sự HHTB là quá trình vận chuyển hydro từ cơ chất tới oxy
tạo thành nước, là quá trình vận chuyển điện tử và giải phóng năng lượng cho cơ thể.
3.2. Cơ chế của sự hô hấp tế bào
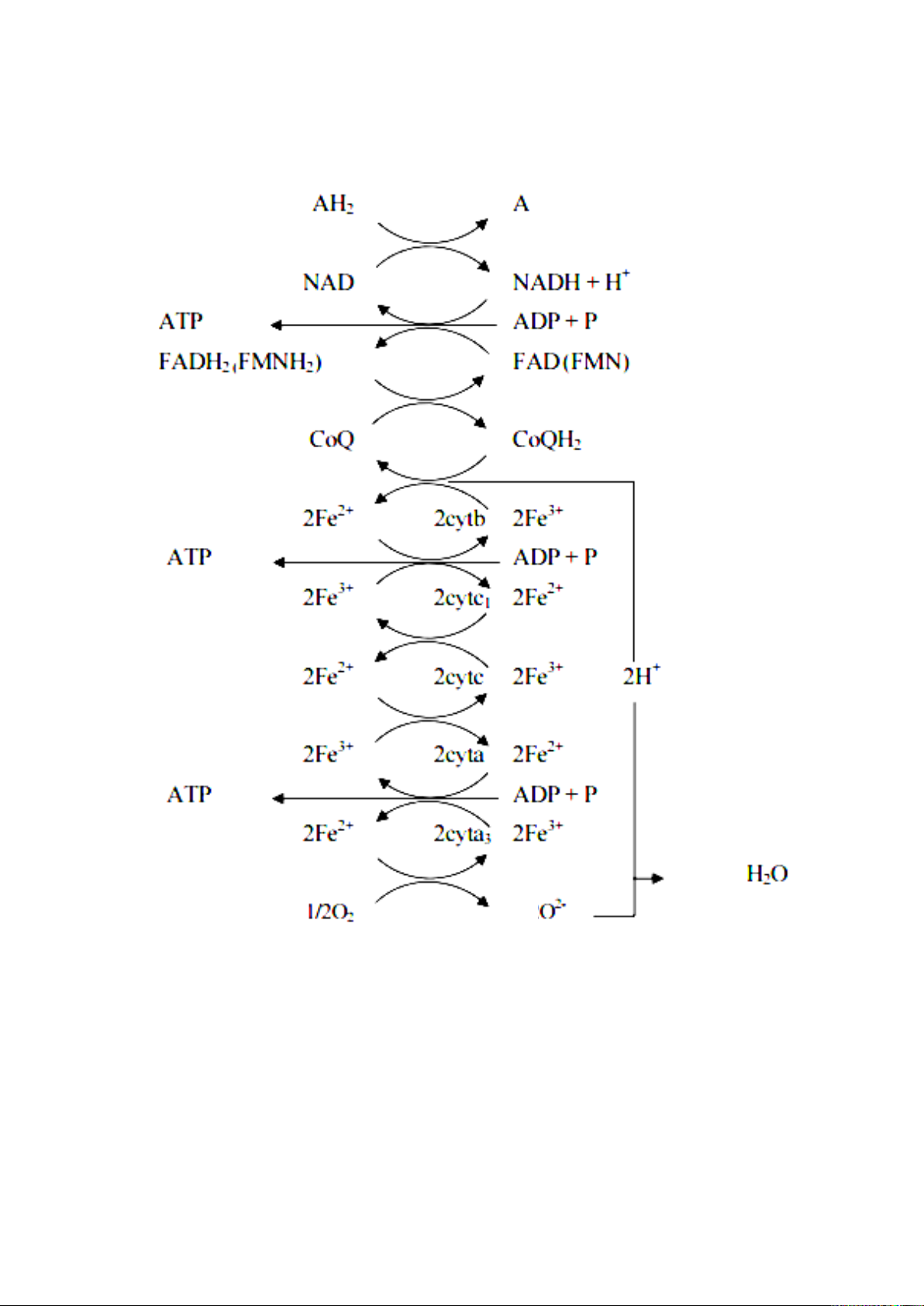
Có thể chia chuỗi hô hấp tế bào ra làm 5 giai đoạn:
- Giai đoạn 1: Chuyển hydro từ cơ chất (AH2) sang NAD+ (Nicotinamid Adenin
Dinucleotid) nhờ enzym dehydrogenase có coenzym NAD+:
AH2 + NAD+ A + NADHH+ (phần lớn chuyển cho chuỗi HHTB) 22
- Giai đoạn 2: NADHH+ chuyển hydro cho FAD (Flavin Adenin Dinucleotid
FMN) hoặc FMN (Flavin Mononucleotid) nhờ enzym dehydrogenase có coenzym FAD NADHH+ + FAD NAD+ + FADH2
Có trường hợp FAD (FMN) nhận hydro trực tiếp từ cơ chất mà không qua NAD+.
- Giai đoạn 3: FADH2 chuyển hydro cho coenzym Q FADH2 + CoQ FAD + CoQH2
- Giai đoạn 4: CoQH2 nhả hydro và chuyền điện tử đến hệ thống cytocrom (cyt),
từ cyt b cyt c1 cyt c cyt a cyt a3 (cyt a3 còn gọi là cytocrom oxydase hay enzym hô hấp warburg).
CoQH2 + 2cyt b Fe3+ CoQ + 2cyt b Fe2+ + 2H+
2cyt b Fe2+ + 2cyt c1 Fe3+ 2cyt b Fe3+ + 2cyt c1 Fe2+
2cyt c1 Fe2+ + 2cyt c Fe3+ 2cyt c1 Fe3+ + 2cyt c Fe2+
2cyt c Fe2+ + 2cyt a Fe3+ 2cyt c Fe3+ + 2cyt a Fe2+
2cyt a Fe2+ + 2cyt a3 Cu2+ 2cyt a Fe3+ + 2cyt a3 Cu+
- Giai đoạn 5: Cyt a3 chuyển điện tử cho oxy phân tử tạo thành ion O2-, O2- gắn
với 2H+ từ CoQH2 tách ra tạo thành phân tử nước:
2 cyt a3 Cu+ + ½ O2 2 cyt a3 Cu++ + O2- 2 H+ + O2- H2O
Thông thường sản phẩm cuối cùng của chuỗi HHTB là H2O, tuy nhiên cũng có
trường hợp xảy ra phản ứng sau:
2 cyt a3 Cu+ + ½ O2 2 cyt a3 Cu++ + 2O- 2 H+ + 2O- H2O2
H2O2 là một chất độc đối với tế bào, sau khi được hình thành, chất này sẽ bị thủy
phân ngay nhờ enzym catalase: H2O2 H2O + ½ O2
Toàn bộ chuỗi hô hấp tế bào từ cơ chất dạng khử AH2 tới oxygen phân tử qua AD,
flavoprotein, coenzym Q, hệ thống cytochrome được trình bày ở hình 3.1.
Như vậy, quá trình vận chuyển hydrogen đến oxygen tạo ra H2O, thực chất là một
quá trình trao đổi electron (cho và nhận) một cách liên tục. Bản chất của nó là một quá
trình oxy hóa khử. Vì vậy, người ta gọi hô hấp tế bào là oxy hóa-khử sinh học. Quá trình
trên được gọi là chuỗi trung bình, trong một số trường hợp, chuỗi HHTB có thể kéo dài
hay rút ngắn hơn phụ thuộc vào thế năng oxy hóa-khử của cơ chất.
- Khi oxy hóa pyruvat hoặc α-cetoglutarat, hydro tách ra được gắn vào lipothitamin
pyrophosphat (LTPP) rồi mới chuyển tới NAD+, gọi là chuỗi dài:
Cơ chất LTPP NAD+ FAD Cytocrom Oxy 23
- Khi oxy hóa acid béo, hydro từ cơ chất được chuyển thẳng tới FAD. Chuỗi HHTB
này được gọi là chuỗi ngắn
Cơ chất FAD Cytocrom Oxy
Hình 3.1. Sơ đồ chuỗi hô hấp tế bào 24
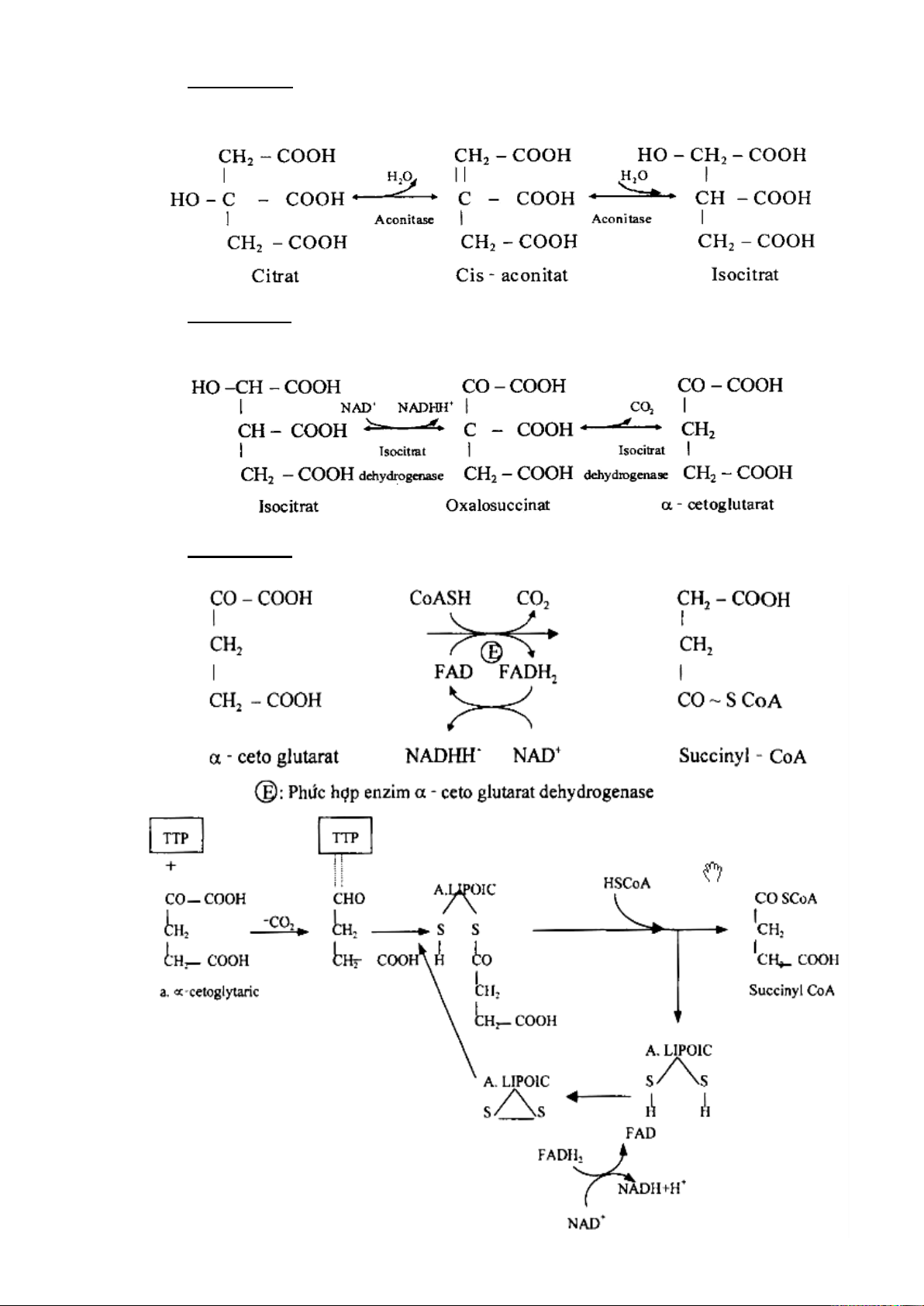
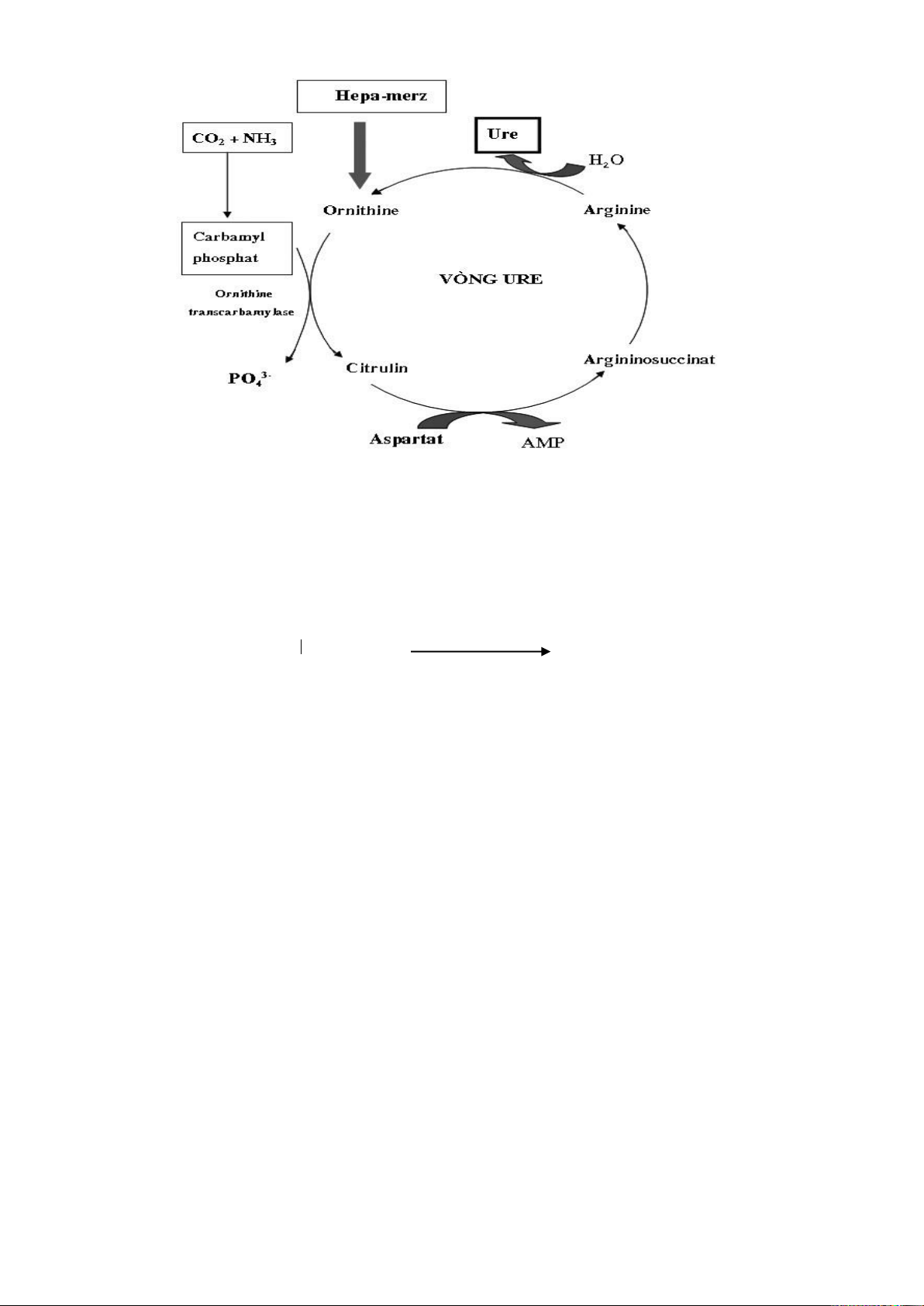
4. CHU TRÌNH KREBS (Chu trình acid citric, chu trình acid tricarboxylic)
Các chất glucid, lipid, protid đều bị thoái hóa trong tế bào đến một sản phẩm chung
là gốc acetyl coenzym A (acetyl CoA: CH3-CO ~ ScoA), chất này tiếp tục được oxy hóa
đến sản phẩm cuối cùng là CO2 và H2O. Quá trình này được thực hiện ở điều kiện hiếu
khí trong ty thể, được gọi là chu trình Krebs. α-Ketoglutarat
Hình 3.2. Sơ đồ chu trình Krebs
4.1. Các giai đoạn của chu trình Krebs
Người ta có thể chia chu trình Krebs thành 8 giai đoạn:
- Giai đoạn 1: ngưng tụ acetyl CoA với oxaloacetat (OOA) tạo thành citrat 25
- Giai đoạn 2: đồng phân hóa citrat thành isocitrat, qua trung gian là cis-aconitat
và được xúc tác bởi enzym aconitase.
- Giai đoạn 3: oxy hóa-khử carboxyl isocitrat thành α-ketoglutarat, qua chất trung
gian oxalosuccinat và enzym isocitrat dehydrogenase có coenzym NAD+.
- Giai đoạn 4: 26
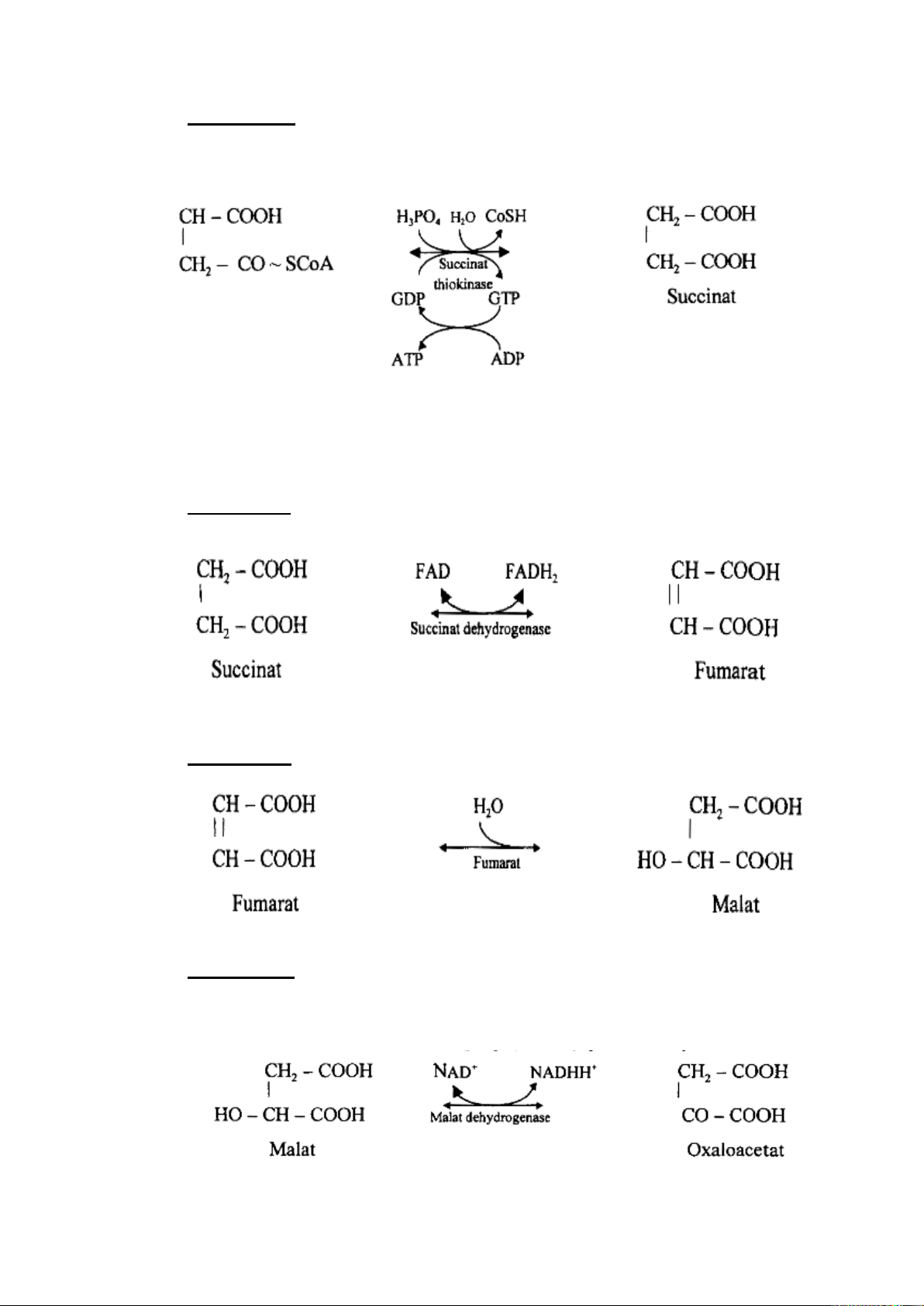
- Giai đoạn 5: tạo succinat từ succinyl CoA, succinat thiokinase (succinyl-CoA
synthetase) xúc tác và cần một acid phosphoric. Năng lượng giải phóng dưới dạng GTP, sau đó chuyển thành ATP.
- Giai đoạn 6: oxy hóa succinat thành fumarat, với enzym succinat dehydrogenase có coenzym FAD xúc tác.
- Giai đoạn 7: hydrat hóa fumarat thành malat, fumarase xúc tác.
- Giai đoạn 8: oxy hóa malat thành oxaloacetat, enzym malat dehydrogenase có
coenzym NAD+ xúc tác. Phản ứng đóng vòng chu trình Krebs và phân tử tiếp tục trở lại
ngưng tụ với một phân tử acetyl CoA mới. 27
4.2. Năng lượng giải phóng của chu trình Krebs
Kết quả của chu trình là sự oxy hóa hoàn toàn gốc acetyl, trong đó có hai phản ứng
khử carboxyl loại carbon dưới dạng CO2 và bốn phản ứng oxy hóa cung cấp 4 cặp hydro
để chuyển đến oxy trong chuổi HHTB tạo thành H2O và năng lượng.
Năng lượng đươc tích trữ trong chu trình Krebs bao gồm:
- Giai đoạn 3 giải phóng 1 NADHH+ vào chuỗi HHTB được 3 ATP
- Giai đoạn 4 giải phóng 1 NADHH+ vào chuỗi HHTB được 3 ATP
- Giai đoạn 6 giải phóng 1 FADH2 vào chuỗi HHTB được 3 ATP
- Giai đoạn 8 giải phóng 1 NADHH+ vào chuỗi HHTB được 3 ATP
- Giai đoạn 5 giải phóng 1 GTP được 1 ATP Tổng cộng: 12 ATP
4.3. Ý nghĩa của chu trình Krebs
Chu trình Krebs cung cấp nhiều cơ chất cho hydro, các chất này được chuyển đến
chuỗi HHTB để tạo năng lượng. Năng lượng tạo thành của chu trình, một phần tỏa ra
dưới dạng nhiệt, một phần tích trữ lại dưới dạng ATP cho cơ thể sử dụng trong các quá
trình tổng hợp và sinh học khác trong cơ thể.
Ngoài ra, chu trình Krebs còn là nơi cung cấp các sản phẩm trung gian cần thiết
như oxaloacetat, α-cetoglutarat, succinyl CoA, fumarat, … dùng cho các phản ứng tổng
hợp, chuyển hóa như: tổng hợp glucid, acid amin, hemoglobin, …
Chu trình Krebs là vị trí nối liền với các quá trình chuyển hóa khác của cơ thể nên
chu trình trở thành vị trí trung tâm điều hòa chuyển hóa các chất.
Chu trình Krebs có mối liên quan với HHTB và phosphoryl hóa: Chu trình Krebs
cung cấp cơ chất cho hydro cho chuỗi HHTB, trong chuỗi HHTB chúng bị oxy hóa để
tạo năng lượng, năng lượng này được phosphoryl hóa để tích trữ dưới dạng ATP.
CÂU HỎI LƯỢNG GIÁ
1. Bản chất của sự HHTB là:
A.Sự đốt cháy các chất hữu cơ
B.Sự oxy hóa khử tế bào
C.Sự đốt cháy các chất hữu cơ trong cơ thể
D.Sự kết hợp hydro và oxy để tạo thành nước
2. Sản phẩm cuối cùng của chuổi HHTB thường là: A. H2O B. CO2 và H2O C. H2O2 D. H2O và O2 28
3. Sự phosphoryl oxy hóa là :
A. Sự gắn oxy vào acid phosphoric
B. Sự gắn acid phosphoric vào ADP
C. Đi kèm theo phản ứng oxy hoá khử D. Gồm B và C
4. Năng lượng của chu trình acid tricarboxylic sinh ra là: A. 5 ATP B. 4 ATP C. 3 ATP D. 12 ATP
5. Sinh vật tự dưỡng là:
A. Thực vật và động vật B. Động vật C. Vi sinh vật
D. Động vật và vi sinh vật
6. Quang hợp là một quá trình không được tìm thấy ở: A.Thực vật B.Loài tảo
C. Các loài cây sống ở dưới nước
D.Cây không có lá màu xanh
7. Quá trình đồng hóa là:
A. Quá trình biến đổi G, L, P thức ăn thành acid amin, acid béo, monosaccarid...
B. Quá trình tổng hợp nên các chất G, L, P đặc hiệu cho cơ thể từ các chất khác
C. Quá trình tổng hợp thành một sản phẩm đồng nhất từ các chất khác D. Câu A và B 8. Quá trình dị hóa là:
A. Quá trinh giải phóng năng lượng
B. Quá trình thoái hóa các chất G, L, P thành các sản phẩm trung gian, các
chất này được đào thải ra ngoài.
C. Quá trình thoái hóa các chất G, L, P thành các sản phẩm trung gian, dẫn đến
các chất cặn bả rồi đào thải ra ngoài. D. Câu A và B 29
Chương 4. HÓA HỌC VÀ CHUYỂN HÓA GLUCID Mục tiêu
1. Trình bày được định nghĩa, phân loại và vai trò của glucid.
2. Nếu được cấu tạo và tính chất của các mono- và ligo-saccharid.
3. Trình bày được quá trình tiêu hóa và hấp thu glucid.
4. Trình bày được quá trình thoái hóa glucid ở tế bào và mô.
5. Trình bày được quá trình sinh tổng hợp glycogen.
6. Nêu được những nguyên nhân gây rối loạn chuyển hóa.
PHẦN 1. HÓA HỌC GLUCID 1. ĐẠI CƯƠNG 1.1. Khái niệm
Glucid là hợp chất hữu cơ mang năng lượng, có chứa các nguyên tố C, H, O, trong
phân tử có chứa một hay nhiều saccarid. Có công thức chung (CH2O)n. 1.2. Vai trò
Ở thực vật, glucid chiếm khoãng 80% trọng lượng khô, là thành phân các mô nâng
đỡ (cellulose) hay ở dạng tích trữ với lượng lớn (tinh bột). Ở động vật, hàm lượng glucid
thấp, thường không quá 2%.
Glucid là thành phần quan trọng trong mọi sinh vật. Trong cơ thể, glucid vừa có
vai trò cấu tạo vừa có vai trò chuyển hóa năng lượng. Nó có thể được tổng hợp từ một
lượng nhỏ lipid và protein, song phần lớn dược cung cấp từ thực vật. 1.3. Phân loại
1.3.1. Monosaccarid: (ose, đường đơn) là đơn vị cấu tạo của glucid không bị thủy phân
thành những chất đơn giản hơn, là chất có chứa nhiều nhóm rượu và một nhóm khử oxy
(aldehyd hay ceton).
1.3.2. Oligosaccarid: gồm 2-10 ose nối nhau bằng các liên kết glycosid. Tùy theo số
monosaccarid mà gọi tên khác nhau. Đơn giản và quan trọng nhất là các disaccarid.
a) Disaccarid: saccarose (đường mía), lactose (đường sữa), maltose.
b) Trisaccarid: maltosetriose, rafinose.
c) Oligosaccarid trong glycoprotein có thể chứa tới 14 monosaccarid.
1.3.3. Polysaccarid: là những glucid khi thủy phân cho ra nhiều đơn vị monosaccarid.
Tùy vào bản chất các thành phần tạo ra khi thủy phân mà có các tên gọi khác nhau. 30 2. MONOSACCARID
2.1. Cấu tạo và danh pháp
Bảng 4.1: Tên gọi của một số monosaccarid Số C Tên gọi theo số C CTPT Aldose Cetose 3 Triose C3H6O3 Aldo-triose Ceto-triose 4 Tetrose C4H8O4 Aldo-tetrose Ceto-tetrose Ribose Ribulose 5 Pentose C5H10O5 Aldo-penose Ceto-penose Glucose Fructose 6 Hexose C6H12O6 Aldo-hexose Ceto-hexose
Tùy theo số C trong mạch hydrocarbon mà có thể gọi tên các đường đơn là: triose,
tetrose, pentose, hexose. Cũng có thể chia saccharid thành 2 phân nhóm là aldose và
cetose dựa vào nhóm chức aldehyd hay ceton trong phân tử.
2.2. Tính chất của monosaccarid
Các monosaccarid là những chất không màu, không mùi tan trong nước, không tan
trong dung môi hữu cơ, tạo tinh thể khi cô đặc và có vị ngọt; có tính hoạt quang (trừ
biose vì không có C*- carbon bất đối xứng).
2.2.1. Tính chất do nhóm aldehyd, ceton
a) Phản ứng với các chất oxy hoá
- Chất oxy hoá nhẹ như nước brom: Đường aldose sẽ thành acid aldonic, với cetose phản ứng không xảy ra.
- Chất oxy hoá mạnh như HNO3 đậm đặc có sự oxy hoá xảy ra ở cả chức rượu bậc
một và chức aldehyd, đều chuyển thành acid.
- Nếu bảo vệ nhóm -OH glucoside bằng cách methyl hóa hay acetyl hoá trước khi
oxy hoá bằng nước brom, sản phẩm tạo thành là acid uronic.
- Tác nhân oxy hóa là Cu++: Trong môi trường kiềm nóng, các saccarid ở dạng
endiol không bền để khử nhanh các ion kim loại nặng (Cu++, Mg++…) có hoá trị cao
thành ion có hóa trị thấp hay các ion kim loại thành kim loại, làm đứt các nối đôi tạo hỗn hợp đường, acid.
b) Phản ứng với chất khử
- Tạo polyalcohol: Khi bị khử: monose sẽ biến thành polyalcohol.
- Tạo ozazon: Tác dụng với amin, các ozazon thường là các chất tinh thể, vì vậy
có thể dựa vào dạng tinh thể tạo thành để nhận ra loại monosaccarid tương ứng. 31
2.2.2. Tính chất của nhóm -OH
Các gốc rượu của monose có khả năng kết hợp với acid vô cơ và hữu cơ như:
CH3COOH, H2SO4, H3PO4 … để tạo thành este. Các este phosphat quan trọng thường
gặp trong chuyển hóa: glucose-6-phosphat, fructose-6-phosphat, ribose-5-phosphat…
2.2.3. Tính chất do nhóm -OH bán acetal, tạo thành liên kết glycosid
Tương ứng với các dạng vòng α, β của monosaccarid có thể thu được các dạng
liên kết α-, β-glycosid. Sự tạo thành các có thể xảy ra giữa các monosaccarid với nhau
để tạo thành oligo- và polysaccarid.
2.2.4. Các monosaccarid quan trọng
Bảng 4.2: Các pentose có vai trò sinh lý quan trọng Dấu hiệu lâm Đường Nguồn
Tầm quan trọng/ hóa sinh sàng
Chất trung gian trong quá trình
thoái hóa glucose . Tham gia D – Ribose Acid nucleic
vào cấu tạo acid nucleic và coenzym.
D – Ribulose Trong chuyển hóa Thoái hóa glucose. Gum gỗ, proteoglycan D – Xylose
Thành phần của glycoprotein và glycoamino-glycan trong nước tiểu D – Xylusoe
Chất trung gian trong con đường thoái hóa acid uronic của người pentose niệu
Bảng 4.3: Các hexose có vai trò sinh lý quan trọng Đường Nguồn Tầm quan trọng
Dấu hiệu lâm sàng
Dịch thủy phân tinh Đường vận chuyển qua Có trong nước tiểu người D – Glucose
bột, đường mía, máu và là dạng sử dụng bệnh đái tháo đường kèm maltose và lactose chính của các tổ chức tăng glucose/ máu Các dịch, mật ong, Không dung nạp fructose
Có thể biến đổi thành D – Fructose thủy phân đường bẩm sinh tích lũy glucose ở gan và ruột mía và inulin.
fructose hạ đường máu Chuyển hóa thành
glucose ở gan và được Không có khả năng
tổng hợp ở tuyến vú tạo chuyển hóa gây galactose
D – Galactose Thủy phân lactose lactose, thành
phần huyết và bệnh đục thủy
chính của glycolipid, tinh thể glycoprotein
Thủy phân mốt số thành phần của nhiều D - Mannose gum và nhựa cây glycoprotein 32 3. OLIGOSACCARID
Do các monose liên kết nhau bằng liên kết glycosid, tạo thành giữa -OH glucosid
của ose này với -OH glucosid của ose kia, hay giữa nhóm -OH glucosid của ose này với
-OH không phải glucosid của ose kia. Disaccarid chỉ có tính khử khi ít nhất một trong
2 nhóm -OH glucosid ở trạng thái tự do.
- Disaccarid khử tiêu biểu như maltose, lactose, trong thành phần phân tử còn chứa nhóm -OH glucosid.
- Disaccarid không khử tiêu biểu như saccarose, trong thành phần phân tử không chứa nhóm -OH glucosid.
Các disaccarid có vai trò sinh lý quan trọng: 3.1. Maltose
Do 2 phân tử α-D-glucose liên kết với nhau ở vị trí C1-C4, nhóm -OH glucosid ở
C1 của phân tử này kết hợp với nhóm -OH rượu của phân tử kia ở C4.
Maltose it gặp ở trạng thái tự do, thường thu nhận bằng cách thủy phân tinh bột,
có nhiều trong mầm lúa và mạch nha (maltum) nên gọi nó là maltose.
3.2. Lactose (đường sữa)
Do một phần tử β-D-galactose và một phân tử β D-glucose kết hợp với nhau nhờ
nhóm ở vị trí C1-C4. Lactose có trong sữa người và động vật nên còn gọi là đường sữa. 3.3. Saccarose
Do một phần tử α-D-glucose liên kết với một phân tử β-D-fructose qua 2 nhóm -
OH glucosid ở vị trí C1-C2, do đó nó không có tính khử. Saccharose còn gọi là đường
mía, đường củ cải, rất phổ biến trong thiên nhiên, có ý nghĩa quan trọng đối với dinh dưỡng của người. 4. POLYSACCARID
Polysaccarid là đường đa, có trọng lượng phân tử rất cao, do nhiều gốc
monosaccarid kết hợp với nhau nhờ các kiểu liên kết α- hoặc β-glycosid. Công thức chung: (C6H10O5)n.
Tùy vào thành phần monose, polysaccarid được chia thành polysaccarid thuần
(chứa một loại monose) và polysaccarid tạp (có ít nhất 2 loại monose).
Polysaccarid đóng vai trò quan trọng trong đời sống động-thực vật. Tùy theo
nguồn gốc được chia thành các nhóm: polysaccarid thực vật, động vật, vi sinh vật. Một
số polysaccarid thường gặp như tinh bột, glycogen, cellulose...
4.1. Polysaccharid thuần 4.1.1. Tinh bột
Đây là nguồn glucid quan trọng trong khẩu phần thức ăn của người và động vật.
Tinh bột là một polysaccarid dự trữ của thực vật, có nhiều trong các loại củ, hạt ngũ cốc
… có hình dạng, kích thước cấu tạo khác nhau tùy nguồn gốc. 33
Tinh bột không tan trong nước, đun nóng thì hạt tinh bột phồng lên rất nhanh tạo
thành dung dịch keo gọi là hồ tinh bột. Phản ứng đặc trưng để nhận biết tinh bột là tác
dụng với iod, cho màu xanh tím.
Tinh bột có cấu tạo hai phần: amylose và amylopectin, ngoài ra có khoảng 2%
phospho dưới dạng ester. Tỷ lệ amylopectin/amylose ở các đối tượng khác nhau là khác
nhau. Amylose và amylopectin khác nhau về cấu tạo và tính chất. 4.1.2. Glycogen
Là polysaccarid dự trữ ở động vật được tìm thấy trong gan và cơ, hiện nay còn
tìm thấy trong một số thực vật như ngô, nấm.
Có cấu tạo giống amylopectin, nghĩa là trong phân tử có chứa liên kết α-(1-4) và
α-(1-6) glucosid, nhưng phân nhánh nhiều hơn và độ dài mạch nhánh ngắn hơn, mỗi
nhánh gồm 11-18 gốc α-D-glucose. 4.1.3. Cellulose
Là thành phần chủ yếu của vách tế bào thực vật, gồm nhiều mạch thẳng chứa các
đơn vị β-D-glucopyranose liên kết với nhau bằng liên kết 1-4 glucosid. Cellulose có
dạng hình sợi dài, nhiều sợi kết hợp song song với nhau thành chùm nhờ các liên kết
hydro, mỗi chùm chứa khoảng 60 phân tử cellulose.
Ở người, cellulose không có giá trị dinh dưỡng vì không bị thủy phân trong ống
tiêu hóa. Một số nghiên cứu cho thấy nó có vai trò trong điều hòa tiêu hoá.. 4.2. Polysaccarid tạp 4.2.1. Acid hyaluronic
Acid hyaluronic rất phổ biến, là thành phần quan trọng của mô liên kết, tìm thấy
trong dịch khớp xương, trong thủy tinh thể mắt, có tác dụng vận động và bảo vệ bên
trong tế bào để chống lại sự xâm nhập của vi khuẩn cũng như các chất độc khác. Acid
hyaluronic có trọng lượng phân tử rất lớn, cấu tạo bởi chuỗi disaccarid lặp lại gồm: acid
β-glucuronic và N-acetylgalactosamin sulfat (β1-3).
Acid hyaluronic bị thủy phân bởi hyaluronidase, enzym này được tìm thấy trong
vi khuẩn gây bệnh, trong tinh trùng. Hyaluronidase tạo dễ dàng cho tinh trùng đi vào
noãn của buồn trứng, mặt khác nó cũng là yếu tố giúp cho các chất khác và vi khuẩn gây
bệnh đi vào các mô trong cơ thể.
4.2.2. Chondroitin sulfat
Đươc cấu tạo bởi chuỗi disaccarid lặp lại gồm: acid β-glucuronic và N-
acetylgalactosamin sulfat (β1-3). Chứa nhiều trong mô liên kết, là thành phần không thể
thiếu được ở mô xương sụn dưới dạng phức chất nhầy chondromucoid. 4.2.3. Heparin
Là glycosaminoglycan acid, gồm acid iduronic và glucosamin gắn sulfat. Được
tìm thấy đầu tiên ở gan, sau đó là ở cơ, tim, phổi, … có tác dụng chống lại sự đông máu
và ngăn chặn sự biến đổi prothrombin thành thrombin. Được dùng làm chất ổn định máu và chống đông máu. 34
Heparin còn có tác dụng giải phóng lipoproteinase từ tổ chức vào huyết tương.
Enzym này xúc tác sự phân hủy các phức hợp lipoprotein trong quá trình vận chuyển và chuyển hóa lipid.
PHẦN 2. CHUYỂN HÓA GLUCID
1. TIÊU HÓA, HẤP THU VÀ NHU CẦU 1.1. Sự tiêu hóa
Quá trình tiêu hóa glucid từ thức ăn nhờ sự thủy phân của các ezym trong hệ tiêu
hóa tạo thành sản phẩm của glucid là disaccarid, monosaccarid. Sản phẩm cuối cùng
chủ yếu là các glucose và một số ít là fructose, galactose .... 1.2. Sự hấp thu
Sản phẩm thủy phân glucid là các monosaccharid được hấp thụ qua tế bào niêm
mạc ruột thường xảy ra ở đầu phần ruột non, qua tĩnh mạch cửa đến gan.
Ở gan, một phần glucose được gan sử dụng, một phần được dữ trữ ở gan dưới dạng
glycogen, phần còn lại qua tĩnh mạch cửa trên gan và máu để cung cấp glucose cho gan,
thần kinh, hồng cầu và các mô khác sử dụng.
1.3. Nhu cầu Glucid trong cơ thể
Ở người trưởng thành, nhu cầu tối thiểu hàng ngày 180g glucose để cung cấp
năng lượng cho các tế bào, đảm bảo duy trì nồng độ glucose trong máu : 60-100 mg/dl.
2. CHUYỂN HÓA GLUCID Ở TẾ BÀO VÀ MÔ
Trong các tế bào của các tổ chức, glucose tự do được tạo ra một phần do thoái hoá
glycogen hoặc do tế bào lấy từ máu ngoại biên vào. Glucose chỉ có thể đi vào con đường
thoái hoá khi nó ở dạng glucose-6-phosphat. Từ glucose-6-phosphat có thể theo nhiều
con đường thoái hoá như: (1) Con đường đường phân (glycolysis, hexose diphosphat);
(2) con đường hexose monophosphat hay chu trình pentose phosphate; (3) con đường acid uronic.
2.1. Thoái hóa theo con đường Hexose Diphosphat (HDP)
Quá trình oxy hoá glucose đến pyruvat gọi là quá trình đường phân (glycolysis).
Được chia thành 2 giai đoạn:
Giai đoạn 1: 2 lần phosphoryl hóa G DOAP. GAP (5 phản ứng).
- Phản ứng 1: phosphoryl hóa lần 1, tạo glucose-6-phosphat (G6P), cần 1 ATP,
enzym xúc tác (hexokinase/glucokinase).
- Phản ứng 2: đồng phân hóa G6P <=> fructose-6-phosphat (F6P)
- Phản ứng 3: phosphoryl hóa lần 2, F6P F1,6-diphosphat, cần ATP thứ 2.
- Phản ứng 4: phân cắt F1,6-diphosphat = DOAP + GAP, nhờ aldolase.
- Phản ứng 5: đồng phân hóa DOAP = GAP
Giai đoạn 2: Oxy hóa GAP Pyruvat (5 phản ứng) -
Phản ứng 6: GAP bị Oxy hóa bởi GAPDH tạo 1,3-ĐPG (1,3-Diphophoglycerat) và NADH2. -
Phản ứng 7: Cắt đứt liên kết (~), cần P-glyceratkinase: 1,3 DPG ↔ G3P +ATP
- Phản ứng 8: Chuyển 3P-G = 2-PG, glyceromutase 35
- Phản ứng 9: Loại H2O, 2-PG =>P.E.P (có Lk ~/C2) P.E.P = Phospho Enol Pyruvat
- Phản ứng 10: P.E.P cắt đứt liên kết ~ tạo ATP và Pyruvat, pyruvatkinase
Hình 4.1. Thoái hoá glucose theo con đường hexose diphosphat
Sự thoái hóa tiếp tục của acid pyruvic
Tùy theo điều kiện môi trường và điều kiện phản ứng, acid pyruvic đi theo những con đường khác nhau:
Trường hợp yếm khí: Acid pyruvic chuyển thành lactat.
Trường hợp hiếu khí: Acid pyruvic bị khử carboxyl oxy hóa thành Acetyl CoA,
với sự tham gia của hệ thống men phức tạp gồm: thiamin pyrophosphat, acid lipoic,
CoA, NAD+, ion Mg++ tham gia kích thích phản ứng.
Acetyl CoA tiếp tục được thoái hóa trong chu trình Krebs cho ra sản phẩm cuối
cùng là TP, CO2 và H2O. 36 Ý NGHĨA
Đường phân “ái khí”: Cung cấp năng lượng lớn nhiều so với ĐP “yếm khí” cho
38ATP từ 1glucose, 39ATP từ glucosyl/glycogen Phản ứng 1-10: 2 ATP
Phản ứng 6: 2NADH2 – HHTB 6 ATP
Phản ứng 11A: 2NADH2 – HHTB 6 ATP 2AcetylCoA- Krebs 24 ATP 38 ATP
Cung cấp các sản phẩm trung gian quan trọng: acid pyruvic, acetylCoA.
2.2. Thoái hóa theo con đường Pentose Monophosphat (Hexose monophotphat – HMP)
Glucose chi được phosphoryl hóa một lần tạo (GP6). Gồm 2 giai đoạn:
a). Oxy hóa trực tiếp glucose-6-phosphat thành pentose phosphat
Với sự xúc tác của enzym tương ứng đặc biết là glucose-6-phosphat
dehydrogennase (G6PD) và 6 phosphogluconat dehydrogenase (6PGD). Các coenzym
có bản chất là nucleotid.
NADPH, H+ được tạo thành tham gia các quá trình tổng hợp acid béo, cholesterol, hormon steroid. b). Chu trình Pentose
Có thể tóm tắt các con đường chuyển hóa glucid trong hình sau đây: 37
2.3. Ý nghĩa - Liên quan giữa Hexose diphosphat và Pentose monophosphat:
Chính phosphoglyceraldehyd (PGA) và frutose-6-phosphat (F6P) (6C) là những
mốc liên quan giữa chu trình pentose và 2 HDP.
F6P có thể được đồng phân hóa thành G6P và 2 GPA có thể biến thành F1,6 DP
thành G6P tùy theo nhu cầu của tế bào mà quá trình thoái hóa diễn ra với mức độ khác nhau.
Nếu nhu cầu về ribose-5-phosphat (R5P) nhiều hơn nhu cầu về NADPH,H+, đa
số G6P biến thành F6P theo con đường HDP.
Nếu nhu cầu về NADPH,H+ bằng nhu cầu về R5P: xảy ra giai đoạn oxy tạo
thành 2 NADPH,H+ và 1 R5P từ G6P.
Nếu nhu cầu về NADPH,H+ lớn hơn so với R5P: vừa xảy ra giai đoạn 1 (tạo 2
NADPH,H+ và 1 R5P) và cả giai đoạn 2 (chu trình pentose). Như vậy từ 1 phân tử
G6P tạo được 12 NADPH,H+; 6 phân tử G6P thoái hóa theo cả hai giai đoạn của con
đường HMP thì tái tạo trả lại 5 phân tử (qua phản ứng chuyển F6P G6P) và tạo được 12 NADPH,H+.
Tóm lại: ý nghĩa chủ yếu của con đường HDP là sự tạo hình. HDP xảy ra chủ yếu
ở những mô cần năng lượng, HMP ở những mô cần tổng hợp một số chất (vỏ thượng
thận, tuyến giáp, gan, tuyến vú, hồng cầu…)
Trường hợp thiếu enzym glucose-6-phosphat dehydrogenase (G6PD) ở hồng cầu
làm hồng cầu dễ bị vỡ. Bệnh nhân dễ bị những cơn tiêu huyết nặng sau khi uống một số
thuốc có tính oxy hóa như thuốc sốt rét, sulfamid,… ở hồng cầu không có ty thể không
có sự hoạt động của chu trình Krebs, glucose được sử dụng theo quá trình đường phân
và con đường HMP, NAPDH,H+ cần thiết để giữ glutathion ở dạng khử (G-SH), giúp
cho sự nguyên vẹn ổn định cấu trúc hồng cầu. 3. TẠO ACID URONIC
Xảy ra: động vật (tế bào gan, bào quan tế bào), thực vật.
Sơ đồ 4.1. Vòng tròn acid uronic 38 Gồm 3 giai đoạn:
Tạo acid glucuronic từ G6P (quan trọng nhất).
Biến đổi L-gulonat acid ascorbic/thực vật.
Tạo xylose-5P từ L-gulonat, sau đó xylose-5P G6P ban đầu. Ý nghĩa:
Cung cấp acid glucuronic: liên hợp với bilirubin tự do tạo Bilirubin liên hợp (vai
trò liên hợp khử độc/gan).
Tổng hợp vitamin C (ở thực vật).
4. SỰ TỔNG HỢP GLUCOSE
Não và hồng cầu sử dung glucose là nguồn năng lượng chính nhưng lại không tổng
hợp được glucose. Sự tổng hợp glucose xảy ra khi đói và khi cạn kiệt glycogen dự trữ.
Chức năng này rất cần thiết đối với việc cung cấp glucose cho các mô, đặc biệt mô thần
kinh. Cơ quan chủ yếu của sự tân tạo glucose là gan và khoảng 10% được tân tạo ở thận (phần vỏ) và ruột.
Sơ đồ 4.2. Sơ đồ tổng hợp Glucose 39
Các giai đoạn đặc biệt của quá trình tổng hợp glucose
Quá trình tổng hợp glucose (tân tạo glucose) sử dụng các enzym của con đường
đường phân. Có 3 enzym trong con đường đường phân không xúc tác phản ứng thuận
nghịch đó là hexokinase, phosphofructokinasevà pyruvat kinase.
Các phản ứng tân tạo glucose gồm những phản ứng gần như ngược lại của con
đường đường phân, trừ 3 enzym không xúc tác thuận nghịch .
Từ pyruvat thành PEP phải trải qua các phản ứng sau: trước hết pyruvat vào trong
ty thể, dưới tác dụng của pỵruvat carboxỵlase cần ATP để pyruvat chuyển thành
oxaloacetat, sau khi tạo thành malat, malat được chuyển ra bào tương nhờ con thoi
malat-aspartat (chất vận chuyển dicarboxylat), ở bào tương malat chuyển thành
oxaloacetat rồi carboxyl hóa dưới tác dụng của phosphoenol pyruvat carboxykinase cần GTP tạo thành PEP.
Phản ứng từ Fl,6DP thành G6P cần enzym fructose - 1,6-diphosphatase.
Phản ứng từ G6P thành glucose cần sự xúc tác của glucose-6-phosphatase
Năng lượng cần thiết để tổng hợp glucose từ pyruvat có thể viết:
2Pyruvat + 2NADH + 4H+ +4ATP + 2GTP +6H20 Glucose + 2NAD+ + 4ADP + 2GDP + 6Pi
5. SINH TỔNG HỢP GLYCOGEN
Quá trình tổng hợp glycogen là quan trọng, được tiến hành ở các mô, tế bào nhưng
chủ yếu là ở gan và cơ.
Có sự khác nhau giữa gan và cơ: -
Cơ có thể tổng hợp glycogen chủ yếu từ glucose. -
Gan: ngoài glucose, có thể sử dụng nguyên liệu khác như fructose,
mannose, galactose và các sản phẩm chuyển hóa khác (acid pyruvic, acid lactic).
5.1. Quá trình tổng hợp glycogen từ glucose
a) Tạo UDP-glucose
- Phosphoryl hóa glucose tạo glucose-6P nhờ enzym hexokinase, hoặc glucosekinase ở gan:
- Biến đổi glucose-6P thành glucose-1P nhờ enzyme phosphoglucomutase:
- Glucose-1P tác dụng với UTP tạo thành UDP-glucose
b) Tạo mạch thẳng:
Glycogensyntetase vận chuyển glucose từ UDP-glucose thêm vào một dây
glycogen sẵn có tạo liên kết α(1 -4). Phản ứng tổng quát:
UDP – glucose + (C6H10O5)n UDP + (C6H10O5)n+1 40
c) Tạo mạch nhánh:
Khi có trên 10 gốc glucose nối vơi nhau bởi liên kết α (1 -4), nhờ enzyme gắn
nhánh là 1,4->1,6 transglucosidase. Enzym “gắn nhánh” là enzyme có khả năng cắt liên
kết σ(1-4) và vận chuyển một đoạn osid của mạch thẳng đến C6 của một phân tử glucose
của mạch khác tạo nên mạch nhánh mới (tạo σ(1-6)).
5.2. Tổng hợp glycogen từ các ose khác
Các đường đơn khác nhau, khi ăn vào cơ thể tới gan, cuối cùng đều được chuyển hóa thành glucose.
- Fructose được chuyển hóa thành glucose:
Fructose F6P G6P
- Mannose cũng được chuyển hóa tương tự fructose:
Mannose M6P G6P
6. RỐI LOẠN CHUYỂN HÓA GLUCID
6.1. Hệ thống điều hòa đường huyết
Sơ đồ 4.3. Hệ thống điều hòa đường huyết 41
a) Insulin: Do tế bào β của tuyến tụy tiết ra, gây hạ đường huyết, có tác dụng làm giảm glucose:
- Làm tăng sử dụng glucose ở tất cả các mô nhất là tế cơ, xương, tim và mô mỡ.
- Tăng tổng hợp glycogen bằng cách tăng hoạt động glycogen synthase.
- Giảm sự phân ly glycogen ở gan, cơ.
b) Glucagon: Do tế bào của tụy tiết ra tác động lên gan kích thích gan phân giải
glycogen thành glucose vào máu.
c) Adrenalin: Sự co cơ hay kích thích thần kinh tuyến thượng thận giải phóng
adrenalin kích thích gan phân giải glycogen cung cấp năng lượng cho cơ hoạt động.
d) Thyroxin: Hormon tuyến giáp, làm tăng glucose máu do: tăng hấp thu glucose ở
ruột, tăng phân ly glycogen ở gan.
e) Glucocorticoid: Hormon vỏ thượng thận, làm tăng đường huyết:
- Tăng hấp thu glucose ở ruột. - Tăng tân tạo glucose. - Tăng phân ly glycogen.
- Ức chế tiêu dùng glucose ở các mô ngoài gan.
f) Hormon tăng trưởng: Hormon tuyến yên trước làm tăng đường huyết do giảm
tổng hợp và tăng phân hủy glycogen, giảm sự thấm glucose và các mô.
g) ACTH: kích thích vỏ thượng thận tiết hormon steroid trong đó có glucocorticoid.
6.2. Rối loạn chuyển hóa glucid
Mức độ dung nạp glucose là khả năng sử dụng glucose của cơ thể thay đổi tùy theo
các hiện tượng bệnh lý.
Dung nạp glucose giảm trong bệnh đái tháo đường do bài tiết insulin kém, tổn
thương gan, bệnh nhiễm khuẩn, béo phì và đôi khi trong xơ vữa động mạch.
Insulin gây tăng sử dụng glucose đồng thời với việc dự trữ dưới dạng glycogen ở
gan và cơ. Sự tăng dung nạp glucose còn có thể gặp trong những trường hợp suy tuyến
yên hay vỏ thượng thận làm giảm tác dụng đối kháng bình thường với insulin dẫn đến thừa hormon này.
a) Bệnh đái tháo đường
Có hai dạng đái tháo đường tụy: type 1 được gọi là type trẻ vì xảy ra ở trẻ em và
người nhỏ tuổi, type 2 xảy ra ở người lớn tuổi và đặc biệt có thể trạng mập.
Đặc điểm ở người đái đường tụy:
- Nồng độ glucose trong máu tăng.
- Tăng thể ceton và acid béo tự do trong máu. - Mất muối.
- Tăng lượng nước tiểu, tăng ure.
- Mô và tế bào đói năng lượng. 42
Nguyên nhân do thiếu insulin, khả năng vận chuyện glucose qua màng tế bào bị
giảm và quá trình phosphoryl hóa glucose bị giảm. Nồng độ glucose tăng cao ở khu vực
ngoài tế bào như máu và dịch gian bào. Trong khi tế bào không có glucose để chuyển
hóa, nên lâm vào tình trạng đói năng lượng tế bào. Tế bào phải tăng cường thoái hóa các
cơ chất khác, nhất là lipid.
Quá trình thoái hóa lipid tạo nhiều acetyl CoA. Acetyl CoA lại không được oxy
hóa hết trong chu trình acid citric vì thiếu oxaloacetic (sản phẩm được tạo ra chủ yếu
bởi acid pyruvic của quá trình thoái hóa glucose). Acetyl CoA bị ứ đọng, chuyển hóa
theo hướng tạo thể ceton. Chất này được đào thải qua đường tiểu và hơi thở. Vì tăng đào
thải thể ceton trong nước tiểu sẽ kết hợp với tăng thải muối.
b) Bệnh rối loạn chuyển hóa glycogen
Một số enzym trong quá trình thoái hóa glycogen bị giảm hoặc mất hoạt tính xúc
tác do thiếu hụt hay sai lệnh về cấu trúc (bệnh Von Gierke do thiếu G-6-Pase) dẫn đến
tình trạng ứ đọng glycogen hoặc sản phẩm thoái hóa dở dang của ở các tổ chức, đặc biệt
là ở gan và cơ. Biểu hiện thường gặp trên lâm sàng là: gan to, rối loạn hoạt động cơ, hạ đường huyết khi đói.
c) Bệnh galactose huyết bẩm sinh
Do thiếu galactose-uridin-transfrase nên không có phản ứng biến đổi galactose
thành glucose. Trên lâm sàng, trẻ không dung nạp được sữa (tiêu chảy, nôn sau khi bú,
suy dinh dưỡng). Galactose bị ứ đọng tại gan gây suy gan, dẫn đến tử vong.
d) Bệnh hạ đường huyết tự phát
Là do có khối u tế bào β của các đảo Langerhans (ở phần thân tụy) gây tiết insulin.
Hậu quả là thường xuyên bị hạ đường huyết dẫn đến những cơn hôn mê ở thời điểm xa bửa ăn.
CÂU HỎI LƯỢNG GIÁ
1. Các chất nào sau đây là Polysaccarid tạp:
A. Cellulose, tinh bột, heparin.
B. Heparin, acid hyaluronic, cellulose.
C. Tinh bột, condroitin sunfat, heparin.
D. Condroitin sunfat, heparin, acid hyaluronic.
2. Các nhóm chất sau đây, nhóm nào có cấu tạo phân nhánh: A. Amylopectin, Cellulose. B. Cellulose, Amylose. C. Dextrin, Cellulose. D. Amylopectin, Glycogen. 43
3. Trong các chất sau đây, chất nào tác dụng với Iod cho màu đỏ nâu: A. Cellulose. C. Amylodextrin B. Glycogen D. Maltodextrin
4. Trong các chất sau đây, chất nào tác dụng với Iod cho màu xanh: A. Tinh bột C. Amylodextrin B. Glycogen D. Amylopectin
5. Nhóm chất nào là Mucopolysaccarid
A. Acid hyaluronic, Cellulose và Condroitin Sulfat.
B. Acid hyaluronic, Condroitin Sulfat và Heparin.
C. Acid hyaluronic, Cellulose và Dextran.
D. Cellulose, Condroitin Sulfat và Heparin.
6. Chất nào không có tính khử A. Saccarose. B. Lactose C. Mantose D. Galactose
7. Phản ứng Molish dùng để nhận định: A. Các chất là Protid. B. Các chất là acid amin.
C. Các chất có nhóm aldehyd. D. Các chất là Glucid.
8. Glucose và Fructose khi bị khử (+2H ) sẽ cho chất gọi là: A. Ribitol. C. Mannitol. B. Sorbitol. D. Alcol etylic.
9. Phản ứng Feling dùng để nhận định: A. Saccarose. B. Lactose C. Amylose D. Amylopectin
10. Các nhóm chất nào sau đây có cấu tạo mạch thẳng không phân nhánh:
A. Amylose, Glycogen, Cellulose.
B. Amylopectin, Glycogen, Cellulose. C. Amylose, Cellulose.
D. Dextran, Cellulose, Amylose. 44
Chương 5. HÓA HỌC VÀ CHUYỂN HÓA LIPID Mụ c tiêu
1. Trình bày được định nghĩa, phân loại và vai trò của lipid với cơ thể.
2. Trình bày được quá trình tiêu hóa và hấp thu lipid.
3. Trình bày được quá trình chuyển hóa của lipid trong cơ thể.
4. Trình bày được sự rối loạn chuyển hóa lipid.
PHẦN 1. HÓA HỌC LIPID 1. ĐẠI CƯƠNG
Lipid là những chất chuyển hoá của acid béo và tan được trong dung môi hữu cơ.
Lipid rất phổ biến ở động vật cũng như ở thực vật và tồn tại dưới 2 dạng:
- Mỡ nguyên sinh chất: là các phospholipid cũng như các bào quan, ví dụ: ty thể,
lạp thể... dạng này không bị biến đổi khi con người bị bệnh béo phì hoặc đói.
- Dạng dự trữ (dạng tự do) có tác dụng cung cấp năng lượng cho cơ thể, bảo vệ các
nội quan, là dung môi cần thiết cho một số chất khác. 1.1. Phân loại 1.1.1. Lipid thuần
Các lipid thuần có nhiệm vụ cung cấp năng lượng, hàm lượng luôn thay đổi. Cấu
tạo gồm: acid béo và alcol (chỉ có C, H, O).
- Glycerid: este của acid béo vớiglycerol.
- Sáp ong (wax): este của acid béo với alcol có trọng lượng phân tử cao.
- Sterid: este của acid béo với alcol vòng (cholesterol).
1.1.2. Lipid phức tạp
Lipid phức tạp có nhiệm vụ tham gia xây dựng các cấu tử của tế bào, hàm lượng
không thay đổi hay rất ít thay đổi. Là este khi thủy phân giải phóng ngoài alcol và acid
béo còn có các thành phần: acid phosphoric, các monosaccarid…
1.2. Vai trò của lipid
- Tham gia cấu tạo cơ thể: màng tế bào và màng các bào quan.
- Cung cấp năng lượng nhiều nhất (1g cho 9.3 Kcal).
- Tham gia cơ chế thông tin: steroid, prostagladin, các glucolipid.
- Dung môi hòa tan các vitamin tan trong dầu (A, D, E, K)
- Bảo về các cơ quan trong cơ thể chống lại những tác động từ bên ngoài. 45 2. HÓA HỌC LIPID 2.1. Acid béo
Acid béo là thành phần không thể thiếu của tất cả lipid, là đơn vị cấu tạo của lipid.
Đã phát hiên hơn 70 acid béo có từ 14-22 C (có số carbon chẵn), nhiều nhất là loại
có 16C, 18C, 20C. Acid béo thường gặp là những acid béo có số carbon chẵn, mạch
thẳng, có thể no hay không no và chuỗi C xếp theo hình chữ chi.
Acid béo chẵn, thẳng, no: CH3(CH2)nCOOH Số C cấu tạo Tên thông thường Ghi chú 4 CH3-(CH2)2-COOH A. butyric Nhiều trong cơ. 12 n=10 A. lauric Trong dầu dừa. 16 n=14 A. palmitic
Trong dầu động thực vật. 18 n =16 A. stearic
Trong dầu động thực vật. 20 n =18 A. arachidonic Trong dầu lạc.
Acid béo chẵn, thẳng, không no
Công thức có một hoặc nhiều liên kết đôi. Acid béo không no thường ở dạng loãng. -
Acid oleic: CH3-(CH2)7-CH=CH-(CH2)7-COOH -
Acid linoleic: CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH 2.2. Lipid thuần 2.2.1. Glycerid Cấu tạo
Glycerid là este của rượu glycerol và acid béo. Tùy theo số nhóm hydroxyl của
glycerol được este hóa mà có mono, di hay tri-glycerid. CH2 – OH CH2 – O – CO – R1 CH2 – O – CO – R1 CH2 – O – CO – R1 CH – OH CH – OH CH – O – CO – R2 CH – O – CO – R2 CH2 – OH CH2 – OH CH2 – OH CH2 – O – CO – R3 Gly cerol Monoacyl glycerol Diacylglycerol Triacylglycerol (Monoglycerid) (Diglycerid) (Triglycerid) Tính chất
Triglycerid không tan trong nước, ít tan trong cồn thấp (ethanol, methanol). Tan
trong các dung môi hữu cơ (benzen, ether, chloroform). Glycerid chứa acid béo bão hòa
ở thể rắn, glycerid chứa acid béo không bão hòa ở thể lỏng. 46
Triglycerid khó thủy phân, quá trình thủy phân được thực hiện bằng các phương
pháp xà phòng hóa, acid, kiềm, thủy phân bằng lipase.
2.2.2 Sáp thật (Cerid)
Là este của acid béo cao phân tử và alcol đơn chức mạch dài (mono hoặc dialcol
từ 16-30 C). Sáp ong, sáp cá voi là este của rượu cetol và acid palmitic.
Trong tự nhiên, sáp là chất chống thấm sinh học rất phổ biến có ở động thực vật.
Da của động vật có tuyến sáp giúp bảo vệ tóc và da, làm lông chim không bị thấm nước.
Ở thực vật nó thường tạo thành một lớp mỏng phủ lên lá, thân, quả của cây giữ cho
không bị thấm nước, không bị khô và tránh sự xâm nhập của vi khuẩn gây hại. 2.2.3. Sterid
Sterid là este của acid béo mạch dài với rượu sterol có vòng và este của acid béo
mạch dài với vitamin A, D.
Sterol có trọng lượng phân tử rất lớn tiêu biểu là cholesterol, acid mật. Acid béo
thường là palmitic, oleic, ricinoleic. 2.3. Lipid tạp
Cấu tạo ngoài acid béo, alcol còn có P, N, S, glucid. Có nhiều ở các tổ chức gan,
tim, thận, não. Thành phần tương đối cố định. 2.3.1. Phosphatid
Phosphatid là diester của acid phosphoric. Một nhóm -OH của acid phosphoric liên
kết với glycerol, nhóm khác tạo liên kết với X. Tùy cấu tạo của X có các loại
glycerophospholipid khác nhau
- Lecithin: X là cholin. Lecithin có nhiều trong lòng đỏ trứng gà, trong đậu nành,
trong máu, trong các dây thần kinh.
- Cephalin: X là ethanolamin, cấu tạo gồm hai phần ưa nước và kị nước, là thành
phần của dây thần kinh và có nhiều trong não. 2.3.2. Glycolipid
Thành phần: sphingosin, acid béo, đường hexose (galactose hay các dẫn xuất của
galactose, glucose), không có H3PO4. -
Cerebrosid: cấu tạo gồm sphingosin liên kết với acid béo bằng liên kết peptid,
với galactose (X) bằng liên kết glucosid. Các cerebrosid khác nhau về thành phần acid
béo, có nhiều trong mô thần kinh, hồng cầu, bạch cầu, tinh trùng… -
Sulfatid: dẫn xuấ của cerebrosid, galactose được este hóa ở vị trí C3 với H2SO4. -
Ganglyosid: cấu tạo gồm sphingosin, acid béo và 3 phân tử hexose. Có nhiều
trong não, đầu dây thần kinh, có nhiệm vụ dẫn truyền luồng thần kinh. 47
PHẦN 2. CHUYỂN HÓA LIPID
1. TIÊU HÓA VÀ HẤP THU 1.1. Tiêu hóa
Sự tiêu hóa lipid thực chất là sự thủy phân triglycerid xảy ra theo từng giai đoạn ở
hành tá tràng nhờ tác dụng của enzym lipase cùng với sự tham gia của các tác nhân nhũ
tương hóa là mật và muối mật.
Trước khi thủy phân, lipid được nhũ tương hóa bởi muối mật có trong dịch mật, vì
ở trạng thái nhũ tương lipid có diện tích tiếp xúc lớn, làm tăng tác động của lipase và
được phân tán dưới những hạt nhỏ để có thể khuếch tán dễ dàng qua màng ruột.
Lipase tách các acid béo từ phân tử glycerid với tốc độ khác nhau tùy thuộc vào vị
trí của acid béo trong phân tử glycerid. 1.2. Hấp thu
Hỗn hợp lipid bị thủy phân chưa hoàn toàn được hấp thu qua màng ruột ở dạng nhũ
tương nhờ các acid mật.
Glycerol và acid béo mạch ngắn (<10C) theo máu đến gan, chủ yếu qua tĩnh mạch
cửa. Các acid béo di chuyển trong máu dưới dạng kết hợp với albumin.
Các acid béo mạch dài, mono-, di-glycerid được sử dụng để tổng hợp lại triglycerid
ở màng ruột. Các triglycerid mới được tổng hợp này khuếch tán qua mạch bạch huyết
vào máu để vận chuyển đến gan, các tổ chức, cơ, mô mỡ dưới dạng những hạt liporotein gọi là chylomicron.
Tại các tổ chức, phần lớn triglycerid của chylomicron được thủy phân thành
glycerol và acid béo. Những sản phẩm này sẽ được chuyển hóa tiếp tục ở tế bào.
Ở cơ, các acid béo bị oxy hóa để giải phóng năng lượng; ngược lại, ở mô mỡ các
acid béo được este hóa trở lại thành triglycerid dự trữ. Khi khẩu phần ăn chứ nhiều acid
béo hơn nhu cầu cần cho cơ thể, triglycerid tổng hợp ở gan được vận chuyển vào máu
dưới dạng lipoprotein tới các tổ chức, đăc biệt là mô mỡ để dự trữ, và đến cơ để cung cấp năng lượng. 2. THOÁI HÓA LIPID
2.1. Thoái hóa glycegol
Ở gan và một số tổ chức khác, glycerol được phosphoryl hóa thành glycerol-3-
phosphat dưới tác dụng của enzym glycerolkinase. Chất này sau đó được oxy hóa thành
phosphat-dioxiaceton. phosphat-dioxiaceton được chuyển thành glyceraldehyd-3-
phosphat dưới tác dụng của enzym triose-phosphat-isomerase. Chất này tiếp tục tham
gia con đường Embden Meyerhof hay tổng hợp glycogen.
Mô mỡ không có enzym glycerolkinase. 48
Sơ đồ 5.1. Thoái hóa glycerol
2.2. Thoái hóa acid béo bão hòa
Trước khi tham gia vào quá trình oxy hóa, acid béo được hoạt hóa thành acyl
CoA: nhóm carboxyl của acid béo tác dụng với nhóm thiol của CoA để tạo thành một thioeste.
Phản ứng hoạt hóa xảy ra ở bên ngoài ty thể, với sự hiện diện của ATP, Mg2+ và
được xúc tác bởi enzym acyl CoA synthase (thiokinase).
- Pyrophosphat được hình thành trong quá trình phản ứng sẽ lập tức bị thủy phân
dưới tác dụng của enzym pyrophosphatase tạo thành orthophosphat
- AMP được giải phóng trong phản ứng trên sẽ được phosphoryl hóa trở lại.
- Quá trình hoạt hóa một phân tử acid béo đã sử dụng 2 ATP.
- Có nhiều loại thiokinase khác nhau tương ứng với từng loại acid béo ngắn, dài.
2.2.1. Vận chuyển acid béo vào ty thể
Quá trình oxy hóa xảy ra ở trong ty thể (là nơi có nhiều enzym cần thiết cho sự
oxy hóa) mà các acyl CoA không vượt qua được màng ty thể nên phải được vận 49
chuyển vào trong ty thể nhờ hệ thống carnitin có nhiều trong cơ và mô động vật.
- Carnitin là một amin bậc 4 mang một chức alcol bậc 2, có thể este hóa với acid
béo dưới tác động của acylcarnitin-transferase I. -
Gốc acyl được chuyển từ liên kết thioeste với CoA sang liên kết oxy-este với nhóm hydroxyl của canitin. -
Acylcarnitin vượt qua màng ty thể dễ dàng, sau khi vào ty thể, nó giải phóng trở
lại cartinin và acyl CoA (gốc acyl được chuyển từ cartinin đến CoA có sẵn trong ty thể,
dưới tác động của enzym carnitin-acyltransferase II). Acyl CoA lúc này mới bắt đầu quá trình oxy hóa. -
Những acid béo mạch ngắn (<12C) có thể di chuyển qua ty thể mà không cần chất vận chuyển.
2.2.2. Quá trình oxy hóa
a) Phản ứng oxy hóa lần 1
Được xúc tác bởi enzym acyl CoA dehydrogenase, có coenzym là FAD, hình thành
một liên kết đôi giữa C và C sản phẩm tạo thành là trans - 2 enoyl CoA.
Acid béo chưa bão hòa tạo thành trong giai đoạn này có cấu trúc dạng trans, trong
khi phần lớn acid béo thiên nhiên thuộc loại Cis.
- FAD kết hợp với một cặp H tách ra từ C và C của cơ chất tạo FADH2
- FADH2 tạo thành được oxy hóa trở lại bởi enzym trong chuỗi hô hấp tế bào.
b) Phản ứng kết hợp nước
Sự kết hợp nước vào nối đôi của trans- 2 enoyl CoA được xúc tác bởi enzym enoyl
CoA hydratase ( gốc OH được gắn vào C ) tạo thành - hydroxyacyl CoA.
c) Phản ứng oxi hóa lần 2
Dưới sự xúc tác của enzym -hydroxyacyl CoA dehydrogenase, có coenzym là
NAD, chức alcol bậc 2 được oxy hóa thành chức ceton.
d) Phản ứng phân cắt dẫn xuất -keton
Nhóm thiol của CoA tác động tại C của -keto acylCoA, phân cắt liên kết giữa
C và C , tách một phân tử acetyl CoA ra khỏi -ketoacyl CoA. Phản ứng này được
xúc tác bởi enzym -ketothiolase (acyl CoA acetyl transferase) và có sự tham gia của
một phân tử coenzym A tự do.
Như vậy, kết quả của một chu trình oxy hóa là tách ra được một phân tử acetyl
CoA và một phân tử acyl CoA ngắn đi 2 C so với acid béo ban đầu. Acyl CoA ngắn đi
2 C lại tiếp tục bị oxy hóa qua các giai đoạn như trên cho đến khi toàn bộ phân tử acid
béo biến thành acetyl CoA. 50
R – CH2 – CH2 – CO ~ SCoA (Acyl CoA ban đầu) FAD (Acyl CoA dehydrogenaz) FADH2 CHHTB 2ATP R – CH = CH – CO ~ SCoA (Trans - ∆2 – enoyl CoA) H2O
(Trans - ∆2 – enoyl hydralaz)
R – CH – CH2 – CO ~ SCoA OH NAD+
(L – Beta - OH – acyl CoA)
(L – Beta – OH acyl CoA dehydrogenaz) NADH,H+ CHHTB 3ATP R – C – CH2 – CO ~ SCoA (Beta - ceto – acyl CoA) O HS CoA
(Beta – ceto - acyl CoA thiolaz) R – C – CH2 – CO ~ SCoA O
R – C ~ SCoA + R – C ~ SCoA Krebs O O Acyl CoA kém đi 2C Act CoA Beta oxy hóa
Acyl CoA kém đi 4C + Act CoA
Hình 3.2. Quá trình oxy hóa AB
2.2.3. Các con đường thoái hóa tiếp tục của acetyl CoA
a). Oxy hóa ở chu trình Krebs
Bình thường acetyl CoA sẽ tiếp tục vào chu trình Krebs, tiếp tục bị oxy hóa hoàn
toàn thành 2 CO2, 4 H2O và 12 năng lượng ATP.
b). Sự tạo thành các thể ceton
Acetyl CoA được tạo thành từ phản ứng oxy hóa của acid béo cũng có thể biến
đổi thành các thể ceton. Các thể ceton gồm acetoacetat, - hydroxybutyrat và aceton.
- Hai phân tử acetyl CoA ngưng tụ với nhau tạo thành aceto acetyl CoA, dưới tác
động của enzym - cetothiolase. 51
- Aceto acetyl CoA ngưng tụ với 1 phân tử acetyl CoA nữa tạo thành -hydroxy-
-metylglutaryl-CoA (HMG CoA) dưới tác động của enzym HMG CoA synthetase.
Sau đó, chất này phân tích để cho trở lại acetyl CoA và acetoacetat dưới tác động của enzym HMG CoA lyase.
- Acetoacetat bị khử thuận nghịch để tạo thành - hydroxybutyrat dưới tác động
của enzym -hydroxybutyrat dehydrogenase.
- Acetoacetat bị khử nhóm carboxyl dưới tác động của enzym acetoacetat
decarboxylase để tạo thành aceton.
Acetoacetat, -hydroxybutyrat được tạo thành ở gan, vào máu rồi chuyển đến các
tổ chức. Tại đây, chúng được biến đổi thành acetyl-CoA và bị oxy hóa trong chu trình
acid citric để cung cấp năng lượng cho mô, đặc biệt là cơ xương, cơ tim và vỏ thượng
thận. Não thường sử dụng năng lượng từ glucose, có thể thay bằng năng lượng từ các
chẩt trên khi bị đói kéo dài, hay cơ thể thiếu glucose.
2.3. Thoái hóa acid béo không bão hòa
Được oxy hóa gần giống như con đường OXH AB bão hòa nhưng có 2 điểm khác:
- Trong quá trình thoái hóa các AB bão hòa phải được chuyển từ dạng cis sang
dạng trans, dạng D sang L, các liên kết đôi ở những vị trí khác nhau lần lượt chuyển
sang dạng ∆2. . Đây là những dạng chuyển hóa trung gian thích hợp cho hoạt động của hệ thống enzyme beta OXH
- Số lượng phân tử ATP tạo thành trong quá trình oxy hóa AB không bão hòa thấp
hơn số lượng ATP tạo thành khi OXH AB bão hòa có số carbon tương ứng. 3. TỔNG HỢP LIPID
3.1. Tổng hợp acid béo bão hòa
Quá trình tổng hợp acid béo bão hoà xảy ra ở nhiều tổ chức nhưng mạnh nhất trong
gan, mô, mỡ, ruột và tuyến vú. Sự tổng hợp cũng gồm 4 giai đoạn ngược lại với quá
trình -oxy hóa: phản ứng oxy hóa, khử nước, các enzym có coenzym NADH2, NADPH2
(được cung cấp do quá trình đường phân theo con đường pentose và chu trình acid citric.
3.2. Tổng hợp triglycerid
Triglycerol được tổng hợp ở nhiều tổ chức, tế bào của gan, thận, mô mỡ, ruột…
Nguyên liệu ban đầu là glycerol và acid béo dưới dạng hoạt hóa glycerol-3-phosphat và acyl-CoA.
Quá trình sinh tổng hợp triglycerid là sự este hóa glycerol và acid béo dưới xúc tác
của enzym transacylase. Dùng acyl-CoA làm cơ chất.
- Acid phosphatidic chuyển thành 1,2 diglycerid nhờ sự xúc tác của enzym phosphatase.
- Diglycerid tiếp tục phản ứng với một acyl-CoA thứ ba, dưới tác dụng của enzym
diglycerid-acyl-transferase để tạo thành triglycerid. 52
4. CHUYỂN HÓA CHOLESTEROL
Cholesterol tham gia vào thành phần cấu tạo của màng tế bào, quá trình tổng hợp
nhiều hormon steroid. Được tạo ra từ 2 nguồn: nội sinh và ngoại sinh, nó được tổng hợp
nhiều ở gan, vỏ thượng thận với nguồn nguyên liệu là acetyl-CoA. Cholesterol có nhiều
trong thức ăn như thịt, gan, não, lòng đỏ trứng được cơ thể hấp thu gọi là cholesterol
ngoại sinh. Phần lớn cholesterol được tổng hợp bởi những tế bào chủ yếu là gan,
cholesterol này được gọi là cholesterol nội sinh.
4.1. Tổng hợp cholesterol
Chủ yếu ở gan, ruột, ngoài ra cũng được tổng hợp ở thượng thận, tinh hoàn, buồng
trứng, da, hệ thần kinh. Người lớn, trung bình tổng hợp được 1 g/ngày.
Nguyên liệu chính để tổng hợp cholesterol là 2 phân tử acetyl CoA. Gồm hàng loạt
các phản ứng ngưng tụ, đóng vòng rất phức tạp tạo phân tử cholesterol gốm 27 C, một
liên kết đôi, một nhóm –OH
Xảy ra qua 4 giai đoạn chính: Acetyl CoA + AcetoAcetyl CoA (2C) (4C) GĐ I Mevalonat (6C) GĐ II Isoprene hoạt hóa GĐ III Squalen (30C) GĐ IV Cholesterol (27C)
Tổng hợp cholesterol este hóa:
Con đường thứ nhất: xảy ra chủ yếu ở gan, ruột, thượng thận: đầu tiên acid béo
được hoạt hóa bởi coenzyme A thành Acyl CoA với sự tham gia của ATP, sau đó acyl
CoA tác dụng với cholesterol nhờ xúc tác của acyl CoA – cholesterol, acyl transferaz
(ACAT) tạo ra cholesterol este. ACAT Acyl CoA + Cholesterol Cholesterol este
Con đường thứ 2: xảy ra trong huyết tương dưới tác dụng xúc tác của men
Lecithin cholesterol acyl transferaz (LCAT) gốc acyl của acid béo ở vị trí C2 trong
phân tử lecithin được chuyển trực tiếp đến cholesterol LCAT
Lecithin + Cholesterol Cholesterol este + Lysolecithin 53
4.2. Sự thoái hóa cholesterol
Ở động vật, sự thoái hóa cholesterol dẫn đến sự tạo thành acid mật. Quá trình này xảy ra ở gan và ruột.
Hầu hết acid mật được giải phóng từ gan dưới dạng liên hợp, đổ trực tiếp vào hành
tá tràng, qua ống dẫn mật hay dự trữ ở túi mật khi chưa cần đến.
Cholesterol Acid Cholic Các acid mật
(Glycocholic hoặc Taurocholic)
5. RỐI LOẠN CHUYỂN HÓA LIPID
Chuyển hóa lipid phụ thuộc vào tình trạng dinh dưỡng và quá trình điều hòa các
hormon lên quá trình phân hủy và tổng hợp lipid.
5.1. Điều hòa chuyển hóa lipid
5.1.1. Điều hòa của các hormon lên sự thoái hóa lipid
Các hormon như adrenalin, noadrenalin, ACTH, glucagon,... tăng cường sự giải
phóng acid béo từ mô mỡ và làm tăng acid béo huyết tương. Tác động lên sự phân hủy
lipid bằng cách hoạt hóa adenylcyclase tăng cường sự tạo thành AMPv, AMPv hoạt hóa
lipase ở dạng không hoạt động thành hoạt động qua trung gian protein kinase.
Một số hormon khác: thyroxin, hormon sinh trưởng (GH) tác dụng chậm lên sự phân hủy lipid.
Glucocorticoid, ngoài tác dụng trực tiếp lên adenyl cyclase để hoạt hóa lipase và
còn hạn chế sự tổng hợp lipid bằng cách ức chế sự xâm nhập glucose vào trong tế bào,
như vậy hạn chế sự cung cấp nguyên liệu cần thiết cho sự tổng hợp triglycerid.
5.1.2. Điều hòa của các hormon lên sự tổng hợp lipid
Một số hormon tác dụng lên sự điều hòa tổng hợp lipid: insulin, prostaglandin. Các
hormon này còn được gọi là hormon chống thoái hóa lipid.
Insulin: có 2 tác dụng là chống thoái hóa lipid và tăng tổng hợp lipid. Insulin ức
chế hoạt động adenyl cyclase do đó ức chế tổng hợp AMPv và giảm hoạt động lipase.
Insulin hoạt hóa sự xâm nhập glucose vào trong tế bào do đó làm tăng NADPH-H+ cung
cấp acetyl CoA cần thiết cho sự tổng hợp lipid.
Prostaglandin E (PGE1): tác dụng chuyển hóa lipid tương tự như insulin, chống
thoái hóa lipid bằng cách ức chế adenyl cylase AMPv, PGE1 có tác dụng tăng tổng hợp
lipid yếu hơn so với insulin.
5.2. Rối loạn chuyển hóa lipid:
Đái đường tụy: thiếu NADPH do không có con đường pentose nên việc tổng hợp
acid béo không thực hiện được, acetyl CoA sẽ tạo ra nhiều thể ceton nên giai đoạn cuối
của bệnh đái tháo đường sẽ xuất hiện thể ceton trong nước tiểu.
Ứ đọng lipid: Do thiếu yếu tố tiêu mỡ như cholin, methionin, là những chất có tác
dụng làm cho quá trình thoái hóa, tổng hợp phospholipid được thực hiện dễ dàng, là dẫn
xuất có metyl tổng hợp nên lecithin, chất này là dạng vận chuyển mỡ ở gan. 54
Rối loạn hấp thu: Bệnh gan mật ảnh hưởng đến yếu tố tiêu mỡ, khi bệnh nhân tắc
mật sẽ xuất hiện triệu chứng sợ mỡ do ăn vào không tiêu hóa được. CÂU HỎI LƯỢNG GIÁ
1. Lipid là nhóm hợp chất
A. Tan hoặc ít tan trong nước
B. Tan trong dung môi phân cực
C. Tan trong dung môi hữu cơ
D. Không tan trong dung môi không phân cực
2. Lipid có câú tạo chủ yếu là : A. Acid béo B. Alcol
C. Este của acid béo và alcol D. Liên kết glucosid
3. Trong lipid có thể chưá các vitamin sau : A. Vitamin C , Vítamin A B. Vitamin B1, B2 C. Vitamin PP, B6, B12 D. Vitamin A , D, E, K
4. Acid béo bão hòa có công thức chung : A. CnH2n - 1 COOH B. CnH2n +1 OH C. CnH2n - 3 OH D. CnH2n - 3 COOH
5. Acid béo có ký hiệu dưới đây là acid arachidonic : A. C18 :1; 9 B. C18 : 2; 9 ; 12 C. C18 : 3 ; 9 ; 12 ; 15 D. C20 : 4 ; 5 ; 8 ; 11 ; 14
6. Lipid thuần có cấu tạo : A. Chủ yếu là acid béo
B. Este của acid béo và alcol
C. Acid béo , alcol , acid phosphoric
D. Glycerol , acid béo , cholin
7. Trong công thức cấu tạo của lipid có acid béo , alcol
và một số thành phần khác được phân vào loại : A. Lipid thuần B. Phospholipid C. Lipid tạp D. Steroid
8. Những chất sau đây là lipid thuần : 55
A. Phospholipid , glycolipid , lipoprotein
B. Triglycerid, sphingophospholipid , acid mật
C. Cerid, Cerebrosid , gangliosid D. Glycerid, cerid , sterid
9. Những chất sau đây là lipid tạp :
A. Cerebrosid, triglycerid, sterid
B.Cerid, phosphoglycerid, glycolipid
C. Glycerid, sterid, glycolipid
D. sterid, cerid, sphingolipid
10. Este của acid béo với sterol gọi là : A. glycerid B. Cerid C. Sterid D. Cholesterol
11. Chất nào là tiền chất của Vitamin D3 : A. Acid mật B. Phospholipid C. Triglycerid D. 7 Dehydrocholesterol 12. Lipoprotein
1. Cấu tạo gồm lipid và protein 2. Không tan trong nước 3. Tan trong nước
4. Vận chuyển lipid trong máu 5. Lipid thuần Chọn tập hợp đúng: A. 1, 2 ,3 B. 1, 2, 4 C. 1, 3, 4 D. 1, 3, 5 56
Chương 6: HÓA HỌC VÀ CHUYỂN HÓA ACID NUCLEIC Mục tiêu
3. Trình bày được thành phần cấu tạo của nucleotid và acid nucleic.
4. Trình bày cấu trúc và vai trò của ADN, ARN.
5. Trình bày được quá trình thoái hóa và tổng hợp nucleotid và acid.
6. Trình bày được sự điều hòa chuyển hóa acid nucleic.
PHẦN 1. HÓA HỌC ACID NUCLEIC 1. ĐẠI CƯƠNG
Acid nucleic là chất liệu quan trọng nhất, mang thông tin di truyền của sự sống,
là polymer hình thành từ các monomer là nucleotid.
Acid nucleic gồm ADN (acid deoxyribonucleic) và RNA (acid ribonucleic),
chiếm 5-10% trọng lượng khô tế bào và ở dưới dạng kết hợp với protein.
2. THÀNH PHẦN HÓA HỌC ACID NUCLEIC
Acid phosphoric H3PO4: tạo nên tính acid cho acid nucleic. Ký hiệu P (ở trạng
thái kết hợp), Pvc (ở trạng thái tự do).
Đường pentose: Đường pentose 5 C có hai loại là deoxyribose và ribose (một
trong những đặc điểm phân biệt DNA và RNA).
Base nitơ: Các base nitơ đều là dẫn xuất của base purin hoặc pyrimidin.
- Base purin gồm: Adenin và Guanin.
- Base pyrimidin gồm: Thymin, Cytosin và Uracil.
Nucleosid và nucleotid
Nucleosid: Base nitơ ------ Đường 5C
Nucleotid: Base nitơ ------ Đường 5C ------ H3PO4
2.1. Sự tạo thành nucleosid
Nucleosid là sản phẩm thuỷ phân không hoàn toàn của acid nucleic, gồm hai thành
phần: đường pentose và base nitơ. Nối với nhau bằng liên kết β N-glycosid.
Liên kết này được hình thành do: C1 của pentose với N9 của base purin, hoặc C1
của pentose với N1 của base pyrimidin. 57
Bảng 6.1. Cách gọi tên các nucleosid Base Ribonucleosid Deoxyribonucleosid A Adenosin Deoxyaenosin G Guanosin Deoxyguanosin C Cytisin Deoxycytidin U Uridin T Deoxythymidin
2.2. Sự tạo thành nucleotid
Nucleotid cũng là sản phẩm thuỷ phân không hoàn toàn của nucleic acid, gồm ba
thành phần: đường pentose, một base nitơ và acid phosphoric.
- H3PO4 nối với pentose bằng liên kết este, thường là C5’, đôi khi ở C2’ hoặc C3’.
- Nếu liên kết vừa ở C2’ và C3’ hoặc C3’ và C5’ thì phosphodieste ở dạng vòng.
Các phosphodieste là đơn vị cấu tạo của acid nucleic.
- RNA có 4 đơn vị cấu tạo chính: AMP, GMP, CMP, UMP
- DNA có 4 đơn vị cấu tạo chính: dAMP, dGMP, dCMP, dTMP
Bảng 6.2. Cách gọi tên các nucleotid Ribonucleosid Deoxyribonucleosid Base 5’-monophosphat 5’-monophosphat Adenosin monophosphat Deoxyadenosinmonophosphat A (AMP) (dAMP) Guanosin monophosphat Deoxyguanosinmonophosphat G (GMP) (dGMP) Cytidin monophosphat Deoxycytidinmonophosphat C (CMP) (dCMP) Uridin monophosphat U (UMP) Deoxythymidinmonophosphat T (dTMP) 2.3. Acid nucleic
Các nucleotid nối với nhau bằng liên kết phosphodieste nhờ các nhóm OH ở vị trí
C’3 và C’5 của đường pentose để tạo thành một chuỗi dài gọi là monophosphat.
Liên kết phosphodieste được tạo thành ở vị trí C’3 và C’5 nên chuỗi monophosphat
có tính phân cực: đầu 5’ thường có gốc phosphate và đầu 3’ thường có OH tự do.
Acid nucleic gồm hai loại phân tử có cấu tạo rất giống nhau là ADN
(Deoxyribonucleic acid) và ARN (Ribonucleic acid). 58
3. DNA (Desoxyribonucleic acid) 3.1. Cấu trúc DNA
Là một chuỗi xoắn kép gồm hai chuỗi đơn nucleotid, có thể lên đến hàng triệu
nucleotid. Đơn vị cấu thành DNA gồm: dAMP, dGMP, dCMP, dTMP, nối với nhau
bằng những liên kết 3’-5’ phosphodieste.
Hai chuỗi xoắn đôi theo hướng ngược nhau quanh một trục chung với chu kỳ 3,4
nm. Một sợi xoắn theo hướng 5’-3’ và sợi kia xoắn theo hướng 3’-5’ và kết hợp với
nhau nhờ các liên kết hydro hình thành giữa các base bổ sung nằm trên hai chuỗi: A bổ
sung cho T và C bổ sung cho G. Trong đó:
Tổng base purin = Tổng base pyrimidin
Như vậy, thứ tự sợi nucleotid này quyết định thứ tự sợi còn lại, thông tin di truyền
nằm trong một sợi gọi là sợi mã hóa.
Các dạng cấu trúc DNA
- Xoắn đơn: một số virus.
- Xoắn đôi: phổ biến nhất ở các phân tử DNA.
- Xoắn đơn vòng: DNA ty thể và một số virus.
- Xoắn đôi vòng: dạng nhân đôi của virus hay DNA của virus.
3.2. Vai trò của DNA
Thông tin di truyền tích trữ trong DNA được dùng làm: nguồn thông tin cho sự
tổng hợp các phân tử protein của tế bào và cơ thể, cung cấp thông tin mà các tế bào sau
kế thừa từ tế bào mẹ.
DNA được dùng làm khuôn để chuyển mã thông tin di truyền cho RNA, cao chép
thông tin vào phân tử DNA con.
Như vậy, vai trò chính của DNA là:
- Tích trữ thông tin di truyền.
- Làm khuôn cho chuyển mã và sao chép.
4. RNA (Ribonucleic acid) 4.1. Cấu trúc RNA
Phân tử RNA có cấu tạo tương tự DNA với ba điểm khác biệt:
- Phân tử RNA là chuỗi đơn.
- Đường pentose của phân tử RNA là ribose.
- Base thymin được thay thế bằng uracil trong phân tử RNA.
Cấu trúc và chức năng của RNA có sự biến đổi rõ rệt so với DNA. Về cơ bản
RNA chỉ là chất mang thông tin di truyền ở virus, sau đó người ta chứng minh rằng 59
nó không những đóng vai trò cơ bản ở việc chuyển thông tin di truyền mà còn có vai trò
cấu trúc khi tạo nên phức hệ RNA-protein.
Có 3 loại RNA chính, có các chức năng khác nhau:
a) RNA thông tin (mRNA)
Là bản sao của những trình tự nhất định trên phân tử DNA, có vai trò chuyển
thông tin mã hóa từ DNA đến bộ máy giải mã thành phân tử protein tương ứng.
Các RNA có cấu trúc đa dạng, kích thước nhỏ hơn so với DNA vì chỉ chứa thông tin
mã hóa cho một hoặc vài protein và chỉ chiếm khoảng 2-5% tổng số RNA trong tế bào.
Quá trình chuyển thông tin được thể hiện như sau: Phiên mã Dịch mã DNA RNA Protein
b) tRNA (vận chuyển)
tRNA vận chuyển các acid amin hoạt hóa đến ribosom để tổng hợp protein từ các
mRNA tương ứng. Có ít nhất một loại tRNA cho một loại acid amin.
tRNA là phân tử RNA nhỏ nhất, chứa khoảng 75 nucleotid (trọng lượng khoảng
25 kDa). Các tRNA có cấu trúc dạng cỏ ba lá, ổn định nhờ các liên kết bổ sung hiện
diện ở nhiều vùng của phân tử tRNA. c) rRNA (ribosom)
rRNA là thành phần cơ bản của ribosom, đóng vai trò xúc tác và cấu trúc trong sự
tổng hợp protein. rRNA chiếm nhiều nhất trong ba loại RNA (80% tổng số RNA tế bào),
tiếp đến là tRNA và mRNA chỉ chiếm 5%.
Ribosom của mọi tế bào đều gồm một tiểu đơn vị nhỏ và một tiểu đơn vị lớn. Mỗi
tiểu đơn vị có mang nhiều protein và rRNA có kích thước khác nhau.
d) Một số loại RNA khác.
Ngoài ra, còn một số RNA khác, có vai trò nhất định trong bộ máy tổng hợp protein.
- snRNA (small nuclear): Tham gia vào việc ghép nối các exon.
- hnRNA (heterogenous nuclear) là RNA không đồng nhất ở nhân tế bào.
- scRNA (small cytoplasmic) là RNA nhỏ của tế bào chất.
4.2. Vai trò sinh học của RNA
Sự tổng hợp ARN đảm bảo cho gen cấu trúc thực hiện chính xác quá trình dịch mã
ở tế bào chất, cung cấp các protein cần thiết.
PHẦN 2. CHUYỂN HÓA NUCLEOTID
1. QUÁ TRÌNH THOÁI HÓA
Acid nucleic trong thức ăn không bị phá hủy bởi môi trường acid ở dạ dày và chỉ 60
bị thoái hóa chủ yếu ở tá tràng dưới tác dụng của enzym nuclease của tụy và các enzym
phosphodiesterase của ruột non. Các sản phẩm tạo thành không qua được màng tế bào
mà tiếp tục bị thủy phân thành các nucleosid dưới xúc tác của enzym nucleotidase đặc
hiệu nhóm và phosphatase. Các nucleosid có thể được hấp thu tự do qua thành ruột hoặc
tiếp tục thoái hóa tạo các base tự do, ribose hoặc ribose-1-phosphat dưới tác dụng của
các enzym nucleosidase và nucleoside phosphorylase: Nucleosid + H3PO4 base + ribose
Nucleoside phosphorylase Nucleosid + H3PO4 base + ribose-1-P
Các acid nucleic thường xuyên thoái hóa và quá trình đó nằm trong sự biến đổi liên
tục của tất cả các bộ phận cấu thành tế bào.
Sơ đồ thoái hóa acid nucleic Acid nucleic (AND, ARN) H2O Nuclease Nucleotid Pvc Nucleotidase Nucleosid Nucleosidase Base N + Pentose Purin Pyrimidin Acid uric NH3, CO2 Ure
1.1. Thoái hóa của purin nucleotid
Khởi đầu quá trình thoái hóa là phản ứng thủy phân gốc phosphat của adenylat
(adenosin nucleotid) dưới sự xúc tác của enzym 5-nucleotidase tạo thành adenosin.
Adenosin tiếp tục bị khử amin tạo thành inosin với sự xúc tác của enzym adenosin deaminase
Inosin bị thủy phân giải phóng hypoxanthin và ribose-1-P dưới tác dụng xúc tác của enzym nucleosidase.
Hypoxanthin bị oxy hóa thành xanthin rồi thành acid uric với sự xúc tác của xanthin oxidase. 61 5-nucleotidase Adenosin Adenylat Adenosin Inosin deaminase nucleosidase. xanthin oxidase Acid uric xanthin hypoxanthin
Guanylat (guanosin nucleotid)
Với sự xúc tác của enzym 5-nucleotidase, guanylat bị thủy phân tạo thành
guanosin. Guanosin bị thủy phân giải phóng guanin tự do và ribose-1-P với sự xúc tác của enzym nucleosidase
Guanin bị khử amin tạo thành xanthin nhờ enzym xanthin deaminase.
Xanthin bị oxy hóa thành acid uric nhờ enzym xanthin oxidase. 5-nucleotidase Guanylat Guanosin nucleosidase. xanthin oxidase Xanthin deaminase Acid uric xanthin Guanosin 62
Ở người, sản phẩm thoái hóa cuối cùng của base purin là acid uric. Nồng độ acid
uric trong máu người bình thường là 2.2 - 8.1 mg/dl (130 - 480 µmol/l). Lượng acid
trong nước tiểu khoảng 0.3 - 0.8 g/24h và thay đổi theo chế độ ăn. Trong bệnh Gout
(thống phong) lượng acid uric máu có thể tăng tới 7-8 g/dl.
Ở chim, bò sát, côn trùng sản phẩm thoái hóa cuối cùng của base purin cũng là acid
uric. Tuy nhiên, ở một số loài động vật có xương sống khác, acid uric tiếp tục thoái hóa
tạo thành allantoin dưới sự xúc tác của enzym urat oxidase. Ở loài cá có xương sống,
sản phẩm cuối cùng là allantoat (do allantoin gắn thêm một phân tử nước). Ở những loài
động vật biển không có xương sống, sản phẩm cuối cùng là NH + 4 (do urê bị thủy phân thành CO + 2 và NH4 ).
1.2. Thoái hóa pyrimidin nucleotid
Trong các tế bào động vật, pyrimidin nucleotid thoái hóa thành các đơn vị cấu tạo.
Giống như quá trình thoái hóa các purin nucleotid, các sản phẩm thoái hóa pyrimidin
lần lượt là: khử phosphoryl hóa, khử amin hóa và cắt đứt liên kết glycosid. Uracil và
thymin tiếp tục bị thoái hóa ở gan qua quá trình khử thay vì quá trình oxy hóa như quá
trình chuyển hóa purin nucleotid.
Các pyrimidin nucleotid bị thủy phân tạo thành base pyrimidin dưới tác dụng xúc
tác của enzym nucleotidase và nucleosidase. Sản phẩm chuyển hóa cuối cùng của
pyrimidin nuleotid là amino acid: β - alanin và aminoisobutyrat, qua quá trình trao đổi
amin tạo thành manonyl-CoA và methylmaloyl-CoA tiếp tục tham gia chuyển hóa.
2. QUÁ TRÌNH TỔNG HỢP
2.1. Tổng hợp purin ribonucleotid
Quá trình tổng hợp purin nucleotid có thể chia thành bốn giai đoạn chính:
- Giai đoạn 1: Tạo glycinamid ribosyl-5’-phosphat (glycinamid ribonucleotid).
- Giai đoạn 2: Tạo nhân enzym63le của purin.
- Giai đoạn 3: Tạo nhân pyrimidin của purin và sự hình thành acid inosinic
- Giai đoạn 4: Chuyển inosinat (IMP) thành adenylat (AMP) và guanylat (GMP).
Điều hòa tổng hợp: sự tổng hợp các purin nucleotid được điều hòa bởi cơ chế điều
hòa ngược, trong đó nồng độ purin nucleotid được tạo thành ức chế lại các enzyme tham
gia phản ứng tổng hợp.
2.2. Tổng hợp pyrimidin ribonucleotid
Được tạo thành từ aspartat, carbamoyl phosphat và PRPP (5’-phosphoribosyl-1-
pyrophosphat). Khác với tổng hợp purin nucleotid, quá trình tổng hợp pyrimidin
nucleotid đơn giản hơn, nhân pyrimidin được hình thành trước dưới dạng orotat, sau đó
orotat gắn với PRPP. Quá trình tổng hợp pyrimidin nucleotid gồm hai giai đoạn:
- Giai đoạn 1: Sự tạo thành orotat.
- Giai đoạn 2: Tạo thành pyrimidin nucleotid: uridylat (UMP), cytidylat (CTP). 63
PHẦN 3. CHUYỂN HÓA ACID NUCLEIC
Tất cả các tế bào của cơ thể sống đều có khả năng tự tổng hợp acid nucleic cần
thiết cho mình và không yêu cầu bổ sung acid nucleic trong thức ăn. Vì vậy, hàm lượng
acid nucleic trong thức ăn không có ý nghĩa quan trọng đối với cơ thể.
Trong tế bào, sự đổi mới của ADN chậm hơn nhiều so với ARN. Sự đổi mới của
ARN xảy ra ở những tế bào đang phân chia và phát triển. Còn lượng ARN thì lại phụ
thuộc vào tốc độ sinh tổng hợp protein.
1. THOÁI HÓA ACID NUCLEIC 1.1. Thoái hóa ADN
Các enzym nuclease thủy phân liên kết phosphodieste trong ADN
(deoxyribonuclease) có hai loại:
- Exonuclease: thủy phân không chọn lọc, cắt một nucleotid ở đầu 5 hoặc đầu 3
tạo thành oligonucleotid ngắn hơn.
- Endonuclease: thủy phân liên kết phosphodieste giữa chuỗi polynucleotid. 1.2. Thoái hóa ARN
Các nuclease thủy phân liên kết phosphodieste trong ARN gồm hai loại:
- Exonuclease: có nhiều loại ARN exonuclease được tinh chế.
Ví dụ: ARN exonuclease II thủy phân chuỗi đơn ARN theo chiều 3’-5’ và sản
phẩm thủy phân là các ribonucleotid-5-phosphat. Trong khi ARN exonuclease V thủy
phân chuỗi đơn ARN theo chiều 5’-3’, sản phẩm tạo thành cũng là ribonucleotid-5- phosphat.
- Endonuclease tạo sản phẩm 5-phosphat.
Với sự phối hợp của các exonuclease và endonuclease, các acid nucleic sẽ bị thủy
phân tạo thành sản phẩm là các oligonucleotid ngắn và các mononucleotid. Các
mononucleotid này hoặc được tận dụng để tổng hợp các polynucleotid hoặc được thoái
hóa tiếp tục để tạo thành các sản phẩm cuối cùng.
2. TỔNG HỢP ACID NUCLEIC 2.1. Tổng hợp DNA
Quá trình tổng hợp ADN còn được gọi là quá trình tái bản, đây là quá trình bảo tồn
thông tin di truyền cho thế hệ sau.
Theo giả thuyết của Watson và Crick, chuỗi ADN được sử dụng như một khuôn
để tổng hợp chuỗi ADN mới theo nguyên tắc bổ sung. Sự tái bản trước hết được khu trú
ở một vùng, sau đó di chuyển dọc theo chiều dài của chuỗi ADN song song với sự mở
xoắn kép. Vùng này có cấu trúc hình chữ Y nên được gọi là chạc ba tái bản của ADN.
Tại vị trí này, hai sợi ADN mới được tổng hợp với sự xúc tác của hệ thống đa enzym.
Trong đó, một sợi được tổng hợp liên tục (chuỗi nhanh) còn sợi kia được tổng hợp ngắt
quãng (chuỗi chậm) trên khuôn mẫu của ADN mẹ. Quá trình tổng hợp chuỗi chậm tạo 64
nên các đoạn Okazaki. Kết thúc quá trình tổng hợp, các đoạn Okazaki này được nối với
nhau nhờ sự xúc tác của enzym ADN ligase.
Các enzym tham gia quá trình tổng hợp ADN:
- ADN helicase: là enzym mở xoắn kép.
- ADN gyrase (topoisomerase): có tác dụng ngăn không cho ADN mở xoắn kép
trở lại chạc ba tái bản, có vai trò quan trọng trong quá trình tái bản ở vi khuẩn.
- ARN primase (ADNG protein): thuộc nhóm enzym ARN polymerase, là enzym
xúc tác quá trình tổng hợp sợi ARN mồi ngắn.
- ADN polymerase I (Pol I): là enzym xúc tác sự tổng hợp ADN từ các
deoxynucleosid triphosphat với sự có mặt của ADN làm khuôn.
- ADN polymerase II (Pol II): tác dụng chưa rõ, nó cũng có hoạt tính exonuclease
theo chiều 3-5 nhưng không có hoạt tính exonuclease theo chiều 5-3
- ADN polymerase III (Pol III): vai trò chủ yếu trong quá trình kéo dài chuỗi ADN
mới theo chiều 5-3 ở Escherichia coli, có hoạt tính exonuclease theo chiều 3-5
- ADN ligase: xúc tác việc nối các mẩu ADN sợi đơn (các đoạn Okazaki) thông
qua việc tạo thành liên kết phosphodieste giữa đầu 3 hydroxyl của mẩu ADN này với
đầu 5 phosphat của mẩu ADN khác. ADN ligase có thể tham gia quá trình nối hai sợi
ADN bị đứt hoặc nối kín để tạo ADN vòng 65 2.2. Tổng hợp RNA
Sự tổng hợp ARN là quá trình chuyển thông tin di truyền từ ADN sang phân tử
ARN. Quá trình tổng hợp này dựa trên nguyên tắc giống như sự tái bản ADN:
o Chiều tổng hợp từ 5’- 3’.
o Năng lượng do ATP cung cấp.
Tuy nhiên cũng có một số điểm khác:
- Khuôn ADN được bảo tồn hoàn toàn trong quá trình tổng hợp ARN.
- ARN polymerase không có hoạt tính nuclease.
- Quá trình tổng hợp không cần có sự tham gia của đoạn mồi.
Các enzym tham gia
- ARN polymerase phụ thuộc ARN (replicase): xúc tác tự nhân đôi ARN của virut trong tế bào chủ.
- ARN polymerase phụ thuộc AND: xúc tác phản ứng tổng hợp ARN từ các
nucleosid triphosphat bằng cách kéo dài chuỗi ARN theo phản ứngL (NMP)n + NTP (NMP)n+1 + Ppi ARN kéo dài
Các giai đoạn của quá trình tổng hợp ARN
- Giai đoạn mở đầu: ARN polymerase liên kết với promoter trên ADN ở vị trí -
35 tạo thành phức hợp đóng. Sau đó ARN polymerase di chuyển đến vị trí 10 tạo thành
phức hợp mở. Một vùng xoắn kép khoảng 17 cặp base được tháo xoắn. ARN polymerase
xúc tác sự tổng hợp với sự tham gia của GTP hoặc ATP. Đoạn ngắn ARN mới được
tổng hợp (~ 12 nucleotid) được xoắn kép tạm thời với ADN.
- Giai đoạn kéo dài chuỗi: Phân tử ARN polymerase di chuyển dần theo chiều
dài sợi ADN đã được tháo xoắn để lộ vùng khuôn sẽ được ghép bổ sung. Như vậy, chuỗi
ARN được kéo dài theo chiều 5-3 với sự tham gia của yếu tố kéo dài. Sau khi đã làm
khuôn thì đoạn ADN được xoắn trở lại ngay lập tức.
- Giai đoạn kết thúc: Sau khi tổng hợp được các U, đoạn ARN trước đó có thể tự
bổ sung thành đoạn kép đôi gấp khúc như kẹp (nhờ yếu tố kết thúc). Đoạn ARN này
chứa nucleoyid có tính chất bổ sung tạo thành cặp đôi xoắn kép. ARN ngừng tổng hợp,
ARN polymerase giải phóng khỏi ADN, được dephosphoryl hóa để có thể bắt đầu một chu kỳ sao chép mới. CÂU HỎI LƯỢNG GIÁ
1. Base nitơ trong thành phần acid nucleic dẫn xuất từ nhân: A. Purin, Pyridin B. Purin, Pyrol C. Pyrimidin, Imidazol D. Pyrimidin, Purin 66
2. Base nitơ dẫn xuất từ pyrimidin: A. Uracil, Cytosin, Thymin B. Thymin, Uracil, Guanin
C. Uracil, guanin, Hypoxanthin D. Cytosin, Guanin, Adenin
3. Base nitơ dẫn xuất từ purin: A. Adenin, Guanin, Cytosin
B. Guanin, Hypoxanthin , Thymin
C. Hypoxanthin, Metylhypoxanthin, Uracil
D. Guanin, Adenin, Hypoxanthin 4. Công thức sau có tên: A. Guanin NH2 B. Adenin N N C. Cytosin D. Hypoxanthin N NH 5. Công thức sau có tên: NH2 A.Cytosin B. Thymin N C. Hypoxanthin HO N D. Adenin
6. Thành phần hóa học chính của ADN:
A. Guanin, Adenin, Cytosin, Uracil, .D ribose, H3PO4
B. Adenin, Guanin, Uracil, Thymin, .D deoxyribose, H3PO4
C. Guanin, Adenin, Cytosin, Thymin, .D deoxyribose, H3PO4
D. Guanin, Adenin, Uracil, Thymin, .D deoxyribose, H3PO4
7. Thành phần hóa học chính của ARN :
A. Guanin, Adenin, Cytosin, Thymin, .D deoxyribose, H3PO4
B. Guanin, Adenin, Cytosin, Thymin, .D ribose
C. Guanin, Adenin, Cytosin, Thymin, .D ribose
D. Uracil, Thymin, Adenin, Hypoxanthin, .D deoxyribose, H3PO4 67
8. Thành phần hóa học chính của acid nucleic :
1. Pentose, H3PO4 , Base nitơ
2. Deoxyribose, H3PO4 , Base dẫn xuất từ purin
3. Ribose, H3PO4 , Base dẫn xuất từ pyrimidin
4. Ribose, H3PO4 , Base dẫn xuất từ pyridin
5. Deoxyribose, H3PO4 , Base dẫn xuất từ pyrol A. 1, 2, 4 B. 1, 2, 3 C. 2, 4, 5 D. 1, 4, 5 9. Các nucleosid sau gồm :
1. Adenin nối với Ribose bởi liên kết glucosid
2. Uracil nối với Hexose bởi liên kết glucosid
3. Guanin nối với Deoxyribose bởi liên kết glucosid
4. Thymin nối với Deoxyribose bởi liên kết glucosid
5. Cytosin nối với Ribinose bởi liên kết peptid A. 1,2,3 B. 1,3,5 C. 2,3,4 D. 1,3,4
10. Thành phần nucleotid gồm : 1. Nucleotid, Pentose, H3PO4 2. Base nitơ, Pentose, H3PO4
3. Adenosin, Deoxyribose, H3PO4 4. Nucleosid, H3PO4 5. Nucleosid, Ribose, H3PO4 A. 1, 2 B. 3, 4 C. 4, 5 D. 2, 3 68
Chương 7: HÓA HỌC VÀ CHUYỂN HÓA PROTID Mục tiêu
1. Trình bày được định nghĩa, cấu tạo, tính chất chung của acid amin, peptid.
2. Trình bày được định nghĩa, cấu trúc và tính chất của protein
3. Trình bày được chức năng của protein.
4. Trình bày được sự thoái hóa chung của acid amin.
5. Trình bày được chu trình urê
PHẦN 1. HÓA HỌC PROTID 1. ĐẠI CƯƠNG 1.1. Định nghĩa
Protid là những hợp chất hữu cơ trong thành phần cấu tạo gồm bốn nguyên tố chính:
C, H, O, N. Ngoài ra còn có các nguyên tố khác như: P, Fe, S, Cu, v.v.. 1.2. Vai trò
- Là thành phần cấu tạo nhân và nguyên sinh chất của tế bào
- Tham gia điều khiển hoạt động sinh lý của cơ thể (insulin, corticoid).
- Xúc tác các phản ứng chuyển hóa của cơ thể (lipase, urease…).
- Tham gia vào các quá trình bảo vệ cơ thể (các kháng thể).
- Tham gia vận chyển và phân bố oxy khắp cơ thể (hemoglobin). - Cung cấp năng lượng.
1.3. Phân loại protid
Thuật ngữ protid dùng để chỉ ba loại: acid amin, peptid và protein.
- Acid amin: Đơn vị cấu tạo nên protein. -
Peptid: Gồm từ hai đến hàng chục acid amin nối với nhau bằng liên kết peptid có
phân tử lượng < 6000 dalton. -
Protein gồm hàng trăm hàng ngàn acid amin nối với nhau. Tạo thành một hoặc nhiều chuỗi polypeptid. 2. ACID AMIN 2.1. Cấu tạo
Acid amin là những chất hữu cơ trong phân tử vừa có chứa nhóm amin (-NH2) vừa
có chứa nhóm carboxyl (-COOH), cùng gắn vào vị trí carbon nên các được gọi là acid
amin, một số khác có nhóm amin không gắn vào carbon , ví dụ …alanin. Công thức chung: R-CH-COOH NH2
Trừ prolin, còn tất cả các acid amin có cấu tạo chung như trên và chỉ khác nhau ở
gốc R. Thành phần gốc R đơn giản nhất là H, hoặc là gốc hydrocarbon, hoặc còn có
thêm nhóm chức -SH, -OH, -NH2, -COOH. 69
Acid amin là đơn vị cấu tạo của protein. Có khoảng 300 acid amin hiện diện trong
tự nhiên nhưng chỉ có 20 acid amin tham gia cấu trúc protein.
Bảng 7.1. 20 acid amin tham gia vào cấu trúc protein Khối Tên acid
Tên acid amin gọi theo danh Tên Ký lượng amin pháp hoá học viết tắt hiệu (MW) Glycin Acid α-aminoacetic Gly G 75 Alanin Acid α-aminopropionic Ala A 89 Prolin Acid α-pyrolydilcarboxylic Pro P 115 Valin Acid α-aminoisovaleric Val V 117 Leucin Acid α-aminoisocaproic Leu L 131 Isoleucin Acid α-amino-β-metylvaleric Ile I 131 Methionin
Acid α-amino-β-etylthiobutyric Met M 149 Phenylalanin
A. α-amino-β-phenylpropionic Phe F 165 A. α-amino-β- Tyrosin Tyr Y 181 hydroxyphenylpropionic Tryptophan
Acid α-amino-β-indolylpropionic Trp W 204 Serin
Acid α-amino-β-hydoxypropionic Ser S 105 Threonin
Acid α-amino-β-hydroxybutiric Thr T 119 Cystein
Acid α-amino-β-thiopropionic Cys C 121 Aspargin Amid của aspartate Asn B 132 Glutamin Amid của glutamate Gln Q 146 Lysin Acid α, ε diaminocaproic Lys K 146 Histidin
Acid α-amino-β-imidazolpropionic His H 155 Arginin
Acid α-amino-δ-guanidinvaleric Arg R 174 Aspartat Acid α-aminosuccinic Asp D 133 Glutamat α-aminoglutarate Glu E 147
Các acid amin được hình thành bằng nhiều con đường khác nhau. Tuy nhiên trong
cơ thể người và động vật không tổng hợp được tất cả các loại đó mà phải đưa từ ngoài
vào qua thức ăn. Những acid amin phải đưa từ ngoài vào được gọi là các acid amin
không thể thay thế. Người ta biết được có khoảng 8-10 loại acid amin không thể thay
thế bao gồm: Met, Val, Leu, Ile, Thr, Phe, Trp, Lys, Arg và His và ngày nay người ta
còn xem Cys cũng là một acid amin không thể thay thế. 70
2.2. Phân loại acid amin
Các acid amin được phân loại theo nhiều kiểu khác nhau, mỗi kiểu phân loại đều
có ý nghĩa và mục đích riêng. Tuy nhiên, đều dựa trên cấu tạo hoá học hoặc một số tính chất của gốc R.
Hiện nay cách phân loại các acid amin được sử dụng nhiều nhất là dựa vào gốc
R và được chia làm 5 nhóm:
a) Nhóm I: Gồm 7 acid amin có R không phân cực, kỵ nước, đó là: glycin, alanin,
prolin, valin, leucin, isoleucin và methionin.
b) Nhóm II: Gồm 3 acid amin có gốc R chứa nhân thơm, đó là phenylalanin, tyrosin và tryptophan.
c) Nhóm III: Gồm 5 acid amin có gốc R phân cực, không tích điện, đó là serin,
theonin, cystein, aspargin và glutamin.
d) Nhóm IV: 3 acid amin có R tích điện dương: lysin, histidin và arginin, trong
phân tử chứa nhiều nhóm amin.
e) Nhóm V: Gồm 2 acid amin có gốc R tích điện âm, đó là aspartat và glutamat,
trong phân tử chứa hai hóm carboxyl.
Hình 7.1. Công thức cấu tạo của các acid amin nhóm I (a), II (b) 71
Hình 7.2. Công thức cấu tạo của các acid amin nhóm III
Hình 7.3. Công thức cấu tạo các acid amin nhóm IV
Hình 7.4. Công thức cấu tạo của các acid amin nhóm V 72
2.3. Tính chất của acid amin
2.3.1. Tính chất lý học
Acid amin dễ tan trong dung môi phân cực (nước, ethanol), không tan trong dung
môi không phân cực (benzen, ether). Các acid amin thường có vị ngọt kiểu đường, muối
natri của acid glutamic có vị ngọt kiểu đạm (được dùng làm chất gia vị).
2.3.2. Tính chất lưỡng tính
Trong phân tử acid amin có nhóm carboxyl -COOH nên có khả năng nhường
proton (H+) thể hiện tính acid, mặt khác có nhóm amin –NH2 nên có khả năng nhận
proton nên thể hiện tính base. Vì vậy acid amin có tính chất lưỡng tính.
Trong môi trường acid, acid amin ở dạng cation (tích điện dương), nếu tăng dần
pH thì acid amin lần lượt nhường proton thứ nhất chuyển qua dạng lưỡng cực (trung
hoà về điện), và tiếp tục tăng pH acid amin sẽ nhường proton thứ hai chuyển thành
dạng anion (tích điện âm). Vì vậy người ta coi nó như một di-acid.
Các acid amin đều có nhóm –NH2 và -COOH liên kết với Cα, vì vậy chúng có
những tính chất hoá học chung. Mặt khác các acid amin khác nhau bởi gốc R, vì vậy
chúng có những phản ứng riêng biệt.
a). Phản ứng do gốc R
Do gốc R mang những nhóm hóa học khác nhau nên có thể dùng để xác định từng
acid amin riêng rẽ nhờ các phản ứng đặc trưng của nó, như phản ứng oxy hoá khử (do
nhóm -SH của cystein), tạo muối (do nhóm -COOH hay -NH2 của glutamat hay
lysine), tạo este do nhóm -OH của tyrosin v.v...
b). Phản ứng do cả 2 nhóm α-carboxyl -COOH và α-amin
Phản ứng Ninhydrin
Tất cả các acid amin trong phân tử protein đều phản ứng với hợp chất ninhydrin
tạo thành phức chất màu xanh tím, riêng imino acid như proline tạo thành màu vàng.
Phản ứng này được ứng dụng rộng rãi trong sắc ký, điện di … để xác định các acid amin
định tính, định lượng).
Phản ứng tạo lên kiết peptid
Đây là phản ứng quan trọng nhất của các acid amin, xảy ra giữa nhóm α-amin của
acid amin này với nhóm α-carboxyl của acid amin khác, tạo nên liên kết peptid và giải
phóng một phân tử nước. 73
c). Phản ứng do nhóm α-carboxyl
Ngoài các phản ứng thông thường tạo este, tạo amid, tạo muối ... mhóm -
COOH còn có những phản ứng đặc trưng khác như có thể bị khử thành hợp chất
rượu amino dưới sự xúc tác của NaBH4 R - NH2 - CH – COOH R - NH2 - CH – CH2OH
Nhóm -COOH có thể tạo thành phức aminoacyl-adenylat trong phản ứng hoạt
hoá acid amin để tổng hợp protein, hay có thể loại CO2 (gặp rất nhiều trong quá trình thoái hoá acid amin).
d). Phản ứng do nhóm α-amin
Nhiều phản ứng của nhóm amin được dùng để định tính và định lượng các chỉ tiêu của acid amin như:
Để định lượng nitrogen của acid amin người ta cho phản ứng với HNO2 để giải phóng N2. HOOC – CH – R HOOC – CH – R NH2 + HNO2 OH + N2 + H2O
Để định lượng acid amin người ta cho phản ứng với aldehyd tạo thành base schiff.
Để xác định acid amin đầu N-tận cùng người ta cho tác dụng với 2-4
dinitrofluobenzen (phản ứng Sanger) hay phenyliothiocyanate (phản ứng Edman). 3. PEPTID 3.1. Định nghĩa
Peptid là phân tử protein gồm hai đến hàng chục acid amin, nối với nhau bằng các
liên kết peptid, có phân tử lượng < 6000 dalton. 3.2. Cấu tạo
Các peptid có thể được tổng hợp trong tự nhiên hoặc được hình thành do sự thoái hoá
protein. Trong các peptid các acid amin liên kết với nhau thông qua liên kết peptide (hình 7.6).
Trong chuỗi peptid, ở đầu của là acid amin có nhóm α-amin (α-NH2) tự do gọi là
đầu N tận cùng và đầu có nhóm α-carboxyl (α-COOH) tự do gọi là đầu C tận cùng.
Liên kết peptid tạo nên bộ khung chính, còn gốc R tạo nên mạch bên của chuỗi
Như vậy, chuỗi peptid lúc nào cũng có một nhóm α-amin và một nhóm α-
carboxyl tự do. Với n acid amin thì có (n-1) liên kết peptid được hình thành và loại
(n-1) phân tử nước. 74
Hình 7.6. Sự tạo thành liên kết peptide 3.3. Cách gọi tên
Gọi theo số acid amin có trong chuỗi pepetid: dipeptid (2 acid amin), tripeptid (3 acid amin), …
Gọi theo gốc acid amin: bắt đầu từ đầu N tận cùng của acid amin đầu tiên đến
đầ C tận cùng của acid amin cuối.
Giữ nguyên tên acid amin có đầu C tận và thay đuôi của các acid amin khác bằng đuôi YL Ví dụ:
Serin – Alanin – Methionin – Valin – Glycin
Seryl – Alanyl – Methionyl – Valyl – Glycin
Gọi theo tên riêng: Ví dụ:
Glutathion:tripeptid gồm γ-glutamyl – cysteyl – glycin
Glucagon: polypeptid gồm 29 acid amin
Insulin: polypeptid gồm 51 acid amin
Để biểu thị thành phần và thứ tự acid amin, dùng ký hiệu chữ hoặc một chữ (nếu
chuỗi peptid dài) của acid amin viết liền nhau, từ đầu N tận đến đầu C tận, từ trái qua phải. Ví dụ:
Alanin – Valin – Leucin – Histidin – Prolin
Ala – Val – Leu – His – Pro A V L H P
H2N – Ala – Val – Leu – His – Pro – COOH
3.4. Tính chất hóa học
Phân tử peptid có các nhóm -NH2 và -COOH tự do có tính chất hóa học như acid
amin nên các phương pháp điện di, sắc ký,… dùng xác định các acid amin cũng được
dùng xác định các peptid. 75
Các gốc R của peptid cũng cho những phản ứng màu đặc trưng của các acid amin
tự do tương ứng. Một trong những phản ứng màu đặc trưng nhất để xác định liên kết
peptid đó là phản ứng màu Biuret. Biuret là sản phẩm ngưng tụ của 2 phân tử urê
kèm theo sự giải phóng 1 phân tử NH3. Phản ứng này không xảy ra với acid amin tự do và với dipeptid. NH2 NH2 NH2 O = C O = C + O = C NH3 + NH NH2 NH2 O = C NH2
Trong môi trường kiềm mạnh, liên kết peptid phản ứng với Urê Urê Biuret
CuSO4 tạo phức chất màu tím đỏ (hình 3.11.), hấp thụ cực đại ở bước sóng 540
nm. Đây là phản ứng được sử dụng rộng rãi để định lượng protein.
3.5. Các peptid thường gặp trong thiên nhiên
Trong tự nhiên, tồn tại nhiều dạng peptid có chức phận quan trọng liên quan đến
hoạt động sống của cơ thể: hormon, chất kháng sinh, những chất tiền thân của tế bào
vi khuẩn v.v... Bên cạnh đó cũng có những peptid chức phận chưa rõ ràng, có những
peptid là sản phẩm thuỷ phân đang còn dang dở của protein.
M ột số peptide quan trọng,có nhiều ý nghĩa đối với cho hoạt động sống của sinh vật.
3.5.1. Glutathion và các chất tương tự
Glutathion là một tripeptide γ-glutamyl-cysteyl-glycine có công thức cấu tạo: NH2 CH2 - SH
HOOC- CH - CH2-CH2 -CO-NH- CH - CO-NH-CH2-COOH
Trong cấu trúc của 76lutathione, nhóm SH của 76lutathi là nhóm hoạt động, vì
vậy người ta thường viết tắt chữ 76lutathione là GSH. Đây là 76lutathione dạng
khử. Trong môi trường hoạt động 76lutathione có thể nhường hydrogen (H) để thành
dạng oxy hoá (GSSG) và ngược lại có thể nhận H để thành dạng khử: + 2H 2 GSH GSSG + 2H 76
Glutathion là một trong những peptid nội bào phổ biến nhất, đóng vai trò là
một hệ thống oxy hoá khử (vận chuyển hydrogen)., nó phân bố nhiều trong các mô
và các cơ quan như: gan, thận, lách, tim, phổi, hồng cầu v.v…
3.5.2. Các hormon sinh trưởng (HGH)
Hormon sinh trưởng của người (HGH – human growth hormone) còn gọi STH
(somatotropin hormone) là một chuỗi polypeptid gồm 191 acid amin có khối lượng
phân tử 20.000. Trong cấu trúc có hai cầu disulfua được tạo thành giữa acid amin 53-
165 và giữa acid amin 182-189. Chuỗi hoạt động sinh học gồm 134 acid amin.
HGH có tác dụng đối với sự tăng trưởng nói chung, kích thích tạo sụn hơn là
tạo xương, đây cũng là một chất chuyển hoá, kích thích sự tổng hợp protein và là
hormon gây tăng đường huyết đồng thời kích thích sự thoái hoá lipid để đảm bảo nhu
cầu năng lượng trong cơ thể, gây tăng acid béo tự do trong huyết tương. 3.5.3. Insulin
Từ 1953, Sanger (giải thưởng Nobel 1958) nghiên cứu, tinh chế và xác định hoàn
toàn cấu trúc của phân tử insulin. Gồm 51 acid amin, khối lượng phân tử 5.700, gồm 2
chuỗi polypeptid (chuỗi A có 21 acid amin, chuỗi B có 30 acid amin) nối với nhau bằng 2
cầu disulfua. Trong chuỗi A cũng hình thành 1 cầu disulfua giữa acid amin thứ 6 và acid
amin thứ 11. Phần đặc hiệu của loài chỉ tập trung vào các acid amin thứ 8-9-10, 12-14 của
chuỗi A và đặc biệt là acid amin thứ 30 của chuỗi B.
Insulin có tác dụng rõ nhất trong tất cả các hormon của tuyến tụy, đặc biệt đối với
quá trình chuyển hoá glucid, có tác dụng hạ đường huyết, kích thích quá trình tổng hợp
và ức chế quá trình thoái hoá glycogen ở cơ, gan và mô mỡ. Đặc biệt, insulin tăng cường
tổng hợp acid béo, protein và kích thích sự đường phân. Tác dụng quan trọng nhất
của insulin là kích thích sự thâm nhập glucose, một số ose, acid amin trong tế bào
cơ, mỡ. Do vậy insulin làm giảm lượng glucose trong máu. Ngoài ra insulin cũng
làm giảm sự tân tạo glucose do làm giảm nồng độ enzym như pyruvat carboxylase
và fructose 1-6 diphosphatase.
3.6. Một số peptid có hoạt tính sinh học khác
a) Oxytocin: là một peptid có 9 acid amin, tác dụng trên cơ trơn của tử cung và tuyến
vú, gây co khi tử cung sinh con và kích thích sự tiết sữa khi cho con bú.
b) Vasopressin: là một peptid 9 acid amin, tác dụng chống lợi niệu, tăng cường
tái hấp thu nước ở thận, đồng thời làm co mạch, do đó có tác dụng tăng huyết áp.
c) Glucagon: có 29 acid amin, tác dụng làm tăng đường huyết.
d) Bradykinin: là chất gây hạ huyết áp cơ trơn, tăng hoạt động tự kích thích và phản
ứng tự vệ, liều thấp có tác dụng giảm đau.
e) Kallidin: tác nhân gây hạ huyết áp cơ trơn.
f) Peptid kháng sinh: do vi khuẩn hoặc nấm sinh sản: gramicillin, penicilin, tyrocidin, bacitracin. 77 4. PROTEIN 4.1. Định nghĩa
Protein là những đại phân tử có khối lượng > 6000 dalton, gồm hàng trăm, hàng
ngàn acid amin kết hợp lại với nhau tạo thành một chuỗi polypetid. 4.2. Phân loại
Protein có thể được phân loại theo nhiều cách: có thể dựa vào cấu tạo, khả năng
hòa tan, hình dạng, chức năng v.v…
4.2.1. Phân loại theo cấu tạo
- Protein thuần ( protein đơn giản): là các protein khi thủy phân cho các acid amin
thường gặp, ví dụ: albumin, globumin, protamine, histon, v.v…
- Protein tạp (protein liên hợp): gồm protein thuần và phần phi protein ( có bản
chất không phải là protein, có thể là glucid, lipid, acid nucleic, kim loại, v.v…).
- Protein khi thủy phân dở dang tạo thành các peptid, khi thủy phân đến cùng biến thành các acid amin.
4.2.2. Phân loại theo hình dạng
- Protein hình cầu: là những protein có kích thước chiều dài/kích thước ngang <
10 dalton; gồm protein enzym và protein huyết thanh.
- Protein hình sợi: là những protein có kích thước chiều dài/kích thước chiều ngang
> 10, gồm keratin của tóc, móng và collagen của mô liên kết.
4.3. Cấu trúc của protein
- Cấu trúc bậc I: biểu thị thứ tự sắp xếp các acid amin trong chuỗi polypeptid,
hoặc nhiều chuỗi polypeptide và vị trí của liên kết disulfid.
- Cấu trúc bậc II: biểu thị sự xoắn của chuỗi polypeptide, điển hình là cấu trúc
bậc II của protein sợi, liên kết hydrogen đóng vai trò quan trọng trong cấu trúc bậc II.
- Cấu trúc bậc III: biểu thị sự xoắn và gấp khúc của chuỗi polypeplid, liên kết
disulfide đóng vai trò quan trọng trong việc duy trì cấu trúc bậc III.
- Cấu trúc bậc IV: biểu thị sự kết hợp của nhiều chuỗi polypeptide có cấu trúc
bậc III trong phân tử protein. Ví dụ: hemoglobin có cấu trúc bậc IV.
4.4. Tính chất của protein
4.4.1. Tính chất lý – hoá a) Tính tan
Các loại protein khác nhau có khả năng hoà tan dễ dàng trong một số loại dung
môi nhất định, như: albumin dễ tan trong nước, globulin dễ tan trong muối loãng,
glutelin chỉ tan trong dung dịch kiềm hoặc acid loãng v.v...
b) Tính ngậm nước
Trong môi trường nước, protein kết hợp với nước trương lên thành dạng keo
(hydrate hoá), các phân tử nước bám vào các nhóm ưa nước trong phân tử protein như 78
-NH2, -COOH... Lớp áo nước bao quanh phân tử protein là một trong các yếu tố làm
bền vững cấu trúc, ngăn cách các phân tử protein không cho chúng dính vào nhau để thành tủa.
c) Độ nhớt của dung dịch protein
Các protein khác nhau có độ nhớt khác nhau khi hòa tan trong dung dịch . Tính
chất này dùng để xác định khối lượng phân tử của protein (độ nhớt càng cao thì khối
lượng phân tử càng cao).
d) Hằng số điện môi của dung dịch protein
Khi thêm các dung môi hữu cơ trung tính như ethanol, aceton vào dung dịch
protein trong nước thì độ tan của protein giảm và protein sẽ kết tủa do việc giảm mức
độ hydrate hoá của các nhóm ion hoá của protein, các phân tử protein kết hợp với
nhau thành tủa. Như vậy, hằng số điện môi của dung môi làm ngăn cản lực tĩnh
điện giữa các nhóm tích điện của protein và nước.
e) Tính chất điện li của protein
Cũng như acid amin, protein là chất điện li lưỡng tính vì trong phân tử có nhiều
nhóm phân cực mạnh (gốc R) của acid amin.
Trạng thái tích điện của các nhóm này phụ thuộc vào pH của môi trường. Ở
một pH nào đó mà tổng điện tích (+) và điện tích (-) của phân tử protein bằng không,
phân tử protein không di chuyển trong điện trường gọi là pHi (isoelectric - điểm
đẳng điện) của protein.
Trong môi trường có pH = pHi của protein, protein dễ dàng kết tụ lại với nhau, do
đó, tính chất này dung để xác định pHi của protein cũng như để kết tủa protein. Mặt
khác do sự sai khác nhau về pHi giữa các protein mà có thể điều chỉnh pH của môi
trường để tách riêng các protein ra khỏi hỗn hợp của chúng.
f) Sự kết tủa bằng muối của dung dịch protein
Muối trung tính có ảnh hưởng rõ tới độ hoà tan của protein hình cầu, nồng độ thấp
làm tăng độ hoà tan. Khi tăng nồng độ muối, độ hòa tan giảm và ở nồng độ muối rất cao,
protein có thể kết tủa hoàn toàn.
Các protein khác nhau bị kết tủa ở những nồng độ muối trung tính khác nhau.
Người ta dùng tính chất này để chiết xuất và tách riêng protein khỏi hỗn hợp. Đó là phương
pháp diêm tích (kết tủa protein bằng muối).
g) Sự biến tính
Khi các liên kết (trừ liên kết peptid) trong phân protein bị cắt đứt, làm cấu trúc
protein thay đổi, protein bị biến tính. Hiện tượng biến tính làm giảm độ hòa tan, mất các
hoạt tính sinh học. Khi bị biến tính, cấu trúc protein đảo lộn, các nhóm kỵ nước quay ra
ngoài, các nhóm ưa nước quay vào trong, sự hydrat hóa giảm, các protein dễ kết hợp với
nhau. Tính chất này được áp dụng trong xét nghiệm protein niệu. 79
Các tác nhân gây biến tính:
Vật lý: nhiệt độ, tia tử ngoại, áp suất cao, …
Hóa học: acid mạnh (a. tricloacetic, a. nitric,…), muối kim loại nặng (HgCl2), kiềm mạnh, alcol, …
Phân biệt 2 loại biến tính:
Thuận nghịch: protein biến tính có thể trở về trạng thái ban đầu (sự hoàn
nguyên). Dung dịch trypsin bị biến tính khi bị đun nóng ở pH = 3 và hoàn nguyên sau
khi làm lạnh trong một thời gian nhất định.
Không thuận nghịch: protein biến tính không thể trở về trạng thái ban đầu, như luộc trứng gà.
4.4.2. Các phản ứng hoá học của protein
Protein có các phản ứng hoá học tương tự các acid amin và peptid: phản ứng của các
nhóm -COOH, -NH2, gốc R và phản ứng tạo màu đặc trưng của liên kết peptid như phản ứng biuret.
Ngoài ra, còn có một số phản ứng màu đặc trưng khác, có ý nghĩa quan trọng trong
phát hiện protein và các gốc acid amin khác trong chuỗi polypeptid.
a) Phản ứng với thuốc thử Folin-Ciocateau
Thuốc thử Folin-Ciocateau chứa phosphomolipdic acid và phosphovolframic acid.
Các chất này làm tăng độ nhạy của phản ứng biuret, mặt khác phản ứng với gốc Tyr và Trp
trong phân tử protein. Các gốc này tham gia trong quá trình tạo phức chất màu xanh da trời.
b) Các phản ứng màu đặc trưng khác
Dùng để phát hiện acid amin, protein trong dung dịch nhớ vào sự có mặt của các
nhóm chức hóa học trong phân tử protein.
Phản ứng xanthproteic: các gốc acid amin Tyr, Trp, Phe trong protein tác dụng
với HNO3 đậm đặc tạo thành màu vàng và sau khi thêm kiềm sẽ chuyển thành da cam.
Phản ứng Pauli: các gốc Tyr, His tác dụng với diazobenzosulfonic acid tạo thành màu đỏ anh đào.
Phản ứng Millon: gốc Tyr tác dụng với thuỷ ngân nitrate trong HNO3 đậm
đặc tạo thành kết tủa màu nâu đất.
Phản ứng Saccaguichi: gốc Arg tác dụng với dung dịch kiềm của α-naphtolvà
hypobromite cho màu đỏ anh đào.
Phản ứng Adamkievich: gốc Trp tác dụng với glyoxylic acid và H2SO4 đặc
tạo thành vòng tím đỏ ở mặt phân cách.
4.5. Chức năng sinh học của Protein
Protein tham gia mọi hoạt động sống trong cơ thể sinh vật, ngoài vai trò là thành
phần chính trong cấu trúc của tế bào và mô, protein còn có nhiều chức năng phong phú 80
khác quyết định những đặc điểm cơ bản của sự sống như sự truyền đạt thông tin di
truyền, sự chuyển hoá các chất do các 81ormone, các kháng thể chống lại bệnh tật, các
81ormone dẫn truyền các tín hiệu trong tế bào v.v…
4.5.1. Chức năng tạo hình
Ngoài các protein làm nhiệm vụ cấu trúc như vỏ virus, màng tế bào, còn gặp
những protein thường có dạng sợi như: sclerotin có trong lớp vỏ ngoài của sâu bọ;
fibroin của tơ tằm, nhện; collagen, elastin của mô liên kết, mô xương. Collagen đảm
bảo cho độ bền và tính mềm dẻo của mô liên kết.
4.5.2. Chức năng xúc tác
Hầu hết các phản ứng trong cơ thể đều do các protein đặc hiệu đóng vai trò xúc
tác, được gọi là các enzym. Hiện nay, đã biết được khỏang 3.500 enzym khác nhau,
nhiều enzym đã được tinh sạch, kết tinh và nghiên cứu cấu trúc.
4.5.3. Chức năng bảo vệ
Protein tham gia vào hệ thống miễn dịch, đặc biệt nhiều loại protein thực hiện
các chức năng riêng biệt tạo nên hiệu quả miễn dịch đặc hiệu và không đặc hiệu. Các
protein miễn dịch được nhắc đến nhiều hơn cả là các kháng thể, bổ thể ...
Ngoài ra protein còn tham gia vào quá trình đông máu để chống mất máu cho
cơ thể hoặc một số loài có thể sản xuất ra những độc tố có bản chất là protein như
enzym nọc rắn, lectin v.v... có khả năng tiêu diệt kẻ thù để bảo vệ cơ thể.
4.5.4. Chức năng vận chuyển
Trong cơ thể có những protein làm nhiệm vụ vận chuyển như: hemoglobin,
myoglobin, hemocyanin vận chuyển O2, CO2 và H+ đi khắp các mô, các cơ quan trong
cơ thể; lipoprotein vận chuyển lipid, ceruloplasmin vận chuyển Cu trong máu…
4.5.5. Chức năng vận động
Nhiều protein làm nhiệm vụ vận động co rút cơ (myosin, actin), chuyển vị trí
của nhiễm sắc thể trong quá trình phân bào
4.5.6. Chức năng dự trữ và dinh dưỡng
Protein dự trữ là nguồn cung cấp dinh dưỡng quan trọng cho các tổ chức mô, phôi phát
triển. Các protein dự trữ như: casein của sữa, ovalbumin của trứng, feritin của lách (dữ trữ sắt) v.v...
4.5.7. Chức năng dẫn truyền tín hiệu thần kinh
Protein tham gia vào việc dẫn tín hiệu thần kinh đồi với các kích thích đặc hiệu như:
sắc tố thị giác rodopsi ở màng lưới mắt.
4.5.8. Chức năng điều hoà
Điều hoà quá trình trao đổi chất thông qua tác động lên bộ máy thông tin di
truyền. Các hormon, các protein ức chế đặc hiệu enzym đều có chức năng điều hoà 81
nhiều quá trình trao đổi chất, ví dụ như các protein repressor ở vi khuẩn có thể làm
ngừng quá trình sinh tổng hợp enzym từ các gen tương ứng.
4.5.9. Chức năng cung cấp năng lượng
Protein cũng là nguồn cung cấp năng lượng quan trọng cho mọi hoạt động
sống trong cơ thể. Trong cơ thể các protein bị phân giải thành các acid amin, từ đó
tiếp tục tạo thành hàng loạt các sản phẩm, trong đó có các ceto acid, aldehyd và
carboxylic acid. Các chất này đều bị oxy hoá dần dần tạo thành CO2 và H2O đồng thời
giải phóng ra năng lượng.
4.6. Một số protein thường gặp -
Protamin: Là protein đơn giản nhất trong nhân tế bào, có từ 6 - 9 acid amin, có
phân tử lượng từ 4000 - 5000 dalton. -
Albumin: Có trong tất cả mọi sinh vật (lòng trắng trứng, huyết thanh). -
Globulin: Có trong huyết thanh, trứng sữa. -
Nucleoprotein: Protein và nhóm ngoại acid nucleic. -
Chromoprotein: Protid tạp bao gồm phần protid đơn giản và nhóm ngoại có màu. - Glucoprotein. - Lipo – protein. - Phosphoprotein.
PHẦN 2. CHUYỂN HÓA PROTID 1. ĐẠI CƯƠNG
1.1. Sơ đồ tổng quát
CO2, H2O, urê, năng lượng Peptid Tiêu hóa Acid Protein Hấp thu amin
Sản phẩm sinh học đặc biệt Protein Ố NG TIÊU HÓA TẾ BÀO 1.2. Nguồn gốc
- Protein thuần (protein đơn giản): là các protein khi thủy phân cho các acid amin
thường gặp, ví dụ: albumin, globulin, protamin, histon.v..v..
- Acid amin ngoại sinh: do động vật, thực vật và vi sinh vật (như tảo, men bia)
cung cấp cho cơ thể qua quá trình tiêu hóa và hấp thu.
- Acid amin nội sinh: tổng hợp được trong cơ thể, do protid của tế bào bị thủy phân
thành các acid amin, gọi là các acid amin nội sinh. 82 1.3. Tiêu hóa
1.3.1. Sự thủy phân protid ngoại sinh (sự tiêu hóa protid)
Quá trình tiêu hóa bắt đầu ở dạ dày. Dạ dày bài tiết HCl và pepsin, pH rất acid (1-
2) nên các protein có cấu trúc bậc 2, 3, 4 bị phá vỡ, protein bị phân giải.
Pepsin được bài tiết dưới dạng tiền chất không hoạt động là pepsinogen.
Pepsinogen được hoạt hóa bởi HCl thành pepsin hoạt động. Pepsin thủy phân đặc hiệu
liên kết của acid amin nhân thơm hoặc liên kết của acid amin tạo ra các peptid ngắn hơn.
Sau đó các peptid này được đưa xuống ruột.
Ở ruột non, với pH kiềm thì pepsin bị bất hoạt. Tụy bài tiết các proenzym
(zymogen) như trysinogen, chymotrysinogen, procarboxypeptidase, đổ vào ruột non và
được biến đổi thành dạng hoạt động.
Trypsinogen đươc hoạt hóa bởi enterokinase của ruột non thành trypsin. Trypsin
trở lại hoạt hóa trypsinogen, chymotrypsin, procarboxypeptidase thành các enzym hoạt
động trypsin, chymotrypsin, carboxypeptidase.
- Trypsin thủy phân liên kết peptid của các acid amin kiềm.
- Chymotrypsin thủy phân liên kết peptid của các acid amin đầu C tận giải phóng acid amin tự do.
- Ruột non bài tiết aminopeptidase, thủy phân liên kết peptid của acid amin đầu N
tận giải phóng acid amin tự do.
1.3.2. Sự thủy phân protid nội sinh
Ở người trưởng thành, các protid nội sinh cũng đươc thoái hóa và tổng hợp mới
với số lượng hằng định, quá trình này gọi là sự đổi mới protid. Mỗi ngày, lượng protid
đổi mới chiếm khoảng 1-2% protid toàn phần. Ở trẻ em trong thời kì phát triển, tỷ lệ
protid đổi mới nhiều hơn so với người trưởng thành. Phần lớn các protid đổi mới trong
tế bào nơi chúng tồn tại.
Các protid huyết tương kết hợp với các receptor đặc hiệu trên tế bào gan và được
thoái hóa. Các enzym tiêu hóa protid (pepsin, trypsin, chymotrypsin) thủy phân protid
trong thức ăn không có vai trò trong sự đổi mới protid trong cơ thể.
Sự đổi mới protid là sự thoái hóa protid thành peptid hoặc acid amin. Phần lớn acid
amin tạo ra được sử dụng để tổng hợp protid mới, một số thoái hóa thành sản phẩm để đào thải và bài tiết. 1.3.3. Hấp thu
Do quá trình tiêu hóa trên, các acid amin tự do được hấp thu qua niêm mạc ruột
non, theo cơ chế vận chuyển tích cực cần năng lượng, vào tĩnh mạch cửa tới gan, qua
máu tới các tế bào và mô. 83
2. SỰ THOÁI HÓA ACID AMIN
2.1. Chuyển hóa của nhóm amin
2.1.1. Phản ứng chuyển amin
Hầu hết, các acid amin loại nhóm α amin bằng cách vận chuyển nhóm α amin đến
carbon α của acid α-ketonic. Acid amin trở thành acid α cetonic tương ứng, còn acid α-
ketonic nhận nhóm amin trở thành acid amin mới. Quá trình này gọi là phản ứng chuyển
amin. Enzym xúc tác phản ứng chuyển amin là aminotransferase (transaminase) có
coenzym là pyridoxal phosphate (dạng hoạt động của vitamin B6). Phản ứng tống quát: Transaminase
Acid amin A + acid -ketonic B
Acid cetocic A + acid amin B
Phần lớn các acid amin chuyển nhóm amin sang chất nhận là α-ketoglutarat, enzym
xúc tác cho phản ứng này là transaminase. Các enzym này phổ biến ở các mô (cơ, gan,
tim, thận,….) và có hoạt tính xúc tác cao.
Kết quả của quá trình trao đổi amin, nhóm amin của nhiều acid amin được vận
chuyển đến α-ketoglutarat thành glutamat. Tất cả các acid amin đền có thể chuyển amin
nhưng với mức độ khác nhau, mạnh nhất là glutamate và aspartat.
2.1.2. Phản ứng khử amin
Là một quá trình quan trọng, trong đó nhóm NH2 tách khỏi phân tử acid amin dưới dạng NH3.
a) Khử amin oxy hóa các acid amin thông thường
Quá trình khử amin oxy hóa gồm hai giai đoạn: oxy hóa acid amin tạp acid α imin,
thủy phân tự phát acid α Imin tạo ra acid α-ketonic và NH +
4 . Quá trình này xảy ra ở bào
tương, enzym xúc tác là L-amino-acid-oxidase có coenzym là FMN.
b) Khử amin oxy hóa glutamat
Glutamat được tạo ra chủ yếu trong quá trình trao đổi amin, được chuyển vào ty
thể và bị khử amin oxy hóa nhờ enzym glutamat dehydrogenase (có coenzym là NAD+
hoặc NADP+). Enzym glutamat dehydrogenase có hoạt tính xúc tác mạnh, nên trong hầu
hết các sinh vật, glutamat được khử amin oxy hóa tốc độ cao. Vì vậy, quá trình này có
vai trò trung tâm trong việc khử amin của các acid amin.
L glutamat dehydrogenase L-glutamat -ketoglutarat + NH3
c) Sự liên quan giữa quá trình trao đổi amin và khử amin oxy hóa
Các acid amin thông thường khử amin oxy hóa gián tiếp qua glutamat vì:
- Hoạt tính của enzym glutamat dehydrogenase rất mạnh nên glutamat được khử
amin oxy hóa với tốc độ cao và có lợi về mặt năng lượng.
- Hoạt tính của enzym glutamat aminotransferase cao nên nhóm amin của hầu hết
các acid amin tập trung tạo glutamat trong quá trình trao đổi amin. 84
• Các enzym L-amino-aicd-oxidase xúc tác cho quá trình khử amin oxy hóa các
acid amin thông thường hoạt động yếu và sinh ra chất độc là H202.
• 𝛼-ketoglutarat là chất trung gian có hoạt động như một “con thoi” vận chuyển nhóm amin.
d) Phản ứng amin hóa
Là phản ứng ngược lại với phản ứng khử amin oxy hóa, đó là sự tổng hợp lại acid
amin từ các acid 𝛼-ketonic và NH3. Ví dụ tổng hợp alanin từ acid pyruvic và NH3.
2.2. Sự chuyên chở NH + 4 Khi NH +
4 tăng cao, cơ thể có biểu hiện nhiễm độc, biểu hiện trạng thái hôn mê cấp
tính do thay đổi pH của tế bào, làm cạn kiệt cơ chất của chu trình Citric. Vì vậy, NH + 4
phải được biến thành chất không độc trước khi được đưa vào máu tới gan hoặc thận. Nó
được gắn vào acid glutamic tạo thành glutamat nhờ enzym glutamin synthetase (phản ứng amin hóa).
L glutamat dehydrogenase L-glutamat + NH3 L-Glutamin
Glutamin không độc, trung tính nên dễ dàng qua màng tế bào. Glutamin từ các mô
vào máu tuần hoàn rồi đến gan và thận. Nhờ enzym glutaminase ở ty thể thủy phân
glutamin thành glutamat và NH3 .
- Ở thận: sự thủy phân glutamin tạo NH +
4 cung cấp cho nước tiểu. Sự đào thải NH +
4 ở thận góp phần điều hòa thăng bằng acid base của cơ thể. Nếu lượng H+ trong
nước tiểu cao, quá trình thủy phân glutamin ở thận xảy ra mạnh. - Ở gan : NH +
4 được biến đổi thành urê và được đào thải ra ngoài qua nước tiểu.
2.3. Chu trình tạo thành urê
Hay còn gọi là chu trình Ornithin của Krebs và Henseleit. Urê được tạo thành ở gan qua 5 giai đoạn sau :
- Giai đoạn 1: tạo thành Carbamyl phosphat do sự gắn NH3 tự do với CO2 nhờ sự xúc
tác của carbamyl phosphat synthetase ở trong ty thể, phản ứng xảy ra ở ty thể tế bào
gan. Carbamyl phosphat synthetase là enzym then chốt của chu trình urê.
- Giai đoạn 2: Chuyển nhóm carbamin phosphat tới ornithin tạo thành Citrullin nhờ
enzym ornithin carbamyl transferase ở ty thể.
- Giai đoạn 3: tạo thành arginosuccinat ở gan do sự kết hợp citrullin với aspartat nhờ
enzym arginosuccinat synthetase.
- Giai đoạn 4: phân ly arginosuccinat thành arginin và fumarat nhờ arginosuccinat lyase.
- Giai đoạn 5: tao thành urê do enzym arginase xúc tác sự thủy phân arginin.
Ornithin được tạo thành vận chuyển vào ty thể bắt đầu một chu trình mới.
Urê được tạo thành ở gan vào máu, tới thận để đào thải. Bình thường lượng urê trong
máu khoảng 0,2-0,4g/l (3,5-7mmol/l). Trong nước tiểu, lượng urê từ 15-20g/24h. Lượng
urê thay đổi tùy thuộc vào chế độ ăn giàu protid. 85
2.4. Chuyển hóa của nhóm carboxyl
Trong quá trình thoái hóa của các acid amin, phản ứng khử carboxyl xảy ra dễ dàng
trong các mô nhờ enzym decarboxylase tạo thành các amin tương ứng. Enzym
decarboxylase đặc hiệu cho từng acid amin. R – CH – COO- R – CH – NH2 Decarboxylase + CO2 NH + 3
Một số acid amin khử carboxyl tạo thành amin có hoạt tính sinh học như : 𝛾 amino
butyric acid (GAGA) là sản phẩm khử carboxyl của glutamat, là chất ức chế thần kinh.
Hay histamin (do histidin bị khử carboxyl) là chất dẫn truyền thần kinh.
Các amin tiếp tục khử amin oxy hóa nhờ enzym monoamino oxidase (MAO) hoặc
diamino oxidase tạo thành aldehyd rồi thành acid tương ứng. Acid carboxylic tiếp tục
thoái hóa đến CO2 và H2O.
Phản ứng tổng quát: R – CH – NH2 RCHO RCOOH CO2 + H2O
2.5. Chuyển hóa của khung carbon
Sau khi mất nhóm amin, sản phẩm của các acid amin có thể là pyruvat, oxaloacetat,
𝛼-ketogultarat, acetyl CoA, succinyl CoA. Các sản phẩm này có thể đi vào chu trình
acid citric hoặc tổng hợp glucose, hoặc tổng hợp thể cetonic.
- Thoái hóa trong chu trình acid citric: tất cả sản phẩm thoái hóa của acid amin đều
có thể đi vào chu trình acid citric tiếp tục thoái hóa hoàn toàn đến CO2 và H2O.
- Tổng hợp glucose ở bệnh nhân đái tháo đường tụy: khi đưa một số acid amin vào
cơ thể thấy tăng đào thải glucose ra nước tiểu, gọi là các acid amin sinh đường.
- Tổng hợp thể cetonic: acid amin khi thoái hóa khung carbon tạo acetoactyl CoA
và acetyl CoA đều có thể tổng hợp nên các thể cetonic. 86
3. TỔNG HỢP ACID AMIN
Cơ thể người và động vật có xương sống chỉ có thể tổng hợp được 10 hoặc 12 acid
amin từ các sản phẩm chuyển hóa của glucid và lipid, đó là arginin, histidin, isoleucin,
leucin, lysin, methyonin, phenylalanin, threonin, tryptophan, valin. Số còn lại cơ thể
không tổng hợp được là acid amin cần thiết, phải lấy từ thức ăn (vi sinh vật và thực vật).
Ở trẻ em, hai acid amin không thể tổng hợp được là Arg và His nên gọi là acid amin bán cần thiết.
3.1. Quá trình tạo thành NH +
4 từ nitơ, nitrit và nitrat
Quá trình này chỉ có ở vi sinh vật và thực vật thượng đẳng. N + 2 + 10H+ + 8e- + 16ATP Nitro genase 2NH4 + 16ADP + 16Pi + H2
3.2. Sự vận chuyển NH +
4 vào các hợp chất sinh học NH +
4 hình thành sẽ được chuyển vào các hợp chất sinh học qua glutamat và glutamin.
Quá trình tổng hợp glutamin đơn giản và giống nhau ở mọi cơ thể sống.
- Tạo glutamin : Con đường quan trọng nhất là tập trung NH + 4 vào glutamat và
glutamin dưới sự xúc tác của enzym glutamin synthetase. - Tạo glutamat:
• Ở vi khuẩn: tổng hợp glutamat bằng cách amin hóa 𝛼-ketoglutarat nhờ
enzym glutamat synthetase, glutamin là chất chuyển nhóm amin.
-ketoglutarat + Glutamin + NADPHH+ 2 Glutamat + NADP
• Ở động vật: Sự tạo thành glutamat chủ yếu bằng trao đổi amin với 𝛼
cetolutarat hoặc có thể gắn với NH + 4 với 𝛼 cetoglutarat. cetoglutarat + NH +
4 + NADPHH+ Glutamat + NADP + H2O Trong cơ thể NH +
4 được đưa vào phân tử sinh học ở dạng nhóm amin của glutamat
hoặc glutamin. Các nhóm amin này tham gia quá trình sinh tổng hợp của các acid amin
và những hợp chất có chứa nitơ khác.
3.3. Sự tổng hợp acid amin
Tổng hợp 20 acid amin thường gặp ở các thể sinh vật có sự khác nhau. Thực vật
thượng đẳng tổng hợp được tất cả các acid amin cần cho sự tổng hợp protid từ các nguồn
nitơ, nitrit, nitrat. VD: E.coli tổng hợp được tất cả các acid amin từ NH + 4 .
Quá trình tổng hợp acid amin là quá trình gắn nhóm amin vào khung carbon tương
ứng tạo các acid amin tương ứng. Từ khung carbon (các chất chuyển hóa trung gian)
tổng hợp nên một số acid amin gọi là họ của acid amin: họ 𝛼-ketoglutarat, họ 3
phosphoglycerat, họ oxaloacetat và pyruvat, họ phosphoenol pyruvat, v.v...
Sự tổng hợp acid amin được điều hòa theo cơ chế điều khiển ngược (Feedback),
sản phẩm cuối cùng của quá trình ức chế enzym xúc tác đầu tiên. 87 4. TỔNG HỢP PROTID
Tổng hợp protid hay còn gọi là sự dịch mã (dịch mã di truyền từ ARNm sang trật
tự acid amin trong phân tử protid).
Mọi sự sai lệch trong cấu trúc phân tử protid tổng hợp (do di truyền hay do quá
trình tổng hợp) có thể dẫn tới những trạng thái bệnh lý nghiêm trọng của cơ thể sống
Quá trình sinh tổng hợp protid
Sinh tổng hợp có thể mô tả 2 quá trình: sao chép mã (phiên mã) và dịch mã.
Quá trình phiên mã: là quá trình tổng hợp ARNm trên khuôn mẫu ADN nhờ enzym ARN polymerase.
Quá trình dịch mã : được hiểu là quá trình sinh tổng hợp protid. Gồm 2 bước :
- Bước 1: hoạt hóa acid amin.
- Bước 2 gồm 3 giai đoạn: mở đầu, kéo dài và kết thúc.
4.1. Hoạt hóa acid amin
Sự hoạt hóa acid amin xảy ra ở bào tương dưới tác dụng của enzym aminoacyl- ARNt synthetase.
Trước hết phản ứng tạo chất trung gian là aminoacyl adenylat gắn với trung tâm
hoạt động của enzym. Sau đó tạo phức hợp với aminoacyl-ARNt. Enzym aminoacyl-
ARNt synthetase đặc hiệu với acid amin không cao lắm, nên có thể hoạt hóa đối với
những acid amin tương tự nhau. Nhưng những acid amin được hoạt hóa nhầm này không
chuyển sang ARNt tương ứng.
Phản ứng có thể tóm tắt như sau: E + Acid amin + ATP [Aminoacyl-AMP] E + PPi ARNt AMP Aminoacyl-ARNt
4.2. Giai đoạn mở đầu chuỗi
Thông thường sự mở đầu tổng hợp protein đều bắt đầu bằng acid amin methionin,
mã hóa bởi bộ ba AUG (mã mở đầu) nằm trên ARNm. Methionin tham gia mở đầu chuỗi
polypeptid ở dưới dạng fomylmethionin-ARNt.
Kết quả của giai đoạn mở đầu là fomylmethionin-ARNt gắn vào vị trí P của
ribosom tương ứng với mã mở đầu của AUG của ARNm.
4.3. Giai đoạn kéo dài chuỗi polypeptid
Đây là quá trình lắp ráp các acid amin theo một trình tự nhất định đã được mã hóa
ở ARNm, tạo thành chuỗi polypeptid đặc hiệu. Quá trình này là quá trình giãi mã hay
dịch mã, là chuyển các thông tin ở ARNm (dưới dạng các mã) sang chuỗi polypeptid. 88
Giai đoạn kéo dài chuỗi có thể chia làm 3 chặng:
- Chặng đầu: gắn aminoacyl-ARN, vào vị trí A của ribosom.
- Chặng hai: tạo liên kết peptid với sự xác tác của enzym peptidyltransferase, tạo
thành peptidyl-ARN(fomylmethionin-ARNt) vẫn gắn ở vị trí A.
- Chặng ba: chuyển vị trí. Sau khi liên kết peptid được hình thành nhờ tác dụng
của EFG ribosom trượt một khoảng tương đương với chiều dài một bộ ba mật mã. Do
đó peptidyl-ARNt chuyển từ vị trí A sang vị trí F, EFG tách khỏi ribosom. Lúc này vị
trí A lại trống, sẵn sàng nhận thêm acid amin-ARNt với bộ ba đối mã tương ứng, bắt đầu
một chu kỳ kéo dài mới.
4.4. Giai đoạn kết thúc
Sự kéo dài chuỗi polypeptid sẽ kết thúc khi vị trí A trên ribosom xuất hiện những
bộ ba kết thúc (UAG, UAA, UGA), nghĩa là nhửng bộ ba không mã hóa cho acid amin
nào. Các yếu tố kết thúc RF1, RF2, RF3 gắn vào ribosom tại điều kiện tách các thành
phần của phức hợp ribosom hoạt động: chuỗi polypeptid, ARNt cuối cùng, ARNm,
ribosom 70S phân ly thành 30S và 50S.
CÂU HỎI LƯỢNG GIÁ
1. Acid amin là hợp chất hữu cơ trong phân tử có:
A. Một nhóm -NH2, một nhóm -COOH B. Nhóm -NH2, nhóm -COOH C. Nhóm =NH, nhóm -COOH D. Nhóm -NH2, nhóm -CHO
2. Acid amin trung tính là những acid amin có:
A. Số nhóm -NH2 bằng số nhóm -COOH
B. Số nhóm -NH2 nhiều hơn số nhóm -COOH
C. Số nhóm -NH2 ít hơn số nhóm -COOH
D. Không có các nhóm -NH2 và -COOH
3. Acid amin acid là những acid amin:
A. Gốc R có một nhóm -NH2
B. Gốc R có một nhóm -OH
C. Số nhóm -COOH nhiều hơn số nhóm -NH2
D. Số nhóm -NH2 nhiều hơn số nhóm -COOH
4. Acid amin base là những acid amin:
A. Tác dụng được với các acid, không tác dụng với base
B. Chỉ có nhóm -NH2, không có nhóm -COOH 89
C. Số nhóm -NH2 ít hơn số nhóm -COOH
D. Số nhóm -NH2 nhiều hơn số nhóm -COOH
5. Hoạt tính GPT tăng chủ yếu trong:
A. Rối loạn chuyển hóa Glucid
B. Một số bệnh về gan
C. Một số bệnh về tim
D. Nhiễm trùng đường tiết niệu
6. Sản phẩm khử amin oxy hóa của một acid amin gồm: 1. Amin 2. Acid cetonic 3. NH3
4. Acid carboxylic 5. Aldehyd
Chọn tập hợp đúng: A: 1, 2; B: 2, 3; C: 3, 4; D: 4, 5.
7. NH3 được vận chuyển trong cơ thể chủ yếu dưới dạng:
A. Kết hợp với acid glutamic tạo glutamin
B. Kết hợp với acid aspartic tạo asparagin C. Muối amonium
D. Kết hợp với CO2 tạo Carbamyl phosphat
8. Glutamin tới gan được:
A. Phân hủy ra NH3 và tổng hợp thành urê
B. Kết hợp với urê tạo hợp chất không độc
C. Chuyển vào đường tiêu hóa theo mật
D. Phân hủy thành carbamyl phosphat, tổng hợp ure 9. Glutamin tới thận:
A. Phân hủy thành NH3, đào thải qua nước tiểu dưới dạng NH + 4 B. Phân hủy thành urê
C. Phân hủy thành carbamyl phosphat
D. Phân hủy thành NH3, tổng hợp urê và đào thải ra ngoài theo nước tiểu 10. Histamin:
1. Là sản phẩm khử carboxyl của Histidin
2. Là sản phẩm trao đổi amin của Histidin
3. Có tác dụng tăng tính thấm màng tế bào, kích ứng gây mẫn ngứa
4. Là sản phẩm khử amin oxy hóa của Histidin
5. Là một amin có gốc R đóng vòng Chọn tập hợp đúng:
A. 1, 2, 3; B: 1, 2, 4; C: 1, 2, 5; D: 1, 3, 5; 90
Chương 8. HÓA SINH HỆ THỐNG GAN MẬT Mục tiêu
1. Trình bày đúng thành phần hóa học của gan, mật.
2. Trình bày đầy đủ các chức năng hóa sinh của gan, mật.
3. Nắm được một số xét nghiệm sinh hóa thăm dò chức năng gan, mật. 1. ĐẠI CƯƠNG
Gan là một trong những cơ quan quan trọng nhất của cơ thể về chức năng chuyển
hóa, là cơ quan nặng thứ hai sau hệ xương (~ 2 kg). Các hoạt động chuyển hóa của gan
xảy ra ở các tế bào nhu mô, chiếm 80% khối lượng gan. Gan gồm các tế bào Kupffer,
chứa hệ thống lưới nội nguyên sinh chất.
Do đảm nhận nhiều chức năng chuyển hóa, là cửa ngõ của các chất vào cơ thể qua
bộ máy tiêu hóa, nên gan là cơ quan dễ bị nhiễm bệnh. Tỷ lệ bệnh gan mật thường cao
hơn bệnh lý của các cơ quan khác và các xét nghiệm hóa sinh là rất quan trọng, giúp cho
việc chẩn đoán, theo dõi điều trị các bệnh lý của hệ thống này.
2. THÀNH PHẦN HÓA HỌC
Protid: Chiếm ½ khối lượng gan khô (15% khối lượng gan tươi). Gồm: albumin,
globulin, một ít nucleoprotein, collagen, feritin (dự trữ sắt), acid amin tự do: methionin,
tryptophan, arginin, glycin, histidin, acid glutamic.
Glucid: Chủ yếu là glycogen (2–10% trọng lượng khô). Người trưởng thành
glycogen chứa trong gan có thể tới 150 – 200g.
Lipid: Gan chiếm một lượng lipid khá lớn (chiếm khoảng 5% trọng lượng khô
của gan). Trong đó: 40% là mỡ trung tính, 50% là phosphatid, 10% là cholesterol.
Enzym: Gan là cơ quan quan trọng trong chuyển hóa, tập trung nhiều enzym
như: lipase, transaminase, phosphorylase, phosphatase, glutaminase, decarboxylase, hệ
thống enzym xúc tác tổng hợp urê, phân ly glycogen và một số enzym khác.
Vitamin: Có nhiều caroten (tiền vit A); các vitamin D3, nhóm B (B1, B6, B12), C,
K. Ngoài ra, còn có nhiều ion kim loại như: Fe3+, Na+, K+, Mg2+,...
3. CHỨC NĂNG SINH HÓA CỦA GAN
3.1. Chức năng tạo mật
3.1.1. Thành phần hóa học của mật Gồm: sắc tố mật, muối mật, cholesterol.
Muối mật được tạo thành do sự kết hợp của glycin/taurin với các acid mật, là sản
phẩm thoái hóa cuối cùng của cholesterol ở gan. Sắc tố mật là sản phẩm thoái hóa của
hemoglobin, chủ yếu là bilirubin liên hợp và biliverdin. 91
3.1.2. Quá trình bài xuất mật -
Mật được tạo ra ở tế bào gan, dự trữ ở túi mật, được tiết xuống tá tràng để tham
gia vào quá trình tiêu hóa. -
Mật có màu vàng (bilirubin). Trong túi mật, mật có màu sẫm hơn từ màu xanh lá
cây đến màu nâu nhạt (do bilirubin bị oxi hóa thành biliverdin và bị cô đặc). -
Ở tá tràng mật không bị biến đổi về hóa học, phần lớn được tái hấp thu qua hệ
tĩnh mạch cửa về gan, một phần nhỏ theo phân ra ngoài. Lượng mật bài xuất hằng ngày
tùy thuộc vào tính chất và khối lượng thức ăn, trung bình gan bài tiết 1 lít mật/ngày.
Tác dụng của mật Muối mật có tác dụng: -
Nhũ tương hóa lipid tăng diện tích tiếp xúc với lipase. Những hạt nhũ tương
nhỏ (đường kính < 0,5 micron) có thể được hấp thu trực tiếp ở ruột. Vì vậy, tiêu hóa và
hấp thu lipid phụ thuộc vào lượng muối mật có trong mật. -
Hoạt hóa lipase giúp cho lipid được tiêu hóa và hấp thu dễ dàng cùng với các vitamin tan trong dầu.
Khi bài xuất xuống ruột, mật làm tăng nhu động ruột. Mật kéo theo rất nhiều chất
độc được gan giữ lại và đào thải theo phân.
Nếu tổn thương gan và đường dẫn mật sẽ ảnh hưởng đến quá trình tạo mật và bài
xuất mật, ảnh hưởng đến tiêu hóa - hấp thu lipid và các vitamin tan trong dầu, ảnh hưởng
đến việc đào thải một số chất độc qua đường mật.
Dùng xét nghiệm định lượng bilirubin trong huyết thanh, tìm sắc tố mật, muối mật
trong nước tiểu để chẩn đoán vàng da.
3.2. Chức năng chuyển hóa glucid
3.2.1. Tổng hợp glycogen
Glycogen là dạng dự trữ glucid cho cơ thể. Gan tổng hợp glycogen từ:
- Glucose, các ose khác (galactose, fructose, manose) nhờ hệ enzym chỉ có ở gan.
- Từ các sản phẩm chuyển hóa trung gian như: acid pyruvic, acetyl CoA, lactat.
3.2.2 Phân ly glycogen: tạo glucose cung cấp cho các mô.
- Thủy phân: thủy phân với sự tham gia của enzym amylase, maltase. Quá trình
thủy phân xảy ra ở gan ít, chủ yếu là quá trình khử phosphoryl.
- Phân ly: Với sự tham gia của phosphorylase là enzym xúc tác phản ứng sau:
Glycogen Glucose-1-phosphat Glucose-6-phosphat Glucose-6-phosphat G6 phosph a tase Glucose + H3PO4 (Sơ đồ)
Enzym glucose-6-phosphatase chỉ có ở gan, nên quá trình phân ly từ glycogen
thành glucose chỉ xảy ra ở gan. 92
3.2.3 Gan tham gia điều hòa đường huyết
- Chức năng phân ly glycogen cùng với các yếu tố khác như: thần kinh thể dịch,
hormon (insulin, adrenalin) tham gia vào quá trình điều hòa đường huyết.
- Bình thường glucose trong máu 90 - 130 mg/dl.
- Glucose máu < 90 mg/dL Gan tăng cường thoái hóa glycogen để tạo glucose,
đưa glucose vào máu và giảm tổng hợp glycogen.
- Glucose máu > 130 mg/dL Gan tăng tổng hợp glycogen dự trữ cho cơ thể.
- Trên lâm sàng dùng nghiệm pháp dung nạp glucose nhằm thăm dò chức năng
chuyển hóa glucid: cho bệnh nhân uống liều glucose 75 g/250ml trong vòng 5 phút và
lấy máu để định lượng glucose sau 2 giờ uống.
Bình thường glucose tăng ngay sau uống ½ giờ (từ 100mg% - 150mg%).
Giảm dần, sau 3 giờ bình thường.
Gan suy: Khả năng chuyển glucose mới hấp thu thành đường dự trữ kém.
Glucose máu tăng 200mg/l sau 1 giờ.
Rồi từ từ hạ về mức cũ sau 3 giờ.
3.3. Chức năng chuyển hóa lipid
Gan là cơ quan duy nhất sản xuất mật: để nhũ tương hóa lipid giúp tiêu hóa
và hấp thu lipid dễ dàng.
Thoái hóa lipid: xảy ra mạnh mẽ ở gan tạo acetyl CoA.
- Một phần nhỏ acetyl CoA đốt cháy trong chu trình acid citric tạo CO2, H2O và ATP cho gan sử dụng.
- Một phần acetyl CoA làm nguyên liệu tổng hợp cholesterol để tổng hợp acid mật và các hormon steroid.
- Phần lớn được tổng hợp thành các chất cetonic vận chuyển đến các mô.
Quá trình tổng hợp lipid
- Gan tổng hợp lipid cho gan.
- Gan tổng hợp các lipoprotein cho máu và các acid béo tự do cho máu.
- Gan tổng hợp phospholipid, có vai trò quan trọng trong sự vận chuyển mỡ ra
khỏi gan tránh ứ đọng mỡ trong gan. nếu chức năng gan giảm sẽ dẫn đến giảm lipid
huyết thanh và ứ đọng mỡ ở gan.
𝐶ℎ𝑜𝑙𝑒𝑠𝑡𝑒𝑟𝑜𝑙 𝑒𝑠𝑡𝑒 ℎó𝑎 Bình thường tỷ lệ: = 0,65
𝐶ℎ𝑜𝑙𝑒𝑠𝑡𝑒𝑟𝑜𝑙 𝑡𝑜à𝑛 𝑝ℎầ𝑛
Khi nhu mô gan tổn thương tỷ lệ này giảm: 0,5. 93
3.4. Chức năng chuyển hóa protid
Trong gan có nhiều enzym transaminase (GOT/AST, GPT/ALT): tham gia
quá trình trao đổi và khử amin.
Tổng hợp: urê từ NH3, albumin của huyết tương, một phần globulin, fibrinogen,
prothrombin, ferritin, heparin.
Trong tổn thương gan (viêm gan, xơ gan):
- Khi tế bào gan bị tổn thương GOT, GPT tăng.
- Lượng albumin giảm, tỷ lệ A/G giảm. - 𝛽, 𝛾 globulin tăng
Xét nghiệm sinh hóa
Điện di protein, định lượng protein, globulin, albumin, phản ứng Gros, Maclagan.
Định lượng enzym AST, ALT.
3.5. Chức năng khử độc của gan
3.5.1. Cố định và thải trừ
Một số kim loại như muối đồng, chì, thủy ngân, chất màu (dẫn chất của phthalein)
vào cơ thể bị gan giữ lại rồi thải trừ qua mật, những chất này giữ nguyên trạng thái cũ.
Dùng nghiệm pháp chất màu BSP (Bromosulpgophtalein) để thăm dò chức năng gan:
tiêm 5mg BSP/1 kg thể trọng, 30 phút sau lấy máu định lượng.
Gan bình thường: 30 phút sau BSP mất hết trong máu.
Gan suy: nồng độ chất màu trong máu cao vì gan giữ được ít chất màu.
3.5.2. Khử độc hóa học
Đây là quá trình khử độc quan trọng nhất. Chất độc bị gan giữ lại chịu sự biến đổi
hóa học thành chất không độc dễ tan và được đào thải nhanh ra ngoài.
Ví dụ: Quá trình tạo urê từ NH3
H2O2 là chất độc được sinh ra trong một số phản ứng hóa học sẽ được phân hủy bởi
enzym catalase hoạt động rất mạnh ở gan. H2O2 H2O + ½ O2
Các loại khử độc hóa học:
- Khử độc bằng cách oxi hóa (rượu etylic bị oxi hóa dưới tác dụng của alcol
dehydrogenase thành aldehyd acetic rồi thành acid acetic). - Khử oxi.
- Khử độc bằng cách metyl hóa.
- Khử độc bằng cách liên hợp (bilirubin tự do là một chất độc liên hợp với acid
glucuronic tạo bilirubin liên hợp không độc). 94
4. NHỮNG XÉT NGHIỆM SINH HÓA HỆ THỐNG GAN MẬT
Có rất nhiều xét nghiệm hóa sinh về gan. Việc chọn lựa các xét nghiệm hóa sinh
trong bệnh lý hệ thống gan mật tùy thuộc vào bản chất và giai đoạn tiến triển của bệnh.
Các xét nghiệm về hệ thống gan mật rất đa dạng, không một xét nghiệm nào thăm dò
hoàn chỉnh. Do vậy, cần phối hợp các xét nghiệm.
4.1. Hội chứng suy giảm chức năng gan
Bảng 8.1. Các xét nghiệm và các kết quả Các xét nghiệm
Giá trị bình thường Kết quả Albumin huyết thanh 35 – 45 g/l Giảm Lipid máu 4 – 7 g/l Tăng Cholesterol T.P huyết thanh 1,5 – 2,2 g/l Tăng Fibrinogen huyết tương 2,5 – 4 g/l Giảm
Bilirubin toàn phần trong huyết thanh 2 – 8 g/l Bình thường
Các nghiệm pháp kết hợp
- Nghiệm pháp tăng đường huyết: thời gian cố định glucose của gan kéo dài. - Nghiệm pháp BSP (+).
Hiện nay, các xét nghiệm thường làm về enzym để đánh giá chức năng gan là:
(1) GPT (Glutamat pyruvat transaminase): Đánh giá tình trạng tổn thương tế bào nhu mô gan.
(2) GGT (Gamma glutamyl transferase): GGT là enzym màng tế bào, có nhiều ở
thận, tụy, gan, lách, ruột non. Hoạt độ GGT ở tế bào ống thận lớn gấp 12 lần ở tụy, 25
lần ở gan, và có ở huyết tương.
Có giá trị đánh giá tình trạng ứ mật ở gan. Hiện nay, nhiều nghiên cứu đã chứng
minh GGT cùng với GOT, GPT còn có tác dụng chẩn đoán sớm, theo dõi điều trị bệnh
gan-mật, đánh giá mức độ tổn thương tế bào nhu mô gan.
(3) GOT: đánh giá mức độ tổn thương ở ty thể tế bào nhu mô gan. Tăng cao trong
viêm gan mạn tiến triển, nhiễm độc hóa chất.
(4) GLDH (Glutamat dehydrogenase): là enzym hoạt động mạnh khu trú ở ty thể của
tế bào nhu mô gan., xúc tác phản ứng khử amin-oxy hóa trực tiếp của acid glutamic tạo NH3 và α-cetoglutarat.
GLDH đánh giá mức độ tổn thương nặng, hủy hoại lớn tế bào nhu mô gan.
(5) ALP (Alkaline phosphatase): đánh giá mức độ ứ mật ở gan. Trong ứ mật, ALP
tăng cao hơn so với bình thường. Bình thường: Hoạt độ ALP < 280 U/l (37OC) 95
(6) Một số xét nghiệm khác như:
- Bilirubin TP, trực tiếp huyết tương.
- 10 chỉ tiêu nước tiểu.
- Định lượng amoniac, fibrinogen.
- Định lượng HBsAg , anti HBV, anti HCV…
4.2. Hội chứng tổn thương tế bào gan Các xét nghiệm
Giá trị bình thường Kết quả
- Hoạt độ các transaminase huyết thanh Nam < 50 u/l Cao Nữ < 35 u/l
- Hoạt độ 𝛾 glutamyltransferase (GGT) huyết Nam < 40 u/l Cao thanh Nữ < 35 u/l
- Glutamat dehydrogenase (GLDH) huyết Nam < 40 u/l Cao thanh Nữ < 35 u/l
- Bilirubin toàn phần trong huyết thanh < 1mg/dl Có thể tăng
- Sắc tố mật, muối mật, nước tiểu Không có Có thể (+)
4.3. Hội chứng tắc mật
Mật có thể bị tắt do sỏi mật, các u chèn vào đường dẫn mật hoặc viêm gan có
phù nề làm tắt các ống vi mật. Khi tắt mật, mật sẽ không xuống được ruột hoặc xuống
ít sẽ ứ lại và tràn vào máu. Các xét nghiệm
Giá trị bình thường Kết quả - Bilirubin huyết thanh < 1 mg/dl
Tăng chủ yếu bilirubin LH
- Hoạt độ phosphatase kiềm huyết thanh (ALP: Alkalin 30 – 90 u/l Tăng phosphatase).
- Cholesterol TP trong huyết 1,5 – 2,2 g/l Tăng thanh. Không có (+)
- Sắc tố mật, muối mật, NT. 96
Tóm lại: Gan là cơ quan quan trọng của cơ thể, thể hiện qua các chức năng:
a). Với chức năng chuyển hóa các chất vai trò của gan thể hiện:
- Cơ quan duy nhất tham gia điều hòa đường huyết. - Sinh tổng hợp:
Toàn bộ albumin huyết thanh.
Một phần globulin và nhiều protein cho máu.
Tổng hợp urê, chuyển hóa acid amin mạnh.
Tổng hợp muối mật, nhũ tương hóa lipid.
b). Với chức năng khử độc
Gan là cơ quan chính biến đổi các chất độc nội sinh, ngoại sinh thành các chất
không độc, đào thải ra ngoài.
c). Các xét nghiệm hóa sinh hệ thông gan mật
Rất đa dạng, phong phú. Chúng có vai trò rất lớn trong quá trình chẩn đoán điều
trị và tiên lượng bệnh. CÂU HỎI LƯỢNG GIÁ
1. Liên quan chức năng tạo mật của gan:
A. Sắc tố mật giúp cho lipid thức ăn được nhũ tương hoá
B. Muối mật là do sắc tố mật kết hợp với glycin và taurin
C. Sắc tố mật chính là Bilirubin tự do
D. Tất cả các câu đều đúng
2. Chuyển hoá glucid ở gan:
A. Nghiệm pháp hạ đường huyết được dùng để đánh giá chức năng điều hoà đường huyết của gan
B. Nghiệm pháp galactose được thực hiện để thăm dò chức năng gan
C. Galactose niệu thấp chứng tỏ gan suy D. Câu A, B, C đúng
3. Liên quan chức năng điều hoà đường huyết:
A. Gan tham gia điều hoà đường huyết bằng cách tổng hợp và phân ly Glycogen
B. Khi nồng độ Glucose 0,7 g/l gan sẽ tổng hợp glycogen
C. Khi nồng độ Glucose 1, 2 g/l gan sẽ giảm tổng hợp Glucose thành Glycogen dự trữ D. Câu A, B đúng 97
4. Chuyển hoá lipid ở gan:
A. Gan tổng hợp cholesterol từ acetyl CoA
B. Gan tổng hợp cholesterol vận chuyển mở ra khỏi gan
C. Giảm khả năng tổng hợp phospholipid dẫn đến giảm ứ đọng mỡ ở gan
D. Tất cả các câu đều đúng
5. Liên quan chức năng khử độc của gan:
A. Cố định và thải trừ là cơ chế khử độc thường xuyên của cơ thể
B. Khử độc bằng oxy hoá đã biến alcol etylic thành acid acetic
C. Nghiệm pháp BSP với BSP tăng trong máu chứng tỏ gan suy D. Câu B, C đúng
6. Những enzyme sau đây giúp đánh giá tình trạng ứ mật:
A. Phosphatase kiềm, LDH, GT
B. Phosphatase kiềm, GOT, GPT
C. Phosphatase kiềm, GT, 5’ nucleotidase, LAP
D. Tất cả các câu đều sai
7. Đánh giá tình trạng hoại tử tế bào gan dựa vào các enzym sau: A. Phosphatase kiềm B. GOT, GPT, GT C. GOT, GPT, OCT, LDH
D. Tất cả các câu đều đúng
8. Liên quan thử nghiệm gan mật:
A. Khi định lượng transaminase: GPT tăng là biểu hiện bệnh gan do rượu
B. GPT tăng cao so với GOT gặp trong các trường hợp viêm gan cấp
C. GOT, GPT là chất chỉ điểm ung thư D. Câu B, C đúng
9. Đặc điểm thành phần hoá học của gan:
A. Tỉ lệ % nước bằng tỉ lệ % chất khô
B. Cholesterol là thành phần chủ yếu của lipid trong gan
C. Gan chứa một hệ thống enzyme hoàn chỉnh
D. Tất cả các câu đều sai
10. Gan có các chức năng sau : A. Chức năng khử độc.
B. Chức năng bài tiết mật. 98
C. Chức năng chuyển hoá glucid, lipid, protid.
D. Tất cả các câu trên đều đúng.
11. Chất nào sau là muối mật :
A. Glycin. B. Taurin. C. Taurocholic. D. Cholesterol. 12. Sắc tố mật là : A. Bilirubin tự do. B. Urobilinogen. C. Stercobilinogen D. Bilirubin liên hợp 13. Muối mật :
A. Làm giảm sức căng bề mặt nước tiểu.
B. Làm tăng sức căng bề mặt nước tiểu. C. Là cholesterol este hoá.
D. Là sản phẩm thoái hoá của bilirubin.
14 .Định lượng enzyme SGOT , enzyme SGPT trong huyết thanh :
A. Tăng cao trong trường hợp viêm gan cấp tính.
B. Enzyme SGOT tăng cao trong nhồi máu cơ tim.
C. Enzyme SGPT tăng cao trong viê viêm gan mạn tính.
D. Cả ba câu A, B, C đều đúng 99
Chương 9: HÓA SINH THẬN VÀ NƯỚC TIỂU Mục tiêu
1. Trình bày được chức năng của thận.
2. Trình bày được tính chất chung của nước tiểu.
3. Trình bày được các chất bất thường có trong nước tiểu. 1. ĐẠI CƯƠNG
Hai thận ở người trưởng thành nặng khoảng 300g (0,5% khối lượng cơ thể). Tuy
khối lượng không lớn nhưng hoạt động của thận rất mạnh. Thận sử dụng 8-10% oxy của
cơ thể. Hàng ngày khoảng 1000-1500 lít máu qua thận, 10% làm nhiệm vụ cung cấp
chất dinh dưỡng cho thận, 90% làm nhiệm vụ bài tiết. Thận có các chức năng:
- Bài tiết các chất cặn bã có hại hoặc không cần thiết của quá trình chuyển hóa ra
ngoài cơ thể, bằng cơ chế lọc và tái hấp thu.
- Tham gia điều hòa thăng bằng acid – base nhờ cơ chế bài tiết ion hydro và giữ
base dưới dạng muối natri.
- Tham gia chuyển hóa các chất. - Chức năng nội tiết.
Đơn vị chức năng của thận là nephron, mỗi thận có khoảng 1-1,5 triệu nephron. Mỗi nephron gồm:
- Cầu thận: gồm một bó bao mao động mạch hình cầu (quản cầu thận) được bọc
bằng hai túi màng (bọc Bowman).
- Ống thận: gồm ống lượn gần nói với bọc Bowman, quai Henlé và ống lượn xa.
Ống lượn xa nối với ống góp và cuối cùng là bể thận.
2. CHỨC NĂNG CỦA THẬN 2.1.
Chức năng bài tiết
Các chức năng chính của thận gồm sự lọc, tái hấp thu và bài tiết. Thận kết hợp
những chức năng này để duy trì và điều hòa cân bằng nội mô. Sự hình thành nước tiểu
là tổng hợp các quá trình: siêu lọc ở cầu thận; tái hấp thu và bài tiết xảy ra ở ống thận.
2.1.1. Quá trình siêu lọc
Siêu lọc là giai đoạn đầu của quá trình tạo thành nước tiểu, hàng ngày có khoảng
180 lít nước tiểu ban đầu được hình thành. Màng cầu thận cho nước và các chất trong
máu qua lại một cách dễ dàng. Nước và các phân tử nhỏ qua lại màng cầu thận như một
sàng phân tử. Các phần tử lớn như protein có các phân tử lớn hơn 70.000 Da (Dalton)
không qua được. Vì vây, nước tiểu ban đẩu có thành phần giống như huyết tương trừ protein. 100
Sự lọc của màng cầu thận đối với các chất khác nhau tùy thuộc vào: kích thước của
phân tử được lọc, sự tích điện của phân tử protein, hình dáng của phân tử được lọc và
tùy thuộc vào trình trạng huyết động cục bộ hay lưu lượng máu.
2.1.2. Quá trình tái hấp thu
Quá trình tái hấp thu là quá trình xảy ra liên tục ở ống thận. Các chất được tái hấp
thụ ở ống thận với mức độ khác nhau: tái hấp thu hoàn toàn, tái hấp thu phần lớn, tái
hấp thu một phần và không được tái hấp thu. Mặt khác, ống thận cũng sản xuất ra một
số chất được đào thải ra ngoài.
a) Tái hấp thu hoàn toàn
Những chất có ngưỡng tái hấp thu cao như glucose hầu hết được tái hấp thụ hoàn
toàn chủ yếu ở ống thận. Trong điều kiện bình thường glucose được lọc qua cầu thận
với tốc độ 150 g/24 giờ và hầu như được tái hấp thu hoàn toàn nên trong nước tiểu chỉ
có 6 mg/24 giờ. Nồng độ glucose 1,75 g/l gọi là ngưỡng tái hấp thu của thận.
Ở người bình thường, khi nồng độ glucose trong máu lớn hơn 1,75g/l đều có đường
niệu là do thận tái hấp thu không hoàn toàn. Tuy nhiên, cũng có một số trường hợp
ngưỡng tái hấp thu glucose thấp hơn 1,75g/l thì đường niệu xuất hiện ở mức đường huyết thấp hơn.
Sự tái hấp thụ glucose kèm theo sự tái hấp thu natri ở tế bào ống thận.
b) Tái hấp thu hầu hết
Rất nhiều chất được tái hấp thu hầu hết để đảm bảo sự cân bằng nội môi.
- Nước được tái hấp thu khoảng 99% chủ yếu ở ống lượn gần, sự tái hấp thu nước
thường đi kèm với sự tái hấp thu natri và clo. -
Kali được tái hấp thu khoảng 98%. -
Phosphat được tái hấp thu khoảng 95%. -
Bicarbonat được tái hấp thu trên 90% chủ yếu ở ống lượn gần. -
Các acid amin cũng được tái hấp thu gần hết.
c) Tái hấp thu phần lớn
Natri, clor và nhiều muối khác được tái hấp thu phần lớn ở ống lượn gần. Sự tái
hấp thu Na+ liên quan đến tái hấp thu nước và nhiều chất tan khác.
Thận tái hấp thu phần lớn những protein đã được lọc qua cầu thận. Khoảng 99 %
albumin lọc qua cầu thận được tái hấp thu ở ống lượn gần. Nhờ quá trình tái hấp thu ở
ống thận mà hầu hết các protein lọc qua cầu thận đều được tái hấp thu.
Nước tiểu ở người khỏe mạnh lượng protein rất ít. Các xét nghiệm thông thường
không phát hiện được và thường coi nước tiểu người khỏe mạnh không có protein.
d) Tái hấp thu một phần
Các chất như urê, urat, vitamin C ... được tái hấp thu khoảng 50 % tại ống thận. 101
e) Không tái hấp thu
Các chất được lọc qua cầu thận nhưng không được tái hấp thu ở ống thận là inilin,
mannitol và natri hyposulfid. Do đó, thường đo độ thanh thải của các chất này để khảo
sát chức năng lọc của cầu thận.
2.1.3. Quá trình bài tiết
Chức năng bài tiết của thận nhằm loại bỏ các sản phầm chuyển hóa cuối cùng và
các chất vô cơ dư thừa trong chế độ ăn ra khỏi cơ thể, là quá trình các chất từ huyết
tương được tế bào ống thận đào thải vào nước tiểu.
Các sản phẩm dư thừa được bài tiết gồm: hợp chất urê có nitơ không phari là
protein, một số acid hữu cơ (gồm cả acid amin) được bài tiết với số lượng nhỏ. Các chất
như kali, acid uric, creatinin, H+, NH +
4 , … cũng được bài tiết vào ống thận khi nồng độ trong máu cao.
Ngoài ra, các chất được đưa vào cơ thể để điều trị hay chẩn đoán như P.S.P (phenyl
sulfo phtalein), acid para amino hippuric (P.A.H), penicillin … cũng được bài tiết ở ống thận.
Qua các chức năng trên của thận, có thể thấy rằng nước tiểu cô đặc được hình thành
thông qua các quá trình siêu lọc, tái hấp thu và bài tiết. Đây cũng chính là cơ chế đào
thải có chọn lọc của thận.
2.2. Chức năng chuyển hóa
Thận tham gia chuyển hóa các chất chủ yếu là quá trình thoái hóa glucid, lipid để
cung cấp năng lượng cho thận hoạt động.
- Chuyển hóa glucid chiếm ưu thế, chu trình pentose xảy ra không mạnh mẽ chủ
yếu là con đường đường phân.
- Chuyển hóa lipid các lecithin được khử phosphat nhờ glycerophosphatase. Các
chất cetonic đượcthoái hóa hoàn toàn.
- Chuyển hóa protid. Thận có nhiều hệ thống emzym khử amin tạo ra các acid cetonic, giải phóng NH +
3 dưới dạng NH4 ở thận.
2.3. Chức năng điều hòa cân bằng acid - base
Thận đóng vai trò chính trong việc duy trì thăng bằng acid – base thông qua việc
tái tại bicarbonat và bài tiết NH + 4 , H+.
Máu động mạch có pH hằng định khoảng 7.38 - 7.42. Sự hằng định này bị thay đổi
bởi sản sinh hàng ngày khoảng 1 mEq/kg ion H+. Thận là cơ quan duy nhất bày tiết sự
thừa acid, do đó pH của nước tiểu bao giờ cũng thấp hơn so với pH máu. Tuy nhiên, khả
năng điều hòa của thận bắt đầu có hiệu lực sau vài giờ, không nhanh bằng các hệ đệm
trong máu. Có ba cơ chế chính để điều hòa thăng bằng acid - base nhằm duy trì lượng
bicarbonate có trong khu vực ngoài tế bào.
- Sự tái hấp thu bicarbonat: Gần 90% bicarbonat được tái hấp thu ở ống lượng
gần. Trong tế bào ống thận CO2 và H2O được tạo thành trong quá trình chuyển hóa, dưới 102
tác dụng của carbonic anhydrase chuyển thành H2CO3, H2CO3 là một acid yếu phân ly thành H+ và HCO - -
3 . Ion H+ được tiết ra ngoài ống thận, HCO3 cùng với Na+ được hấp thu trở lại máu.
- Sự tái tạo lại ion bicarbonat bằng cách đào thải ion H+: Ở ống lượn xa ion H+
cũng được đào thải thế chỗ cho Na+ được tái hấp thu cùng với HCO -3. Các muối
phosphate di-natri trở thành muối phosphat mononatri trong nước tiểu, pH giảm.
- Sự tái tạo lại ion bicarbonat bằng cách bài xuất NH +
4 : tế bào ống thận bài tiết
ion H+ dưới dạng muối amoni xảy ra ở ống lượn xa. Ở tế bào ống thận amoniac được
tạo ra chủ yếu do thủy phân glutamin dưới tác dụng của glutaminase. Amoniac khuếch
tán thụ động ra nước tiểu, cùng với H+ đào thải dưới dạng NH + 4 .
- Đào thải các acid không bay hơi như acid lactic, thể cetonic, acid sulfuric (sản
phẩm chuyển hóa của protid), acid phosphoric (sản phẩm chuyển hóa các phospholipid).
Các acid này kết hợp với các cation mà chủ yếu là Na+. Các cation này sẽ tái hấp thu ở
tế bào ống thận thế chỗ cho H+ đào thải ra ngoài.
2.4. Chức năng nội tiết của thận
2.4.1. Hệ thống Renin – angiotensin – aldosterone
Hệ thống bên cạnh cầu thận tổng hợp bài tiết ra một emzym thủy phân protein là
renin. Renin có phân tử lượng 40.000 Da. Renin được đổ vào tĩnh mạch thận. Trong
máu, renin có tác dụng đặc hiệu trên protein là angiotensinogen được tổng hợp từ gan.
Cơ chế tác dụng của renin: renin thủy phân chặt liên kết petid giữa acid amin 10
và 11 giải phóng angiotensin I không có tác dụng sinh học. Một enzym khác trong máu
(enzym chuyển) cắt hai acid amin ở đầu C tận của angiotensin I tạo thành angiotensin
II có tác dụng sinh học rất mạnh. Angiotensin II có tác dụng: co mạch, tăng huyết áp, co
cơ trơn, tăng bài tiết aldosterone của vỏ thượng thận.
2.4.2. Sự bài tiết yếu tố tạo hồng cầu
Lượng hemoglobin lưu thông phụ thuộc chủ yếu vào sự cung cấp oxy ở tế bào, sự
thiếu oxy ở tổ chức kích thích tạo hồng cầu. Năm 1950, xác định được mối liên quan
trực tiếp giữa tình trạng thiếu oxy và nồng độ một hormon mới trong huyết tương, chất
tạo hồng cầu (erythropoietin – Ep) 2.4.3. Prostaglandin
Ba dạng prostaglandin được tìm thấy ở thận là PGE2, PGI2, TXA2, PGE2, PGI2 có
tác dụng giống như angiotensin II, làm đào thải natri và lợi tiểu nhẹ. PGE2 còn có tác
dụng lên sự tổng hợp REF thông qua hoạt hóa adenylat cyclase (AC) để tạo AMPv.
TXA2 là yếu tố co mạch. 2.4.4. Vitamin D
Vitamin D3, (cholecalciferol) là tiền hormon phụ thuộc vào tia tử ngoại, được tạo
thành ở da đến huyết tương nhờ sự vận chuyển của D3-binding protein, được oxy hóa
thành 25-OH-D3 ở gan và 1, 25-(OH)2-D3 hay calcitriol ở thận. Calcitriol có tác dụng
tăng cường hấp thu calci ở ruột và tái hấp thu calci ở thận. 103
3. TÍNH CHẤT CHUNG CỦA NƯỚC TIỂU
3.1. Thể tích nước tiểu
Thể tích nước tiểu trung bình của người lớn trong 24 h là khoảng 1000 - 1400 ml,
tương đương với thể tích từ 18 - 20 ml/kg trọng lượng cơ thể. Thể tích nước tiểu thay
đổi theo điều kiện sinh lý và bệnh lý.
3.2. Màu sắc nước tiểu
Nước tiểu bình thường có màu từ vàng nhạc tới màu hổ phách tùy vào lượng nước
tiểu bài xuất và đậm độ nước tiểu.
3.3. Độ trong suốt
Nước tiểu bình thường, lấy trong điều kiện đúng quy cách, thường trong suốt. Nước
tiểu sau một thời gian ngắn để lắng sẽ tạo thành một đám mây vẩn đục lơ lửng ở giữa
hay ở ống đựng nước tiểu tùy thuộc vào tỷ trọng của nước tiểu. Những vẩn đục trên là
những tế bào bình thường của nội mô đường tiết niệu và các chất nhày urosomucoid.
Nước tiểu bình thường để trong lọ để chỗ mát hay lạnh vẫn có thể có tủa lắng xuống, đó
có thể là cặn acid uric, muối urat natri hoặc phosphate. 3.4. Độ sánh
Nước tiểu bình thường có độ sánh cao hơn nước một chút. Trong một số trường
hợp bệnh lý, tính chất của nước tiểu thay đổi do sự có mặt của một số chất như mủ máu,
protein, mucoprotein, dưỡng chất v.v… sánh hơn và có nhiều bọt. 3.5. Mùi
Nước tiểu bình thường có mùi đặc biệt. Để ngoài không khí có mùi khai do sự biến
đổi urê thành ammoniac. Trong một số trường hợp bệnh lý nước tiểu có mùi aceton, mùi
hôi (sốt cao, ung thư thận, ung thư bang quang).
3.6. Sức căng bề mặt
Nước tiểu bình thường có sức căng bề mặt 64- 69 dynes/cm2 (thấp hơn nước nước,
72). Một số thuốc có acol, ether, chloroform làm giảm sức căng bề mặt nước tiểu. Trong
trường hợp bệnh lý như viêm gan tắc mật trong nước tiểu có muối mật thì thì sức căng
bề mặt của nước tiểu giảm. 3.7. Tỷ trọng
Tỷ trọng nước tiểu thay đổi trong ngày. Nước tiểu 24h ở người lớn bình thường,
chế độ ăn hỗn hợp, do điều kiện nhiệt độ 15oC, có tỷ trọng trung bình khoảng là 1,018
± 0,22. Trong một số trường hợp bệnh lý, đái tháo đường do tụy, tỷ trọng nước tiểu có
khi tới 1,030 – 1,040. Trong trường hợp đái nhạt tỷ trọng nước tiểu lại thấp.
3.8. pH của nước tiểu
Nước tiểu 24h ở người bình thường có pH hơi acid, khoảng 5-6 ttrung bình khoảng
5,8. Độ acid của nước tiểu là do sự có mặt trong nước tiểu của những acid tự do. pH
nước tiểu thay đổi theo chế độ ăn. Trong trường hợp bệnh lý như: viêm bể thận, viêm
bàng quang, pH nước tiểu thường rất kiềm do phản ứng lên men ammoniac; bệnh đái
tháo đường nặng thể cetonic niệu, pH nước tiểu acid. 104
4. THÀNH PHẦN HÓA HỌC CỦA NƯỚC TIỂU
4.1. Các chất vô cơ
Clo: sự bài xuất clo phụ thuộc vào chế độ ăn. Trong một số bệnh lý như viêm thận,
bệnh nhiễm trùng như viêm phổi thì clo trong nước tiểu giảm.
Phosphat: phần lớn phosphat trong nước tiểu là phosphat mono kim loại. Phosphat
nước tiểu có hai nguồn gốc: thức ăn và do dự thoái hóa các hợp chất có photsphat tăng
trong một số bệnh về xương, ưu năng tuyến cận giáp và giảm trong thiểu năng tuyến cận giáp.
4.2. Các chất hữu cơ
Urê: Urê là thành phần có nhiều nhất trong nước tiểu. Sự bài xuất urê phụ thuộc
vào chế độ ăn, tỷ lệ thuận với chế độ ăn giàu đạm. Sự bài xuất urê tăng trong các trường
hợp sốt cao, đái tháo đường, ưu năng tuyến thượng thận, nhiễm độc v.v… Sự bài xuất
urê giảm trong viêm thận cấp, viêm thận do nhiễm độc chì, thủy ngân.
Creatinin: bài xuất creatin trung bình ở người trưởng thành nam giới khoảng 20-
25mg/kg thân trọng, nữ giới là 15-20mg/kg thể trọng. Lượng creatinin trong nước tiểu
tăng trong các trường hợp bệnh teo cơ kèm thoái hóa cơ, ưu năng tuyến cận giáp.
Acid uric: Lượng acid uric bài xuất trong nước tiểu thay đổi theo chế độ ăn, tăng
ở chế độ ăn có nhiều đạm, trường hợp bệnh lý về thận như viêm thận, bệnh lý về chuyển
hóa nucleoprotein ở tế bào.
Acid amin: Nước tiểu có chứa tất cả các acid amin có trong protein. Ở một số bệnh
lý lượng acid amin cao hơn trong nước tiểu.
Các hormon, vitamin và enzym: Trong nước tiểu còn có chứa enzym như amylase,
các vitamin như B1, PP, C và các dạng dẫn xuất của chúng; các hormon sinh dục nam,
sinh dục nữ, vỏ thượng thận dưới dạng dẫn xuất glucuronic liên hợp.
5. CÁC CHẤT BẤT THƯỜNG TRONG NƯỚC TIỂU
Các chất được gọi là bất thường là những chất chỉ xuất hiện trong nước tiểu ở các trường hợp bệnh lý. 5.1. Glucid
Nước tiểu bình thường bao giờ cũng có chưa một lượng nhỏ các ose như glucose,
fructose, arabinose, galactose, ribose. Ose bất thường xuất hiện trong nước tiểu là
glucose, được gọi là glucose niệu. Glucose niệu thường gặp trong bệnh đái tháo đường
tụy do thiếu insulin. Ở một số trường hợp bệnh lý, trong nước tiểu xuất hiện một số ose
khác như fructose, galactose do rối loạn enzym bẩm sinh. 5.2. Protein
Trong nước tiểu ở người bình thường có khoảng 50 – 150mg protein/24h. Với nồng
độ này bằng các xét nghiệm thông thường không phát hiện ra được vì vậy, người ta coi
như không có protein trong nước tiểu. 105
Lượng protein đào thải hằng ngày phụ thuộc vào tuổi, giới, tư thế đứng lâu, phụ
thuộc vào hoạt động của cơ. Trong trường hợp lao động nặng, phụ nữ có thai lượng
protein trong nước tiểu cũng tăng hơn bình thường là albumin.
Bằng xét nghiệm thông thường phát hiện có protein trong nước tiểu thì đó là niệu
bệnh lý. Protein niệu bệnh lý xuất hiện trong các trường hợp: sốt cao, đái đường, bệnh
tim mạch (suy tim, huyết áp cao), bệnh thận.
5.3. Các chất Ketonic
Nước tiểu bình thường chứa khoảng vài mg acetic/1 lít và vài trăm mg acid beta
hydroxybutyric. Các chất cetonic trong nước tiểu tăng trong các rối loạn chuyển hóa
glucid, bệnh đái đường, đói lâu ngày, tăng chuyển hóa glucid, sau một trường hợp dùng thuốc gây mê.
5.4. Sắc tố mật, muối mật
Trong một số trường hợp tổn thương gan và đường mật, nhất là vàng da do viêm
gan, vàng da do tắc mật, bilirubin liên hợp có trong nước tiểu ( gọi là sắc tố mật).
5.5. Hồng cầu và hemoglobin
Nước tiểu có hồng cầu trong viêm thận cấp, lao thận, ung thư thận. Nước tiểu có
hemoglobin trong trường hợp sốt rét ác tính, vàng da do tiêu huyết, bỏng nặng. 5.6. Porphyrin
Người bình thường bài xuất khoảng 50-200mg porphyrin/24h. Có hai loại porphyrin niệu:
- Porphyrin niệu vô căn di truyền do thiếu một enzym của quá trình tổng hợp
hem ở tủy xương và gan.
- Rối loạn porphyrin niệu thứ phát do nhiễm độc, chất độc ức chế tổng hợp hem. 5.7. Dưỡng chấp
Nước tiểu có dưỡng chấp trong các trường hợp bệnh giun chỉ có tổn thương hệ
bạch huyết tại chổ liên quan tới đường bài xuất nước tiểu.
6. THĂM DÒ CHỨC NĂNG THẬN 6.1. Protein niệu
Protein niệu là một trong những xét nghiệm hàng loạt trong việc kiểm tra sức khỏe
thường kỳ. Bằng các xét nghiệm thông thường không phát hiện được protein niệu ở người bình thường. -
Protein niệu trên 150mg /24h được coi là khởi đầu bệnh lý. -
Protein niệu vừa: khi lượng protein trong nước tiểu < 0,2g/l, thường gặp trong
viêm thận cấp, viêm bể thận cấp hoặc mạn. -
Protein niệu nặng: khi lượng protein trong nước tiểu > 0,25g/l, thường gặp trong
hội chứng thận nhiễm mỡ. 106
Việc định tính protein nước tiểu bằng phương pháp điện di có thể giúp ta đánh giá
được mức độ tổn thương của thận đồng thời có thể xác định được tổn thương ở cầu thận hay ở ống thận. 6.2. Urê
Định lượng urê trong máu là một trong những xét nghiệm cơ bản. Ở người bình
thường nồng độ urê trong máu từ 1,7-8,3 mmol/l. Nồng độ urê trong nước tiểu khoảng
333 – 583mmol/24h. Nồng độ urê trong máu được coi là bệnh lý khi > 8,3mmol/l. Nồng
độ urê máu giảm rất hiếm khi gặp. Thường gặp urê máu cao thể hiện sự thiểu năng thận. 6.3. Creatinin
Khi bị tổn thương, nồng độ creatinin trong máu tăng sớm hơn so với urê. Ở người
bình thường, nồng độ creatinin trong huyết thanh là 53-97mmol/l (nam giới) và 44-80 mmol/l (nữ giới).
Các xét nghiệm nước tiểu và máu sơ bộ có thể đánh giá chức năng của thận. Các
xét nghiệm protein niệu, soi cặn để xác định hồng cầu và trụ hạt là hai xét nghiệm đơn
giản để nghĩ đến thận có bệnh lý hay không. Sự tăng nồng độ urê hay creatinin máu là
một dấu hiệu hóa sinh để nghi vấn chức năng lọc của thân. Theo dõi biến đổi urê hay
creatinin máu có thể tiên lượng sự tiến triển của bệnh đặc biệt là viêm thận mạn tính.
Tuy nhiên, các xét nghiệm trên không hoàn toàn đặc hiệu cho thận, mà chúng còn
phụ thuộc vào chế độ ăn, dùng thuốc và một số bệnh khác. Để dánh giá chức năng của
thận một cách chính xác và cụ thể cần phải tiến hành các nghiệm pháp thăm dò chức
năng như độ thanh thải, nghiệm pháp Zimnisky (nghiệm pháp 8 cốc), nghiệm pháp PSP
(phenol sulphophtalein). Ngoài ra, ở các cơ sở chuyên khoa có thể thăm dò phức tạp hơn
như thăm dò cân bằng acid – base của thận, định lượng hoạt độ renin trong huyết tương.
Ngoài những xét nghiệm trên, để đánh giá mức độ suy thận, người ta làm thêm các
xét nghiệm như nồng độ kali trong huyết thanh, nếu kali trong huyết thanh cao phải cho
chạy thận nhân tạo. Cần xét nghiệm ion đồ huyết thanh và nước tiểu, các thông số về pH, pO2, pCO2 v.v…
CÂU HỎI LƯỢNG GIÁ
1. Các phân tử được lọc qua cầu thận dễ dàng:
A. Protein có trọng lượng phân tử 70000
B. Các phân tử mang điện dương
C. Các phân tử có kích thước nhỏ D. Câu B, C đúng
2. Chất được lọc qua cầu thận và được tái hấp thu hoàn toàn:
A. Na và Cl B. Acid Uric và Creatinin C. Glucose
D. Tất cả các chất trên
3. Nước được tái hấp thu ở thận:
A. 10 % B. 20 % C. 50 % D. 99 % 107
4. Thận điều hoà thăng bằng acid base:
A. Bài tiết Na+ và giữ lại H+ B. Bài tiết Na+ và bài tiết H+
C. Giữ lại Na+ và bài tiết H+ D. Giữ lại Na+ và giữ lại H+
5. Bicarbonat được tái hấp thu trở lại máu cùng với: A. Ion H+ B. Ion Na+ C. Muối amon NH + 4 D. Muối phosphat dinatri 6. Renin:
A. Là một enzyme thuỷ phân protein
B. Trong máu renin tác dụng lên Angiotensinogen được tổng hợp từ gan
C. Renin có trọng lượng phân tử 40000
D. Tất cả các câu đều đúng 7. Angiotensin II:
A. Có hoạt tính sinh học mạnh B. Có đời sống ngắn
C. Tác dụng co mạch, tăng huyết áp, co cơ trơn, tăng tiết Aldosteron D. Câu A, C đúng
8. Sự bài tiết Renin tăng khi: A. Huyết áp hạ B. Huyết áp tăng
C. Tăng nồng độ Natri máu
D. Giảm nồng độ Kali máu
9. Sự tổng hợp Aldosteron tăng khi: A. Tăng Kali máu B. Hạ Natri máu C. Huyết áp hạ
D. Tất cả các câu đều đúng 10. Erythropoietin:
A. Là chất tạo hồng cầu B. Được tổng hợp từ 1 globulin
C. Được tổng hợp từ thận D. Câu A, C đúng
11. Tiền REF chuyển thành REF hoạt động dưới tác động trực tiếp của:
A. Prostaglandin B. Proteinkinase (+) C. AMP vòng
D. Adenylcyclase E. Tất cả các câu đều sai 12. Prostaglandin E2:
A. Được tìm thấy ở một tổ chức cạnh cầu thận cùng với PGI2 và TXA2
B. Tham gia vào sự tổng hợp REF C. Có tác dụng co mạch
D. Biến đổi tiền Erythropoietin thành Erythropoietin
13. Thể tích nước tiểu phụ thuộc vào: A. Tuổi B. Chế độ ăn C. Chế độ làm việc
D. Tất cả các câu đều đúng
14. pH nước tiểu bình thường:
A. Hơi acid, khoảng 5 – 6 B. Có tính kiềm mạnh
C. Không phụ thuộc chế độ ăn D. Không phụ thuộc vào tình trạng bệnh lý
15. Các chất có mặt trong nước tiểu bình thường:
A. Ure, Creatinin, Glucose B. Acid uric, Ure, Creatinin
C. Ure, Cetonic D. Tất cả các câu đều đúng 108
TÀI LIỆU THAM KHẢO
Tài liệu tiếng việt
1. Trần Thị Ân, Đái Duy Ban, Nguyễn Hữu Chấn, Đỗ Đình Hồ, Lê Đức Trình,
Hoá sinh học, NXB Y học, Hà Nội, 1980.
2. Phạm Thị Trân Châu, Trần Thị Áng, Hóa sinh học, NXB Giáo dục, HN, 2004.
3. Hồ Huỳnh Thuỳ Dương, Sinh học phân tử, NXB Giáo dục, Hà Nội, 1998.
4. Đỗ Quý Hai, Giáo trình Hóa sinh đại cương, Tài liệu lưu hành nội bộ Trường ĐHKH Huế, 2004.
5. Bộ môn Hóa sinh, Đại học Y – Dược TPHCM, Hóa sinh y học, NXB Y học TPHCM, 2003.
6. Đỗ Đình Hồ, Đông Thị Hoài An, Nguyễn Thị Hảo, Đỗ Đình Hồ, Phạm Thị
Mai, Trần Thanh Lan Phương, Đỗ Thị Thanh Thủy, Lê Xuân Trường, Hóa sinh
y học, NXB Y học, tp. Hồ Chí Minh, 2005.
7. Nguyễn Tiến Thắng, Nguyễn Đình Huyên, Giáo trình sinh hóa hiện đại, NXB Giáo dục, Hà Nội, 1998.
8. Nguyễn Xuân Thắng, Đào Kim Chi, Phạm Quang Tùng, Nguyễn Văn Đồng,
Hóa sinh học, NXB Y học, Hà Nội, 2004.
9. Nguyễn Xuân Thắng, Đào Kim Chi, Phạm Quang Tùng, Nguyễn Văn Đồng,
Hóa sinh học, NXB Y học, Hà Nội, 2004.
10. Phạm Thị Minh Thư, Lê Thị Thủy, Hóa sinh, NXB Giáo dục VN, Bộ Y tế, 2010.
Tài liệu tiếng nước ngoài
1. F. Percheron, R. Perlès, M. J. Foglietti, Biochimie structurale et métabolique, Tom 1 et 2, Masson, 1992.
2. Peter N. Campbell, Antony D. Smith, Biochemistry Illustrated, 4th edition, Harwal publishing, 2001.
3. Lehninger A. L., Principle of Biochemistry, 4th edition, W.H Freeman, 2004.
4. Nelson D. L., Cox M. M., Lehninger Principles of Biochemistry, 4th edition,
Freeman and Company, New York, USA, 2005.
5. R. K. Murray, D.K. Granner, V.W. Rodwell, Harper’s Illustrated
Biochemistry, 27th edition – Lange Medical Books/Mcgraw – Hill, 2006. 109