













Preview text:
Đ I HỌC ĐÀ N NG TR NG Đ I HỌC S PH M
Đinh Thanh Khẩn (Chủ biên)
Đặng Ng c ToƠn, Nguy n Văn Hi u, Nguy n Ng c Hi u
Nguy n Bá Vũ Chính, Tr nh Ng c Đạt, Lê Th Phương Thảo GIÁO TRÌNH NHI T HỌC
NHÀ XU T B N ĐẠI H C QU C GIA
THÀNH PH H CHÍ MINH - 2025
Đinh Thanh Khẩn (Chủ biên)
Đặng Ng c ToƠn, Nguy n Văn Hi u, Nguy n Ng c Hi u
Nguy n Bá Vũ Chính, Tr nh Ng c Đạt, Lê Th Phương Thảo GIÁO TRÌNH NHI T HỌC
NHÀ XU T B N ĐẠI H C QU C GIA
THÀNH PH H CHÍ MINH - 2025 L I M Đ U
Nhiệt học là bộ phận quan trọng c̉a Vật lí học, nghiên cứu các
hiện tượng liên quan đến chuyển động nhiệt c̉a các phân tử cấu tạo nên
vật chất, sự trao đổi năng lượng thông qua công và nhiệt và các quá
trình chuyển pha c̉a vật chất. Giáo trình Nhiệt học được biên soạn để
đáp ứng nhu cầu về giáo trình trong quá trình dạy và học tại Khoa Vật
lí, Trường Đại học Sư phạm – Đại học Đà Nẵng. Ngoài ra, giáo trình
cũng có thể được sử dụng làm tài liệu tham khảo cho sinh viên các
ngành kĩ thuật tại các trường đại học khác.
Giáo trình gồm 09 chương với nội dung chính như sau:
Chương 1 trình bày các khái niệm và những đại lượng cơ bản c̉a
Nhiệt học. Định luật thứ không c̉a nhiệt động lực học và các định luật
thực nghiệm c̉a chất khí cũng được trình bày. Khái niệm khí lí tưởng
và phương trình trạng thái c̉a khí lí tưởng được thảo luận ở cuối chương này.
Chương 2 trình bày về nội dung c̉a thuyết động học phân tử và
ứng dụng c̉a nó trong việc nghiên cứu về chất khí.
Chương 3 trình bày các khái niệm về công, nhiệt và nội năng và
mối liên hệ giữa chúng thông qua định luật thứ nhất c̉a nhiệt động lực
học. Phần cuối c̉a Chương 3 trình bày ứng dụng c̉a định luật thứ nhất
c̉a nhiệt động lực học trong nghiên cứu các quá trình đặc biệt như quá
trình đẳng tích, đẳng áp, đẳng nhiệt và đoạn nhiệt. Một dạng chung cho
những quá trình trên (quá trình đa biến) cũng được thiết lập.
Chương 4 trình bày về các loại máy nhiệt như động cơ nhiệt và
máy lạnh, hai phát biểu Kelvin-Planck và Clausius về định luật thứ hai
c̉a nhiệt động lực học, chu trình Carnot và định lí Carnot, chu trình
Otto, bất đẳng thức Clausius và entropy.
Chương 5 trình bày về tương tác và va chạm giữa các phân tử
chất khí. Dựa vào tương tác giữa các phân tử, phương trình trạng thái
c̉a khí thực (phương trình Van der Waals) được thiết lập. Tiếp đến,
nhóm tác giả trình bày về các đường đẳng nhiệt Van der Waals và i
Andrew. Phần cuối c̉a chương này trình bày về nội năng c̉a khí thực
và các hiệu ứng đi kèm với quá trình giãn nở c̉a khí thực.
Chương 6 trình bày về chuyển động nhiệt và tương tác giữa các
phân tử chất lỏng, từ đó giới thiệu về sức căng và năng lượng bề mặt
c̉a chất lỏng. Phần cuối c̉a Chương 6 giới thiệu về các hiện tượng liên
quan đến sức căng bề mặt c̉a chất lỏng như hiện tượng dính ướt và
không dính ướt, áp suất phụ và hiện tượng mao dẫn.
Chương 7 trình bày về pha và các quá trình chuyển pha, bao gồm
các quá tình nóng chảy, đông đặc, hóa hơi, ngưng tụ, thăng hoa và
ngưng kết. Ngoài ra, phần cuối c̉a Chương 7 trình bày về giản đồ pha
và phương trình Clapeyron-Clausius áp dụng cho các quá trình chuyển pha loại một.
Chương 8 trình bày các hiện tượng nhiệt, liên quan đến chuyển
động nhiệt c̉a các phân tử như hiện tượng giãn nở vì nhiệt, chuyển
động Brown, hiện tượng khuếch tán, hiện tượng nội ma sát.
Chương 9 trình bày về các hàm nhiệt động và ý nghĩa vật lí c̉a chúng.
Trong quá trình thực hiện, nhóm biên soạn có tham khảo và sử
dụng một số hình ảnh và các số liệu từ các tài liệu đã có như được liệt
kê ở mục tài liệu tham khảo. Nhóm biên soạn chân thành cảm ơn các
nhà khoa học, các thầy cô giáo trong và ngoài đơn vị công tác đã thảo
luận và cho những góp ý hữu ích.
Mặc dù đã cố gắng biên soạn cẩn thận nhưng không thể tránh khỏi
những thiếu sót. Nhóm biên soạn rất mong nhận được sự góp ý c̉a quý
đồng nghiệp và quý bạn đọc để giáo trình được hoàn thiện hơn.
Mọi góp ý xin vui lòng gửi đến đại điện nhóm biên soạn (Đinh Thanh
Khẩn) qua email: dtkhan@ued.udn.vn.
Trân trọng cảm ơn quý bạn đọc! Nhóm biên soạn ii MỤC LỤC
L i m đ u ........................................................................................... i Chương 1
GIỚI THI U VÀ CÁC KHÁI NI M C B N .............................. 1
1.1. Đối tượng, nhiệm vụ và phương pháp nghiên cứu Nhiệt học ....... 1
1.2. Hệ nhiệt động ................................................................................. 2
1.3. Nhiệt độ và định luật thứ không c̉a nhiệt động lực học ............... 6
1.4. Thang đo nhiệt độ .......................................................................... 9
1.5. Khí lí tưởng .................................................................................. 17
Tóm tắt Chương 1 ............................................................................... 29
Bài tập Chương 1 ................................................................................ 30 Chương 2
THUY T ĐỘNG HỌC CH T KHÍ ............................................... 37
2.1. Thuyết động học phân tử ............................................................. 37
2.2. Mô hình phân tử c̉a khí lí tưởng ................................................ 38
2.3. Áp suất khí ................................................................................... 39
2.4. Nhiệt độ khí và động năng tịnh tiến trung bình c̉a phân tử ....... 41
2.5. Định lí phân bố đều năng lượng .................................................. 43
2.6. Quãng đường tự do trung bình .................................................... 43
2.7. Sự phân bố tốc độ phân tử ........................................................... 45
Tóm tắt Chương 2 ............................................................................... 51
Bài tập Chương 2 ................................................................................ 53 Chương 3
ĐỊNH LUẬT THỨ NH T CỦA NHI T ĐỘNG LỰC HỌC ....... 56
3.1. Công trong quá trình chuẩn tĩnh (chuẩn cân bằng) ..................... 56
3.2. Nhiệt ............................................................................................ 63
3.3. Nội năng....................................................................................... 68 iii
3.4. Định luật thứ nhất c̉a nhiệt động lực học ................................... 70
3.5. Nhiệt dung c̉a chất khí ............................................................... 71
3.6. ng dụng định luật thứ nhất c̉a nhiệt động lực học .................. 75
Tóm tắt Chương 3 ............................................................................... 83
Bài tập Chương 3 ................................................................................ 86 Chương 4
ĐỊNH LUẬT THỨ HAI CỦA NHI T ĐỘNG LỰC HỌC ........... 93
4.1. Những hạn chế c̉a định luật thứ nhất c̉a nhiệt động lực học ... 93
4.2. Động cơ nhiệt .............................................................................. 95
4.3. Máy lạnh ...................................................................................... 99
4.4. Các phát biểu c̉a định luật thứ hai c̉a nhiệt động lực học ...... 102
4.5. Chu trình Carnot và định lí Carnot ............................................ 106
4.6. Chu trình Otto ............................................................................ 122
4.7. Bất đẳng thức Clausius .............................................................. 125
4.8. Entropy ...................................................................................... 126
Tóm tắt Chương 4 ............................................................................. 145
Bài tập Chương 4 .............................................................................. 148 Chương 5
KHÍ THỰC ...................................................................................... 155
5.1. Thế năng tương tác phân tử ....................................................... 155
5.2. Va chạm giữa các phân tử ......................................................... 157
5.3. Khí thực và phương trình Van der Waals .................................. 158
5.4. Đường đẳng nhiệt Van der Waals và Andrews ......................... 162
5.5. Nội năng c̉a khí thực ................................................................ 166
5.6. Giãn nở tự do (giãn nở Joule) ................................................... 168
5.7. Hiệu ứng Joule-Thomson .......................................................... 169
Tóm tắt Chương 5 ............................................................................. 173
Bài tập Chương 5 .............................................................................. 174 iv Chương 6
CH T LỎNG .................................................................................. 175
6.1. So sánh ở cấp độ phân tử c̉a chất khí, chất lỏng và chất rắn ... 175
6.2. Chuyển động c̉a các phân tử chất lỏng .................................... 176
6.3. Sức căng bề mặt và năng lượng bề mặt ..................................... 177
6.4. Sự dính ướt và không dính ướt .................................................. 185
6.5. Áp suất phụ ................................................................................ 187
6.6. Hiện tượng mao dẫn .................................................................. 191
Tóm tắt Chương 6 ............................................................................. 194
Bài tập Chương 6 .............................................................................. 196 Chương 7
SỰ CHUYỂN PHA ......................................................................... 199
7.1. Pha và sự chuyển pha ................................................................ 199
7.2. Một số quá trình chuyển pha ..................................................... 201
7.3. Giản đồ pha ................................................................................ 210
7.4. Phương trình Clapeyron-Clausius ............................................. 212
Tóm tắt Chương 7 ............................................................................. 216
Bài tập Chương 7 .............................................................................. 217 Chương 8
CÁC HI N T ỢNG NHI T ........................................................ 219
8.1. Hiện tượng giãn nở vì nhiệt ....................................................... 219
8.2. Hiện tượng truyền nhiệt ............................................................. 222
8.3. Chuyển động Brown .................................................................. 233
8.4. Hiện tượng khuếch tán ............................................................... 234
8.5. Hiện tượng nội ma sát ................................................................ 237
Tóm tắt Chương 8 ............................................................................. 241
Bài tập Chương 8 .............................................................................. 243 v Chương 9
CÁC HÀM NHI T ĐỘNG ............................................................ 246
9.1. Hàm nội năng ............................................................................. 246
9.2. Hàm năng lượng tự do Helmholtz ............................................. 248
9.3. Hàm Enthalpy ............................................................................ 249
9.4. Hàm năng lượng tự do Gibbs .................................................... 251
Tóm tắt Chương 9 ............................................................................. 253
Đáp án .............................................................................................. 254
Chương 1 .......................................................................................... 254
Chương 2 .......................................................................................... 254
Chương 3 .......................................................................................... 255
Chương 4 .......................................................................................... 257
Chương 5 .......................................................................................... 258
Chương 6 .......................................................................................... 258
Chương 8 .......................................................................................... 259
Tài li u tham khảo ......................................................................... 260 vi Chương 1 GIỚI THI U
VÀ CÁC KHÁI NI M C B N
Trong phần đầu của chương này, chúng tôi trình bày một số khái
niệm, đại lượng cơ bản của Nhiệt học như hệ nhiệt động (hay gọi tắt là
hệ), các thông số trạng thái của hệ và cách biểu diễn trạng thái cũng
như quá trình biến đổi trạng thái của một hệ. phần tiếp theo, chúng
tôi trình bày nguyên lí xây dựng một thang đo nhiệt độ, các thang đo
nhiệt độ Celsius, Kelvin và Fahrenheit. Trong phần cuối của chương
này, chúng tôi trình bày các định luật của chất khí, khái niệm về khí ĺ
tư ng và phương trình trạng thái của kh́ ĺ tư ng. Ngoài ra, định luật
thứ không của nhiệt động lực học và định luật Dalton về áp suất riêng
phần của chất khí cũng được trình bày trong chương này.
1.1. Đối tư ng, nhi m v vƠ phương pháp nghiên c u Nhi t h c
1.1.1. Đối tượng
Để làm rõ đ i tượng c a Nhiệt học, trước tiên chúng ta cần làm rõ
một s khái niệm. Đầu tiên là khái niệm về chuyển động nhiệt. Chuyển
động nhiệt là chuyển động hỗn loạn, không ngừng c a các phân tử cấu
tạo nên vật chất. Từ “nhiệt” trong “chuyển động nhiệt” liên quan đến
nhiệt độ c a vật b i vì động năng chuyển động nhiệt c a các phân tử
cấu tạo nên vật tỉ lệ với nhiệt độ c a vật (Điều này sẽ được chứng minh
Chương 2 c a giáo trình). Khái niệm tiếp theo là hiện tượng nhiệt.
Hiện tượng nhiệt là các hiện tượng liên quan đến chuyển động nhiệt c a
các phân tử. Có thể kể ra một s ví d về hiện tượng nhiệt như hiện
tượng khuếch tán, hiện tượng giãn n vì nhiệt, hiện tượng truyền
nhiệt,... Các hiện tượng này sẽ được nghiên cứu chi tiết trong Chương 8 c a giáo trình.
Nhiệt học là môn khoa học nghiên cứu các hiện tượng nhiệt dựa
trên những kiến thức về cấu tạo phân tử c a vật chất. Như vậy, có thể
thấy đ i tượng nghiên cứu c a Nhiệt học là những hệ chứa s lượng rất
lớn các phân tử tham gia chuyển động nhiệt. 1 1.1.2. Nhiệm vụ
Nhiệm v c a Nhiệt học là tìm hiểu các tính chất và quy luật
chuyển động c a các phân tử cấu tạo nên vật chất để giải thích các
tính chất vĩ mô c a vật chất liên quan đến chuyển động nhiệt c a các phân tử.
1.1.3. Phương pháp nghiên cứu
Trong Nhiệt học, có hai phương pháp nghiên cứu chính. Phương
pháp thứ nhất là phương pháp nhiệt động lực học, nghiên cứu sự trao
đổi năng lượng giữa hệ với môi trư ng xung quanh dựa trên quan điểm
vĩ mô. Phương pháp này dựa trên hai định luật cơ bản c a nhiệt động
lực học để nghiên cứu những tính chất c a hệ trong các điều kiện khác
nhau mà không quan tâm đến cấu tạo phân tử c a hệ. Phương pháp thứ
hai là phương pháp th ng kê, nghiên cứu chuyển động tổng thể c a một
tập hợp lớn các phân tử trong hệ thay vì từng phân tử riêng lẻ. 1.2. H nhi t đ ng
1.2.1. Hệ nhiệt động
Hệ nhiệt động (hay gọi tắt là hệ) là một phần giới hạn c a vũ tr
mà chúng ta tập trung sự chú Ủ vào đó. Ví d , nếu chúng ta mu n nghiên
cứu sự biến đổi trạng thái c a một lượng khí được chứa trong một xi
lanh, chúng ta chọn lượng khí này là hệ. Phần còn lại c a vũ tr , bên
ngoài hệ được gọi là môi trư ng xung quanh c a hệ. Như vậy, hệ cộng
với môi trư ng xung quanh c a nó chính là vũ tr . Bề mặt phân cách
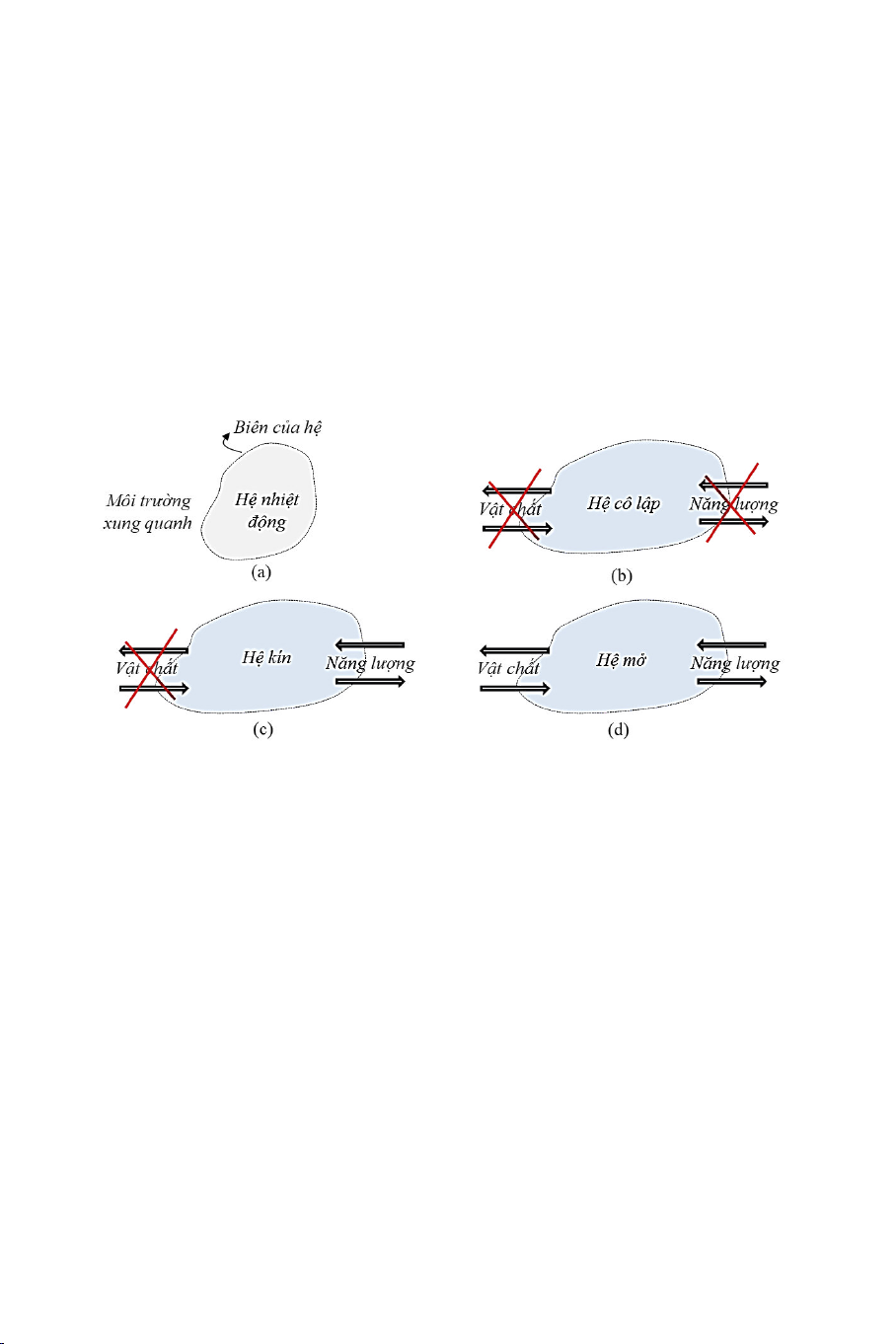
giữa hệ và môi trư ng xung quanh c a nó được gọi là biên c a hệ (Hình
1.1(a)). Bất cứ một sự tương tác nào giữa hệ và môi trư ng xung quanh
c a nó đều thực hiện xuyên qua biên c a hệ. Về mặt tương tác với môi
trư ng xung quanh, chúng ta chia hệ thành ba loại: hệ cô lập (Hình
1.1(b)), hệ kín (Hình 1.1(c)) và hệ m (Hình 1.1(d)).
(i) Hệ cô lập là hệ không tương tác (trao đổi vật chất và năng
lượng) với môi trư ng xung quanh c a nó. Như vậy, lượng
vật chất (s phân tử, s mol, kh i lượng) và năng lượng c a
một hệ cô lập là không đổi theo th i gian.
(ii) Hệ kín (một s tài liệu gọi là hệ đóng) là hệ chỉ trao đổi năng
lượng với môi trư ng xung quanh c a nó mà không trao đổi 2
vật chất. Lượng vật chất c a một hệ kín là không đổi trong
khi năng lượng c a nó có thể thay đổi.
(iii) Hệ m là hệ trao đổi cả vật chất và năng lượng với môi
trư ng xung quanh, do đó lượng vật chất và năng lượng c a
một hệ m có thể thay đổi.
Như đã đề cập trong m c 1.1.1, hệ được nghiên cứu trong Nhiệt
học thư ng bao gồm một s lượng rất lớn các phân tử tham gia chuyển
động nhiệt như một lượng chất khí hay chất l ng nào đó...
Hình 1.1. (a) Hệ và phân loại hệ
(b) hệ cô lập, (c) hệ kín và (d) hệ m .
1.2.2. Thông số trạng thái
Thông s trạng thái c a một hệ là các đại lượng vật lí, được sử
d ng để mô tả trạng thái c a một hệ. Trong Nhiệt học, trạng thái c a
một hệ được mô tả thông qua ba thông s trạng thái, bao gồm thể tích
(V), áp suất (P) và nhiệt độ (T). Do các phân tử chất khí chuyển động
nhiệt hỗn loạn, không ngừng và chiếm toàn bộ thể tích c a bình chứa
nên thể tích c a chất khí chính là thể tích c a bình chứa nó. Đơn vị c a
thể tích trong hệ đơn vị SI là mét kh i (m3). Trong quá trình chuyển
động nhiệt, các phân tử chất khí va chạm đàn hồi với thành bình và tác
d ng lực lên thành bình. Độ lớn c a lực mà các phân tử chất khí tác
d ng lên một đơn vị diện tích c a thành bình được gọi là áp suất khí. 3
Đơn vị c a áp suất trong hệ đơn vị SI là N/m2 hay pascal (Pa). Nhiệt độ
c a chất khí là đại lượng đặc trưng cho mức độ chuyển động nhiệt c a
các phân tử chất khí. Đơn vị c a nhiệt độ trong hệ SI là kelvin (K).
(Việc xác định áp suất và nhiệt độ c a chất khí được trình bày Chương
2 c a giáo trình này.) Trạng thái c a một hệ nào đó với áp suất P, thể
tích V và nhiệt độ T có thể được kí hiệu là (P, V, T).
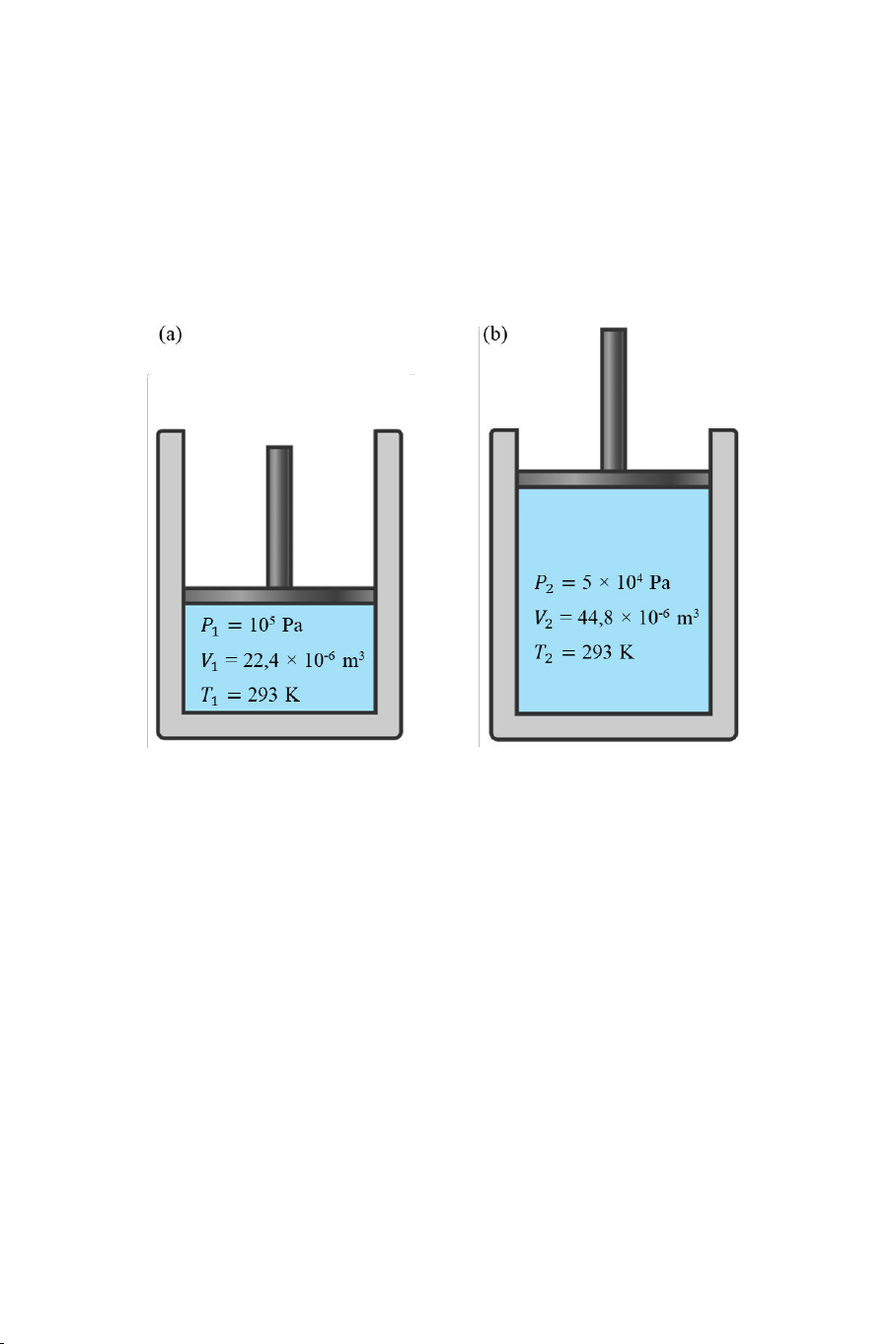
Hình 1.2. Quá trình biến đổi từ (a) trạng thái 1 với các thông số (
, , ) sang (b) trạng thái 2 với các thông số ( , , ) của chất
khí trong xi lanh.
Khi hệ biến đổi từ một trạng thái nào đó sang một trạng thái khác
(ví d : từ trạng thái 1 với các thông s ( , , ) sang trạng thái 2 với
các thông s ( , , ) trong Hình 1.2), ta nói hệ thực hiện một quá
trình biến đổi trạng thái (hay đơn giản là thực hiện một quá trình).
1.2.3. Phương trình trạng thái
Các thông s trạng thái P, V và T c a một hệ không độc lập với
nhau mà mỗi thông s là một hàm c a các thông s còn lại. Phương
trình nêu lên m i liên hệ giữa các thông s trạng thái c a một hệ được
gọi là phương trình trạng thái c a hệ và có thể được viết dưới dạng tổng quát như sau: 4 , , = (1.1)
trong m c 1.5 và 5.3, chúng ta sẽ thiết lập các phương trình trạng thái c a chất khí.
1.2.4. Giản đồ trạng thái
1.2.4.1. Giản đồ P-V-T
Giản đồ P-V-T là một hệ tr c tọa độ trực giao với ba tr c là P, V
và T vuông góc với nhau từng đôi một. Bất kì một trạng thái cân bằng
nào c a một hệ cũng được biểu diễn bằng một điểm trên giản đồ này.
Hay nói cách khác, mỗi điểm trên giản đồ P-V-T biểu diễn một trạng
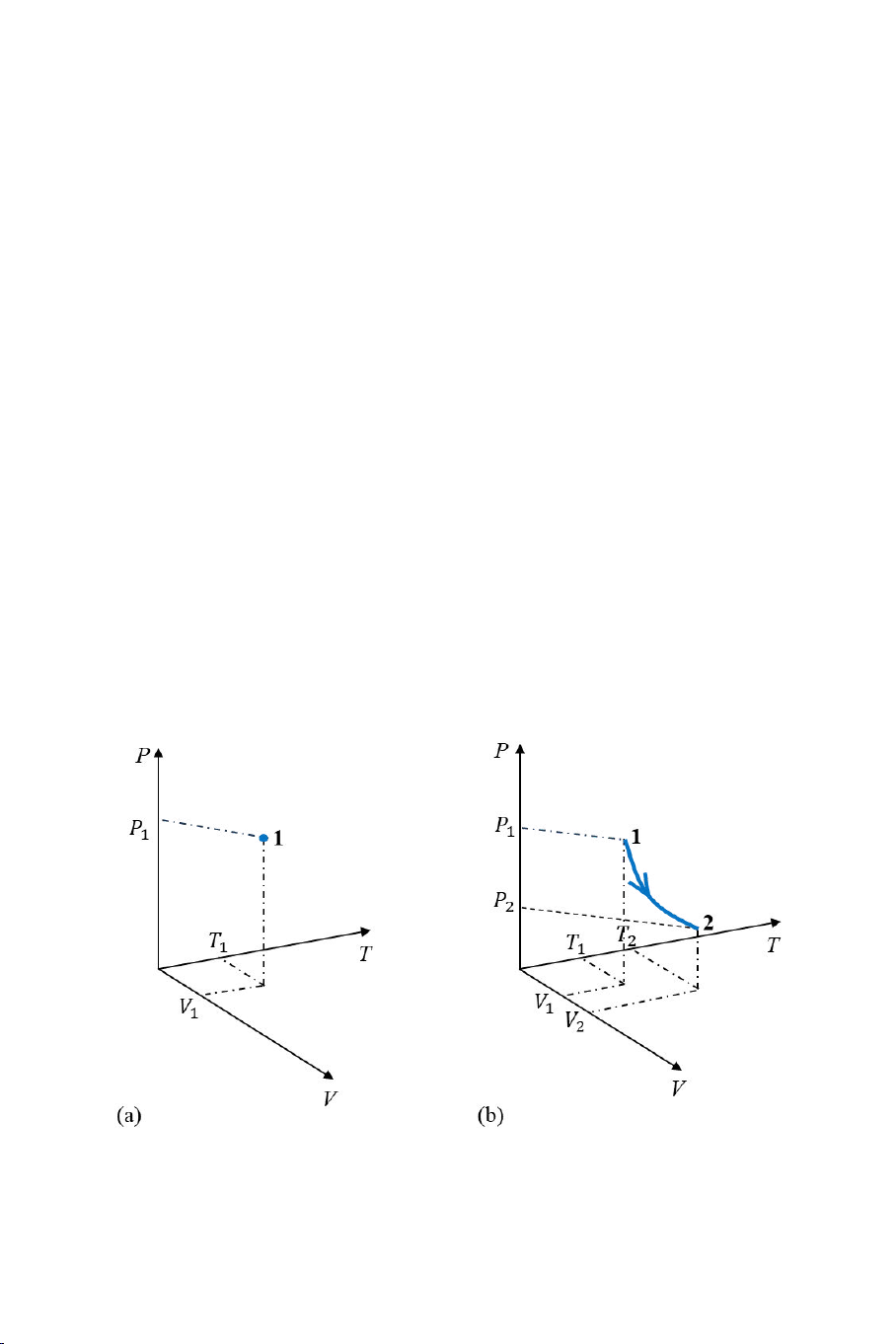
thái cân bằng nào đó c a hệ. Ví d , điểm “1” trên Hình 1.3(a) mô tả
trạng thái 1 c a hệ với áp suất P1, thể tích V1 và nhiệt độ T1. Khi hệ thực
hiện một quá trình biến đổi từ trạng thái 1 với các thông s (P1, V1, T1)
sang trạng thái 2 với các thông s (P2, V2, T2), nó đi qua một loạt các
trạng thái trung gian. Do mỗi trạng thái mà hệ đi qua được biểu diễn b i
một điểm trên trên giản đồ P-V-T, nên quá trình biến đổi từ trạng thái 1
sang trạng thái 2 c a hệ được biểu diễn bằng một đư ng cong trên giản
đồ P-V-T (Hình 1.3(b)).
Hình 1.3. Biểu diễn (a) trạng thái 1 và (b) quá trình biến đổi từ trạng
thái 1 sang trạng thái 2 của một hệ trên giản đồ P-V-T. 5
1.2.4.2. Giản đồ P-V
B i vì các thông s trạng thái c a một hệ ph thuộc lẫn nhau,
không tồn tại hai trạng thái khác nhau c a một hệ có cùng hai trong s
ba thông s trạng thái P, V và T. Do đó, chúng ta chỉ cần biểu diễn một
trạng thái nào đó c a hệ thông qua hai trong ba thông s trạng thái bằng
cách sử d ng giản đồ P-V, V-T hoặc P-T. Trong đó, giản đồ P-V được
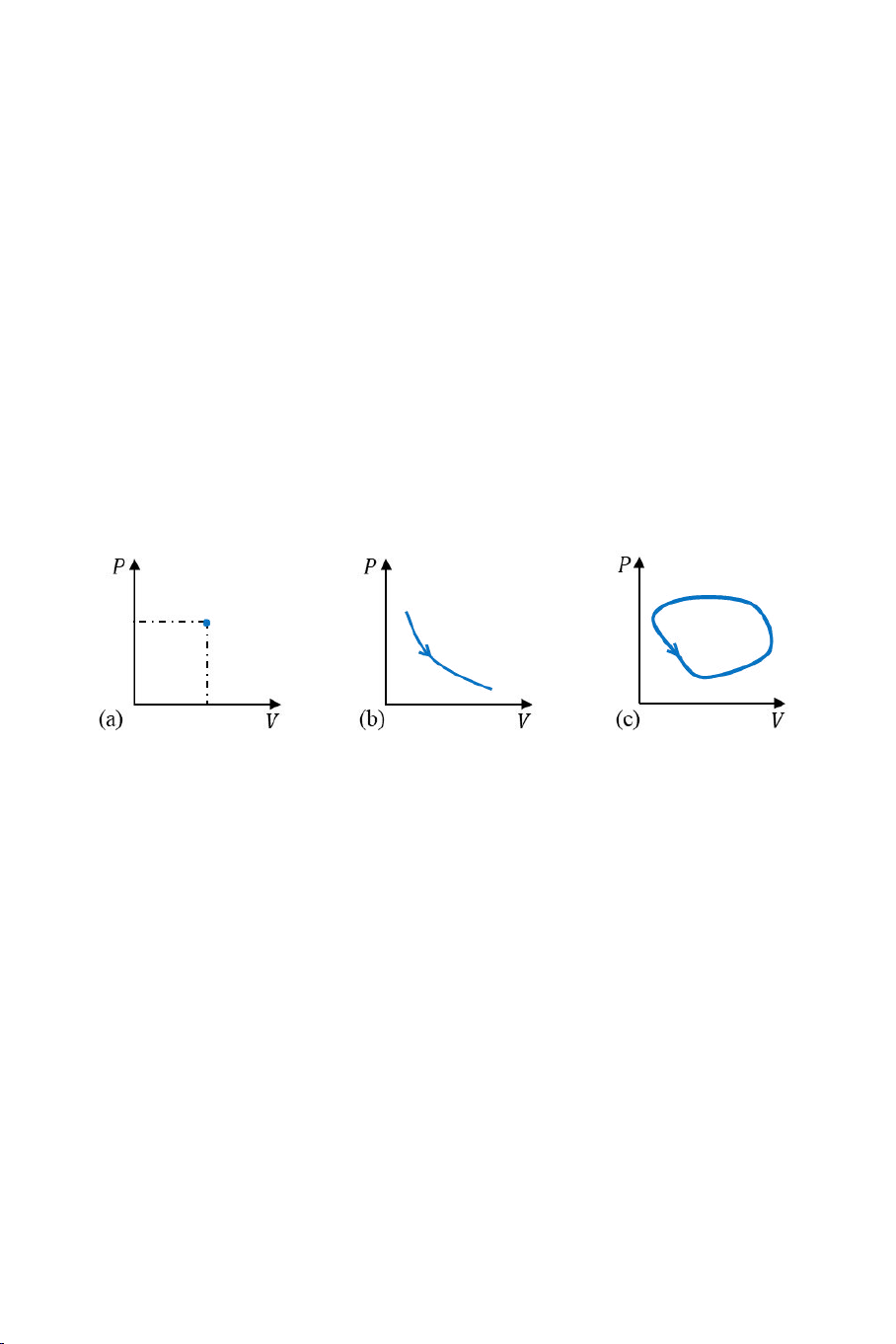
sử d ng nhiều nhất. Trên giản đồ P-V, một trạng thái và một quá trình
biến đổi trạng thái c a một hệ cũng lần lượt được biểu diễn b i một
điểm và một đư ng cong (Hình 1.4(a) và 1.4(b)).
Trong nhiều trư ng hợp, hệ thực hiện một quá trình biến đổi mà
hai trạng thái đầu và cu i trùng với nhau. Quá trình như vậy được gọi
là chu trình. Trong các giản đồ P-V-T và P-V, một chu trình được biểu
diễn bằng một đư ng cong khép kín (Hình 1.4(c)).
Hình 1.4. Biểu diễn (a) trạng thái, (b) quá trình và (c) chu trình biến
đổi của một hệ trên giản đồ P-V.
1.3. Nhi t đ vƠ đ nh lu t th không c a nhi t đ ng l c h c
Trong m c này, chúng ta tìm hiểu về việc đo nhiệt độ c a một vật.
ụ nghĩa vật lí c a nhiệt độ được trình bày trong Chương 2.
1.3.1. Nhiệt độ
Vào mùa đông, khi nhiệt độ không khí xu ng thấp chúng ta sẽ cảm
giác bị lạnh. Ngược lại, vào mùa hè khi nhiệt độ không khí lên cao chúng
ta sẽ có giảm giác nóng. Vậy, nhiệt độ c a một vật nào đó có phải là
thước đo độ nóng hay lạnh khi chúng ta tiếp xúc với vật đó? Điều này
chỉ đúng khi xét cùng một vật. Tuy nhiên, khi chúng ta tiếp xúc với các
vật khác nhau thì điều này lại không chính xác. Ví d , vào mùa đông mặc 6
dù các vật trong nhà chúng ta có cùng nhiệt độ nhưng chúng ta lại có cảm
giác nóng (ấm), lạnh khác nhau khi tiếp xúc với các vật khác nhau. Khi
chúng ta chạm một tay vào tấm thảm và tay còn lại vào nền gạch men,
chúng ta có cảm giác nền gạch men lạnh hơn tấm thảm dù cả hai có cùng
nhiệt độ. Cảm giác nóng hay lạnh khi chúng ta tiếp xúc với một vật nào
đó do xúc giác c a chúng ta mang lại. Thực tế, xúc giác c a cơ thể sẽ cho
chúng ta cảm giác lạnh khi cơ thể chúng ta truyền nhiệt sang vật. Ngược
lại, khi cơ thể chúng ta nhận nhiệt từ vật thì xúc giác sẽ mang lại cho
chúng ta cảm giác nóng. Mức độ nóng hơn hay lạnh hơn khi chúng ta
tiếp xúc với các vật khác nhau ph thuộc vào t c độ trao đổi nhiệt giữa
cơ thể và vật mà không ph thuộc hoàn toàn vào nhiệt độ c a vật. B i vì
gạch men trao đổi nhiệt với bàn tay c a chúng ta t c độ cao hơn so với
tấm thảm nên chúng ta có cảm giác lạnh hơn bàn tay tiếp xúc với nền
gạch men. Với cùng một vật, t c độ trao đổi nhiệt giữa vật với cơ thể c a
con ngư i chỉ ph thuộc vào nhiệt độ c a nó (giả sử nhiệt độ cơ thể ngư i
là không đổi). Do đó, nếu vật đó có nhiệt độ càng cao thì chúng ta có cảm
giác càng nóng và ngược lại.
Như vậy, chúng ta thấy độ nóng, lạnh c a vật không phản ánh
chính xác nhiệt độ c a vật và mang tính cảm tính. Hơn nữa, nó cũng
không cho phép phát hiện những thay đổi nh c a nhiệt độ (không
nhạy). Để xác định chính xác nhiệt độ c a vật, ta cần một thiết bị đo
nhiệt độ. Đó là nhiệt kế. Từ thực nghiệm, ngư i ta phát hiện nhiều tính
chất vật lí (hay đại lượng vật lí) c a vật thay đổi khi nhiệt độ c a nó
thay đổi. Ví d , chiều dài và thể tích c a vật rắn tăng lên khi nhiệt độ
c a nó tăng hay áp suất c a một lượng khí xác định có thể tích không
đổi tăng lên khi nhiệt độ c a chất khí tăng. Những đại lượng vật lí này
được gọi là các đại lượng đo nhiệt độ. Một sự thay đổi c a đại lượng đo
nhiệt độ phản ánh một sự thay đổi trong nhiệt độ c a vật. Do đó, chúng
ta có thể đo nhiệt độ c a một vật thông qua đo đại lượng đo nhiệt độ
c a nó. Hay nói cách khác, một thang đo nhiệt độ có thể được thiết lập
dựa trên một đại lượng đo nhiệt độ.
1.3.2. Cân bằng nhiệt và định luật thứ không của nhiệt động lực học
Một hệ được gọi là tiếp xúc nhiệt với một hệ khác nếu có sự trao
đổi năng lượng giữa chúng do sự chênh lệch về nhiệt độ. Chú ý rằng
hai hệ tiếp xúc nhiệt với nhau không nhất thiết phải tiếp xúc vật lí với 7
nhau. Hay nói cách khác, nếu giữa hai hệ là chân không thì chúng cũng
có thể tiếp xúc nhiệt với nhau. Ví d , Mặt Tr i và Trái Đất luôn tiếp
xúc nhiệt với nhau (như được trình bày Chương 8 c a giáo trình).
Hình 1.5. Sự cân bằng nhiệt của hai vật.
Khi hai hệ có nhiệt độ khác nhau tiếp xúc nhiệt với nhau, sự trao
đổi năng lượng sẽ làm cho chúng tiến tới có cùng nhiệt độ (Hình 1.5).
Khi đó, hai hệ được gọi là cân bằng nhiệt với nhau. Như vậy, hai hệ
được gọi là cân bằng nhiệt với nhau nếu chúng tiếp xúc nhiệt với nhau
và có cùng nhiệt độ. Điều này được vận d ng để đo nhiệt độ c a một
vật. Ví d , khi sử d ng nhiệt kế để đo nhiệt độ c a một bệnh nhân, bác
sĩ thư ng kẹp nhiệt kế vào nách c a bệnh nhân trong một khoảng th i
gian nhất định (khoảng vài phút) để nhiệt kế cân bằng nhiệt với cơ thể
bệnh nhân. Khi đó, nhiệt độ c a nhiệt kế bằng nhiệt độ c a cơ thể bệnh
nhân. Mặt khác, khi lấy nhiệt kế ra để đọc nhiệt độ, bác sĩ phải đọc
ngay nhiệt độ hiển thị trên nhiệt kế để nhiệt độ trên nhiệt kế không bị
thay đổi dẫn đến khác với nhiệt độ cơ thể bệnh nhân. Ngoài ra, nếu
mọi nơi trong một hệ có nhiệt độ như nhau (hay nhiệt độ được phân
b đều trong hệ), hệ đó được gọi là đang trong trạng cái cân bằng nhiệt (Hình 1.6).
Hình 1.6. Quá trình tiến tới cân bằng nhiệt của chất khí
trong một xi lanh. 8
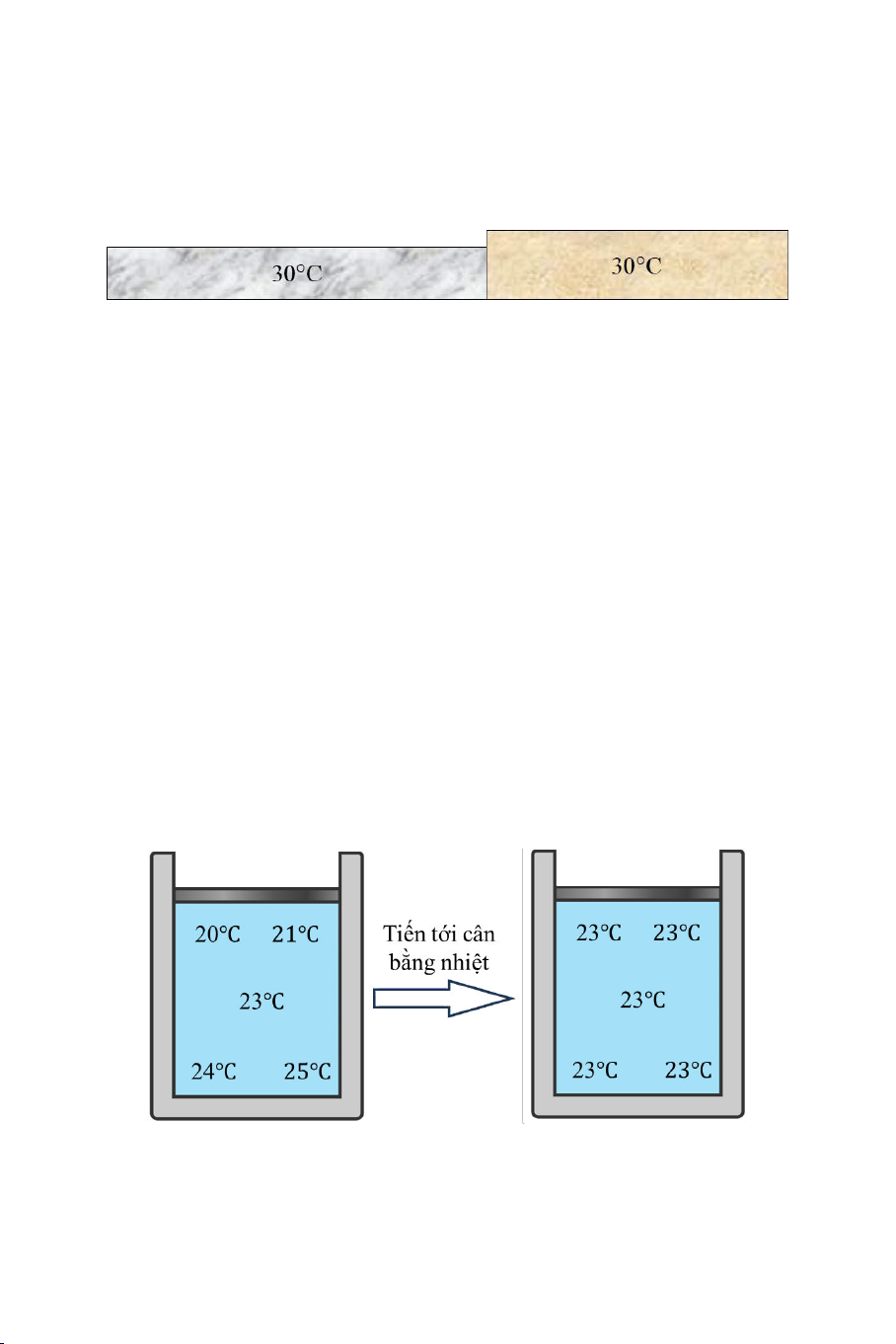
Giả sử chúng ta có hai vật A và B cùng cân bằng nhiệt với vật C
tại 30℃ như Hình 1.7(a) và (b). Nếu chúng ta cho hai vật A và B tiếp
xúc nhiệt với nhau, thực nghiệm chứng t rằng hai vật cũng cân bằng
nhiệt với nhau tại 30℃ như Hình 1.7(c). Kết quả này đã được đúc kết
thành một định luật, được gọi là định luật thứ không c a nhiệt động lực
học và được phát biểu như sau:
N u hai h cùng cân bằng nhi t v i m t h th ba, thì cả ba h
cân bằng nhi t v i nhau.
Hình 1.7. Sự cân bằng nhiệt của ba vật A, B và C.
1.4. Thang đo nhi t đ
1.4.1. Nguyên lí xây dựng thang đo nhiệt độ
Để xây dựng một thang đo nhiệt độ, trước tiên chúng ta tìm hiểu một s khái niệm sau:
(i) Điểm nóng chảy c a nước là nhiệt độ mà tại đó nước cùng tồn
tại cân bằng nhiệt với nước đá áp suất khí quyển (1 atm).
(ii) Điểm sôi c a nước là nhiệt độ mà tại đó nước cùng tồn tại
cân bằng nhiệt với hơi nước áp suất khí quyển (1 atm).
(iii) Điểm ba c a nước là nhiệt độ và áp suất duy nhất mà tại đó
nước đá, nước và hơi nước (ba pha khác nhau c a nước) cùng
tồn tại cân bằng nhiệt với nhau.
Như trình bày m c 1.3.1, một sự thay đổi trong đại lượng đo
nhiệt độ c a một vật phản ánh sự thay đổi trong nhiệt độ c a vật đó nên
bất cứ một đại lượng đo nhiệt độ nào cũng có thể được sử d ng để thiết
lập một thang đo nhiệt độ. D ng c dùng để đo nhiệt độ được gọi là
nhiệt kế. Ví d , với nhiệt kế th y ngân chiều cao c a cột th y ngân trong
ng th y tinh là đại lượng đo nhiệt độ. 9
Gọi a là đại lượng đo nhiệt độ c a chất X trong một nhiệt kế. Khi
nhiệt độ chất này thay đổi, giữa a và nhiệt độ T c a chất X liên hệ với
nhau theo công thức a = f(T). Để đơn giản chúng ta chỉ xét các đại lượng
đo nhiệt độ thay đổi tuyến tính với nhiệt độ T, nghĩa là: = + (1.2)
với là hằng s , là giá trị c a đại lượng tại nhiệt độ = 0.
Đầu tiên, ta nhúng nhiệt kế với chất X vào trong bình chứa nước
và nước đá đang tồn tại cân bằng nhiệt với nhau áp suất khí quyển
1 atm (điểm nóng chảy c a nước). Gọi là điểm nóng chảy c a
nước. Khi nhiệt kế cân bằng nhiệt với nước và nước đá, đại lượng có giá trị: = o + (1.3)
Tiếp theo, lấy nhiệt kế ra và nhúng nó vào trong bình chứa nước
và hơi nước đang tồn tại cân bằng nhiệt với nhau áp suất khí quyển
1 atm (điểm sôi c a nước). Gọi là điểm sôi c a nước. Khi nhiệt kế
cân bằng nhiệt với nước và hơi nước, đại lượng có giá trị: = o + (1.4)
Từ (1.3) và (1.4), hằng s được xác định theo công thức: − = (1.5) −
Cu i cùng, cho nhiệt kế với chất X tiếp xúc nhiệt với một vật
nhiệt độ T nào đó, khi nhiệt kế cân bằng nhiệt với vật này, đại lượng
đo nhiệt có giá trị là . Khi đó, nhiệt độ T c a vật được xác định theo công thức: − − (1.6) = − 10
1.4.2. Nhiệt kế thủy ngân với thang đo nhiệt độ Celsius và Fahrenheit
Nhiệt kế th y ngân thông d ng gồm một ng th y tinh có một đầu
là một bầu chứa một lượng th y ngân xác định. Trong nhiệt kế th y
ngân, đại lượng đo nhiệt độ là chiều dài L c a cột th y ngân trong ng
th y tinh. Chất X trong nhiệt kế th y ngân chính là th y ngân. Khi nhiệt
kế tiếp xúc với một vật có nhiệt độ khác với nhiệt độ c a th y ngân bên
trong nó, cột th y ngân trong ng th y tinh sẽ co giãn, làm cho chiều
dài c a cột th y ngân thay đổi tuyến tính theo nhiệt độ. Dựa vào chiều
dài cột th y ngân trong ng th y tinh, chúng ta có thể tạo ra một thang
đo dọc theo ng th y tinh để đo nhiệt độ như sau:
Hình 1.8. Thiết kế thang đo nhiệt độ Celsius
trên nhiệt kế thủy ngân.
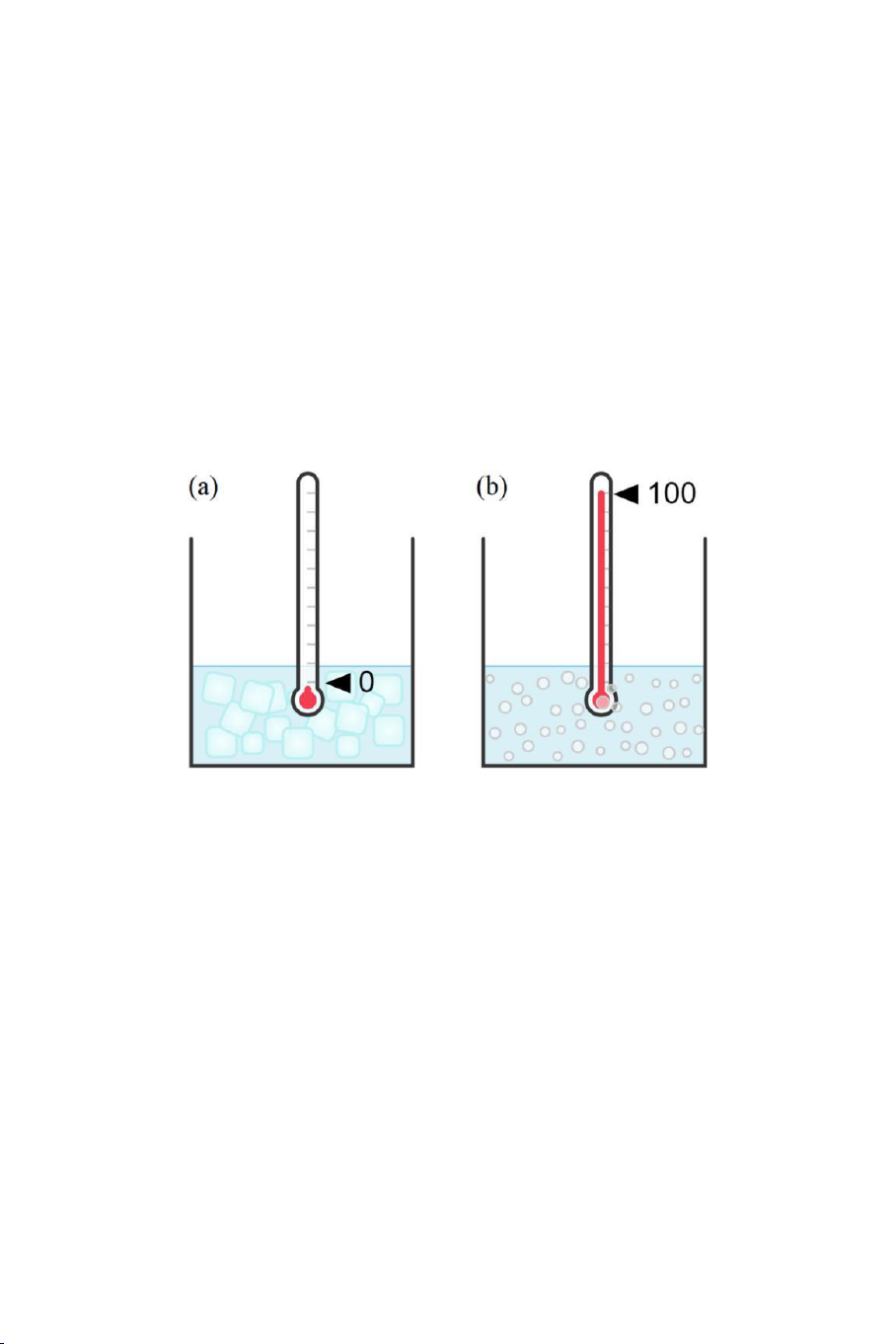
Đầu tiên, nhúng nhiệt kế vào trong một bình chứa nước và nước
đá đang tồn tại cân bằng nhiệt với nhau áp suất khí quyển 1 atm (Hình
1.8(a)). Khi th y ngân và bình cân bằng nhiệt với nhau, đánh dấu vị trí
mực trên c a cột th y ngân lên ng th y tinh. Vị trí này được gọi là
điểm nóng chảy hay nhiệt độ nóng chảy c a nước.
Tiếp theo, lại nhúng nhiệt kế vào trong một bình chứa nước và hơi
nước đang tồn tại cân bằng nhiệt với nhau áp suất khí quyển 1 atm
(Hình 1.8(b)). Khi th y ngân cân bằng nhiệt với bình này, đánh dấu vị
trí mực trên c a cột th y ngân lên ng th y tinh. Vị trí mới này được
gọi là điểm sôi hay nhiệt độ sôi c a nước. 11



