
















Preview text:
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC SƯ PHẠM KỸ THUẬT
THÀNH PHỐ HỒ CHÍ MINH *******************
TS. TRẦN THỊ KIM ANH
TS. HOÀNG THỊ TUYẾT NHUNG
THỰC TẬP XỬ LÝ NƯỚC CẤP
NHÀ XUẤT BẢN ĐẠI HỌC QUỐC GIA
THÀNH PHỐ HỒ CHÍ MINH – NĂM 2020
THỰC TẬP XỬ LÝ NƯỚC CẤP
TRẦN THỊ KIM ANH, HOÀNG THỊ TUYẾT NHUNG
Chịu trách nhiệm xuất bản và nội dung TS. ĐỖ VĂN BIÊN Biên tập LÊ THỊ THU THẢO Sửa bản in PHAN KHÔI Trình bày bìa
TRƯỜNG ĐẠI HỌC SƯ PHẠM KỸ THUẬT TP.HCM
Website: http://hcmute.edu.vn
Đối tác liên kết – Tổ chức bản thảo và chịu trách nhiệm tác quyền
TRƯỜNG ĐẠI HỌC SƯ PHẠM KỸ THUẬT TP.HCM
Website: http://hcmute.edu.vn
NHÀ XUẤT BẢN ĐẠI HỌC QUỐC GIA THÀNH PHỐ HỒ CHÍ MINH
Phòng 501, Nhà Điều hành ĐHQG-HCM, phường Linh Trung, quận Thủ Đức, TP Hồ Chí Minh
ĐT: 028 6272 6361 - 028 6272 6390 E-mail: vnuhp@vnuhcm.edu.vn
Website: www.vnuhcmpress.edu.vn
VĂN PHÒNG NHÀ XUẤT BẢN
PHÒNG QUẢN LÝ DỰ ÁN VÀ PHÁT HÀNH
Tòa nhà K-Trường Đại học Khoa học Xã hội & Nhân văn, số 10-12 Đinh Tiên Hoàng, phường Bến Nghé, Quận 1, TP Hồ Chí Minh
ĐT: 028 66817058 - 028 62726390 - 028 62726351
Website: www.vnuhcmpress.edu.vn
Nhà xuất bản ĐHQG-HCM và tác giả/ đối tác liên kết giữ bản quyền©
Copyright © by VNU-HCM Press and author/
co-partnership. All rights reserved.
ISBN: 978-604-73-7808-1
In 250 cuốn, khổ 16 x 24 cm, XNĐKXB số: 2564-2020/CXBIPH/1-56/ĐHQGTPHCM. QĐXB
số 126/QĐ-NXB ĐHQGTPHCM, cấp ngày 06/7/2020.
In tại: Công ty TNHH In & Bao bì Hưng Phú. Địa chỉ: 162A/1, KP1A, P. An Phú TX. Thuận ,
An, Bình Dương. Nộp lưu chiểu: Quý III/2020.
THỰC TẬP XỬ LÝ NƯỚC CẤP TRẦN THỊ KIM ANH,
HOÀNG THỊ TUYẾT NHUNG .
Bản tiếng Việt ©, TRƯỜNG ĐẠI HỌC SƯ PHẠM KỸ THUẬT TP. HCM, NXB ĐHQG-HCM và TÁC GIẢ.
Bản quyền tác phẩm đã được bảo hộ bởi Luật Xuất bản và Luật Sở hữu trí tuệ
Việt Nam. Nghiêm cấm mọi hình thức xuất bản, sao chụp, phát tán nội dung khi
chưa có sự đồng ý của Trường đại học Sư phạm Kỹ thuật TP. HCM và Tác giả.
ĐỂ CÓ SÁCH HAY, CẦN CHUNG TAY BẢO VỆ TÁC QUYỀN! 2 LỜI NÓI ĐẦU
Giáo trình Thực tập xử lý nước cấp được dùng cho sinh viên
ngành môi trường có thể tìm hiểu các phương pháp xử lý ô nhiễm trong
nước mặt và nước ngầm như xử lý sắt, xử lý độ cứng trong nước ngầm,
xử lý chất rắn lơ lửng trong nước mặt, xử lý chất ô nhiễm hữu cơ trong
nước,.... Từ các đánh giá hiệu quả xử lý nước cấp thông qua nhiều
phương pháp khác nhau, sinh viên môi trường có cái nhìn tổng quan,
thực tế về các phương pháp xử lý nước cấp cũng như hiệu quả của các
phương pháp. Ngoài ra, sinh viên được trang bị những kỹ năng thực hành
phân tích đánh giá các chỉ tiêu phân tích đối với xử lý nước, phân tích
đánh giá số liệu và xây dựng các phương trình động học cho quá trình xử
lý. Từ đó, nắm được quy luật cho từng phương pháp xử lý.
Sinh viên thực tập học phần này sẽ được trang bị đầy đủ kiến thức
và kỹ năng cho quá trình thực tập về lĩnh vực xử lý nước cấp, để có thể
trở thành một kỹ sư môi trường trong tương lai. Các tác giả 3 4 MỤC LỤC
LỜI NÓI ĐẦU ........................................................................................... 3
MỤC LỤC ................................................................................................. 5
CÁC KÝ HIỆU VÀ ĐƠN VỊ .................................................................... 9
MỞ ĐẦU ................................................................................................. 11 BÀI THỰC HÀNH SỐ 1
KEO TỤ - TẠO BÔNG BẰNG PHÈN NHÔM................................... 12
1.1. TỔNG QUAN .............................................................................. 12
1.1.1. Trị số pH của nƣớc ............................................................... 13
1.1.2. Lƣợng dùng chất keo tụ ........................................................ 13
1.1.3. Nhiệt độ nƣớc....................................................................... 14
1.1.4. Tốc độ hỗn hợp của nƣớc với chất keo tụ ............................ 14
1.2. DỤNG CỤ - THIẾT BỊ ................................................................ 15
1.3. HÓA CHẤT ................................................................................. 15
1.4. THỰC NGHIỆM ......................................................................... 15
1.4.1. TN 1: Xác định giá trị pH tối ƣu. ......................................... 15
1.4.2. TN 2: Xác định liều lƣợng phèn tối ƣu ................................ 17
1.4.3. TN 3: S dụng m h nh keo tụ – tạo b ng – lắng ................ 18
1.5. XỬ LÝ SỐ LIỆU ......................................................................... 19
1.6. CÂU HỎI ÔN TẬP ...................................................................... 19
1.7. BÁO CÁO KẾT QUẢ PHÂN TÍCH ........................................... 19 BÀI THỰC HÀNH SỐ 2
LẮNG BÔNG TỤ .................................................................................. 20
2.1. TỔNG QUAN .............................................................................. 20
2.1.1. Các khái niệm ....................................................................... 20 5
2.1.2. Cách xác định hiệu quả lắng b ng tụ ................................... 21
2.2. DỤNG CỤ - THIẾT BỊ ................................................................ 22
2.3. HÓA CHẤT ................................................................................. 22
2.4. THỰC NGHIỆM ......................................................................... 23
2.4.1. Thiết lập thí nghiệm ............................................................. 23
2.4.2. Tiến hành thí nghiệm ............................................................ 24
2.5. XỬ LÝ SỐ LIỆU ......................................................................... 24
2.6. CÂU HỎI ÔN TẬP ...................................................................... 25
2.7. BÁO CÁO KẾT QUẢ PHÂN TÍCH ........................................... 25 BÀI THỰC HÀNH SỐ 3
HẤP PHỤ BẰNG THAN HOẠT TÍNH .............................................. 26
3.1. TỔNG QUAN .............................................................................. 26
3.1.1. Phƣơng tr nh Freundlich ...................................................... 26
3.1.2. Phƣơng tr nh Langmuir ........................................................ 27
3.1.3. Quá tr nh hấp phụ theo dạng mẻ .......................................... 28
3.1.4. Quá tr nh hấp phụ dạng cột .................................................. 28
3.2. DỤNG CỤ - THIẾT BỊ ................................................................ 29
3.4. THỰC NGHIỆM ......................................................................... 29
3.4.1. TN 1: Xác định quan hệ nồng độ màu và độ hấp thu........... 29
3.4.2. TN 2: Quá tr nh hấp phụ theo mẻ ......................................... 30 ng c 3.4.3. TN 3: Hấp phụ dạ t
ộ ....................................................... 31
3.5. XỬ LÝ SỐ LIỆU ......................................................................... 32
3.6. CÂU HỎI ÔN TẬP ...................................................................... 33
3.7. BÁO CÁO KẾT QUẢ PHÂN TÍCH ........................................... 33 BÀI THỰC HÀNH SỐ 4
LOẠI BỎ SẮT TRONG NƯỚC NGẦM ............................................. 34 6
4.1. TỔNG QUAN .............................................................................. 34
4.2. CÁC PHƢƠNG PHÁP KHỬ SẮT .............................................. 35
4.2.1. Kh sắt bằng phƣơng pháp làm thoáng ................................ 35
4.2.2. Kh sắt bằng phƣơng pháp dùng hóa chất ........................... 37
4.3. DỤNG CỤ - THIẾT BỊ ................................................................ 38
4.4. HÓA CHẤT ................................................................................. 38
4.5. PHÂN TÍCH SẮT ........................................................................ 39
4.5.1. Lập đƣờng chuẩn .................................................................. 39
4.5.2. Sắt tổng cộng (TFe) .............................................................. 40
4.5.3. Sắt hai (Fe2+) ....................................................................... 40
4.6. THỰC NGHIỆM ......................................................................... 41
4.6.1. TN 1: Loại bỏ sắt bằng phƣơng pháp thổi khí...................... 41
4.6.2. TN 2: Loại bỏ sắt bằng giàn mƣa ......................................... 44
4.6.3. TN 3: Loại bỏ sắt bằng phƣơng pháp hóa chất .................... 44
4.7. XỬ LÝ SỐ LIỆU ......................................................................... 45
4.8. CÂU HỎI ÔN TẬP ...................................................................... 46
4.9. BÁO CÁO KẾT QUẢ PHÂN TÍCH ........................................... 46 BÀI THỰC HÀNH SỐ 5
KHỬ CỨNG BẰNG HÓA CHẤT ........................................................ 47
5.1. TỔNG QUAN .............................................................................. 47
5.1.1. Kh cứng carbonate bằng v i .............................................. 48
5.1.2. Kh cứng non-carbonate bằng v i và sođa .......................... 48
5.1.3. Phƣơng pháp khuấy trộn ..................................................... 48
5.1.4. Phƣơng pháp bể phản ứng tầng s i (Pellet Reactor) ............ 49
5.2. DỤNG CỤ - THIẾT BỊ ................................................................ 51
5.3. HÓA CHẤT ................................................................................. 51
5.4. THỰC NGHIỆM ......................................................................... 53 7
5.4.1. TN 1: Loại bỏ độ cứng bằng hóa chất theo mẻ .................... 53
5.4.2. TN 2: Loại bỏ độ cứng bằng Pellet Reactor ......................... 54
5.5. XỬ LÝ SỐ LIỆU ......................................................................... 54
5.6. CÂU HỎI ÔN TẬP ...................................................................... 54
5.7. BÁO CÁO KẾT QUẢ PHÂN TÍCH ........................................... 55 BÀI THỰC HÀNH SỐ 6
KHỬ CỨNG BẰNG TRAO ĐỔI ION ................................................. 56
6.1. TỔNG QUAN .............................................................................. 56
6.2. DỤNG CỤ - THIẾT BỊ ................................................................ 58
6.3. HÓA CHẤT ................................................................................. 58
6.4. THỰC NGHIỆM ......................................................................... 59
6.4.1. TN 1: Nh a cationit để là
m mềm nƣớc theo mẻ .................. 59
6.4.2. TN 2: Nh a cationit để làm mềm nƣớc theo thời gian ......... 59
6.4.3. TN 3: Nh a cationit để làm mềm nƣớc liên tục ................... 59
6.5. XỬ LÝ SỐ LIỆU ......................................................................... 60
6.6. CÂU HỎI ÔN TẬP ...................................................................... 60
6.7. BÁO CÁO KẾT QUẢ PHÂN TÍCH ........................................... 61
BÀI THỰC HÀNH SỐ 7
KHỬ TRÙNG ........................................................................................ 62
7.1. TỔNG QUAN .............................................................................. 62
7.1.1. Kh trùng là g ? .................................................................... 62
7.1.2. Kh trùng nƣớc bằng Clo và các hợp chất của nó ............... 63
7.1.3. Kh trùng nƣớc bằng tia UV ................................................ 65
7.2. DỤNG CỤ - THIẾT BỊ ................................................................ 66
7.3. HÓA CHẤT ................................................................................. 66 8 7.4.1. TN 1: Kh t
rùng bằng hóa chất NaOCl ............................... 69 7.4.2. TN 2: Kh t
rùng bằng mô hình ............................................ 70 7.4.3. TN 3: Kh t
rùng bằng UV ................................................... 70
7.5. XỬ LÝ SỐ LIỆU ......................................................................... 71
7.6. CÂU HỎI ÔN TẬP ...................................................................... 71
7.7. BÁO CÁO KẾT QUẢ PHÂN TÍCH ........................................... 71
PHỤ LỤC 1 ............................................................................................. 72
PHỤ LỤC 2 ............................................................................................. 82
TÀI LIỆU THAM KHẢO ....................................................................... 83 9
CÁC KÝ HIỆU VÀ ĐƠN VỊ Ký hiệu Nội dung Tiếng Anh Đơn vị DO Oxy hòa tan Dissolved oxygen mg/L EBCT
Thời gian tiếp xúc
Empty bed contact time phút MPN
Số lượng Vi sinh vật Most potable number QCVN Quy chuẩn Việt Nam Q Lưu lượng Flowrate L/h SS
Chất rắn lơ lửng Suspended solid mg/L TFe
Nồng độ sắt tổng mg/L TN Thí nghiệm UV
Bức xạ tử ngoại Ultra violet V Thể tích Volume L 10 MỞ ĐẦU 1. Mục đích thí nghiệm
- Giúp sinh viên làm quen với các kỹ năng cần thiết của người kỹ sư tương lai.
- Công nghệ xử lý, thiết bị xử nước cấp.
- Vận hành các thiết bị xử lý nước cấp
- Điều hành một nhóm sinh viên cùng thực hiện 1 công việc.
- Luyện tập khả năng viết một báo cáo kỹ thuật.
2. Yêu cầu trước thí nghiệm
Sinh viên phải đọc bài hướng dẫn thí nghiệm, tham khảo tài liệu
liên quan để tìm hiểu các kiến thức cần thiết cho bài thí nghiệm. Xem
thiết bị để hiểu cách tiến hành thí nghiệm, vạch kế hoạch làm việc và phân công trong nhóm.
3. Yêu cầu khi làm thí nghiệm
Sau mỗi bài thí nghiệm mỗi nhóm sinh viên phải làm một bản báo
cáo kết quả thu được. Tổng hợp tất cả các bản báo cáo thành một tập và
nộp lại cho giáo viên sau khi học xong 7 bài thí nghiệm. 4. Nội dung
- Trình bày yêu cầu, nội dung tóm tắt và kết quả của bài thí nghiệm
- Lý thuyết liên quan đến bài thí nghiệm
- Thực hiện: trình bày các bước thí nghiệm và số liệu thô.
- Kết quả tính toán, nhận xét kết quả thu được. - Tài liệu tham khảo. 11 BÀI THỰC HÀNH SỐ 1
KEO TỤ - TẠO BÔNG BẰNG PHÈN NHÔM
Mục tiêu bài thực hành số 1: Sau khi học xong bài này, sinh viên có khả năng:
Trình bày được cơ chế của phương pháp keo tụ tạo bông.
Giải thích được các yếu tố ảnh hưởng đến quá trình keo tụ tạo bông.
Xác định được giá trị pH tối ưu của quá trình keo tụ tạo bông.
Xác định được liều lượng phèn tối ưu của quá trình keo tụ tạo bông.
Vận hành được bể keo tụ tạo bông kết hợp lắng Lamella. 1.1. TỔNG QUAN
Xử lý bằng phương pháp keo tụ tạo bông bằng phèn nhôm là cho
vào trong nước một lượng chất keo tụ (phèn nhôm) đủ làm cho các hạt
keo trong nước mặt (hạt keo đất sét, các hợp chất humic tạo độ màu với
kích thước bé) mất tính ổn định và kết bông thành những hạt lớn có khả
năng lắng xuống. Thông thường quá trình keo tụ tạo bông xảy ra qua hai giai đoạn sau:
Giai đoạn 1 – Giai đoạn keo tụ làm mất tính ổn định của hạt keo
trong nước. Phèn nhôm thuỷ phân tạo thành các hạt keo mang điện
tích dương, hình thành quá trình hấp phụ và trung hòa điện tích làm
mất tính ổn định của hạt keo trong nước ở pH thấp hoặc sẽ tạo thành
kết tủa Al(OH)3 để có thể kết tụ quét kéo theo các hạt keo trong nước cùng lắng.
Giai đoạn 2 – Giai đoạn tạo bông, kết bông các bông tụ nhỏ bị
mất tính ổn định thành những bông tụ lớn có khả năng lắng được bằng trọng lực.
Kết quả của quá trình trên là hình thành các hạt lớn lắng xuống. 12
Để thực hiện quá trình keo tụ, người ta cho vào nước các chất keo
tụ thích hợp như phèn nhôm Al2(SO4)3, phèn sắt FeSO4 hoặc FeCl3. Các
loại phèn này được đưa vào nước dưới dạng dung dịch hòa tan.
Khi cho phèn nhôm vào nước, chúng phân ly thành các sản phẩm
thủy phân, sau đó, các ion này bị thuỷ phân thành Al(OH)3 với pH thích hợp: Al(H 3+ 2+ 7+ 2O)6
⇔ Al(OH)(H2O)5 ⇔ …. ⇔ Al13O4(OH)24 ⇔ Al(OH) - 3 (s) ⇔ Al(OH)4
Trong phản ứng thuỷ phân trên, ngoài các sản phẩm thủy phân
(nhân tố quyết định đến hiệu quả keo tụ) được tạo thành, các ion H+ còn
giải phóng ra. Các ion này sẽ được khử bằng độ kiềm tự nhiên của nước
(được đánh giá bằng HCO -
3 ). Trường hợp độ kiềm tự nhiên của nước
thấp, không đủ để trung hòa ion H+ thì cần phải kiềm hóa nước. Chất
dùng để kiềm hóa thông dụng là vôi. Một số trường hợp khác có thể dùng
soda (Na2CO3) hay xút (NaOH).
Sau đây là các yếu tố chính ảnh hưởng đến quá trình keo tụ tạo
bông khi sử dụng phèn nhôm:
1.1.1. Trị số pH của nước
Nước thiên nhiên sau khi đã cho Al2(SO4)3 vào, trị số pH của nó bị
giảm thấp vì đây là một loại muối gồm axit mạnh và bazơ yếu. Sự thuỷ
phân của nó có thể tăng thêm tính axit của nước. Đối với hiệu quả keo tụ,
ảnh hưởng chủ yếu là trị số pH của nước sau khi cho phèn vào. Cho nên
giá trị pH dưới đây đều là pH của nước sau khi cho phèn vào.
1.1.2. Lượng dùng chất keo tụ
Quá trình keo tụ không phải là một phản ứng hóa học đơn thuần,
nên lượng phèn cho vào không thể căn cứ vào tính toán để xác định. Tuỳ
điều kiện cụ thể khác nhau, phải làm thực nghiệm Jartest để tìm ra lượng phèn cho vào tối ưu.
Nói chung nếu huyền phù trong nước nhiều thì lượng chất keo tụ
cần thiết lớn. Cũng có trường hợp chất hữu cơ trong nước tương đối ít mà
lượng chất keo tụ vẫn cần nhiều. 13
Bảng 1.1: Liều lượng phèn để xử lý nước cấp Hàm lượng cặn, mg/L
Liều lượng phèn không chứa nước (mg/L) < 100 25 – 35 101 – 200 30 – 40 201 – 400 35 – 45 401 – 600 45 – 50 601 – 800 50 – 60 801 – 1000 60 – 70 1001 – 1500 70 – 80 1.1.3. Nhiệt độ nước
Khi dùng muối nhôm làm chất keo tụ, nhiệt độ nước ảnh hưởng lớn
đến hiệu quả keo tụ. Khi nhiệt độ nước rất thấp (thấp hơn 50C), bông
phèn sinh ra to và xốp, chủ yếu là nước, lắng xuống rất chậm nên hiệu quả kém.
Khi dùng nhôm sunfat để tiến hành keo tụ nước thiên nhiên, nhiệt
độ nước tốt nhất là 25 – 300C.
1.1.4. Tốc độ hỗn hợp của nước với chất keo tụ
Tốc độ hỗn hợp của nước và chất keo tụ ảnh hưởng đến tính phân
bổ đồng đều của chất keo tụ và cơ hội va chạm giữa các hạt keo. Đây là
một yếu tố quan trọng ảnh hưởng đến quá trình keo tụ tạo bông. Tốc độ
khuấy tốt nhất là từ nhanh chuyển sang chậm. Khi mới cho chất keo tụ
vào nước, phải khuấy nhanh, vì sự thuỷ phân của chất keo tụ trong nước
và tốc độ hình thành keo rất nhanh. Cho nên phải khuấy nhanh để chất
keo tụ khuếch tán đến các nơi trong nước để kịp thời tác dụng với các tạp
chất trong nước. Sau khi hỗn hợp hình thành bông tụ nhỏ và lớn lên,
không nên khuấy quá nhanh, vì không những bông phèn khó lớn lên mà
còn phá vỡ những bông phèn đã hình thành.
Rất nhiều nhân tố ảnh hưởng đến hiệu quả keo tụ. Để tìm ra điều
kiện tối ưu để xử lý bằng keo tụ khi thiết kế thiết bị hoặc điều chỉnh vận 14
hành thì nên tiến hành thí nghiệm ở phòng thí nghiệm bằng thiết bị Jartest.
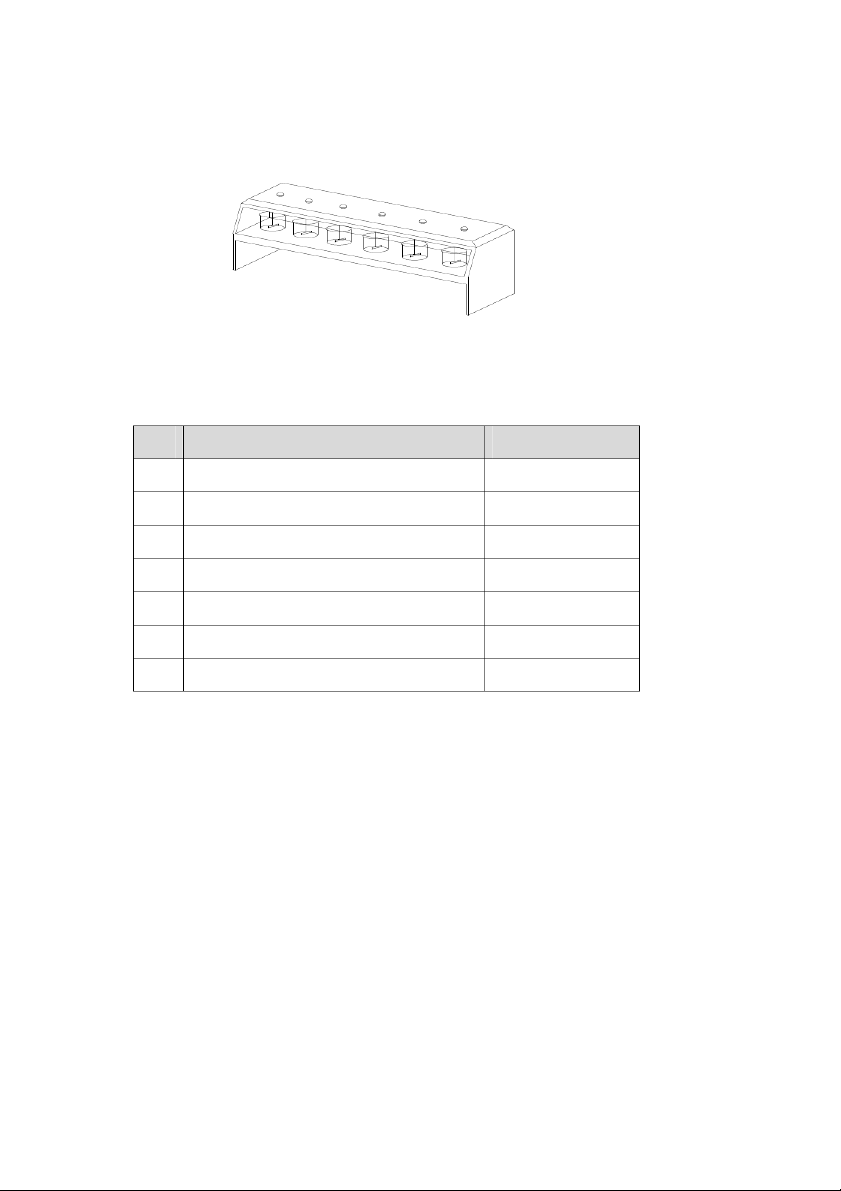
Hình 1.1: Mô hình thí nghiệm Jartest
1.2. DỤNG CỤ - THIẾT BỊ
Bảng 1.2: Danh sách dụng cụ và thiết bị cần dùng STT Dụng cụ Số lượng 1 Erlen 125 mL 10 2 Pipet: 5 mL, 10 mL 03 3 Bóp cao su 02 4 Cốc 500 mL 06 5 Máy Jartest 01 6 pH kế 01 7 Thiết bị đo độ đục 01 1.3. HÓA CHẤT - Phèn nhôm Al2(SO4)3 - NaOH 0,1N, H2SO4 0,1N 1.4. THỰC NGHIỆM
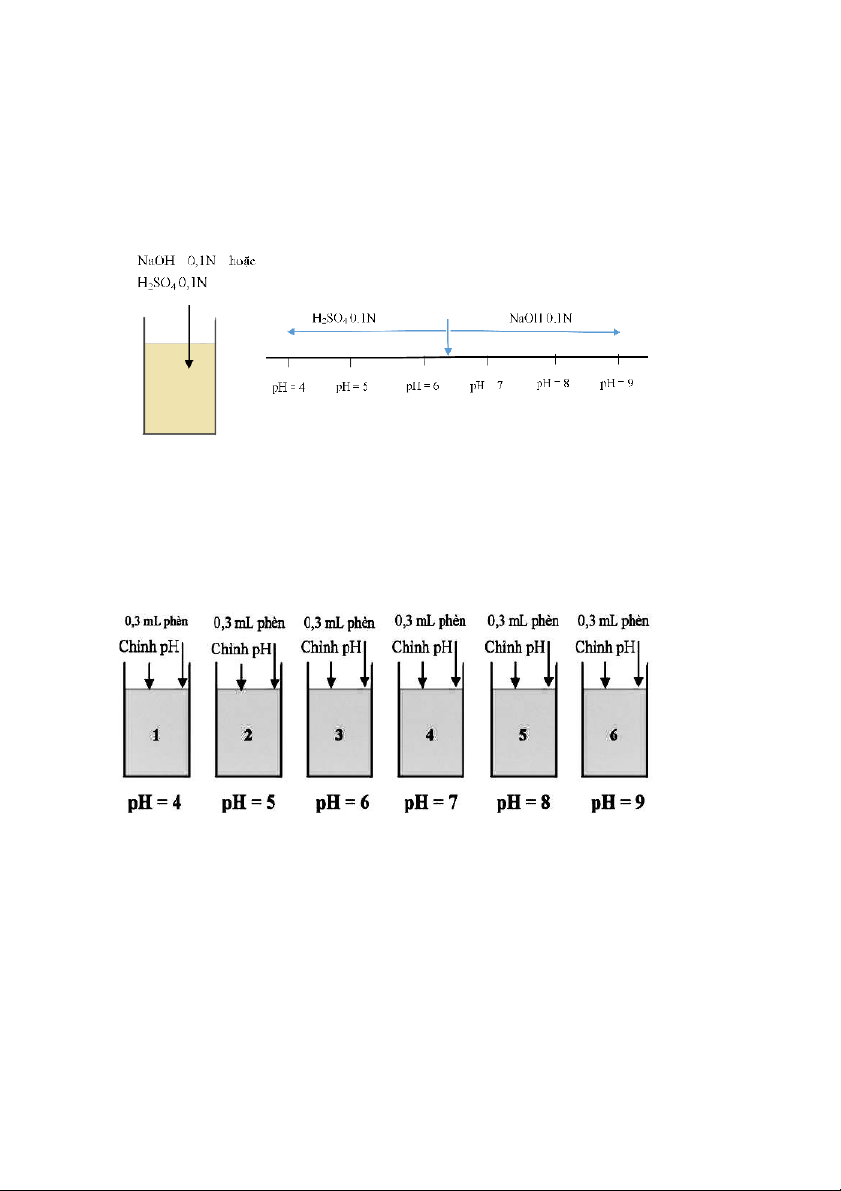
1.4.1. TN 1: Xác định giá trị pH tối ưu.
Bước 1: Định lượng hóa chất điều chỉnh pH
- Lấy 400 mL mẫu nước có độ đục cho vào mỗi cốc Jartest (sử
dụng 2 cốc: 1 cốc điều chỉnh pH tăng, 1 cốc điều chỉnh pH giảm). Đo pH ban đầu. 15
- Cho vào cốc 0,3 mL phèn để nồng độ phèn trong dung dịch đạt 30 mg/L.
- Dùng dung dịch NaOH 0,1N hoặc H2SO4 0,1N điều chỉnh pH đến
các giá trị 4, 5, 6, 7, 8, 9. Ghi nhận giá trị NaOH và H2SO4 đã dùng.
Bước 2: Keo tụ - tạo bông
- Chuẩn bị cốc Jartest, cho vào mỗi cốc 400 mL mẫu nước. 6
- Thêm vào mỗi cốc 0,3 mL phèn và các thể tích NaOH và H2SO4
(đã xác định ở bước 1) vào cùng lúc để 6 cốc đạt giá trị pH tương ứng là 4, 5, 6, 7, 8, 9.
- Đưa 6 cốc vào giàn Jartest, bật máy khuấy ở tốc độ 100 vòng/phút trong 1 phút.
- Điều chỉnh vòng khuấy chậm lại trong 15 phút ở tốc độ 15 – 20 vòng/ phút.
- Sau khi máy tắt, để lắng tĩnh 30 phút. 16 Bước 3: Phân tích mẫu
- Lấy mẫu nước lắng (lớp nước ở phía trên, lấy dưới lớp váng bề
mặt) của tất cả các cốc đem phân tích chỉ tiêu pH, độ đục.
Lưu ý: pH tối ưu là pH ứng với mẫu có độ đục thấp nhất.
1.4.2. TN 2: Xác định liều lượng phèn tối ưu
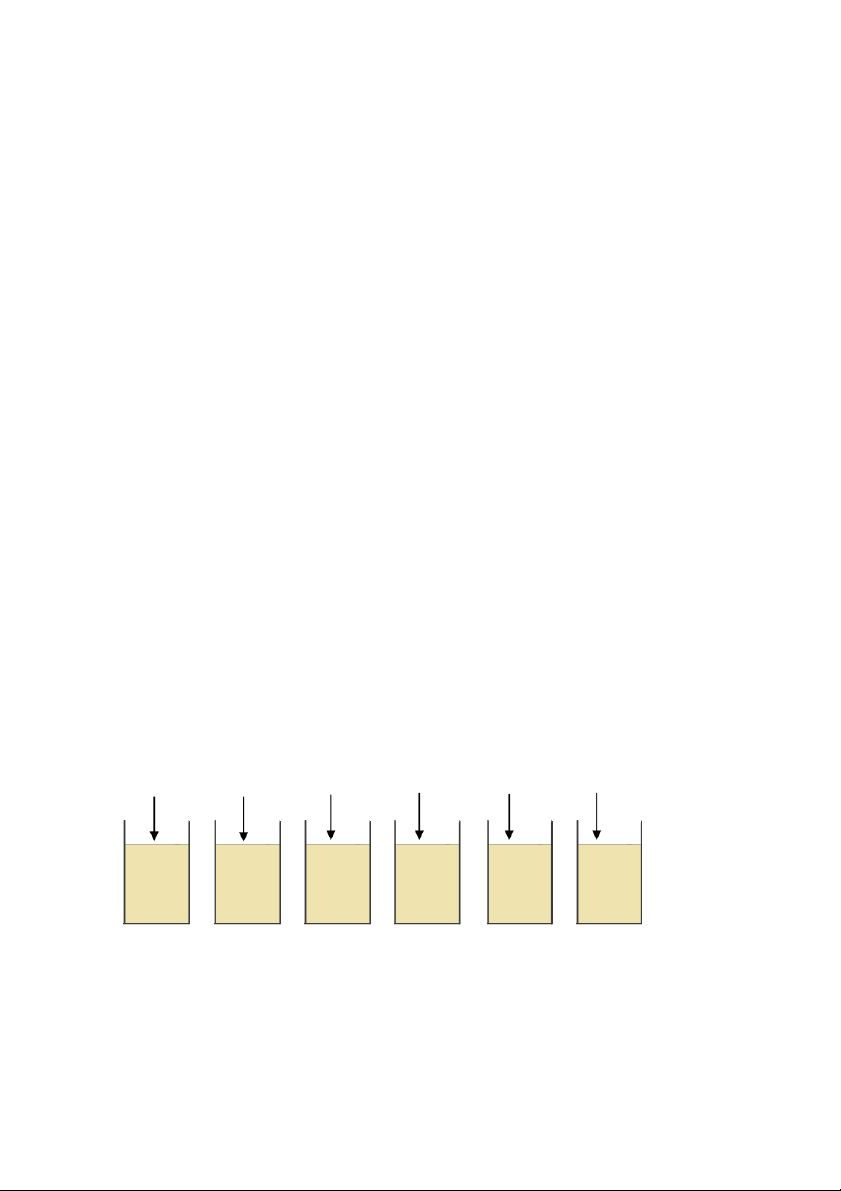
Bước 1: Định lượng hóa chất điều chỉnh pH ứng với các lượng phèn khác nhau
- Lấy 6 cốc Jartest cho vào 400 mL mẫu nước và cho vào lượng
phèn lần lượt là: 0,1; 0,2; 0,3; 0,4; 0,5 và 0,6 mL.
- Dùng dung dịch NaOH 0,1N hoặc H2SO4 0,1N điều chỉnh pH đến
các giá trị pH tối ưu (pH tối ưu đã xác định từ thí nghiệm ), 1 ghi nhận
các thể tích hóa chất điều chỉnh để tiến hành bước 2.
Bước 2: Thí nghiệm lượng phèn thay đổi
- Lấy 6 cốc Jartest cho vào 400 mL mẫu nước.
- Cho vào các lượng phèn xác định ở bước 1 và hóa chất (axit hoặc
kiềm để đạt pH tối ưu ứng với các liều lượng phèn khác nhau) cùng lúc.
- Đặt các cốc vào thiết bị Jartest, điều chỉnh tốc độ khuấy 100 vòng/phút trong 1 phút.
- Điều chỉnh vòng khuấy chậm lại trong 15 phút ở tốc độ 15 – 20 vòng/ phút.
- Sau khi máy tắt, để lắng tĩnh 30 phút. Chỉnh pH Chỉnh pH Chỉnh pH Chỉnh pH Chỉnh pH Chỉnh pH 1 2 3 4 5 6 0,1 mL 0,2 mL 0,3 mL 0,4 mL 0,5 mL 0,6 mL 17




