










Preview text:
lOMoARcPSD|61096548
File tổng hợp công thức cuối kì
Hoá Đại Cương (Đại học Bách khoa Tphcm)

Mục lục
- Hiệu ứng nhiệt ............................................................................................................................................. 68
- Entropy và thế đẳng áp ................................................................................................................................ 70
- Entropy ...................................................................................................................................................... 70
- Thế đẳng áp ............................................................................................................................................... 70
3.Cân bằng hóa học ............................................................................................................................................. 71
- Hằng số cân bằng ...................................................................................................................................... 71
- Hằng số cân bằng và các đại lượng nhiệt động ......................................................................................... 72 a. Quan hệ giữa hằng số cân bằng và độ thay đổi thế đẳng áp .................................................................... 72
b. Quan hệ của hằng số cân bằng với nhiệt độ và nhiệt phản ứng............................................................... 72
- Động hóa học (tốc độ phản ứng hóa học) ....................................................................................................... 72
- Biểu thức tính tốc độc phản ứng ............................................................................................................... 72
- Biểu thức ảnh hưởng ảnh hưởng của nhiệt độ tới tốc độ phản ứng ........................................................... 73
- Dung dịch lỏng ................................................................................................................................................ 73
- Các loại nồng độ ........................................................................................................................................ 73
- Áp suất hơi bão hòa ................................................................................................................................... 74
- Nhiệt độ sôi và nhiệt độ đông đặc ............................................................................................................. 74
5.3 Áp suất thẩm thấu .................................................................................................................................. 74
- Dung dịch điện ly ............................................................................................................................................ 75
- Sự khác biệt giữa dung dịch phân tử và dung dịch điện ly ....................................................................... 75
- Độ điện ly và hằng số điện ly .................................................................................................................... 75 a, Độ điện ly ................................................................................................................................................ 75 b/Hằng số điện ly: ....................................................................................................................................... 75 7. Độ PH .............................................................................................................................................................. 76
1. Hiệu ứng nhiệt
Khi cung cấp cho hệ một lượng nhiệt Q thì lượng nhiệt này dùng làm tăng nội năng U của hệ và giúp hệ thực hiện một công A chống lại các lực bên ngoài tác động lên hệ.
Biểu thức toán học: Q = ΔU + A
Lưu ý, trong môn học này các quá trình hóa học công A thường là công dãn nở
Với : A = ∫ PdV
Quá trình đẳng tích (V= 0) | Công dãn nở A = 0 | QV = U |
Quá trình đẳng áp | Công dãn nở A = P.V | Qp = U + P.V |
Quá trình đẳng nhiêt (Chỉ xét ở hệ khí lý tưởng, số mol khi không đổi) | Công dãn nở A = nRTln V2=nRTln P1 V1 P2 | QT = U + P.V |
Điều kiện đẳng áp, đẳng nhiệt và khí lý tưởng | Công dãn nở : A = Png.∆V =Pk.∆V= ∆n.RT ∆n = tổng số mol khí của sản phẩm - tổng số mol khí chất đầu.
| Q = U+∆n.RT |
Với R = 1,987cal/mol.K = 8,314 J/mol.K
Công thức tính hiệu ứng nhiệt
H = U + PV
Trong quá trình đẳng tích H =U * Quan hệ giữa ΔH và ΔU :
- Trong các phản ứng chỉ có chất lỏng và chất rắn tham gia hoặc phản ứng xảy ra ở trạng thái dung dịch thì V có giá trị không đáng kể. Do đó khi quá trình này được thực hiện ở áp suất thấp (áp suất khí quyển) thì PV ≈ 0 nên H ≈ U.
- Trong các phản ứng có sự tham gia của pha khí, giả sử khí lý tưởng, ta có: PV = nRT
Suy ra : PV =n.RT (Điều kiện đẳng nhiệt , đẳng áp )
Nên: H = U +n.RT
Với: { n = ∑n khí (SẢN PHẨM) -∑n khí (CHẤT ĐẦU) }
R = 1,987cal/mol.K = 8,314 J/mol.K
Khi n = 0 => H =U
Đơn vị R = 1,987cal/mol.K = 8,314 J/mol.K
Quan hệ giữa hiệu ứng nhiệt đẳng tích và hiệu ứng nhiệt đẳng áp:
- Qv = Hv = Uv
- Qp = Hp = Up + P. V
Ta có: Qp – Qv ≈ Hp – Hv ≈ P. V ≈ n.RT
Các hệ quả cần nắm
Hệ quả 1: Hiệu ứng nhiệt của phản ứng thuận có độ lớn bằng hiệu ứng nhiệt của phản ứng nghịch nhưng ngược dấu Hệ quả 2: Không thi
Hệ quả 3: Hiệu ứng nhiệt của phản ứng bằng tổng nhiệt tạo thành của các sản phẩm trừ đi tổng nhiệt tạo thành của các chất đầu. aA + bB = cC + dD ; ∆H°pư
∆H°pư = [c∆H°tt (C) + d∆H°tt (D)] – [a∆H°tt (A) + b∆H°tt (B)]
Hệ quả 4: Hiệu ứng nhiệt của phản ứng bằng tổng nhiệt đốt cháy của các chất đầu trừ đi tổng đốt cháy của các sản phẩm phản ứng aA + bB = cC + dD ; ∆H°pư
∆H°pư = [a∆H°đc (A) + b∆H°đc (B)] – [c∆H°đc (C) + d∆H°đc(D)]
Hệ quả 5: Hiệu ứng nhiệt của phản ứng bằng tổng năng lượng liên kết của chất đầu trừ đi tổng năng lượng liên kết của sản phẩm.
Hiệu ứng nhiệt của phản ứng bằng tổng năng lượng liên kết bị đứt (của chất đầu) trừ đi tổng năng lượng liên kết ráp (của sản phẩm)
- Entropy và thế đẳng áp
2.1 Entropy
Hệ thức Boltzmann :S = kln(w) = R ln(W)
NA
Trong đó: k - hằng số Boltzmann
R - hằng số khí ( 8,314 J/mol.độ hay 1,987 cal/mol.độ) NA - số Avogadro
Trong phản ứng hóa học
aA + bB = cC + dD
∆S0298 = (cS0298 (C) + dS0298 (D)) - ( aS0298 (A) + bS0298 (B) )
2.2 Thế đẳng áp
Phương trình cơ bản của nhiệt động hóa học : ∆G = ∆H - T∆S
Ở điều kiện chuẩn, nhiệt độ T phương trình có dạng là : ∆G0T = ∆H0T - T∆S0T
Các định luật quan trọng Theo định luật Hess:
Phản ứng hóa học : aA + bB = cC + dD
∆G2980 (pư) = c. ∆G2980 ttC + d. ∆G2980 ttD − a. ∆G2980 ttA − b. ∆G2980 ttB Theo phương trình cơ bản của nhiệt động học:
Ở nhiệt độ 298K ∆G0298(pư) = ∆H0298(pư) – 298.∆S0298(pư )
Ở nhiệt độ T 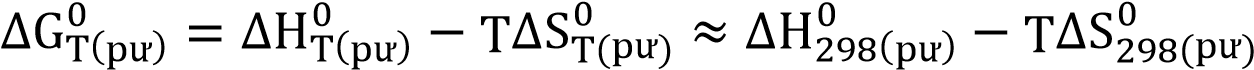
Theo hằng số cân bằng: | |
Ở nhiệt độ 298K | ∆G0298(pư) = -RTlnKcb(T) = - R.298.lnK298 |
Ở nhiệt độ T | ∆GT0(pư) = −RTlnKcb(T) |
Đơn vị R = 1,987cal/mol.K = 8,314 J/mol.K Theo chu trình nhiệt động:
Ví dụ: tính ∆G01 của phản ứng A → B
Cho biết : A → C ∶ ∆G20vàC → B ∶ ∆G30
Ta suy ra: : ∆G10 =: ∆G20+: ∆G30
3.Cân bằng hóa học
3.1 Hằng số cân bằng
Xét phản ứng đồng thể đơn giản tổng quát: aA + bB ⇄ cC + dD
KC = kknt = C CC CaCcA dDbB (KC và KP chỉ phụ thuộc nhiệt độ)
Với kt, kn là hằng số tốc độ của phản ứng thuận và phản ứng nghịch.
Trường hợp cân bằng được thiết lập giữa các chất khí, ta có thể thay nồng độ các chất bằng áp suất riêng phần của các chất đó trong biểu thức tính hằng số cân bằng:
Kp =C CC CacCA dDbB (RT)(c d) (a b+ − + )
=> Kp = Kc (RT)∆n Trong đó: Δn = ∑n khí(sản phẩm) - ∑n khí(chất đầu)
Và R = 0,082 L.atm/mol.K
=> Khi Δn = 0 ( phản ứng không có chất khí hoặc số mol khí không đổi) thì Kp = Kc
3.2 Hằng số cân bằng và các đại lượng nhiệt động
a. Quan hệ giữa hằng số cân bằng và độ thay đổi thế đẳng áp Đối với phản ứng thuận nghịch: aA + bB ⇄ cC + dD
- Nếu phản ứng diễn ra trong pha khí: ΔGT = ΔGT0 + RTln p pp pac dC DA Bb (ở mọi thời điểm τ)
∆GT0 = −RTln (PPaAcCPPDdbB)cb = −RTlnKP
- Nếu phản ứng diễn ra trong pha dung dịch:
ΔG0 =−RTlnCCacCACCdDbB cb =−RTlnKC T
b. Quan hệ của hằng số cân bằng với nhiệt độ và nhiệt phản ứng
K2 ∆H0 1 1
ln = ( − ) K1 R T1 T2
- Động hóa học (tốc độ phản ứng hóa học)
4.1 Biểu thức tính tốc độc phản ứng
* Tốc độ phản ứng
- Tốc độ trung bình : v =C t dC
- Tốc độ tức thời : v =
dt
ở đây : nếu C là nồng độ của chất phản ứng thì lấy dấu – nếu C là nồng độ của sản phẩm thì lấy dấu +
Đối với phản ứng tổng quát: aA + bB = cC + dD
Biểu thức toán học của định luật tác dụng khối lượng có dạng: v kC C= A Bn m
- v : tốc độ tức thời của phản ứng ở thời điểm xác định.
- CA, CB : nồng độ tức thời của các chất A và B ở thời điểm đó.
- k : hằng số tốc độ, phụ thuộc vào bản chất của phản ứng và nhiệt độ.
- n, m : số mũ. Đối với phản ứng đơn giản: n = a, m = b.
Đối với phản ứng phức tạp: n a, m b. n + m = bậc phản ứng.
4.2 Biểu thức ảnh hưởng ảnh hưởng của nhiệt độ tới tốc độ phản ứng
* Quy tắc thực nghiệm của Van’t Hoff
Khi tăng nhiệt độ thêm 100C, tốc độ phản ứng tăng lên từ 2 tới 4 lần.
kkT+T10 24
= =
- γ : hệ số nhiệt độ (là số lần tăng lên của tốc độ phản ứng mỗi khi tăng 100C).
- k : hằng số tốc độ.
n kT+10n
Tổng quát: =
kT
- Dung dịch lỏng
- Các loại nồng độ
Loại nồng độ | Kýhiệu | Ý nghĩa và đơn vị | Công thức tính |
Nồng độ phần trăm khối lượng | C% | số g chất tan trong 100g dd (%)
| m .100% C% = ct mdd |
Nồng độ phân tử gam/l (nồng độ mol/l) | CM | số mol chất tan trong 1 lit dung dịch (M = mol/l) (bài toán áp suất thẩm thấu) | n CM = ct Vdd () |
Nồng độ molan | Cm | số mol chất tan trong 1000g dung môi nguyên chất (m = mol/kg) (bài toán tính độ tăng nhiệt độ sôi và độ giảm nhiệt độ đông đặc) | n .1000 Cm = ct mdm |
Nồng độ phần mol | N | tỷ lệ số mol 1 cấu tử trên tổng số mol tất cả các cấu tử. (bài toán áp suất hơi của dung dịch, độ giảm áp suất khi hòa tan chất tan vào dung dịch) | Ni =ni n |
Nồng độ đương lượng gam/l | CN | số đương lượng gam chất tan trong 1 lit dung dịch (N = đlg/l) | sô CN = Đ V |
- Áp suất hơi bão hòa
𝑃1 = 𝑃0. 𝑁 Với : P0: P hơi bão hòa dung môi nguyên chất.
P1: P hơi bão hòa dung dịch
N1: nồng độ phần mol của dung môi trong dd.
N2: nồng độ phần mol của chất tan trong dd.
→ 𝑁2 = (𝑃0𝑃−0𝑃1) = ∆𝑃𝑃𝑜
- Nhiệt độ sôi và nhiệt độ đông đặc
- ∆𝑇𝑠 = 𝐾𝑠𝐶𝑚
- ∆𝑇đđ = 𝐾đ𝐶𝑚 Với:
- Ts và Tđ – độ tăng nhiệt độ sôi và độ giảm nhiệt độ đông đặc
- Ks và Kđ – hằng số nghiệm sôi và hằng số nghiệm đông của dung môi (phụ thuộc vào bản chất của dung môi)
- Cm – nồng độ molan của chất tan trong dung dịch
- Nhiệt độ sôi và nhiệt độ đông đặc
5.3 Áp suất thẩm thấu
𝜋 = 𝐶𝑀𝑅𝑇
Trong đó: - áp suất thẩm thấu
CM – nồng độ mol của dung dịch
R=0.082
- Dung dịch điện ly
- Sự khác biệt giữa dung dịch phân tử và dung dịch điện ly
Độ giảm áp suất hơi bão hòa | ∆𝑃′ = 𝑖∆𝑃 = 𝑖𝑃𝑜. 𝑁2 |
Độ tăng nhiệt độ sôi | ∆𝑇𝑠′ = 𝑖∆𝑇𝑠 = 𝑖𝐾đ𝐶𝑚 |
Độ giảm nhiệt độ đông đặc | ∆𝑇đ′đ = 𝑖∆𝑇𝑠 = 𝑖𝐾𝑠𝐶𝑚 |
Áp suất thẩm thấu | 𝜋′ = 𝑖𝜋 = 𝑖𝐶𝑀𝑅𝑇
|
o P, T, - tính theo công thức dung dịch điện ly chất khó tan và không bay hơi o P’, T’, ’ – Áp dụng cho dung dịch điện ly i – Gọi là hệ số đăng trương hay hệ số Van’t Hoff, Về ý nghĩa i chính là số lần tăng lên của tổng nồng độ các tiểu phân chất tan (phân tử và ion) so với nồng độ phân tử chất tan. | |
- Độ điện ly và hằng số điện ly a, Độ điện ly
𝛼 = 𝑛 = 𝑆ố𝑚𝑜𝑙𝑝ℎâ𝑛𝑡ửđ𝑖ệ𝑛𝑙𝑦
𝑛0 𝑆ố𝑚𝑜𝑙𝑝ℎâ𝑛𝑠ử𝑏𝑎𝑛đầ𝑢
Quan hệ giữa độ điện ly và hệ số đẳng trương
AmBn ⇄ mAn+ + nBm-
𝑖 − 1
𝛼 =
𝑞 − 1
o q = m + n (tổng số ion do một phân tử điện ly) o : độ điện ly biểu kiến.
b/Hằng số điện ly:
AB ⇄ A+ + B-
Ban đầu: C0
Điện ly: C0 C0 C0
Cân bằng: C0(1 - ) C0 C0 Khi đạt cân bằng hằng số cân bằng chính là hằng số điện ly:
C CA+ . B− (C0)2
KAB = =
CAB C0 (1−)
Đối với chất điện ly yếu ( << 1) thì (1 - ) 1, do đó:
=> 𝐾 = 𝐶0𝛼2<=> K
C0
7. Độ PH
Công thức chung dùng để tính pH của dung dịch là:
- 𝒑𝑯 =−𝒍𝒐𝒈[𝑯+]
- [𝑯+] = 𝟏𝟎−𝒑𝑯
Công thức chung dùng để tính 𝒑𝑶𝑯− của dung dịch là:
- 𝒑𝑶𝑯− =−𝒍𝒐𝒈[𝑶𝑯−]
- [𝑶𝑯−] = 𝟏𝟎−𝒑𝑶𝑯−
Mối liên hệ giữa 𝒑𝑯 và 𝒑𝑶𝑯− là 𝒑𝑯 + 𝒑𝑶𝑯−=14
HCMUT CNCP HÓA ĐẠI CƯƠNG NGUYỄN QUỐC VƯƠNG

XEM TÀI LIỆU TẠI BACHKHOACNCP.COM KHÓA HỌC ONLINE GIẢI TÍCH 1 77




