





Preview text:
2/18/2019 Alkali Metals Noble Gases Alkaline Earths Halogens Main Group HIĐRO NƯỚC Transition Metals Main Group Lanthanides and Actinides 1 2 HIĐRO 3 4
Department of Inorganic Chemistry - HUT 1 2/18/2019
Main article: Isotopes of hydrogen
1. H – e = H+ ∆Ho = 1312 kJ/mol iso NA half-life DM DE (MeV) DP 2. H + e = H- ∆Ho = -67 kJ/mol 1H 99.985% H is stable with 0 neutrons
3. Tạo nên cặp e chung cho liên kết cộng hóa trị 2H 0.0115% H is stable with 1 neutrons 3H trace 12.32 y β− 0.019 3He
H giống halogen về khả năng nhận e thành ion H- và có đặc điểm: Historical information
-Ái lực e của H bằng gần 1/5 so với ái lực e của halogen. Discovered by: Henry Cavendish (1731-1810)
-Ion H- có cấu trúc e của He (1s2) Discovered at: London, England
-Ion H- tự do có khả năng tồn tại trong hidrua muối như KH, CaH2 Discovered when: 1766 Origin of name:
From the Greek words "hydro" and "genes" meaning "water" and "generator"
H giống kim loại kiềm về khả năng mất e thành cation nhưng khác ở:
-Năng lượng ion hóa lớn gấp vài ba lần so với kim loại kiềm.
-Proton bé hơn nhiều so với nguyên tử (1.6-1.7.10-5 Å << 1.2 Å) và mang điện tích dương làm nhiễu loạn
đám mây e của các nguyên tử xung quanh.
-Proton không thể tồn tại một mình mà luôn kết hợp với nguyên tử hay phân tử khác, H3O+
H có vị trí đặc biệt trong bảng hệ thống tuần hoàn các nguyên tố hóa học
H vừa giống-khác với các kim loại kiềm và halogen
H có đặc điểm mà những nguyên tố khác không có (do bản chất của proton và không
có e chắn điện tích hạt nhân) như tạo liên kết hidro, cầu hidro và hợp chất không5 hợp 6 thức với kim loại)
Department of Inorganic Chemistry - HUT TÝnh chÊt lý häc Tính chất hoá học
- Hydro tồn tại dưới dạng phân tử H2. - Phân tử H
- Là chất khí không màu, không mùi, không vị và
2 có cấu hình electron giống nguyên tử nhẹ, dẫn nhiệt tốt.
He, nên rất bền, chỉ bắt đầu phân huỷ thành
nguyên tử H ở nhiệt độ 2000K theo phản ứng sau:
- Phân tử hydro có độ bền cao, độ phân cực bằng
0, có kích thước và khối lượng không đáng kể nên H (K) ⇆ 2H; Ho = 436KJ.mol-1 2
có nhiệt độ nóng chảy và nhiệt độ sôi rất thấp Tnc = -259,1oC và T
- Do đó ở nhiệt độ thường rất kém hoạt động hoá
s = -252,6oC. Do đó nó rất khó tan
trong nước và các dung môi hữu cơ (1 lít nước ở
học, trừ một số trường hợp khi có mặt xúc tác.
0oC chỉ hoà tan được 21,5 ml H2
- Hydro thể hiện cả tính khử và tính oxy hoá, tính
khử của hydro đặc trưng hơn H2 7 8 2 2/18/2019
Ở nhiệt độ cao, hidro có thể chiếm oxi của nhiều hợp chất, đa số là oxit kim loại Tính khử của hydro
- Ở nhiệt độ thường hydro chỉ phản ứng với Flo
CuO(r) H (k) Cu(r) H O(k) H 2 2
2 + F2 = 2HF mãnh liệt ở nhiệt độ thấp
Fe O (r) 4H (k) 3Fe(r) 4H O(k) 3 4 2 2
- Ở nhiệt độ cao hydro phản ứng với nhiều chất
- Phản ứng 1 có thể dùng để định lượng hidro, để điều chế một số kim loại 2H 2(K) + O2(K) 2H2O(L) Ho = - 285,84 KJ.mol-1 như Ni, Fe, W. 2H 2(K) + O2(K) 2H2O(K)
- Khi có Pt làm xúc tác, hidro có thể khử nhiều hợp chất hữu cơ tan trong
các dung môi hữu cơ như: khử hợp chất không no thành hợp chất no, khử andehit thành rượu. H2 HCl CuO Zn 9 10
Department of Inorganic Chemistry - HUT
- Phản ứng của hydro với các phi kim khác Tính oxy hoá của hydro
- Hydro phản ứng với các kim loại kiềm và kiềm thổ ở nhiệt độ Tia tử ngoại
cao để tạo thành hydrua kim loại H2(K) + Cl2(K) = 2HCl 400oC 2Na + H
Phản ứng này với brom, iốt, lưu huỳnh chỉ xảy ra ở nhiệt 2 = 2NaH độ cao
Tính khử của Hydro mới sinh
- Phản ứng của hydro với nitơ. Trong công nghiệp để điều
Zn + H2SO4 (loãng) = ZnSO4 + 2H chế NH MnO - + 5H + 3H+ = Mn2+ + 4H 3 4 2O Tcao, Pcao, xt
- Ngoài ra hydro mới sinh có thể khử SO2 trong môi trường axit 3H tạo thành H2S 2(K) + N2(K) = 2NH3(K) SO2 + 8H = H2S + 2H+ + 2H2O - Khử NO - -
3 , NO2 trong môi trường kiềm thành NH3
- Các phản ứng này không xảy ra đối với hydro phân tử 11 12 3 2/18/2019
Các phương pháp điều chế hydro - Trong công nghiệp: 1000oC, Ni CH4 + H2O = CO + 3H2 CO + H2O = CO2 + H2
- Phương pháp điện phân nước trong dung dịch NaOH
30% cho H2 rất tinh khiết (đắt tiền) - Trong phòng thí nghiệm : Zn + H - 2SO4 (loãng) = ZnSO4 + H2(K) + Zn + 2HCl = ZnCl2 + H2(K) 13 14 What are the Properties NƯỚC of Water? 15 16 4 2/18/2019 Cohesion …
Adhesion Causes Capillary Action Which gives water the ability to “climb” structures
Helps insects walk across water 17 18
Adhesion Also Causes Water to …
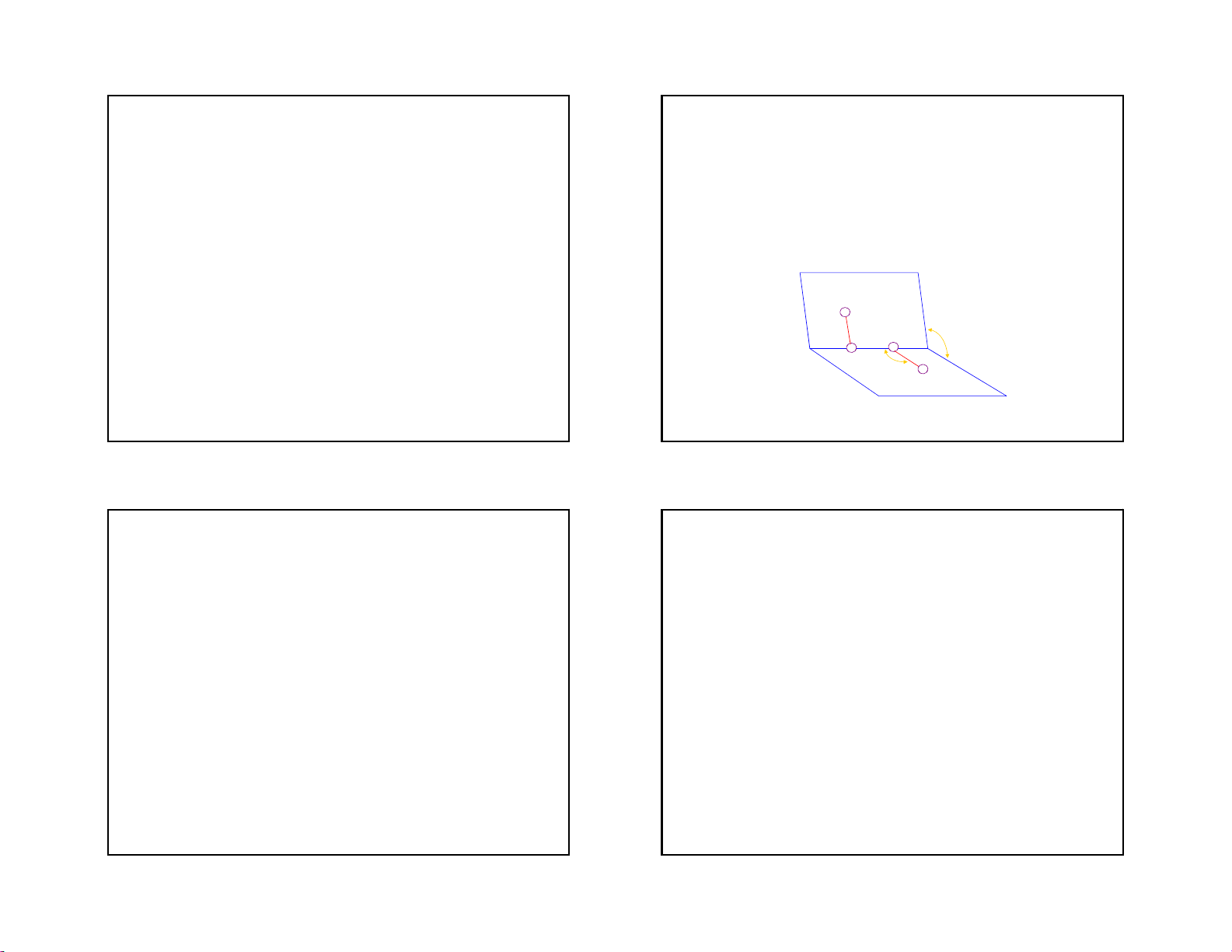
Cấu tạo của nước - Cã cÊu tróc d¹ng gãc ö: H H
- Các AO hoá trị của nguyên tử trung tâm O
có lai hoá sp3, góc liên kết 104o5’, EO-H = 463 KJ.mol-1 Attach to a
- Cấu tạo không đối xứng, momen lưỡng cực Form spheres & silken spider
phân tử lớn là = 1,84D. hold onto plant web leaves 19 20 5 2/18/2019
Tính chất lý học của nước
Effect of Hydrogen-Bonding on Boiling Point - Liên kết hydro O- - H+ … O- - H H H
- Gây ra sự bất thường về tỷ khối: ở t < 4oC thì tỷ khố
của nước tăng theo nhiệt độ và đạt giá trị cực đại ở 4oC
và sau đó tỷ khối lại giảm dần theo nhiệt độ.
- Nhiệt dung riêng của nước cao bất thường là 4,18 J.K-
1.g-1, là chất điều hoà nhiệt độ. 21 22 Unique
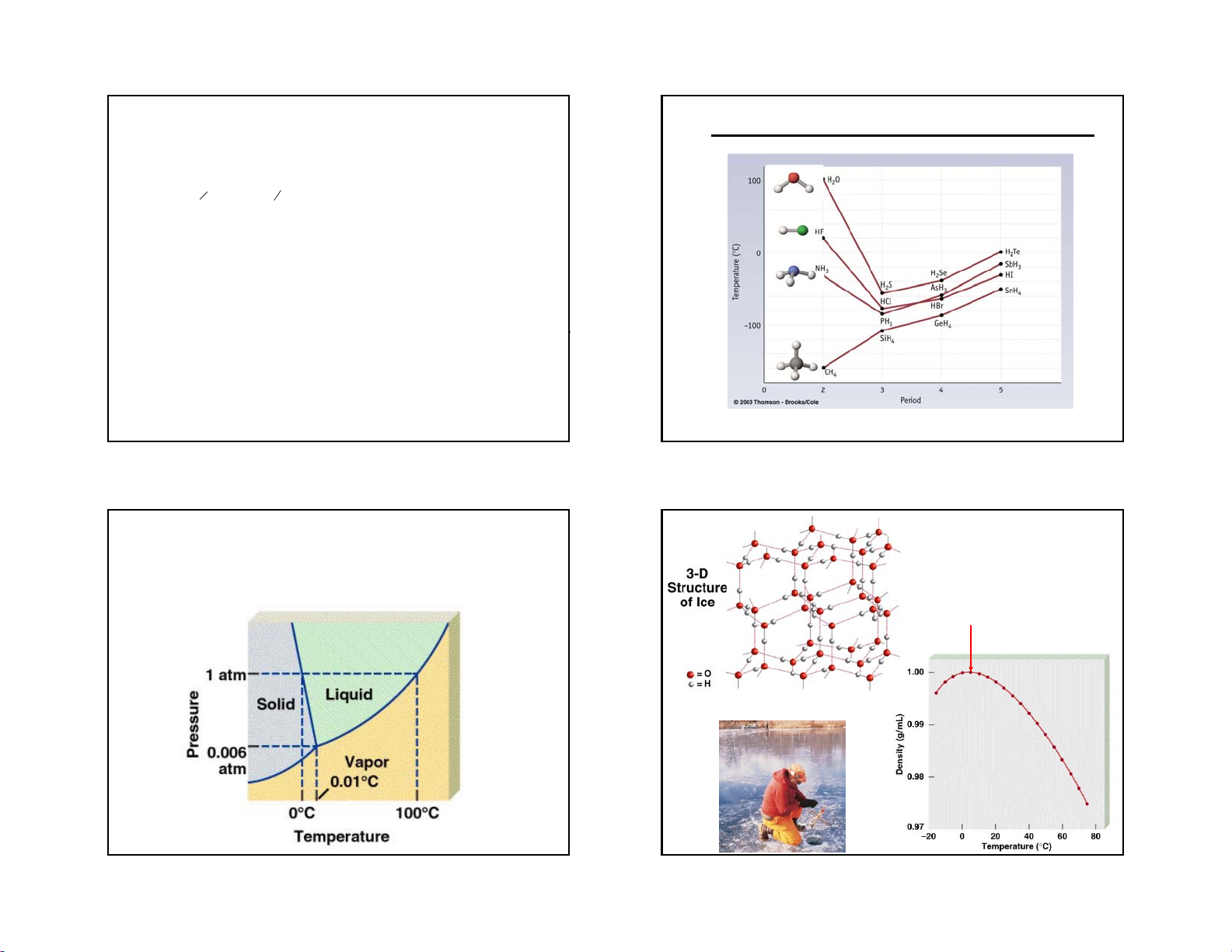
A phase diagram summarizes the conditions at which a Properties of
substance exists as a solid, liquid, or gas. Water Phase Diagram of Water Maximum Density 40C Density of Water
•Ice is less dense than water 23 24 11.8 11.3 6 2/18/2019
Water is Less Dense as a
Water is Less Dense as a Solid Solid
•Which is ice and which is water? Water Ice 25 26
The hypersaline Dead Sea – 300 ‰
Tính chất hoá học của nước
- Các phân tử nước có cực nên có khả năng tham gia vào các quá trình hydrat hoá
- Tham gia vào các phản ứng axit bazơ và các phản ứng thuỷ phân các muối
High density = high floating 27 28 7 2/18/2019
Tính chất hoá học của nước
* Khả năng oxy hoá và khử của nước: được đánh giá dựa vào
thế khử của các cặp sau: 2H+ + 2e H2(K)
- Tính chất oxy hoá-khử của nước: nước vừa thể hiện O2 + 4e + 4H+ 2H2O(L)
tính oxy hoá vừa thể hiện tính khử vì H có số oxi hoá
là +1 và O có số oxy hoá là -2. Tuy nhiên ở điều kiện
Theo công thức Nernest ta có:
thường các tính chất này thể hiện yếu: o 0,059 H 2 ε ε 2 lg 2Na + H H /H H /H 2O 2NaOH + H2 2 2 PH2 2F2 + 2H2O 4HF + O2 0,059 o ε ε O /H O 2 2 lgP . H O /H O 4 O 2 2 4 2 29 30 + Khi P = P = 1 atm, vμ pH= 7 O2 H2
Giản đồ thế khử của nước phụ thuộc vào pH
0,059 .7 0,413 V H / H 2 1,23 3 23 , 1 7 . 059 , 0 V 817 , 0 O H O 2 / 2 0.817 23 , 1 .p 059 , 0 H O H O 2 / 2
Nước sẽ bị khử dưới tác dụng của chất có thế khử < - 0.404
0,413V và bị oxi hoá bởi chất có thế khử > 0,817V. 0,00 2 -0.413 . 059 , 0 pH H / H2 -0.826 1 o o Na / Na 2 V 17 , H / H 0, V 413 2 2Na+ 2H O = 2NaOH + H pH=0 pH=7 pH=14 2 2 Vïng 1- TÝnh oxy ho¸ Vïng 3- TÝnh khö 31 32 8 2/18/2019 Hîp chÊt H O 2 2 - ë vïng 1: nÕu ox/ kh
CÊu t¹o vμ tÝnh chÊt lý häc
H / H th× d¹ng khö cña nã ph¶n øng 2 víi H O gi¶i phãng H 2 2 - CÊu t¹o gÊp khóc; d =1,48A, d = 0,95A, O-O H-O - ë vïng 2: E =217,5KJ.mol-1, E
= 376,5 KJ.mol-1. Do ph©n tö kh«ng ox/ kh th× d¹ng khö cña nã H / H O-O O-H O / H O 2 2 2
khi tiÕp xóc víi O sÏ cã ph¶n øng: ®èi xøng nªn ph©n cùc. 2
Kh + O + H+ (hay H O) Ox + H O hay OH- 2 2 2
Khi d¹ng oxy ho¸ tiÕp xóc víi H sÏ cã ph¶n øng: 2 Ox + H Kh + H+ (hay H O) 0,95A 111,5o 2 2 1,48A - ë vïng 3: nÕu ox/ kh 94,8o O / H O th× d¹ng oxy ho¸ cña nã 2 2
sÏ ph¶n øng víi H O gi¶i phãng O 2 2 33 34
- Ở điều kiện thường là chất lỏng màu xanh Tính chất hoá học
nhạt, hơi nhớt, có thể hoà tan trong nước
- Đây là hợp chất kém bền dễ bị phân huỷ theo phản ứng: 2H
bất cứ tỷ lệ nào, sôi ở t 2O2 = 2H2O + O2, s = 152oC và hoá
tuy nhiên phản ứng này xảy ra chậm ở điều kiện rắn ở tđ= -0,89oC.
thường, tốc độ phản ứng tăng lên nhiều khi có mặt chất - Dung dịch H xúc tác K
2O2 thường được sử dụng 2CrO4
trong phòng thí nghiệm có nồng độ 30%.
- Có số oxi hoá là -1 nên H2O2 vừa thể hiện tính oxi hoá
và vừa thể hiện tính khử. Tính oxi hoá và tính khử của
H2O2 được đánh giá bằng thế khử: H2O2 + 2e + 2H+ ⇄ 2H2O o = 1,77V H2O2 + 2e ⇄ 2OH- o = 0,87V O o 2 + 2e + 2H+ ⇄ H2O2 = 0,68V 35 36 9 2/18/2019 Ví dụ:
+ H2O2 có thể oxi hoá I- thành I2, sunfua thành sunfat…
H2O2 + 2KI + H2SO4 = I2 + K2SO4 + 2H2O 4H2O2 + PbS = PbSO4 + 4H2O
+ Với các chất oxi hoá mạnh như KMnO4, O3 hoặc
Cl2 thì thể hiện tính khử: 5H -
2O2 + MnO4 + 6H+ = 5O2 + 2Mn2+ + 8H2O - Tính axit yếu của H2O2 H ⇄ - 2O2 H+ + HO2 K1 = 1,5.10-12 HO - ⇄ - 2 H+ + O2 K2 rất nhỏ 37 10



