Preview text:
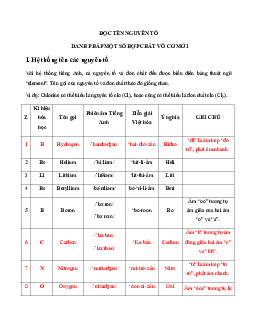
Hóa 10 bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học.
Định luật tuần hoàn được
I. Sự biến đổi tính kim loại, tính phi kim của các nguyên tố hóa học
Tính kim loại, tính phi kim
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ mất electron
để trở thành ion dương. Nguyên tử càng dễ mất electron thì tính kim loại của nguyên tố càng mạnh.
Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ thu electron
để trở thành ion âm. Nguyên tử càng dễ thu electron thì tính phi kim của nguyên tố càng mạnh.
2. Sự biến đổi tính kim loại, tính phi kim
a. Trong cùng chu kỳ, theo chiều tăng dần của điiện tích hạt nhân: Tính kim loại
giảm, tính phi kim tăng dần.
Giải thích: trong một chu kì, theo chiều tăng của điện tích hạt nhân (từ trái sang
phải) thì độ âm điện tăng dần đồng thời bán kính nguyên tử giảm dần => khả
năng nhường electron giảm, khả năng nhận electron tăng
=> tính kim loại giảm, tính phi kim tăng
b. Trong cùng nhóm A, khi điện tích hạt nhân tăng: Tính kim loại tăng, tính phi kim giảm dần.
Giải thích: Trong một nhóm A, theo chiều tăng của điện tích hạt nhân (từ trên
xuống dưới) thì độ âm điện giảm dần đồng thời bán kính nguyên tử tăng nhanh
=> khả năng nhường electron tăng, khả nặng nhận electron giảm.
3. Sự biến đổi độ âm điện
Độ âm điện: của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron
của nguyên tử đó khi tạo thành liên kết hóa học
Theo chiều tăng dần của điện tích hạt nhân:
Trong cùng chu kỳ, độ âm điện tăng.
Trong cùng nhóm, độ âm điện giảm.
II. Sự biến đổi về hóa trị của các nguyên tố
Trong cùng chu kỳ, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ 1
đến 7, hóa trị đối với hidro giảm từ 4 đến 1. IA IIA IIIA IVA VA VIA VIIA Oxit cao R2O RO R2O3 RO2 R2O5 RO3 R2O7 nhất Hợp chất RH RH2 RH3 RH4 RH3 RH2 RH với hidro
Nhận xét: Hóa trj cao nhất của một nguyên tố với oxi, hóa trị với hidro của các phi
kim biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
III. Oxit và hidroxit của các nguyên tố nhóm A thuộc cùng 1 chu kì Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 Oxit lưỡng Oxit bazơ Oxit bazơ Oxit axit Oxit axit Oxit axit Oxit axit tính NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 Hidroxit Axit trung Axit rất Bazơ mạnh Bazơ yếu Axit yếu Axit mạnh lưỡng tính bình mạnh
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính bazơ của oxit và
hidroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit
và hidroxit tương ứng tăng dần, đồng thời tính axit của chúng giảm dần.
Nhận xét: Tính axit - bazơ của các oxit và hidroxit tương ứng của các nguyên tố
biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
IV. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của
các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của
điện tích hạt nhân nguyên tử.
B. Bài tập vận dụng liên quan
Câu 1. Xác định công thức hóa học của một oxit, biết oxit cao nhất của một
nguyên tố chứa 72,73% oxi, còn trong hợp chất khí với hidro chứa 75% nguyên tố đó.
a) Công thức hóa học của oxit đó
b) Viết công thức oxit cao nhất và hợp chất khi với hidro.
Đáp án hướng dẫn giải chi tiết
Gọi hợp chất với hidro có công thức là: AHx
⇒ Hợp chất với oxi có công thức là A2Ox-8 Theo đề bài ta có
(1) (2.A) /16(8-x )= 27,27/72,73. (2) A/x = 75/ 25 = 3
⇒ A = 3x thay vào pt(1) ta có đáp án: x = 4 và ⇒ A = 12
Vậy A là cacbon ⇒ CO2 và CH4
Câu 2. Oxit cao nhất của nguyên tố M có dạng M2O7. Sản phầm khí của M với
hidro chứa 2,74% hidro về khối lượng. Xác định nguyên tử khối của M.
Đáp án hướng dẫn giải chi tiết
Oxit cao nhất của nguyên tố R có công thức M2O7.
→ Công thức hợp chất khí với hidro có dạng RH theo đề: %H = 1/(M + 1) . 100% = 2,74%
Giải ra ta có: M= 35,5 (clo). Cl
→ Công thức phân tử của oxit là Cl2O7
Công thức hợp chất khí với hidro là HCl.
Câu 3. Nguyên tử nguyên tố R có tổng số hạt cơ bản (e, p, n) cấu tạo nên nó là 34.
Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
a. Xác định số hạt (electron, proton, notron) có trong R và viết kí hiệu nguyên tử của R.
b. Viết cấu hình electron nguyên tử của R.
c. Xác định vị trí (ô, chu kì, nhóm) của R trong bảng tuần hoàn.
Đáp án hướng dẫn giải chi tiết
Gọi số hạt proton và notron của X lần lượt là P, N Vì số P = E = Z
Tổng số hạt của X là 34 suy ra 2P + N =34 (1)
Số hạt mang điện trong X nhiều hơn số hạt không mang điện là 10 nên 2P – N= 10 (2)
Giải 2 phương trình (1) và (2) ta được P = 11 và N = 12
Vậy Z = 11 => Nguyên tố R là Natri kí hiệu Na
Cấu hình electron của nguyên tố Na 11Na: 1s22s22p63s1
R có 3 lớp e nên R ở chu kì 3
R có 1e lớp ngoài cùng nên X ở nhóm IA
C. Trắc nghiệm Hóa 10 bài 9
Câu 1: Trong một chu kì, theo chiều tang dần của điện tích hạt nhân,
A. Bán kính nguyên tử giảm dần, tính kim loại tăng dần.
B. Bán kính nguyên tử giảm dần, tính phi kim tăng dần.
C. Bán kính nguyên tử tăng dần, tính phi kim tăng dần.
D. Bán kính nguyên tử tăng dần, tính phi kim giảm dần.
Câu 2: Dãy nguyên tố nào sau đây được sắp xếp theo chiều tang dần độ âm điện? A. Li, Na, C, O, F B. Na, Li, F, C, O C. Na, Li, C, O, F D. Li, Na, F, C, O
Câu 3: Dãy nguyên tố nào sau đây được sắp xếp theo chiều tang dần tính kim loại? A. Li, Be, Na, K B. Al, Na, K, Ca C. Mg, K, Rb, Cs D. Mg, Na, Rb, Sr
Câu 4: Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20. Phát
biểu nào sau đây là sai?
A. Các nguyên tố này đều là kim loại mạnh nhất trong chu kì.
B. Các nguyên tố này không cùng thuộc một chu kì.
C. Thứ tự tăng dần tính bazơ la X(OH)2 < Y(OH)2 < Z(OH)2.
D. Thứ tự tang dần độ âm điện: X < Y < Z.
Câu 5: Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 11, 29, 37. Phát biểu nào sau đây đúng?
A. Các nguyên tố này đều là kim loại nhóm IA.
B. Các nguyên tố này không cùng một chu kì.
C. Thứ tự tính kim loại tang dần: X < Y < Z.
D. Thứ tự tính bazơ tang dần: XOH < YOH < ZOH.