







Preview text:
Chương 1
NHỮNG KHÁI NIỆM - ĐỊNH LUẬT
CƠ BẢN TRONG HÓA HỌC
1. Một số khái niệm cơ bản
1.1. Nguyên tố hóa học
- Nguyên tố hóa học là khái niệm đặc trưng cho mỗi loại nguyên tử có điện tích hạt nhân
xác định, được biểu diễn bằng kí hiệu hóa học riêng. 2
1. Một số khái niệm cơ bản
1.2. Nguyên tử, phân tử
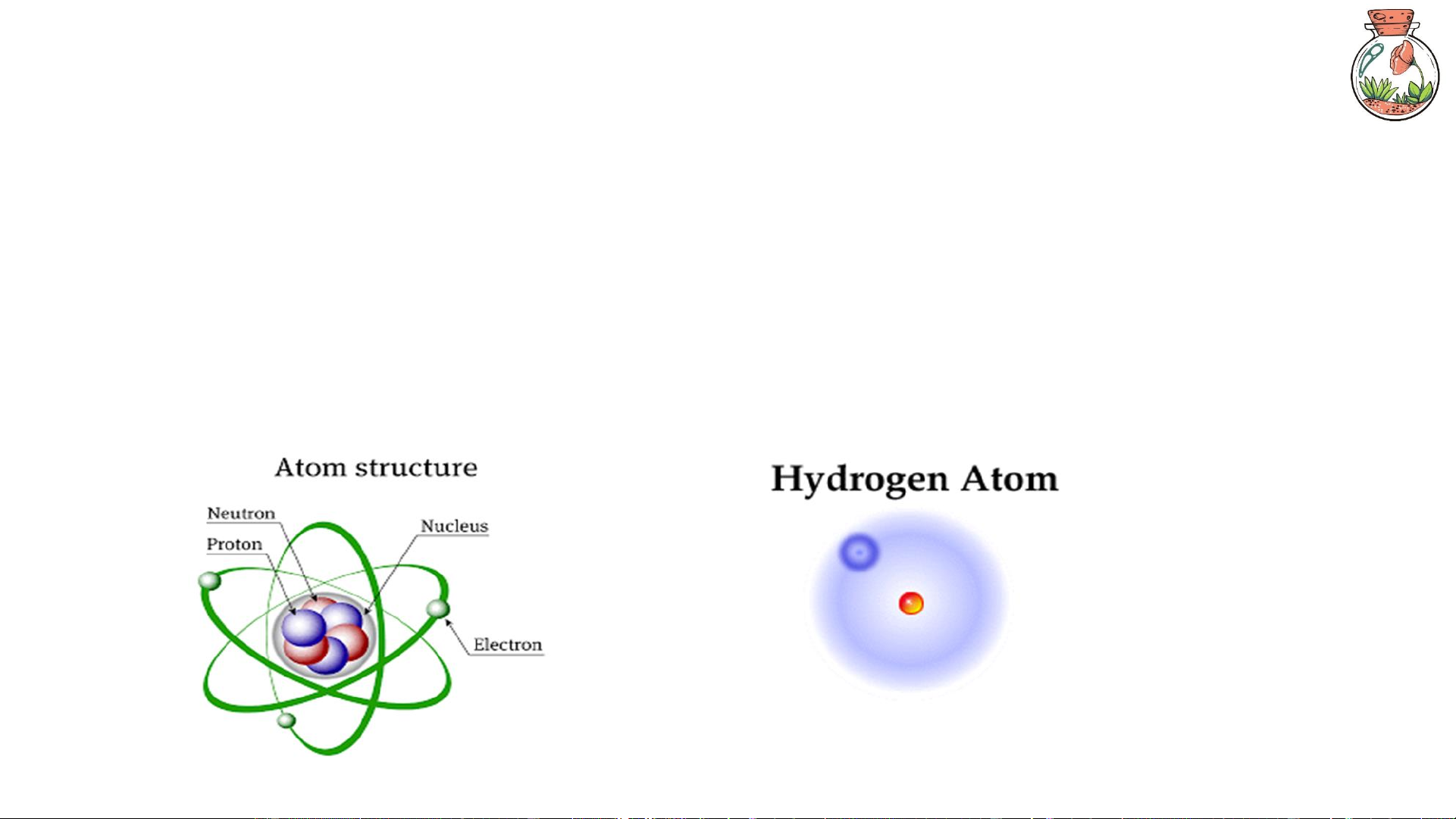
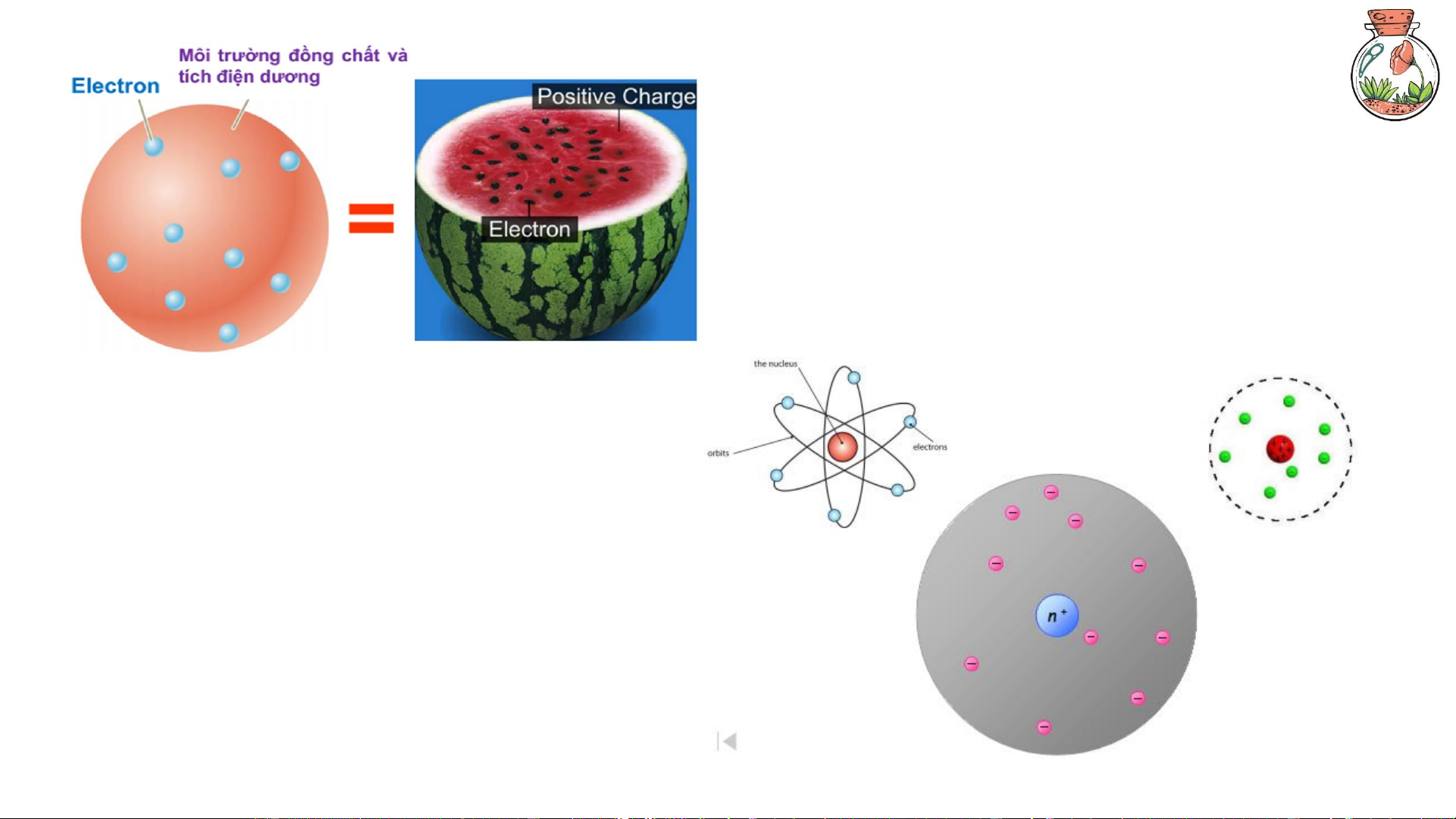
Nguyên tử là đơn vị cấu tạo nhỏ nhất của vật chất thuộc một nguyên tố hóa học, gồm hạt
nhân (chứa proton và neutron) và electron chuyển động quanh hạt nhân.
Nguyên tử là đơn vị cơ bản tạo nên phân tử, ion hoặc mạng tinh thể của các chất. 3
1. Một số khái niệm cơ bản
1.2. Nguyên tử, phân tử
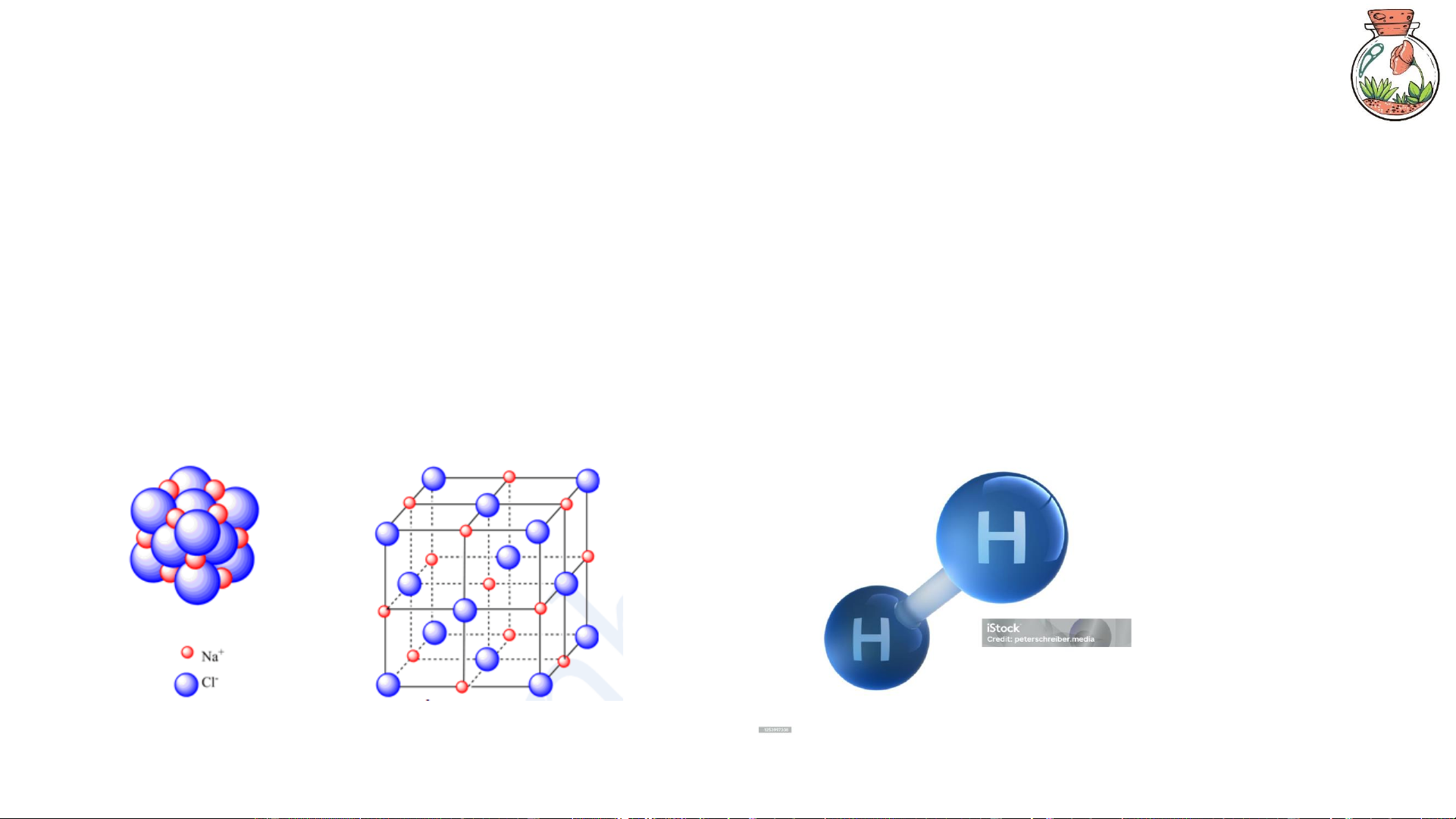
Phân tử là phần tử nhỏ nhất của một chất, tồn tại độc lập, và giữ nguyên tính chất hóa học
của chất đó. Nó có thể là đơn chất (O₂, H₂...) hoặc hợp chất (H₂O, CO₂...). 4
1. Một số khái niệm cơ bản
1.3. Đơn chất, hợp chất
Đơn chất: Là chất chỉ gồm các nguyên tử của cùng một nguyên tố, có thể tồn tại ở dạng
nguyên tử rời rạc (kim loại), hoặc liên kết thành phân tử (O₂, N₂...). 5
1. Một số khái niệm cơ bản
1.3. Đơn chất, hợp chất
Hợp chất : Hợp chất là chất được tạo thành từ các nguyên tử của hai hay nhiều nguyên tố
khác nhau, liên kết với nhau theo một tỉ lệ xác định. 6
2. Một số định luật cơ bản
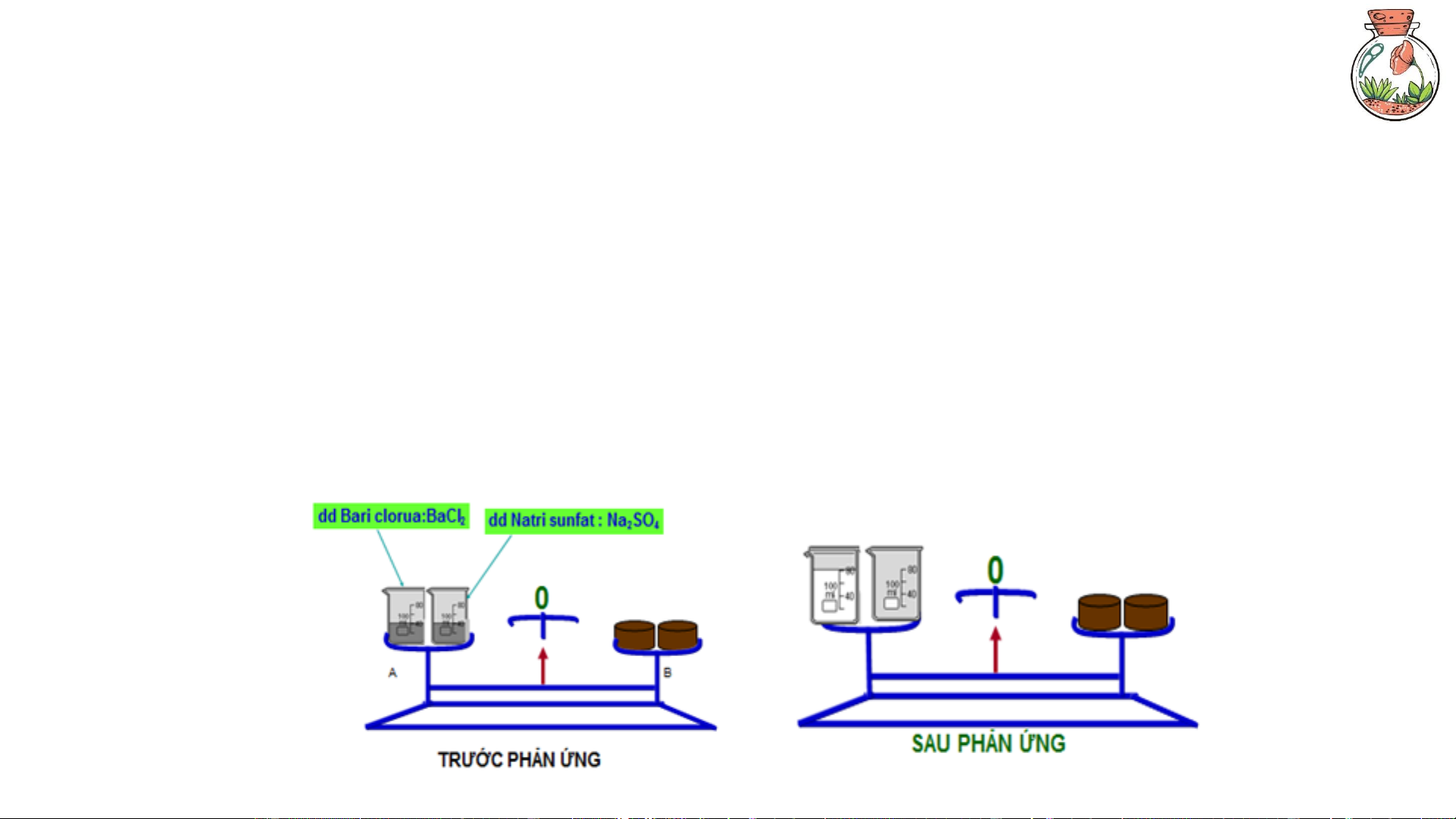
1. Định luật bảo toàn khối lượng
Trong một phản ứng hóa học, tổng khối lượng của các chất phản ứng bằng tổng khối lượng
của các sản phẩm. A + B → C + D m + m = m + m A B C D 7
2. Một số định luật cơ bản
2. Định luật thành phần không đổi (Định luật Proust)
Một hợp chất hóa học luôn có thành phần xác định, tức là các nguyên tố trong đó luôn kết
hợp với nhau theo một tỉ lệ nhất định, không phụ thuộc vào nguồn gốc hay cách điều chế.
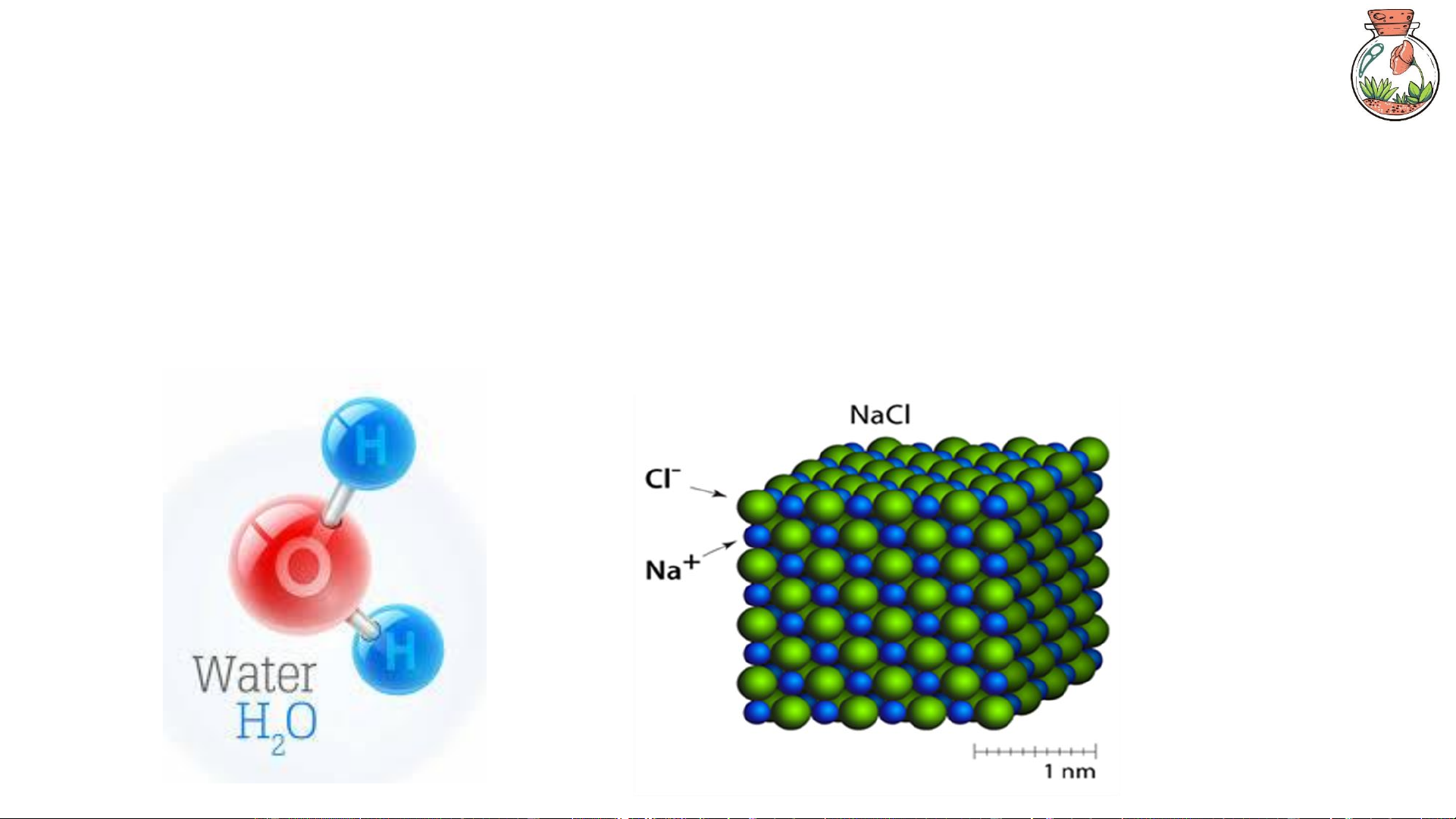
VD: Nước (H₂O) luôn có 2 nguyên tử H và 1 nguyên tử O, bất kể thu từ sông, điều chế
trong phòng thí nghiệm hay tạo ra từ phản ứng cháy. 8
2. Một số định luật cơ bản
3. Phương trình trạng thái khí lý tưởng 𝐏𝐕 = 𝐧𝐑𝐓 Ký hiệu Đại lượng
Đơn vị thường dùng P Áp suất của khí atm (hoặc Pa, mmHg, bar...) V Thể tích khí
lít (L) hoặc mét khối (m³) n Số mol khí mol Hằng số khí R
0,08206 L.atm/mol.K (hoặc 8,314 J/mol.K) (gas constant) T
Nhiệt độ tuyệt đối Kelvin (K) = °C + 273,15 9
2. Một số định luật cơ bản
3. Phương trình trạng thái khí lý tưởng 𝐏𝐕 = 𝐧𝐑𝐓
Đơn vị áp suất (P)
Đơn vị thể tích (V) Hằng số R
Đơn vị của R atm lít (L) 0,08206 L.atm/mol.K mmHg (torr) mililit (mL) 62.400 mL·mmHg/mol.K Pa (N/m²) m³ 8,314 J/mol.K (vì 1 J = 1 Pa·m³) kPa lít (L) 8,314 kPa·L/mol.K bar lít (L) 0,08314 L·bar/mol.K 10
2. Một số định luật cơ bản
4. Định luật đương lượng
- Đương lượng của một nguyên tố là số mol nguyên tử của nguyên tố đó có thể kết hợp
hoặc thay thế 1 mol nguyên tử hydro trong một phản ứng hóa học.
- Nói cách khác, nó biểu thị khả năng liên kết hay thay thế của một nguyên tử nguyên tố trong phản ứng. Số Hợp chất
nguyên tử H thay Công thức
Nguyên tố trung tâm
Đương lượng
thế/kết hợp HCl HCl Cl 1 1 H₂O H₂O O 2 ½ PH₃ PH₃ P 3 ⅓ CH₄ CH₄ C 4 ¼ 11
2. Một số định luật cơ bản
4. Định luật đương lượng
E: đương lượng gam (g) 𝑴
Đương lượng gam: E =
M: Khối lượng mol phân tử (g) 𝒁
Z: số đương lượng
• Đối với một base: Z = số nhóm – OH tham gia phản ứng
• Đối với một acid: Z = số nguyên tử H tham gia phản ứng
• Đối với một muối: Z = tổng điện tích của ion dương hoặc ion âm trong phân tử muối đó
• Đối với phản ứng oxi hoá - khử: z = số e cho hoặc nhận khi tham gia phản ứng 12
• 2NaOH + H SO → Na SO + 2H O 2 4 2 4 2 M M H SO 98 2 4 E 40 49 NaOH E 40 H NaOH 2 4 SO z 2 z 1
• Na CO + 2HCl → 2NaCl + CO + H O 2 3 2 2 M Na CO 106 2 3 E 53 Na CO 2 3 z 2
• 2KMnO + 5H O + 3H SO → K SO + 2MnSO + 5O + 8H O 4 2 2 2 4 2 4 4 2 2 7 2
Mn 5e Mn M KMnO 158 4 E 31,6 KMnO4 z 5 1 0 M H O 34
2 O 2e O 2 2 2 E 17 H O 2 2 z 2 13
2. Một số định luật cơ bản m C%.d.10 Nồ ct
ng độ đương lượng : C .1000 C .z N E. M V E dd
C : nồng độ đương lượng của dung dịch (N) N
m : khối lượng chất tan (g) ct
V : thể tích dung dịch (ml) dd
E: đương lượng gam chất tan (g)
C%: nồng độ phần trăm của dung dịch (%)
d: khối lượng riêng dung dịch (g/ml) C : nồng độ mol/l M z: số đương lượng 14
2. Một số định luật cơ bản
• Giả sử có 2 chất A và B phản ứng với nhau theo phương trình: A + B → C
• Gọi N , N lần lượt là nồng độ đương lượng của dd A và B. A B
• V , V là thể tích của dung dịch A và dung dịch B phản ứng vừa đủ với nhau. A B V .N = V .N A A B B 15
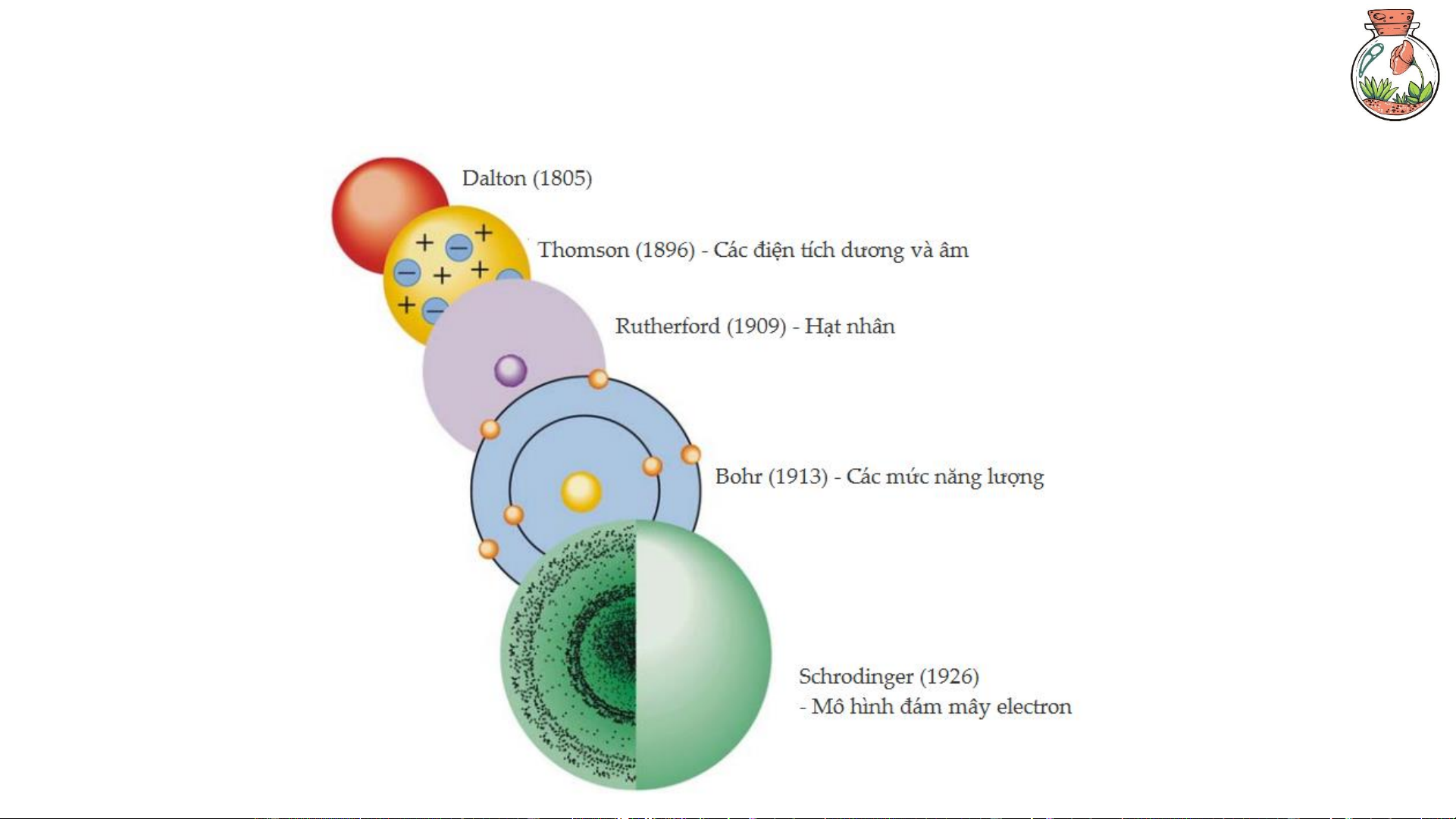
3. Thuyết nguyên tử 16 17 4. Hệ đơn vị
1. Các đơn vị cơ bản Đại lượng Đơn vị Kí hiệu Chiều dài mét m Khối lượng kilogam kg Thời gian giây s Dòng điện ampe a Nhiệt độ kelvin k Lượng chất mol mol Cường độ sáng candela cd 18 4. Hệ đơn vị
2. Những tiếp đầu ngữ thông dụng trong Hóa sinh
Tiếp đầu ngữ Ký hiệu Hệ số -3 mili m 10-6 micro µ 10-9 nano n 10-12 pico p 10
3. Những ước số của mol Đơn vị Ký hiệu Kết quả mol mol -3 milimol mmol 10 mol -6 micromol µmol 10 mol -9 nanomol nmol 10 mol 19
Một số đơn vị trong Hoá học.
1. Đơn vị đo lường và đơn vị SI tương đương Đại lượng đo Đơn vị Ký hiệu
Đơn vị SI tương đương Chiều dài angstrom Å 1 Å = 1 × 10⁻¹⁰ m Lực newton N 1 N = 1 m·kg/s² Áp suất pascal Pa 1 Pa = 1 N/m² = 1 kg/(m·s²) Năng lượng, công, nhiệt atmosphere atm 1 atm = 101.325 Pa Công suất joule J 1 J = 1 N·m = 1 m²·kg/s² Điện tích watt W 1 W = 1 J/s = 1 m²·kg/s³ Điện thế coulomb C 1 C = 1 A·s volt V
1 V = 1 W/A = 1 m²·kg/(s³·A) Nhiệt độ độ Celsius °C °C = K – 273.15 độ Fahrenheit °F °F = 1.8(K – 273.15) + 32 20



