Preview text:
Giải Hoá học 10 Bài 14: Ôn tập chương 3 Câu 1
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết ion? A. Cl2, Br2, I2, HCl. B. Na2O, KCl, BaCl2, Al2O3. C. HCl, H2O, NaCl, N2O D. MgO, H2SO4, H3PO4, HCl. Gợi ý đáp án Câu đúng: B Câu 2
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực A. N2, CO2, Cl2, H2 B. N2, Cl2, H2, HCl C. N2, HI, Cl2, CH4 D. Cl2, O2, N2, F2. Gợi ý đáp án Câu đúng: D Câu 3
Viết công thức cấu tạo và công thức Lewis của các phân tử sau: PH3, H2O, C2H6. Trong phân
tử nào có liên kết phân cực mạnh nhất? Gợi ý đáp án
Công thức cấu tạo Lewis của các phân tử PH3, H2O, C2H6 lần lượt là:
Phân tử có liên kết phân cực mạnh nhất: H2O. Câu 4
Dựa vào giá trị độ âm điện của các nguyên tử trong Bảng 6.2, xác định loại liên kết trong phân
tử các chất: CH4, CaCl2, HBr, NH3. Gợi ý đáp án
CH4: liên kết cộng hóa trị không phân cực CaCl2: liên kết ion
HBr: liên kết cộng hóa trị phân cực
NH3: liên kết cộng hóa trị không phân cực. Câu 5
Cho dãy các oxide sau: Na2O, MgO, Al2O3, SiO2, P2O 5, SO3, Cl2O7.
a) Độ phân cực của các liên kết trong dãy các oxide trên thay đổi thế nào?
b) Dựa vào giá trị độ âm điện của các nguyên tố trong Bảng 6.2, cho biết loại liên kết (ion, cộng
hóa trị phân cực, cộng hóa trị không phân cực) trong từng phân tử oxide. Gợi ý đáp án
a) Độ phân cực tăng dần.
b) Na2O, MgO, Al2O3: liên kết ion
SiO2, P2O 5: liên kết cộng hóa trị phân cực.
SO3, Cl2O7: liên kết cộng hóa trị không phân cực. Câu 6
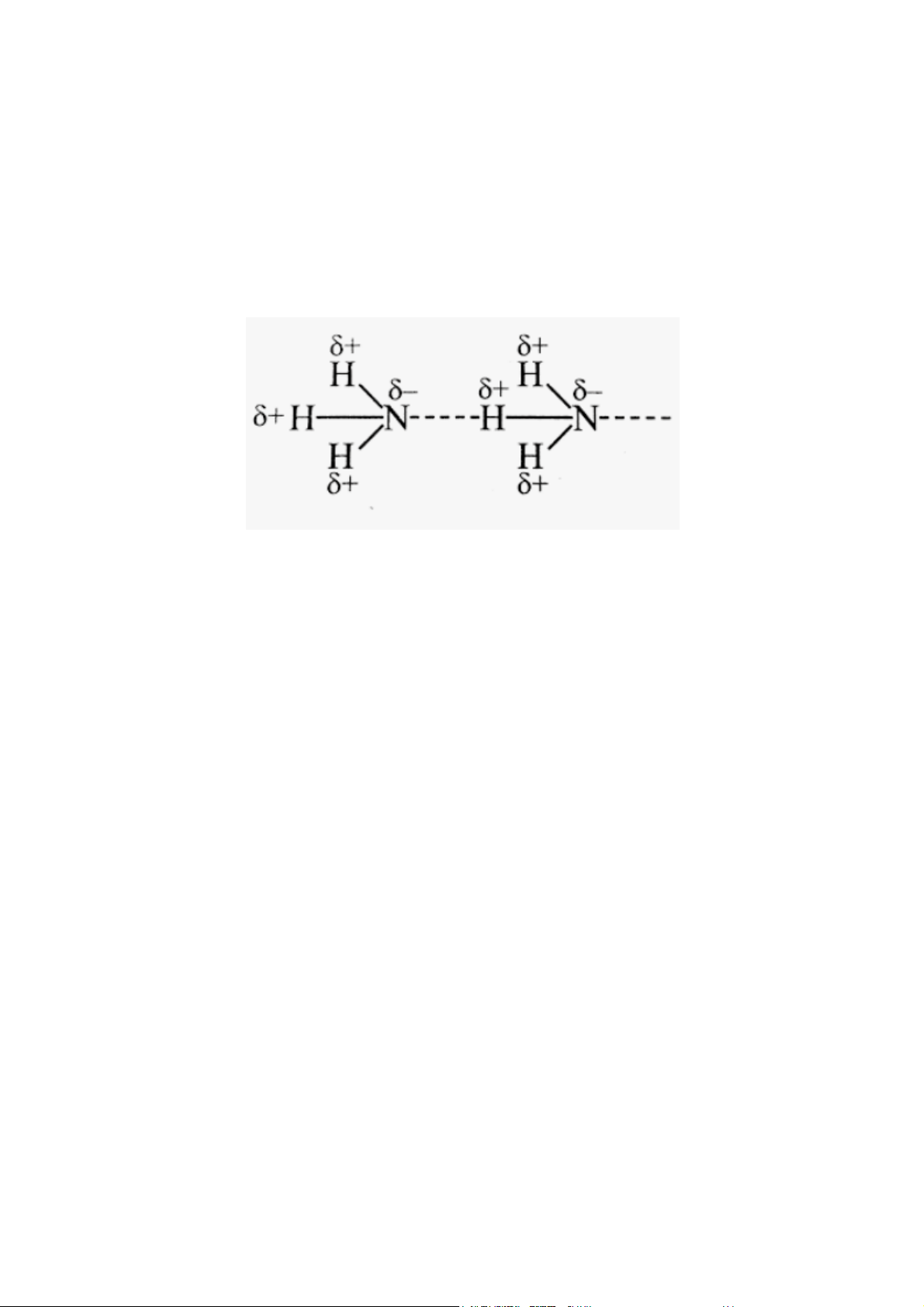
a) Cho dãy các phân tử: C2H6, CH3OH, NH3. Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó. Gợi ý đáp án
a) Phân tử có thể tạo liên kết hydrogen là NH3. b)