Preview text:
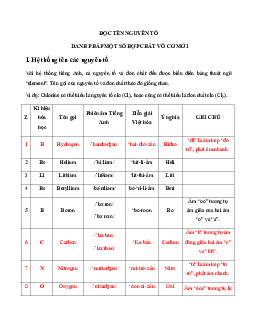
HÓA HỌC 10 BÀI 8: SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH
ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ HÓA HỌC
A. Tóm tắt lý thuyết Hóa 10 bài 8
I. Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố
Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng (số e hóa trị).
Đầu mỗi chu kì là nguyên tố có cấu hình electron lớp ngoài cùng của
nguyên tử là ns1, kết thúc mỗi chu kì là nguyên tố có cấu hình
electron lớp ngoài cùng của nguyên tử ns2np6 (trừ chu kì 1)
Cấu hình electron ngoài cùng của các nguyên tố trong cùng một
nhóm được lặp đi lặp lại biến đổi tuần hoàn.
II. Cấu hình electron nguyên tử của các nguyên tố nhóm A
1. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A
Các nguyên tố thuộc cùng 1 nhóm A có cùng số electron lớp ngoài cùng (số
e hóa trị) là nguyên nhân sự giống nhau về tính chất hóa học của các
nguyên tố trong cùng một nhóm A.
Số thứ tự của nhóm = Số e lớp ngoài cùng = số e hóa trị
Nguyên tố s thuộc nhóm IA, IIA
Nguyên tố p thuộc nhóm IIIA => VIIIA
2. Một số nhóm A tiêu biểu
a. Nhóm VIIIA (Nhóm khí hiếm)
Gồm các nguyên tố: He, Ne, Ar, Kr, Xe, Rn
Cấu hình e lớp ngoài cùng chung ns2np6 (trừ He)
Hầu hét các khí hiếm không tham gia phản ứng hóa học, tồn tại ở dạng khí,
đơn phân tử chỉ 1 nguyên tử
b. Nhóm IA (Nhóm kim loại kiềm)
Gồm các nguyên tố: Li, Na, K, Rb, Cs, Fr
Cấu hình e ớp ngoài cùng chung: ns1 (dễ nhường 1e để đạt cấu hình
electron bền vững của khí hiếm) Tính chất hóa học:
Tác dụng với oix tạo oxit bazơ
Tác dụng với phi kim tạo muối
Tác dụng với nước tạo hidroxit + H2
c. Nhóm VIIA (Nhóm halogen)
Gồm các nguyên tố: F, Cl, Br, I, At
Cấu hình e lớp ngoài cùng chung: ns22p5 (Dễ dàng nhận 1e để đặt cấu hình
e bền vững của khí hiếm) Tính chất hóa học:
Tác dụng với oxi tạo oxit axit
Tác dụng với kim loại tạo muối
Tác dụng với H2 tạo hợp chất khí.