





Preview text:
Giải bài tập Hóa 12 nâng cao bài 31
Bài 1 (trang 167 sgk Hóa 12 nâng cao): Chất nào sau đây không bị phân hủy khi nung nóng? A. Mg(NO3)2 B. CaCO3 C. CaSO4 D. Mg(OH)2 Lời giải: Đáp án C
Bài 2 (trang 167 sgk Hóa 12 nâng cao): Theo thuyết Brón-stet, ion nào sau
đây (trong dung dịch) có tính lưỡng tính? A. CO 2- 3 B. OH- C. Ca2+ D. HCO3- Lời giải: Đáp án D
Bài 3 (trang 167 sgk Hóa 12 nâng cao): Nước tự nhiên có chứa ion nào dưới
đây được gọi là nước có tính cứng tạm thời? A. Ca2+, Mg2+, Cl- B. Ca2+, Mg2+, SO 2- 4 . C. Cl-, SO 2- - 4 , HCO3 ,Ca2+. D. HCO3-,Ca2+, Mg2+. Lời giải: Đáp án D
Bài 4 (trang 167 sgk Hóa 12 nâng cao): Một loại nước cứng khi đun sôi thì
mất tính cứng, trong loại nước cứng này có hòa tan những hợp chất nào sau đây? A. Ca(HCO3)2, MgCl2. B. Ca(HCO3)2, Mg(HCO3)2 C. Mg(HCO3)2, CaCl2. D. MgCl2, Ca2SO4. Lời giải: Đáp án D
Bài 5 (trang 167 sgk Hóa 12 nâng cao): Cho các chất: A. NaCl B. Ca(OH)2 C. Na2CO3 D. HCl E. BaCl2 F. Na2SO4 Những chất nào có thể
a. làm mềm nước có tính cứng tạm thời.
b. làm mềm nước có tính cứng vĩnh cửu.
Viết các phương trình hóa học. Lời giải: a. Đáp án B hoặc C
Để làm mềm nước cứng tạm thời có thể dùng Ca(OH)2 hoặc Na2CO3 do chúng
làm kết tủa Ca2+ và Mg2+ dưới dạng muối cacbonat theo các phương trình: Ca(OH) - 2- 2 OH- + HCO3 → CO3 +H2O CO 2- 3 + Mg2+ → MgCO3 ↓ CO 2- 3 + Ca2+ → CaCO3 ↓ Na 2-
2CO3: CO3 + Mg2+ → MgCO3 ↓ CO 2- 3 + Ca2+ → CaCO3 ↓
b. Đáp án C (phản ứng xem phần a)
Bài 6 (trang 167 sgk Hóa 12 nâng cao): a. Có 4 chất rắn dựng trong 4 lọ riêng
biệt: Na2CO3, CaCO3, Na2SO4. CaSO.2H2O. Bằng cách nào để nhận biết 4 chất,
nếu ta chỉ dùng nước và dung dịch axit HCl.
b. Có 3 chất rắn đựng trong 3 lọ riêng biệt: NaCl, CaCl2 và MgCl2. Hãy trình
bày phương pháp hóa học để nhận biết mỗi chất (có đủ dụng cụ và những hóa chất cần thiết). Lời giải:
a, Hòa tan 4 chất vào nước ta thu được hai nhóm:
- Nhóm tan nhiều trong nước có Na2CO3 và Na2SO4.
- Nhóm ít tan trong nước có CaCO3 và CaSO4.2H2O Nhỏ dung dịch HCl vào
từng chất thuộc hai nhóm trên
- Nhận ra Na2CO3 vì có khí thoát ra còn Na2SO4 thì không
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
- Nhận ra CaCO3 vì có khí còn CaSO4.2H2O thì không
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
b, Lấy mỗi lọ một ít chất rắn đem hòa tan vào nước, đánh số rồi chia làm hai phần
Phần 1: Nhò từ từ dung dịch NaOH vào, nhận ra ống đựng MgCl2 vì có kết tủa
2NaOH + MgCl2 → Mg(OH)2 ↓ + 2NaCl
Phần 2: Loại bỏ ống nghiệm MgCl2 đã nhận ra, nhỏ từ từ dung dịch Na2CO3
vào nhận ra ống đựng CaCl2 vì có kết tủa
CaCl2 + Na2CO3 → CaCO3 + 2NaCl Còn lại là NaCl
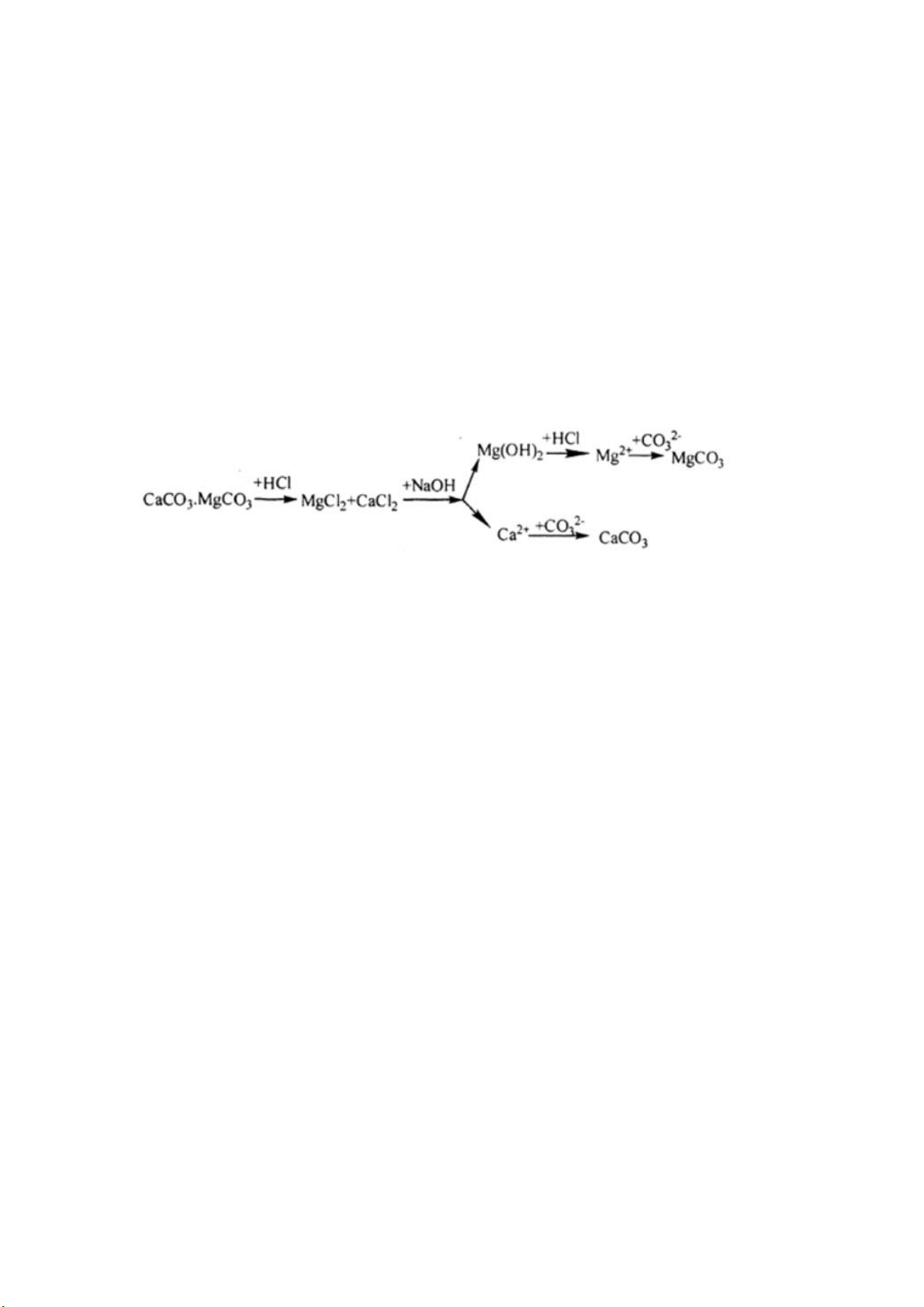
Bài 7 (trang 167 sgk Hóa 12 nâng cao): Trong tự nhiên các nguyên tố magie và
canxi có trong quặng đôlômit: CaCO3.MgCO3. Từ quặng này hãy trình bày phương pháp điều chế:
a. Hai chất riêng biệt là CaCO3 và MgCO3.
b. Hai kim loại riêng biệt là Ca và Mg.
Viết các phương trình hóa học. Lời giải: Sơ đồ tách
CaCO3 + 2HCl → CaCl2 + CO2 + 2H2O
MgCO3 + 2HCl → MgCl2 + CO2 + 2H2O
MgCl2 + 2NaOH → Mg(OH)2 ↓ + 2NaCl
- Lọc tách phần không tan thì dung dịch còn chứa các ion Ca2+, Cl-, Na+, OH-
thêm Na2CO3 vào dung dịch ta thu CaCO3 kết tủa Ca 2 2+ + CO3 → CaCO3
CaCO3 + 2HCl → CaCl2 + CO2 + 2H2O CaCl2 đpnc→ Ca + Cl2
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
MgCl2 + Na2CO3 → MgCO3 + 2NaCl MgCl2 đpnc→ Mg + Cl2
Bài 8 (trang 168 sgk Hóa 12 nâng cao): Dựa vào bảng tính tan của một số hợp
chất kim loại kiềm thổ (xem phần tư liệu), hãv xét xem phản ứng nào sau đây xảy ra:
Mg(OH)2 + Ca2+ → Ca(OH)2 + Mg2+.
Ca(OH)2 + Mg2+ → Mg(OH)2 + Ca2+ Lời giải: Phản ứng xảy ra là:
Ca(OH)2 + Mg2+ → Mg(OH)2 + Ca2+
Độ tan của Ca(OH)2 là 16.10-4 mol/100 g H2O còn Mg(OH)2 là 0,2.10-4 mol/100g H2O
=> Phản ứng diễn ra do tạo chất Mg(OH)2 là chất ít tan trong nước hơn nhiều so với Ca(OH)2
Bài 9 (trang 168 sgk Hóa 12 nâng cao): Cho 10 lít (đktc) hỗn hợp khí gồm N2
và CO2 tác dụng với 2 lít dung dịch Ca(OH)2 0,02 mol/l, thu được 1 gam chất
kết tủa. Hãy xác định thành phần % theo thể tích của mỗi khí trong hỗn hợp ban đầu? Lời giải:
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O (1)
Nếu dư CO2 dư: CO2 + CaCO3 + H2O → Ca(HCO3)2 (2)
* Trường hợp: Nếu CO2 không dư: = = 1 : 100 = 0,01 mol => = 0,01 . 22,4 = 0,224 (lít)
=> %(V) CO2 = 0,224 : 10 . 100 = 2,24%
%(V)N2 = 100 – 2,24 = 97,76%
*Trường hợp 2: Nếu CO2 dư, xảy ra phương trình số 2 = 2.0,02 = 0,04 mol Theo (1) = = = 0,04 mol
Nhưng theo đề bài chỉ thu được 0,01 mol kết tủa => có 0,03 mol kết tủa bị hòa tan theo phương trình (2) = tan ra = 0,03
Tổng số mol CO2 = 0,04 + 0,03 = 0,07 (mol) => = 0,07.22,4 = 1,568 lít
=> %(V) CO2 = 1,568 : 10 . 100 = 15,68%
%(V)N2 = 100 – 15,68 = 84,32%
Bài 10 (trang 168 sgk Hóa 12 nâng cao): Có ba cốc đựng lần lượt: nước mưa,
nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu. Hãy nhận biết nước
đựng trong mỗi cốc bằng phương pháp hóa học. Viết phương trình phản ứng. Lời giải:
Đun nóng 3 cốc, cốc có kết tủa xuất hiện là cốc có chứa nước cứng tạm thời
Ca(HCO3)2 to → CO2 + CaCO3 + H2O
Mg(HCO3)2 to → CO2 + MgCO3 + H2O
Nhỏ dung dịch Na2CO3 vào hai mẫu nước còn lại, cốc có kết tủa xuất hiện là
cốc nước cứng vĩnh cửu, còn lại là nước mưa (nước mềm) CO 2- 3 + Mg2+ → MgCO3 ↓ CO 2- 3 + Ca2+ → CaCO3 ↓
Bài 11 (trang 168 sgk Hóa 12 nâng cao): Cần dùng bao nhiêu gam Na2CO3
vừa đủ đề làm mềm lượng nước cứng, biế lượng CaSO4 có trong nước cứng trên là 6.10-5 mol. Lời giải:
Na2CO3 + CaSO4 → Na2SO4 + CaCO3 = = 6.10-5 mol →
cần dùng = 6.10-5.106 = 6,36.10-3 (gam)
Bài 12 (trang 168 sgk Hóa học 12 nâng cao): Tính tổng khối lượng theo mg/lít
của các ion Ca2+ và Mg2+ có trong một loạ nước tự nhiên. Biết rằng nước này có
chứa đồng thời các muối Ca(HCO3)2 Mg(HCO3)2 và CaSO4 với khối lượng
tương ứng là 112,5 mg/l, 11,9 mg/l và 54,5 mg/l. Lời giải: Ca(HCO3)2 → Ca2+ 162 gam 40 gam 112,5 mg → 27,778 mg Mg(HCO3)2 → Mg2+ 146 gam 24 gam 11,9 mg → 1,956 mg CaSO4 → Ca2+ 136 gam 40 gam 54,5 mg → 16,03 mg
Tổng khối lượng Ca2+ và Mg2+ : 27,778 + 1,956 + 16,03 = 45,76 (mg)
Document Outline
- Giải bài tập Hóa 12 nâng cao bài 31




