




Preview text:
Khái niệm tỉ khối hơi là gì? Công thức và bài tập áp dụng tính tỉ khối hơi
1. Tỉ khối hơi được hiểu như thế nào?
Tỷ khối là một khái niệm quan trọng áp dụng đặc biệt trong lĩnh vực chất khí. Nó đại diện cho một công thức
đặc biệt để xác định khối lượng phân tử của chất A so với chất B, cho ta biết liệu chất A có nặng hơn hay
nhẹ hơn chất B một số lần nào. Khái niệm này cũng thể hiện ý nghĩa quan trọng của tỷ khối đối với chất khí.
Trong lĩnh vực hóa học và vật lý, tỷ khối được sử dụng để so sánh khối lượng của các chất khí khác nhau.
Nó được tính bằng cách chia khối lượng của chất A cho khối lượng của chất B. Kết quả của phép chia này
cho ta biết chất A nặng hơn hay nhẹ hơn chất B và bao nhiêu lần.
Việc hiểu và áp dụng tỷ khối trong lĩnh vực chất khí rất quan trọng. Nó cho phép các nhà khoa học và kỹ sư
có thể xác định khối lượng tương đối của các chất khí trong quá trình nghiên cứu và ứng dụng thực tế.
Ngoài ra, tỷ khối cũng được sử dụng trong các quá trình công nghiệp, ví dụ như trong việc kiểm soát chất
lượng và an toàn của các hợp chất khí. Với những ý nghĩa và ứng dụng đa dạng, tỷ khối không chỉ là một
khái niệm đơn giản mà còn mang tính chất quan trọng trong việc khám phá và tìm hiểu về các tính chất của
chất khí. Việc hiểu rõ về tỷ khối và khả năng áp dụng nó sẽ giúp chúng ta mở ra những cánh cửa mới trong
lĩnh vực khoa học, công nghiệp
2. Công thức tính tỉ khối hơi
* Công thức tính tỉ khối hơi so với không khí:
Để xác định sự khác nhau về trọng lượng giữa khí A và không khí, ta sử dụng một khái niệm quan trọng gọi
là tỉ khối. Tỉ khối chất khí A so với không khí được tính dựa trên khối lượng mol của chất khí A (MA) và khối
lượng mol trung bình của không khí (Mkk), có giá trị là 29 g/mol.
Công thức để tính tỉ khối của chất khí A so với không khí được thể hiện như sau: Trong đó:
- dA/kk là tỉ khối của chất khí A so với không khí: Đây là một đại lượng được sử dụng để so sánh trọng
lượng của chất khí A và không khí. Tỉ khối này được tính bằng cách chia khối lượng mol của chất khí A (MA)
cho khối lượng mol trung bình của không khí (Mkk).
- MA là khối lượng mol của chất khí A: Đây là khối lượng mol của chất khí A cần được biết đối với tính toán
tỉ khối. Nó thường được đo bằng đơn vị gram/mol và phụ thuộc vào loại chất khí cụ thể.
- Mkk là "khối lượng mol trung bình" của không khí: Đây là khối lượng mol trung bình của tất cả các thành
phần trong không khí, ví dụ như khí nitơ (N2) và khí oxi (O2). Công thức tính toán khối lượng mol trung bình
của không khí là tổ hợp của tỷ lệ phần trăm các thành phần khí trong không khí nhân với khối lượng mol tương ứng của chúng. => MA = dA/kk.29 (g/mol)
* Công thức tính tỉ khối hơi của chất khí A với chất khí B
Để đo sự khác nhau về trọng lượng giữa khí A và khí B, ta sử dụng một khái niệm quan trọng là tỉ khối. Tỉ
khối của chất khí A so với chất khí B được tính bằng cách so sánh khối lượng mol của khí A (MA) với khối
lượng mol của khí B (MB).
Công thức để tính tỉ khối của chất khí A so với chất khí B là:
Từ công thức trên ta có thể rút ra một số hệ quả: Trong đó:
- dA/B là tỉ khối của chất A so với chất B: Đây là đại lượng được sử dụng để so sánh trọng lượng của chất A
và chất B. Tỉ khối này được tính bằng cách chia khối lượng mol của chất A (MA) cho khối lượng mol của chất B (MB).
- MA là khối lượng mol của chất A: Đây là khối lượng mol của chất A cần được biết để tính toán tỉ khối. Nó
được đo bằng đơn vị gram/mol và phụ thuộc vào loại chất A cụ thể.
- MB là khối lượng mol của chất B: Đây là khối lượng mol của chất B cần được biết để tính toán tỉ khối.
Cũng giống như MA, nó được đo bằng đơn vị gram/mol và phụ thuộc vào loại chất B cụ thể.
- Tỉ khối dA/B cho chúng ta biết chất A nặng hơn hay nhẹ hơn chất B bao nhiêu lần. Nếu tỉ khối là lớn hơn 1,
chất A nặng hơn chất B. Ngược lại, nếu tỉ khối nhỏ hơn 1, chất A nhẹ hơn chất B.
3. Bài tập áp dụng tính tỉ khối hơi
Bài 1: Cho những chất khí sau: O2, N2, N2O5, C2H4. Hãy cho biết
1) Những khí nào nặng hay nhẹ hơn không khí và nặng hay nhẹ hơn không khí bao nhiêu lần?
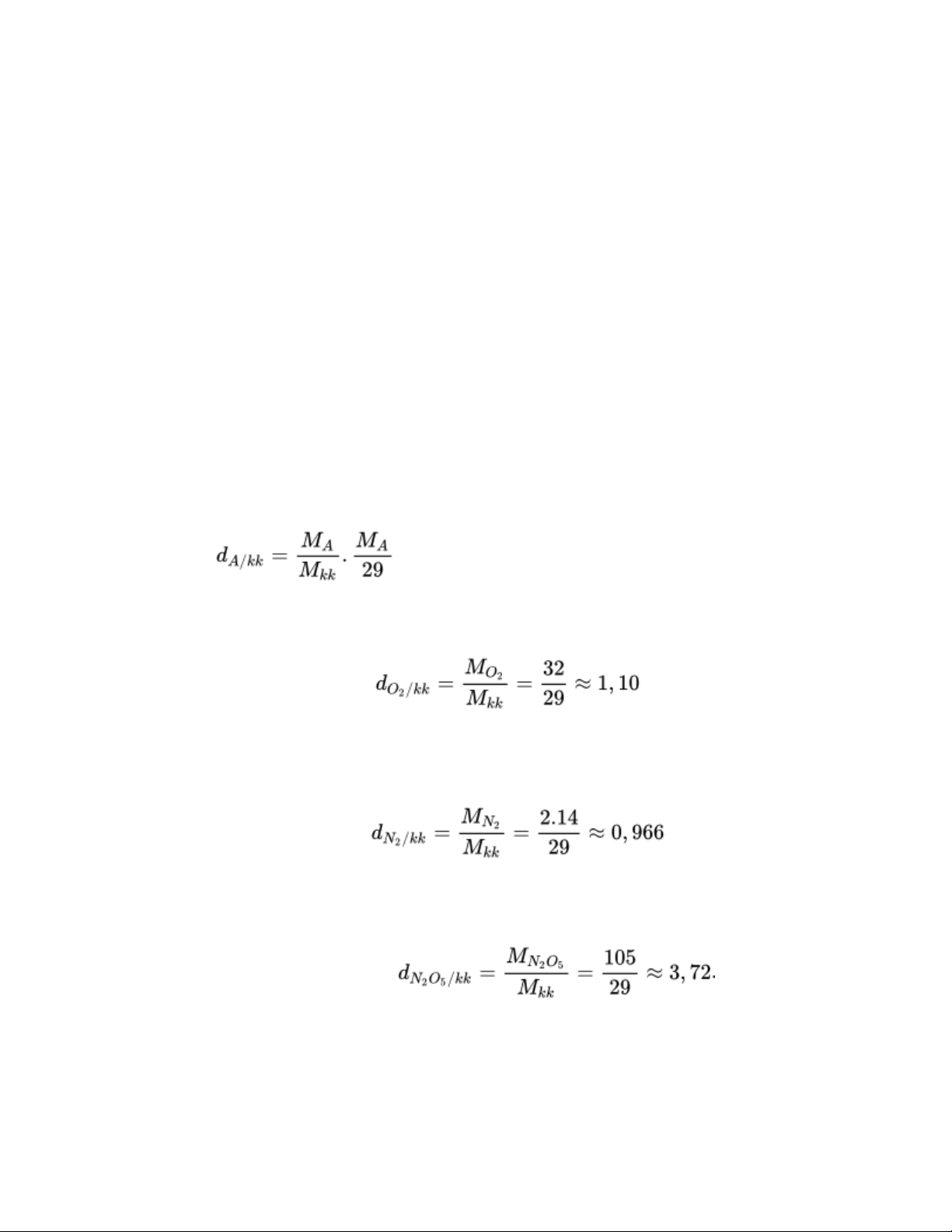
2) Khí O2 nặng hay nhẹ hơn khí hidro bao nhiêu lần. => Lời giải: Áp dụng công thức:
- Tỉ khối của khí O2 so với không khí là:
=> Khí O2 nặng hơn không khí 1,10 lần
- Tỉ khối của khí N2 so với không khí là:
. Khí N2 nhẹ hơn không khí 0,966 lần
- Tỉ khối của khí N2O5 so với không khí là: . Khí N2O5 nặng hơn không khí 3,72 lần
- Tỉ khối của khí C2H4 so với không khí là: . Khí C2H4 nhẹ hơn không khí 0,966 lần.
Bài 2: Khí A có dạng công thức phân tử là RO2, tỉ khối khí A so với H2 là 32. Tìm công thức phân tử của khí A. => Lời giải:
Ta có: tỉ khối khí A so với H2 là 32 => dS/H2 = MA/MH2 => MA = dA/H2.MH2 = 32.2 = 64
=> Tỉ khối khí A so với H2 là 32
A có công thức phân tử dạng RO2 suy ra M = MR + 2.MO = 64
=> MR = 64 – 2.16 = 32 vậy R là nguyên tố S
=> Công thức phân tử của khí A là SO2.
Bài 3: Hỗn hợp Z gồm 0,05 mol CO2 và 0,25 mol SO3
1) Tính khối lượng mol trung bình của hỗn hợp Z.
2) Tính tỉ khối của hỗn hợp Z so với khí N2O => Lời giải:
1) Hỗn hợp X có khối lượng mol trung bình bằng:
2) Tỉ khối của hỗn hợp X so với N2O bằng:
Bài 4: Cho hỗn hợp khí X gồm 11 gam khí CO2, 6,4 gam khí SO2 và 7,7 gam khí N2O. Hãy xác định tỉ khối
của hỗn hợp X so với khí O2 => Lời giải:
Khối lượng mol trung bình của hỗn hợp X:
Tỉ khối của hỗn hợp X so với khí O2 là:
Bài 5: Một hỗn hợp X gồm O2 và H2 (điều kiện không có phản ứng xảy ra), hỗn hợp có tỉ khối đối với không
khí là 0,3276. Tính phần trăm theo số mol của H2 trong hỗn hợp. => Lời giải:
Gọi số mol của H2 và O2 trong hỗn hợp lần lượt là x và y mol
Tỉ khối của X so với không khí :
dX/kk = MX/29 => MX = 29.0,3276 = 9,5
Công thức tính khối lượng trung bình của hỗn hợp X là
MX = (nH2.MH2 + nO2.MO2) / (nH2 + nO2) = (2x + 32y) / (x + y) = 9,5
=> 2x + 32y = 9,5x + 9,5y => 7,5x = 22,5 => x = 3y
=> Phần trăm số mol khí H2là:
%nH2 =nH2/(nH2 + nO2) .100% = 3y/(3y + y).100% = 75%
Bài 6: Hỗn hợp X gồm ozon và oxi có tỉ khối đối với hiđro bằng 18. Tính thành phần theo thể tích của hỗn hợp không khí. => Lời giải:
Coi số mol hỗn hợp X = 1 mol. nO2 = x (mol) ; nO3 = y (mol) x + y = 1 32x + 48y = 1.18.2 ⇒ x = 0,75, y = 0,25 (mol) ⇒ %VO2 = 75% ; %VO3 = 25%
Bài 7: Một hỗn hợp X gồm H2 và O2 (không có phản ứng xảy ra) có tỉ khối so với không khí là 0,3276.
1. Tính khối lượng mol trung bình của hỗn hợp.
2. Tính thành phần phần trăm theo số mol của mỗi khí trong hỗn hợp (bằng 2 cách khác nhau) => Lời giải:
Gọi số mol của H2 và O2 trong hỗn hợp lần lượt là x và y mol
Tỉ khối của X so với không khí:
X/kk = MX/29 => MX = 29.0,3276 = 9,5
Công thức tính khối lượng trung bình của hỗn hợp X là
MX = (nH2.MH2+ nO2.MO2) / (nH2 + nO2) = (2x + 32y) / (x + y) = 9,5
=> 2x + 32y = 9,5x + 9,5y => 7,5x = 22,5 => x = 3y
=> phần trăm số mol khí H2 là: %nH2 = nH2/(nH2 + nO2).100% = 3y/(3y + y).100% = 75%.




