






Preview text:
CHƯƠNG 2
CÁC KỸ THUẬT PHÂN TÍCH THỂ TÍCH VÀ PHÂN TÍCH TRỌNG LƯỢNG
2.1 ĐẠI CƯƠNG VỀ PHÂN TÍCH THỂ TÍCH
2.1.1 Nguyên tắc của phân tích thể tích
Phương pháp phân tích thể tích là phương pháp xác định nồng chất dựa vào phản ứng
của chất phân tích (hay chất định phân ) trong dung dịch thông qua đại lượng đo là thể
tích các dung dịch chất chuẩn (có nồng độ biết trước). Phản ứng của chất phân tích với
chất chuẩn được khi thêm từ từ chất chuẩn và dung dịch chất định phân được gọi là
phản ứng chuẩn độ. Thời điểm khi thêm từ từ chất chuẩn là dung dịch chất định phân
và lượng chất phân tích phản ứng vừa đủ với lượng chất chuẩn theo phản ứng hoá học
gọi là điểm tương đương. Điểm kết thúc phép chuẩn độ gọi là điểm cuối, (có thể không
trùng điểm tương đương). Để xác định điểm tương đương, người ta dùng chất chỉ thị.
2.1.2 Yêu cầu của phản ứng dùng trong phân tích thể tích
Phản ứng phân tích có 4 yêu cầu cơ bản:
- Phản ứng xảy ra hoàn toàn và theo hệ số tỷ lượng xác định, để đáp ứng yêu cầu
định lượng của phương pháp.
- Phản ứng xảy ra nhanh, kéo dài trong thời gian chuẩn độ cho phép để có thể thực
hiện phản ứng trong thời gian chuẩn độ cho phép.
- Phản ứng phải chọn lọc đối với chất cần phân tích
- Có thể xác định được điểm tương đương hay nói cách khác là có chỉ thị phù hợp.
2.1.3 Các phương pháp phân tích thể tích
Phương pháp phân tích thể tích dựa trên 4 loại phản ứng hóa học cơ bản sau đây:
Phương pháp chuẩn độ Axit-bazơ
Phương pháp dựa trên phản ứng trao đổi proton giữa các axit-bazơ để xác định chính
các axit, bazơ. Có thể dùng axít mạnh để xác định bazơ yếu, mạnh và dùng bazơ mạnh
để xác định các axit mạnh, yếu.
Phương pháp chuẩn độ Phức chất
Phương pháp dựa trên các cân bằng tạo phức chất trong dung dịch để xác địch các kim
loại, các anion trong dung dịch, thuốc thử là các hợp chất hữu cơ có khả năng tạo phức màu với ion kim loại. Phương pháp Kết tủa
Phương pháp có cơ sở là các cân bằng phân li của các hợp chất ít tan trong dung dịch
để tính toán nồng độ của chúng. Phương pháp có hạn chế là không có nhiều chất chỉ thị
phù hợp nên mới xác định được một số halogenua.
Phương pháp Oxihóa khử
Đây là phương pháp được phát triển tương đối mạnh, dựa vào các cân bằng oxyhoá khử
để xác định trực tiếp các chất oxyhóa khử tham gia phản ứng, ngoài ra còn xác định các
chất không có tính oxyhoá khử, một số anion.
2.1.4 Các kỹ thuật chuẩn độ
Chuẩn độ trực tiếp
Dùng chất chuẩn A (đã biết nồng độ) để phản ứng với chất cần định phân B theo một
tỷ lệ nhất định. Từ thể tích của chất B đem chuẩn độ và thể tích của A đã phản ứng, có
thể tính nồng độ của chất B.Thí dụ dùng dung dịch H2C2O4 có nồng độ chính xác để
xác định nồng độ NaOH. Chuẩn độ ngược
Chất chuẩn A được dùng để xác định B tuy nhiên do B phản ứng chậm với A nên cho
một lượng A chính xác, dư để phản ứng với B sau đó chuẩn độ lại lượng A dư bằng C.
Từ lượng A và C, tính được nồng độ B. Do để chất chuẩn A ở bình nón chuẩn độ nên
ta gọi là chuẩn độ ngược. Thí dụ để xác định nồng độ Al3+ bằng dung dịch chất tạo phức
etylen diamin tetra-acetic axit (EDTA), ta cho một lượng chính xác EDTA dư sau đó
xác định lại EDTA dư bằng Zn2+. Chuẩn độ thay thế
Thông thường để xác định chất B cần dùng chất chuẩn A, tuy nhiên phản ứng giữa và
B không có chất chỉ thị phù hợp nên cần thay thế bằng C mà đã biết chắc chắn lượng
của C, cho C thay thế B sau đó dùng A để xác định C, từ đó tính ra B. Thí dụ để xác
định Pb2+ bằng EDTA, ta cho dung dịch Pb2+ vào dung dịch complexonat-Magie (MgY2-
) phản ứng thế xảy ra, Mg2+ trong trường hợp này là C đã thay thế Pb2+ trong phức, sau
đó xác định Mg2+ được giải phóng ta xác định được Pb2+. Chuẩn độ gián tiếp
Chất chuẩn A không phản ứng với B cần xác định, tuy nhiên cả A và B lại phản ứng
định lượng với C. Cho một lượng chính xác C để phản ứng với B, sau đó dùng A để xác
định C. Từ lượng của A và C tính ra B. Thí dụ để xác định SO 2- 4 bằng EDTA, cho một
lượng dư chính xác Ba2+ để phản ứng với SO 2- 2+ 4
, sau đó xác định Ba dư, từ đó xác định được SO 2- 4 .
Chuẩn độ phân đoạn
Có hỗn hợp hai hay nhiều chất, thí dụ B và C trong dung dịch, dùng A để xác định lần
lượt B và C với các điều kiện phù hợp trong cùng một mẫu. Thí dụ hỗn hợp gồm Bi3+
và Pb2+ đem chuẩn độ bằng EDTA. Do Bi3+ phản ứng được với EDTA ở pH 2 trong khi
Pb2+ thì không. Vì vậy trước hết điều chỉnh pH = 2 để xác định Bi3+, tiếp theo điều chỉnh
pH =5 với dung dịch vừa chuẩn độ để xác định tiếp Pb2+. 2.2 NỒNG ĐỘ
2.2.1 Các loại nồng độ
¥ Nồng độ mol/l (hay nồng độ mol), được ký hiệu là CM , đơn vị đo là mol/l hoặc M.
Nồng độ mol/l được định nghĩa là số mol chất tan có trong một lit dung dịch.
Thí dụ: dung dịch MgCl2 0,025M tức là trong 1 lit dung dịch này có chứa 0,025 mol MgCl2
CM = n/V trong đó n là số mol chất tan và V là thể tích dung dịch (đo bằng lit)
¥ Nồng độ đương lượng
Nồng độ đương lượng được định nghĩa là số đương lượng gam chất tan trong một lit
dung dịch. Đương lượng gam của một chất bất kỳ nào đó là số gam của nó tương đương
về mặt hoá học với một nguyên tử gam (hoặc một ion gam) hyđro. Đương lượng gam
chất tan được xác định bằng phản ứng hoá học cụ thể.
Đối với phản ứng axit-bazơ, đương lượng gam của đa axít (đa bazơ) bằng phân tử gam
của nó chia cho số H+ (OH-) trao đổi,
Đối với phản ứng oxihoá khử, đương lượng gam của nó bằng phân tử gam của nó chia
cho số electron trao đổi.
¥ Nồng độ phần trăm khối lượng
Nồng độ phần trăm được định nghĩa là số gam chất tan trong một trăm gam dung dịch.
Thí dụ: dung dịch có 10 gam NaCl trong 90 gam H2O là dung dịch NaCl 10%
¥ Nồng độ tỷ lệ thể tích
Nồng độ này thường áp dụng cho các dung dịch axit, không cần chính xác, dùng cho
môi trường phản ứng nên được pha chế là một thể tích axít với 1 hoặc 2 hoặc 3 thể tích
nước cất nên gọi là dung dịch có nồng độ 1:1 ; 1:2 ; 1:3 ¥ Nồng độ ppm, ppb, ppt
Nồng độ này áp dụng cho dung dịch cực kỳ loãng cho nên có thể bỏ qua thể tích của chất tan trong nước.
Nồng độ ppm (parts per million) được định nghĩa là những phần triệu, có thể cụ thể hoá
là số miligam chất trong một Kg mẫu hoặc số microgam chất trong một gam mẫu: mg mg μl μg nl ppm = = = = = Kg l l g ml
Nồng độ ppb (parts per billion) là số microgam chất trong một kilogam mẫu hoặc số
nano gam chất trong một gam mẫu. μg μg nl ng pl ppb = = = = = Kg l l ml ml
Nồng độ ppt (parts per trillion) được định nghĩa là số nano gam chất trong 1kilogam
mẫu. Dung dịch 1 ppt tức là 1µg chất tan trong 1 m3 nước. ng pl pg fl ppt = = = = Kg l ml ml
Thí dụ 2.1: Tính nồng độ Zn theo ppm và ppb biết 2,6 g mẫu thực vật phân tích được 3,6 µg Zn
Giải: theo định nghĩa ppm= µg/g; vậy nồng độ là: 3,6/2,6 = 1,4 ppm;
Nồng độ ppb = ng/g ; vậy 3600ng/2,6 g = 1400 ppb
Thí dụ 2.2: Một mẫu 25 µl dịch tế bào tìm được 26,7 µg gluco. Tính nồng độ ppm.
Giải: Theo định nghĩa ppm= µg/ml
Trong 1ml có 26,7µg. 103/25 = 1068 ppm.
2.2.2 Tính toán nồng độ chất trong phân tích thể tích.
Nồng độ mol/l là nồng độ cơ bản để tính toán trong phân tích thể tích.
Số mol = số gam / khối lượng phân tử (KLPT) CM = nồng độ mol / l CM x số lít = số mol
CM x số lit x KLPT = số gam CM x số ml = số mili mol
CM x số ml x KLPT = số mi li gam
Chuyển đổi từ nồng độ % sang nồng độ CM và ngược lại a 1000 C . = M M V1 . P d.V C .M.V 2 1 a M = = P a 100 1000 = 100 d.V 2
Chuyển đổi từ nồng độ ppm sang nồng độ CM
Dung dịch A nồng độ x ppm= xmg/Kg; x C = (mol/l) M 1000.M A
Thí dụ 2.3: a) Tính nồng độ mol của dung dịch Pb2+ từ nồng độ 1ppm, b) Lượng cân
của Pb(NO3)2 là bao nhiêu để hoà tan vào 1l nước, có nồng độ 100ppm.
Giải: a) 1ppm= 1mg/l= 1.10-3g/l -3 C . 1 10 6 - M = 8 , 4 . 3 10 = M/l 207 b) 100 ppm =100mg/l= 0,1 g/l
Số mol Pb2+ là 0,1/207= 4,84.10-4 M/l
Lượng cân là 4,84.10-4 . 283,2 = 0,137g
Chuyển đổi từ nồng độ CM sang ppm
Thí dụ 2.4: Tính nồng độ ppm của dung dịch Cu2+ 10-6 M (KLNT của Cu là 64)
Giải: số mg Cu2+ là 10-6. 1000.64 = 64.10-3 mg
Vậy 64.10-3mg /l = 64.10-3 ppm (0,064ppm)
Tính nồng độ chất phân tích theo phản ứng với chất chuẩn
Phản ứng giữa axit oxalic và NaOH theo tỷ lệ mol 1:2
H2C2O4 + 2 NaOH = Na2C2O4 + 2 H2O
Vậy phương trình cân bằng mol phải là: 2(VH2C2O4 .C H2C2O4) = CNaOH .VNaOH
CNaOH = (2VH2C2O4 .C H2C2O4) /VNaOH
Thí dụ 2.5: Một mẫu soda 0,2638 g đem phân tích bằng chuẩn độ với HCl 0,1288 M/l
hết 38,27 ml thì đổi màu metyl da cam (pH =4) theo phản ứng: 2H+ + CO 2- 2- 3
= H2CO3 , tính % CO3 trong mẫu.
Giải: Số mmol HCl là 0,1288 x 37,27 = 4,929. Do số mol H+ gấp 2 lần số mol CO 2- 3 nên Số mmol CO 2- 3 là 4,929 / 2 = 2,4645 Số mg CO 2- 3 2,4645 . 105,99 = 261,2 mg. % CO 2- 3
là (261,2/ 263,8) x100 = 99,02% 2.3 PHA CHẾ DUNG DỊCH
2.3.1 Chất gốc, pha chế dung dịch chuẩn từ chất gốc
Chất gốc là các chất đáp ứng các yêu cầu sau:
- Có thành phần đúng với công thức
- Bền về mặt hoá chất khi ở trạng thái tinh thể cũng như trong dung dịch - Là chất tinh khiết
- Có khối lượng phân tử càng lớn càng tốt.
Pha chế dung dịch chuẩn từ chất gốc được tiến hành như sau: Cân lượng chất gốc
cần thiết, chuyển vào bình định mức, thêm nước cất (hoặc dung môi phù hợp), hoà tan
chất gốc sau đó thêm nước cất hoặc dung môi đến vạch. Dung dịch được pha từ chất
gốc thường có nồng độ lớn, gọi là dung dịch gốc. Khi tiến hành phân tích tuỳ theo nồng
độ của chất phân tích, pha loãng dung dịch gốc chuẩn tới dung dịch có nồng độ phù hợp.
Pha chế dung dịch chuẩn từ các chất không phải là chất gốc:
Chất chuẩn có thể được chuẩn bị từ các hoá chất tinh khiết không phải là chất gốc.
Các hóa chất này thường có nồng độ biến đổi chậm theo thời gian, thí dụ axit clohyđric,
NaOH v.v. Vì vậy cần phải định chuẩn các dung dịch này một cách thường xuyên và
cách điều chế cũng khác. Để điều chế các dung dịch chuẩn từ các chất này, cần pha chế
một dung dịch có nồng độ phù hợp nhưng chưa chính xác sau đó dùng chất gốc để xác
định lại nồng độ dung dịch đã pha. Thí dụ để điều chế dung dịch HCl chuẩn, pha chế
dung dịch HCl có nồng độ tương đối từ dung dịch HCl đặc, tinh khiết, sau đó nồng độ
chính xác được xác định theo chất gốc Na2B4O7.10H2O; Chuẩn bị dung dịch KMnO4
chuẩn được tiến hành bằng cách pha chế dung dịch KMnO4 có nồng độ tương đối từ
KMnO4 tinh khiết sau đó nồng độ chính xác được xác định theo chất gốc H2C2O4.2.H2O.
2.3.2 Pha loãng dung dịch
Với các nồng độ mol/l, nồng độ đương lượng và nồng độ ppm, ppb, ppt khi pha
loãng từ nồng độ lớn thành nồng độ nhỏ hơn, luôn áp dụng công thức: C1V1 = C2 V2.
Trong đó V1 và V2 là thể tích ban đầu và thể tích cuối cần pha; C1 và C2 là các nồng độ
ban đầu và nồng độ dung dịch cần pha.
Thí dụ cần pha 500 ml (V2) dung dịch K2Cr2O7 0,1 M (C2) từ dung dịch gốc có
nồng độ 0,25M (C1), cần lấy bao nhiêu ml dung dịch gốc (V1). Ta có 500x 0,01 = V x
0,25, vậy V = 20 ml. Lưu ý rằng đối với dung dịch % khối lượng không áp dụng công thức này.
2.4 DỤNG CỤ PHÂN TÍCH THỂ TÍCH
2.4.1 Một vài dụng cụ đo thể tích thông thường
Các dụng cụ đo thể tích rất đa dạng, trước tiên là các dụng cụ để pha chế các
dung dịch gốc làm chất chuẩn cho các phép đo. Pha các dung dịch gốc nhất thiết phải
dùng bình định mức có dung tích chính xác (hình 2.5). Để lấy thể tích chính xác dung
dịch chuẩn cho một phép đo ta dùng pipet bầu (hình 2.3) hoặc micropipet (hình 2.6).
Đối với các phép phân tích cần lấy lượng dung dịch rất nhỏ, ta dùng syringe (hình 2.7).
2.1: Buret 2.2 : Buret bán tự động 2.3 : Pipet
Trong phân tích, đôi khi cần dung dịch chất phản ứng có nồng độ và thể tích
không cần chính xác, thí dụ các axit để hòa tan mẫu hoặc dung dịch đệm cho một môi
trường phản ứng. Để lấy các dung dịch này, ta dùng ống đong, cốc đong.
2.4 : ống đong 2.5 : Bình định mức 2.6:Cốc đong
Dụng cụ để chuẩn độ là buret (hình 2.1), nếu có nhiều phép chuẩn độ bằng một dung
dịch chuẩn, sử dụng buret bán tự động (hình 2.2) sẽ thuận lợi hơn. 7: Micropipet 8: Syringe
Hình 2.1-2.8: Một vài dụng cụ đo thể tích trong phân tích thể tích
Làm sạch dụng cụ thuỷ tinh
- Đối với các chất vô cơ, sử dụng các axit hoặc bazơ phù hợp, sử dụng các chất
oxy hoá đối với các chất khử, ví dụ các axit có tính oxy hoá cao như HNO3, HClO4.v.v;
sử dụng các chất khử đối với các chất oxy hoá, sử dụng các chất tạo phức, ví dụ sử dụng
axit oxalic để loại Fe3+, Mn4+v.v. Đối với các chất hữu cơ, sử dụng các dung môi phù hợp.
Các hỗn hợp rửa sau đây có thể áp dụng cho nhiều dụng cụ thủy tinh:
- Hỗn hợp sunfocromic, là hỗn hợp gồm axit sunfuric đặc, hoà tan thêm 5%
K2Cr2O7. Dùng hỗn hợp này tráng lên bề mặt thuỷ tinh, ngâm để qua đêm sau đó rửa
lại bằng nước, tráng bằng nước cất. Để làm khô nhanh, tráng dụng cụ bằng axeton sạch,
sau đó thổi bằng dòng không khí.
- Hỗn hợp kiềm – pemanganat được điều chế bằng cách hoà tan 5 gam KMnO4
trong 1 lit dung dịch kiềm kali 10% cũng là một hỗn hợp rửa rất tốt.
2.4.2 Hiệu chỉnh thể tích dụng cụ đo thể tích
Để phép phân tích có kết quả chính xác, tin cậy, các nhà phân tích cần quan tâm
tới dung tích của dụng cụ thuỷ tinh. Người ta thường xác định dung tích của các dụng
cụ đo bằng phương pháp cân trọng lượng nước cất chứa trong chúng. Từ các kết quả
trọng lượng của nước cất chứa trong các dụng cụ đo, áp dụng các hiệu chỉnh tương ứng
với nhiệt độ của môi trường, tìm được dung tích thực của dụng cụ. Có ba đại lượng hiệu chỉnh chính.
a/ Hiệu chỉnh tỷ trọng theo nhiệt độ (hiệu chỉnh A)
Tỷ trọng của nước lớn nhất là ở 3,980C và gần bằng 1, nhưng các phép đo thường
tiến hành trong môi trường có nhiệt độ cao hơn và đương nhiên, tỷ trọng giảm khi nhệt
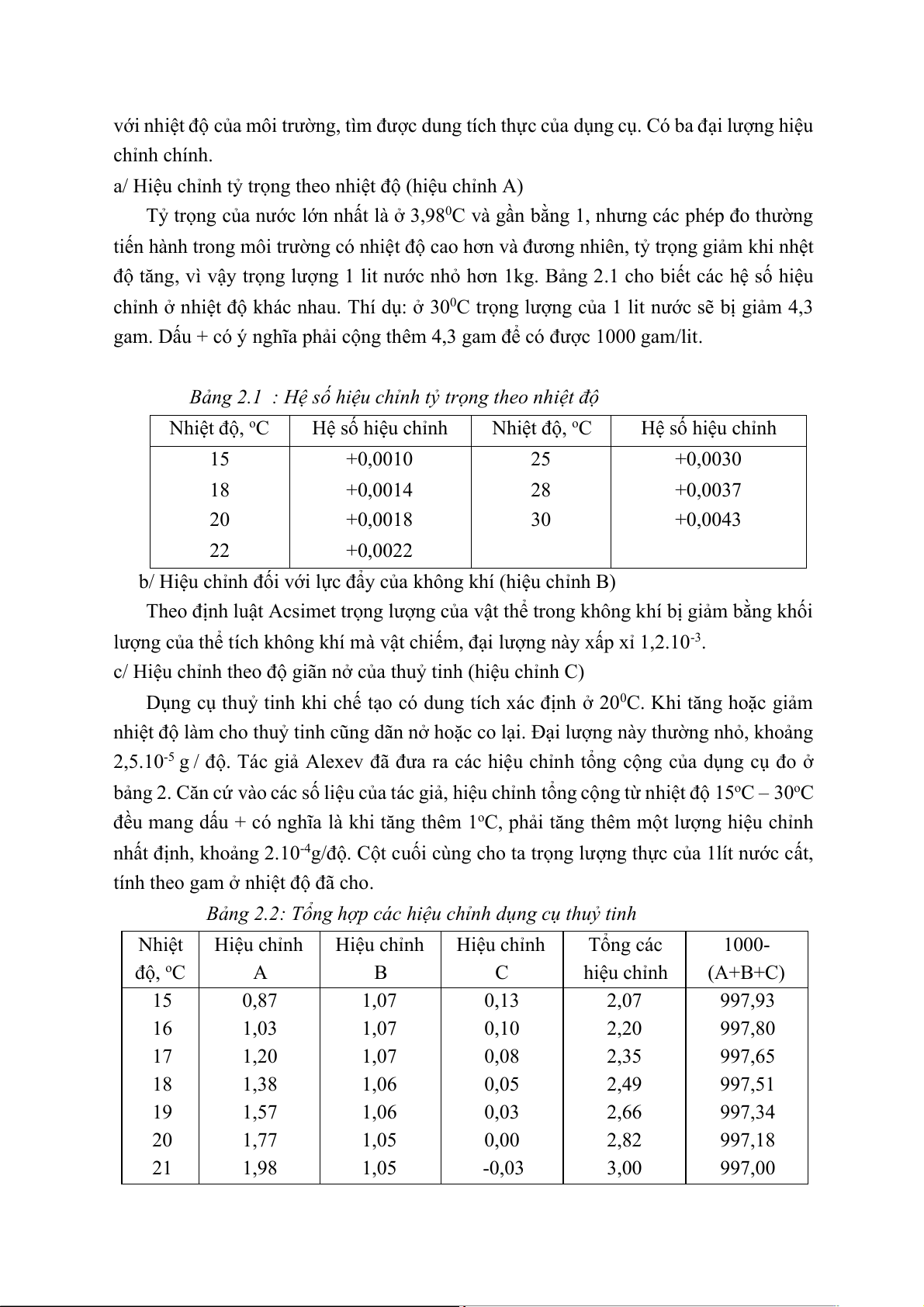
độ tăng, vì vậy trọng lượng 1 lit nước nhỏ hơn 1kg. Bảng 2.1 cho biết các hệ số hiệu
chỉnh ở nhiệt độ khác nhau. Thí dụ: ở 300C trọng lượng của 1 lit nước sẽ bị giảm 4,3
gam. Dấu + có ý nghĩa phải cộng thêm 4,3 gam để có được 1000 gam/lit.
Bảng 2.1 : Hệ số hiệu chỉnh tỷ trọng theo nhiệt độ Nhiệt độ, oC Hệ số hiệu chỉnh Nhiệt độ, oC Hệ số hiệu chỉnh 15 +0,0010 25 +0,0030 18 +0,0014 28 +0,0037 20 +0,0018 30 +0,0043 22 +0,0022
b/ Hiệu chỉnh đối với lực đẩy của không khí (hiệu chỉnh B)
Theo định luật Acsimet trọng lượng của vật thể trong không khí bị giảm bằng khối
lượng của thể tích không khí mà vật chiếm, đại lượng này xấp xỉ 1,2.10-3.
c/ Hiệu chỉnh theo độ giãn nở của thuỷ tinh (hiệu chỉnh C)
Dụng cụ thuỷ tinh khi chế tạo có dung tích xác định ở 200C. Khi tăng hoặc giảm
nhiệt độ làm cho thuỷ tinh cũng dãn nở hoặc co lại. Đại lượng này thường nhỏ, khoảng
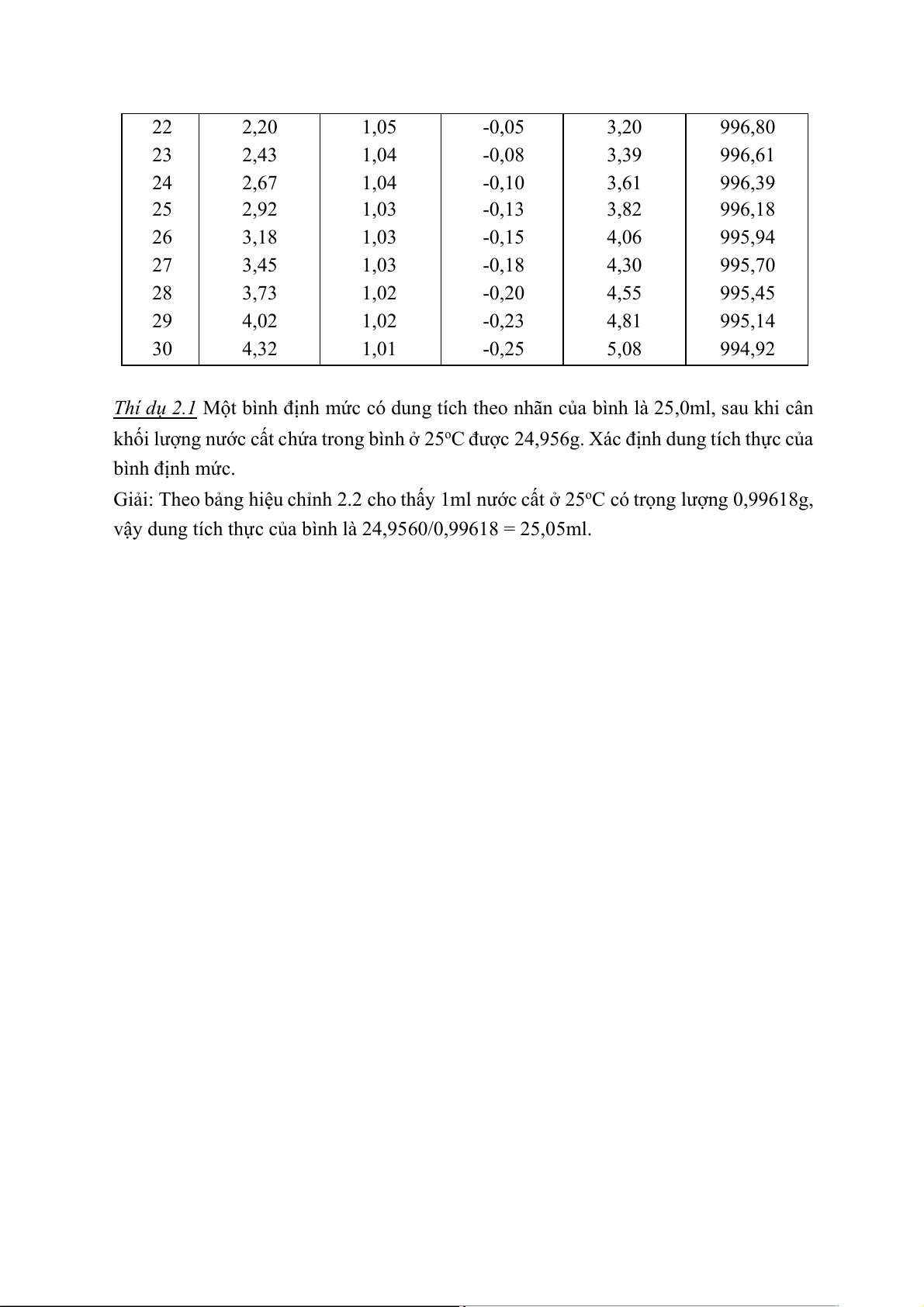
2,5.10-5 g / độ. Tác giả Alexev đã đưa ra các hiệu chỉnh tổng cộng của dụng cụ đo ở
bảng 2. Căn cứ vào các số liệu của tác giả, hiệu chỉnh tổng cộng từ nhiệt độ 15oC – 30oC
đều mang dấu + có nghĩa là khi tăng thêm 1oC, phải tăng thêm một lượng hiệu chỉnh
nhất định, khoảng 2.10-4g/độ. Cột cuối cùng cho ta trọng lượng thực của 1lít nước cất,
tính theo gam ở nhiệt độ đã cho.
Bảng 2.2: Tổng hợp các hiệu chỉnh dụng cụ thuỷ tinh Nhiệt Hiệu chỉnh Hiệu chỉnh Hiệu chỉnh Tổng các 1000- độ, oC A B C hiệu chỉnh (A+B+C) 15 0,87 1,07 0,13 2,07 997,93 16 1,03 1,07 0,10 2,20 997,80 17 1,20 1,07 0,08 2,35 997,65 18 1,38 1,06 0,05 2,49 997,51 19 1,57 1,06 0,03 2,66 997,34 20 1,77 1,05 0,00 2,82 997,18 21 1,98 1,05 -0,03 3,00 997,00 22 2,20 1,05 -0,05 3,20 996,80 23 2,43 1,04 -0,08 3,39 996,61 24 2,67 1,04 -0,10 3,61 996,39 25 2,92 1,03 -0,13 3,82 996,18 26 3,18 1,03 -0,15 4,06 995,94 27 3,45 1,03 -0,18 4,30 995,70 28 3,73 1,02 -0,20 4,55 995,45 29 4,02 1,02 -0,23 4,81 995,14 30 4,32 1,01 -0,25 5,08 994,92
Thí dụ 2.1 Một bình định mức có dung tích theo nhãn của bình là 25,0ml, sau khi cân
khối lượng nước cất chứa trong bình ở 25oC được 24,956g. Xác định dung tích thực của bình định mức.
Giải: Theo bảng hiệu chỉnh 2.2 cho thấy 1ml nước cất ở 25oC có trọng lượng 0,99618g,
vậy dung tích thực của bình là 24,9560/0,99618 = 25,05ml.



